HPSEC-UV-TOC联用技术操作条件对有机物分子量分布测定的影响
夏庆艳,王 琳,陈天宇,李志浩,武道吉
(山东建筑大学市政与环境工程学院,山东济南 250101)
作为评价膜污染的指标[1],分子量分布常由2种方法测得:一种是超滤膜法,但溶质易被截留,且精度不高;另一种方法是凝胶色谱法,但只能测定有紫外响应的有机物,不能测定多糖等含碳单键的有机物。国外发展了一种新型凝胶色谱法(high performance size exclusion chromatography,HPSEC)[2],此方法需在凝胶色谱的基础上串联紫外(UV)检测器,最后串联总有机碳(TOC)检测仪,被称作HPSEC-UV-TOC联用技术。紫外检测器能够检测含苯环及碳碳双键等不饱和有机物,TOC检测仪可以检测含碳单键和无苯环物质[2-3]。这种方法能够较易测定天然有机物(natural organic matter,NOM)相对分子量的大小,所得到的分子量分布图连续,能够更加真实客观地反映NOM的物化性质。近年来,国内已经新引进这种联用技术,并在水处理理论与技术研究中得到初步应用[4-8,14]。
本研究主要考察pH、离子强度、样品配置溶液等运行条件对HPSEC-UV-TOC联用技术测定葡聚糖T1分子量分布的影响,同时,将优化条件用于测定黄河原水及其亲疏水组分中有机物的分子量分布,从而完善该联用技术在饮用水地表水源不同有机物组分研究中的应用。
1 材料与方法
1.1 试验材料
本试验采用的试剂为国药集团化学试剂有限公司生产的分子量为1 000的葡聚糖(dextran,T1),如图1所示。葡聚糖T1属于小分子亲水性有机物,无芳香度,较为符合国内地表原水中主要分子量分布的特征[9-10]。试验原水采用黄河水库原水,该原水浓缩后经XAD-8(北京康林科技有限责任公司)、XAD-4(美国Sigma公司)和IRA958树脂(美国Sigma公司)分离得到强疏、弱疏、极亲、中亲4种组分。盐酸溶液和NaOH(5 mol/L)用于调节pH,采用NaCl(国药集团化学试剂有限公司)调节离子强度(IS)。如果没有特别注明,试验中使用的试剂纯度均为分析纯,溶液采用超纯水(Milli-Q plus超纯水机)配制。
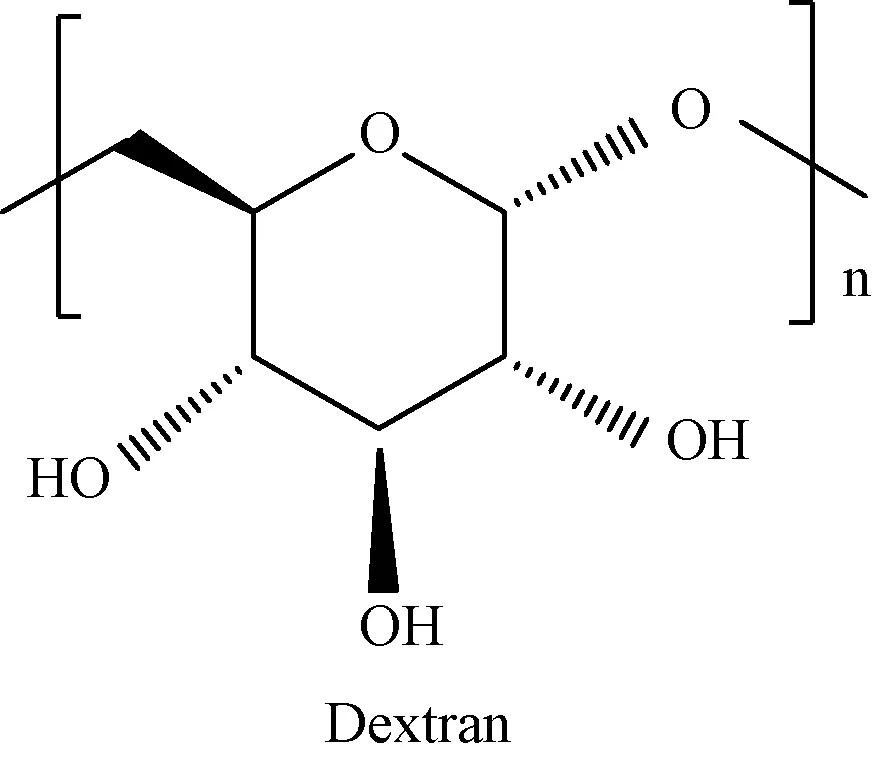
图1 葡聚糖T1分子结构图Fig.1 Molecular Structure of Dextran T1
1.2 试验仪器
沃特世(Waters)Alliance系列e 2695型凝胶色谱仪;Waters 2489型UV-VIS检测器;Sievers M9总有机碳(TOC)检测器;Empower 3色谱软件。
1.3 色谱条件
试验采用的凝胶色谱柱型号是TSK gel G3000 PWXL(7.8 mm×30 cm,填料为聚甲基丙烯酸酯),色谱柱之前串联保护柱型号是TSK-GEL TSK guard column PWXL(6.0 mm×4.0 cm)。 流动相采用Na2SO4(0.02 mol/L),KH2PO4(0.05 mol/L)和NaOH(0.03 mol/L)的混合溶液。
如无特殊说明,凝胶色谱柱的流速为0.5 mL/min,柱温采用40 ℃,UV检测器在254 nm处测定样品, 进样体积为100 μL,测样时间为35 min,试验所用水样均用Milli-Q超纯水配制完成。
1.4 方法原理
高效凝胶色谱主要工作原理是根据溶解性有机物的尺寸进行分离,分子量较大的有机物不能进入凝胶孔隙,会首先流出,分子量小的有机物后流出,因此,能够绘制出不同分子量随时间t的变化曲线。样品随后依次经过UV-VIS检测器和TOC检测器,在Empower 3软件上每秒自动记录2个数据,以体积V(或时间t)为横轴,绘制出UV和TOC信号随体积V(或时间t)的变化曲线。图2为该联用技术示意图。
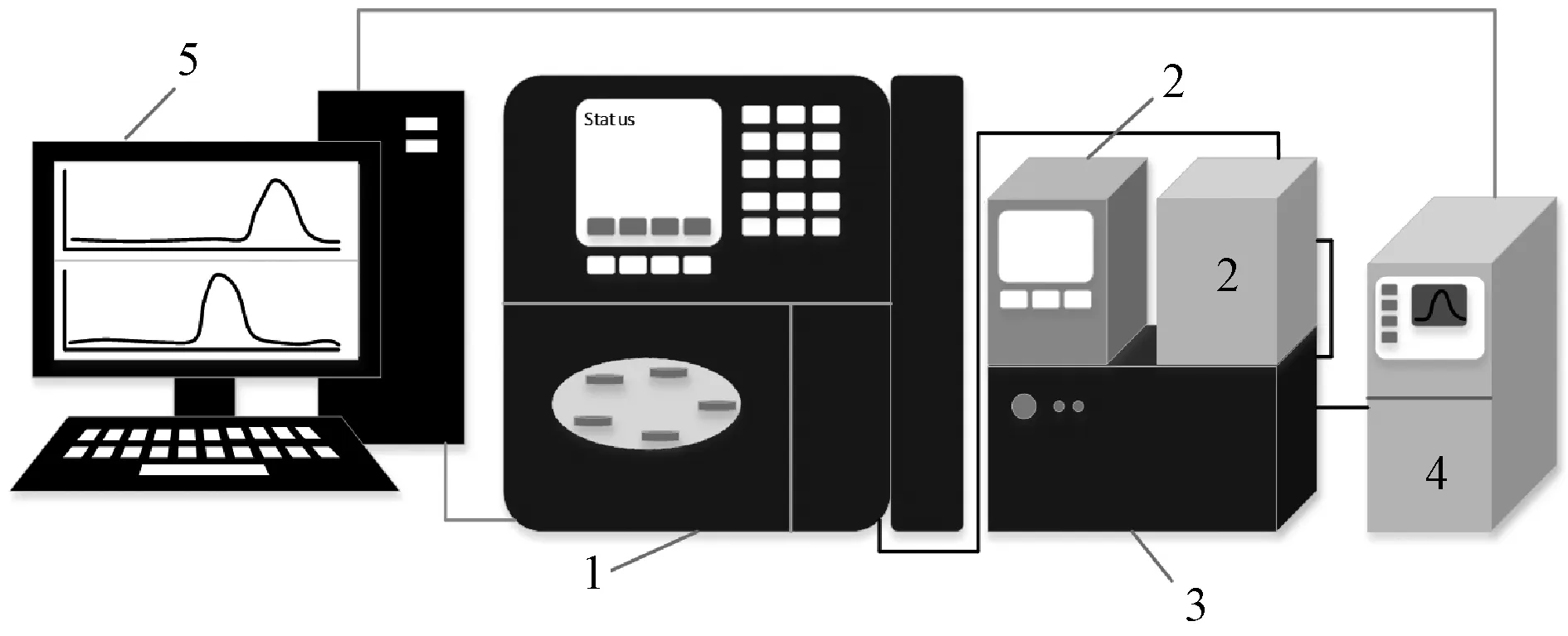
注:1-Waters e 2695型凝胶色谱仪;2-色谱柱柱温箱(右)和温控箱(左);3-Waters 2489 UV-VIS检测器;4-Sievers M9 Portable TOC检测器;5-台式电脑图2 HPSEC-UV-TOC联用技术示意图Fig.2 Schematic Diagram of HPSEC-UV-TOC System
2 结果与讨论
2.1 校正曲线
凝胶色谱测定的是有机物的相对分子质量,因此,需使用已知分子量、物化性质与所测样品相近的标准品来对试验结果进行校正,得到标准曲线,本试验采用宽分布标样校正法。
前期试验结果显示,NOM与聚苯乙烯磺酸钠(sodium polystyrene sulfonate,PSS)的性质相似。本试验选取的是相对分子质量为210、4 300、6 800、17 000、32 000的PSS标准品,作lgMw-t半对数曲线(图3),采用三阶拟合,如式(1)~式(2)。
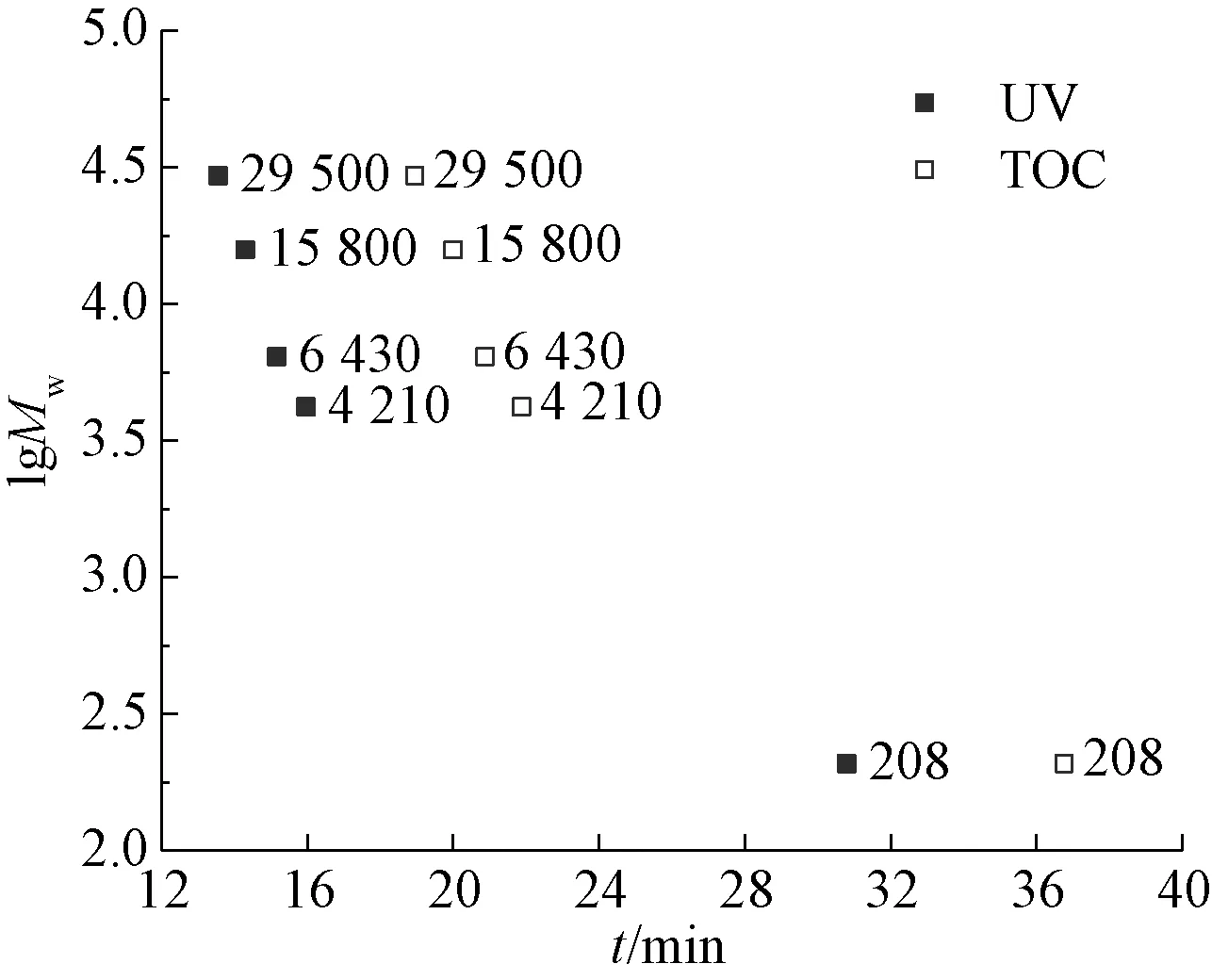
图3 lgMw与峰值保留时间t的关系Fig.3 UV and TOC Curves of lgMw and Peak Time t
AMWUV=10(S-2.665 89t+0.114 13t2-0 .001 63t3 )
(1)
R2=0 .995 05
AMWTOC= 10(S-1 .309 56t+0.033 31t2-0.000 277 4t3)
(2)
R2=0.987 57
其中:AMWUV——UV254响应峰所对应的相对分子量;
AMWTOC——TOC响应峰所对应的相对分子量;
t——峰值保留时间,min;S——常数。
2.2 TOC响应值与浓度的关系
Empower 3软件上采集到的TOC数据不是所测样品的准确浓度,而是电信号(mV),因此,需使用标准浓度的样品进行线性拟合,得到mV对应mg/L的对应关系曲线。如图4所示,R2=0.999 34,表明电信号(mV)与TOC(mg/L)相关性很强。
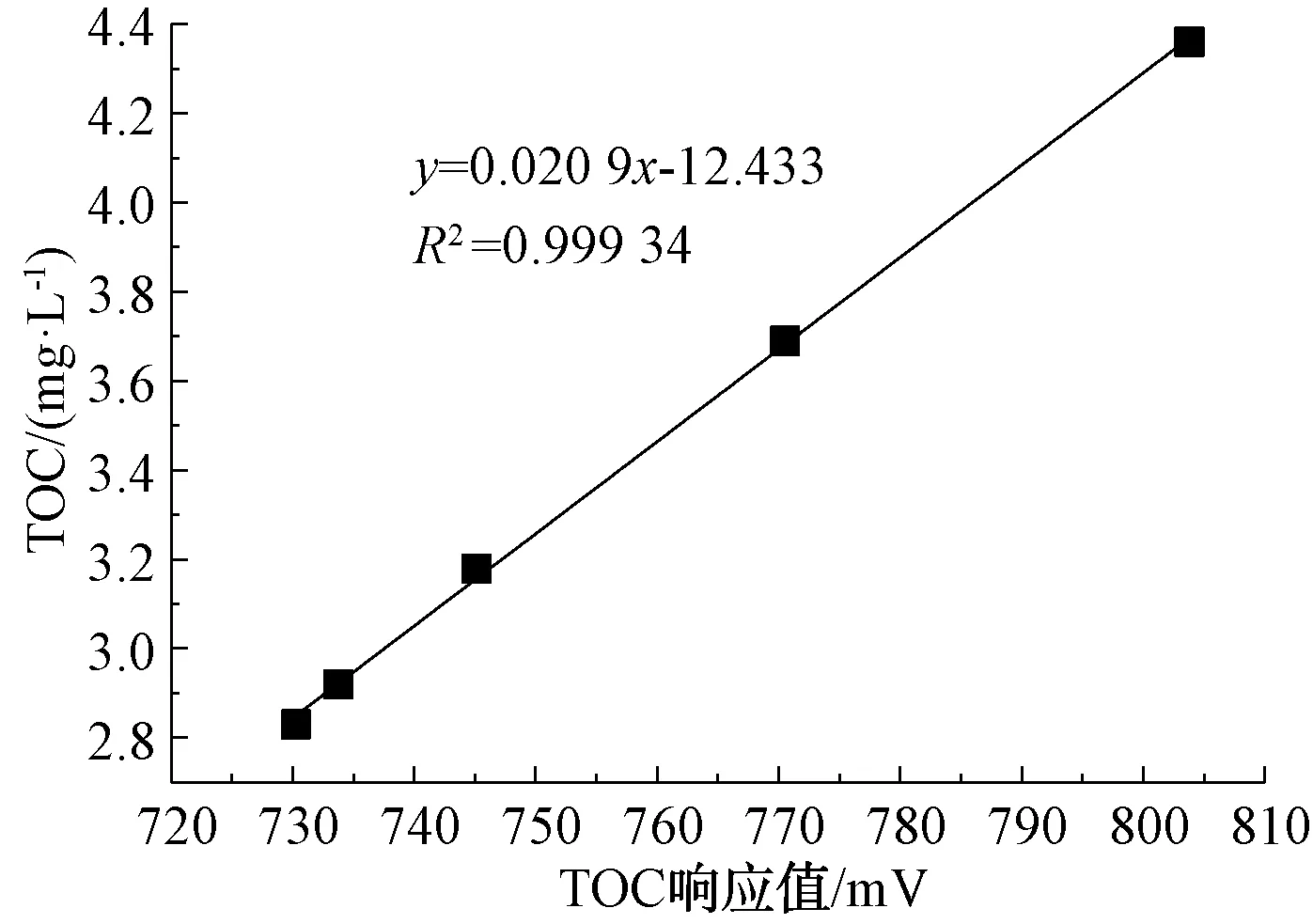
图4 TOC浓度与响应值关系曲线Fig.4 Correlation Curves between TOC Concentration and TOC Response Value
2.3 pH的影响
根据色谱柱的耐受pH值范围(2~12),将20 mg/L的葡聚糖T1溶液的pH值分别调节为3、5、7、9、11,以考察pH对样品测定的影响,结果如图5和表1所示。葡聚糖属于亲水性有机物,无法被传统的HPSEC-UV检测到,因而UV没有明显响应。由TOC测定结果可知,TOC响应峰宽一致,峰面积相近(表1),说明pH对葡聚糖T1的分子量测定影响较小。这与张晗等[11]的研究结果不同,可能是因为本试验TOC检测仪中H3PO4的投加量采用最大投加量2.0 μL/min,能够充分酸化样品中的无机碳,因此,在碱性条件下也能使样品分子量分布的TOC测定结果正常。
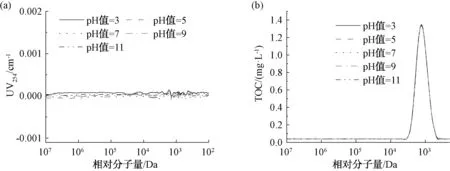
图5 不同pH值条件下的UV和TOC响应Fig.5 Effect of pH Values on UV and TOC Responses
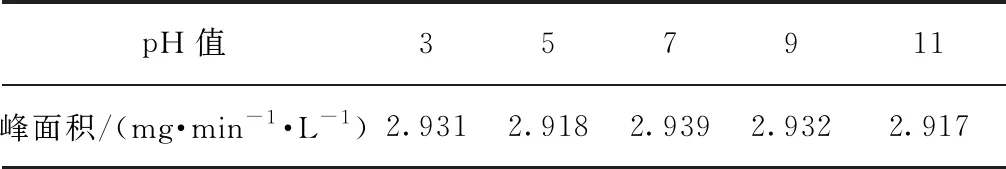
表1 不同pH值条件下的TOC峰面积Tab.1 Peak Areas of TOC under Different pH Values
2.4 离子强度的影响
以0~0.4 mol/L NaCl溶液考察离子强度(IS)对样品测定结果的影响,样品采用20 mg/L葡聚糖T1进行测定。结果如图6、表2、表3所示。由图6(a)可知,离子强度越高,紫外响应越高,表明离子强度对测定有机物相对分子质量分布有一定的影响。这可能是由于有机物在固定相中的吸附作用[12],或者是由于有机物随洗脱液离子强度的变化而发生了构象变化[13]。
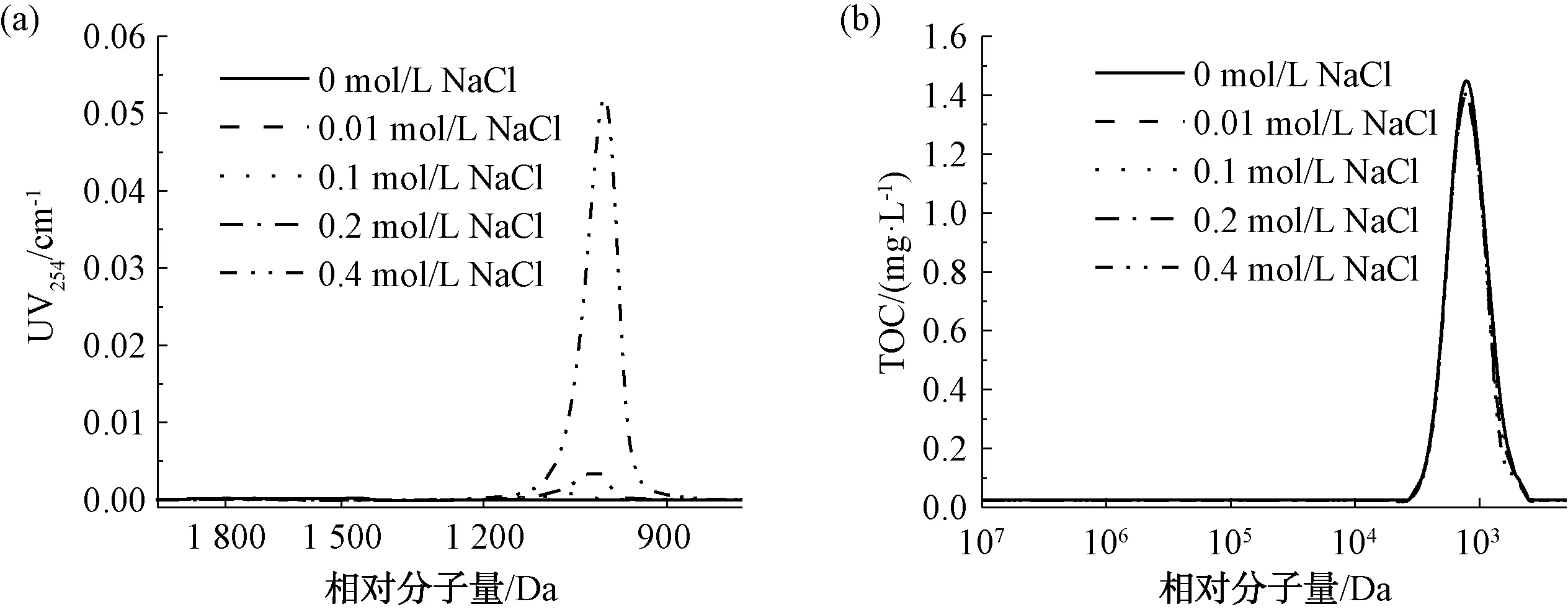
图6 不同离子强度条件下的UV和TOC响应Fig.6 Effects of Different Ionic Strengths on UV and TOC Responses

表2 不同离子强度条件下的UV出峰时间Tab.2 Elution Time of UV under Different Ionic Strengths
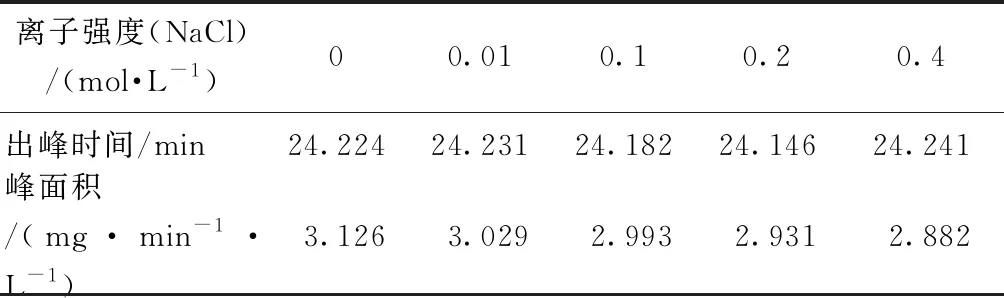
表3 不同离子强度条件下的TOC出峰时间和峰面积Tab.3 Elution Time and Peak Areas of TOC under Different Ionic Strengths
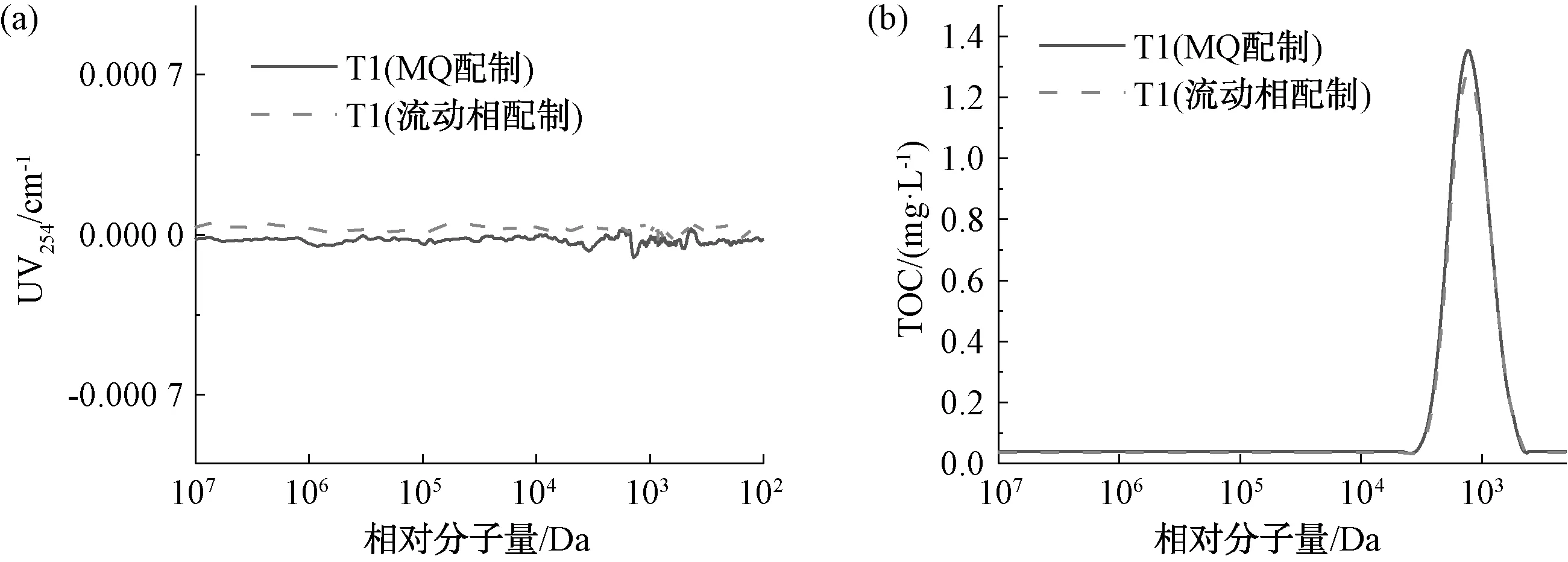
图7 不同样品配制溶液条件下的UV和TOC响应Fig.7 UV and TOC Peaks under Different Sample Solvents
由表2可知,离子强度从0.01 mol/L增加到0.4 mol/L NaCl,出峰时间依次增加,说明向测样中加入盐会导致样品被色谱柱延迟,分子量分布图偏移,测定结果偏小。这与Hine等[12]的研究结果相似,原因可能是离子强度会增强吸附作用,影响污染物在凝胶色谱柱中的迁移,从而导致不准确的分子量分布。
(3)
TOC + HClO → TOX + H2O
(4)
2.5 测试样配制溶液的影响
图7和表4为20 mg/L 的葡聚糖T1溶于超纯水和流动相后的测定结果。如图7(b)所示,用流动相配制的葡聚糖T1的TOC峰高略小于用超纯水配制的样品。两者峰宽基本一致,出峰时间相同,说明配样溶液与色谱柱的甲基丙烯酸酯填料之间相互作用小,因此,配样溶液对测定结果的影响较小。
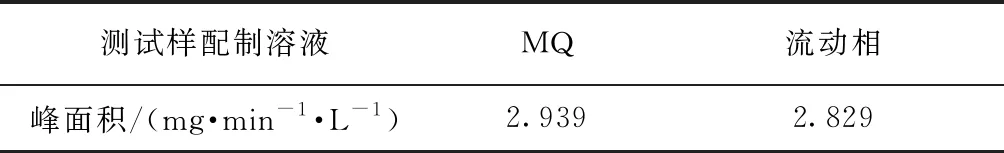
表4 不同测试样配制溶液条件下的TOC峰面积Tab.4 Peak Areas of TOC under Different Sample Solvents
2.6 天然原水的测定
黄河水样浓缩至20 mg/L后经树脂分离得到强疏、弱疏、极亲、中亲4种组分,回收率为101.76%,各组分浓度如表5所示。由表5可知,4种组分的TOC浓度从大到小依次为:中亲>弱疏>极亲>强疏。各组分分别经0.45 μm滤膜过滤后调节pH至中性,测定其分子量分布如图8和表6所示。

表5 原水各组分浓度Tab.5 TOC Concentration of Each Component in Raw Water
由图8可知,试验原水及其各组分中有机物分子量分布分为3部分。第一部分分子量较高(106~1.34×104Da),峰值对应的表观分子量为1.2×105Da。由图8(a)可知,这部分有机物的UV响应均较低。由图8(b)可知,只有原水及中亲组分在这一分子量分布区间出现TOC响应,说明原水含有的大分子有机物多为中性亲水组分,该类有机物多为一些高分子蛋白质、多糖等亲水性组分,此类物质对紫外光的吸收极低[15]。
第二部分为中等分子有机物(2 500~1 500 Da),峰值对应的表观分子量为1 545 Da,与后面的小分子峰分离较差。由图8(a)可知,该区间有机物对紫外有较高响应,可以推测其多为腐殖质类中分子有机物,此类有机物对紫外吸收极强,且结构复杂。由图8(b)可知,该区间原水中的有机物TOC响应最高,出峰面积最大,说明中等分子(2 500~1 500 Da)有机物在原水中含量最高。各组分在该区间的峰面积占原水的比例顺序从大到小依次为:中亲(35%)> 弱疏(26%)> 极亲(21%)> 强疏(18%),说明中亲组分构成原水中等分子(2 500~1 500 Da)有机物的主要部分。
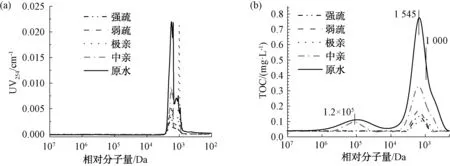
图8 各组分及原水UV和TOC变化图Fig.8 UV and TOC Responses of Each Component in Raw Water

表6 各组分及原水对应的TOC峰面积Tab.6 Peak Areas of TOC with Each Component in Raw Water
第三部分为小分子有机物(1 500~700 Da),峰值对应的表观分子量为1 000 Da,UV响应相比中等分子有机物较小,与中等分子区间的峰分离较差,说明这部分有机物大多数是小分子类有机物,所含碳碳双键和芳香族结构较少[16],也可能包含中等分子有机物的分解产物。
综上,由图8(a) 和图8(b) 可知,大分子(106~1.34×104Da)有机物、中等分子(2 500~1 500 Da)有机物和小分子(1 500~700 Da)有机物均主要由亲水性物质组成。由表6可知,各组分峰面积顺序依次为:中亲>弱疏>极亲>强疏,与固相萃取结果相同。值得注意的是,图8(a) 中极亲组分的UV响应值明显偏高,可能是由于极亲组分的洗脱液中含有较高浓度NaCl,使极亲样品的离子强度高于其他样品,样品与固定相之间发生了吸附或静电排斥反应,导致UV响应极高。图8(b)中极亲组分的响应峰滞后可能也与离子强度较高有关。
3 结论
本试验主要考察了pH、离子强度、配样溶液等操作条件对HPSEC-UV-TOC联用技术测定葡聚糖T1及天然地表水中有机物分子量分布的影响,所得结论如下。有助于完善HPSEC-UV-TOC联用技术,从而使得该技术在饮用水地表水源有机物组分研究中发挥更大作用。
(1)在色谱柱允许的pH范围内,pH对葡聚糖T1分子量分布的测定结果影响较小。
(2)离子强度对相对分子质量分布的测定影响较大,离子强度从0增加到0.4 mol/L NaCl时,UV响应有明显增加,而TOC出峰时间延后,峰面积减小。
(3)葡聚糖T1样品溶液采用超纯水为溶剂与采用流动相为溶剂相比,对其相对分子质量分布的测定影响较小。
(4)HPSEC-UV-TOC联用技术可有效表征黄河原水及其组分的分子量分布。原水中的中性亲水组分含量最高,且该组分在大分子(106~1.34×104Da)、中等分子(2 500~1 500 Da)和小分子(1 500~700 Da)有机物中均占较高比例。