miR-152通过调控FOXR2表达抑制人前列腺癌细胞增殖的研究
李阳波,李 健,贾志刚,许亚宏,刘 琼,莫 非,李弋戈
西部战区空军医院泌尿外科,四川成都 610021
前列腺癌是男性最为常见的恶性肿瘤之一,也是全球男性癌症患者的主要死因。随着人口老龄化程度加深,前列腺癌的发病率呈逐年上升趋势,而前列腺癌的发病机制至今未明[1]。微小RNA(miRNA)是哺乳动物体内广泛存在的一种内源性调节性保守的非编码RNA(ncRNA),其大小为18~25 nt,可以通过转录后调控模式调控靶基因的表达[2]。ncRNA可通过多种途径影响转化生长因子β、表皮生长因子和肿瘤坏死因子的表达,参与前列腺癌的发生、发展[3-4]。有研究指出,miR-200家族(miR-200a/b、miR-141和miR-429)可通过靶向调控Zeb2抑制前列腺癌的侵袭和转移,上调下游靶基因的表达从而抑制前列腺癌的进程[5]。此外,miR-410-3p可作用于磷酸酶及张力蛋白同源基因,调控AKT/mTOR信号通路,在前列腺癌发展过程中发挥促进作用[6];miR-141-3p可通过激活核因子-κB信号通路促进前列腺癌的远端转移[7]。研究发现,前列腺癌组织中miR-152的相对表达水平显著低于正常癌旁组织,随着肿瘤恶性程度的升高,前列腺癌组织中miR-152的相对表达水平越低[8]。生物信息学法预测叉头框蛋白R2(FOXR2)可能为miR-152的直接靶基因。因此,本文研究miR-152和FOXR2之间的调控作用,并探讨二者对前列腺癌细胞增殖的影响,为前列腺癌的发生机制提供依据。
1 材料与方法
1.1材料
1.1.1细胞株来源 人前列腺癌细胞株PC-3(前列腺癌细胞组)和前列腺上皮细胞株RWPE-1(对照组)购自美国标准菌库(ATCC)。
1.1.2细胞培养 PC-3和RWPE-1细胞于含10%胎牛血清的DMEM培养基中培养,37 ℃ 5% CO2,待细胞生长至70%~80%时,0.25%胰酶消化后以1∶3传代。
1.2方法
1.2.1仪器与试剂 DMEM培养基、胎牛血清购自美国Gibco公司。Trizol试剂、lipofectamine 2000购自美国Invitrogen公司。RIPA裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂、BCA蛋白检测试剂盒、蛋白上样缓冲液购自中国碧云天公司。FOXR2抗体和GAPDH内参抗体购自英国Abcam公司,引物由上海恒斐公司合成,TaqMan®Universal PCR Master Mix、TaqMan®MicroRNA Reverse Transcription Kit购自美国ABI公司,miR-152 mimics、miR-152 inhibitor和FOXR2-siRNA由上海吉玛公司合成。双荧光素酶检测试剂盒、pmir-GLO载体购自美国Promega公司。
1.2.2Western blot检测FOXR2蛋白水平 RIPA裂解液提取细胞总蛋白,BCA试剂盒进行蛋白浓度检测后,加入蛋白上样缓冲液,SDS-PAGE凝胶70 V转120 V电泳分离蛋白,250 mA转膜1.0 h,室温封闭1.5 h,FOXR2一抗(1∶1 000)4 ℃孵育过夜,二抗(1∶5 000)室温孵育2.0 h,超敏发光液显色,胶片曝光后,以GAPDH为内参,使用Image软件计算FOXR2蛋白水平,实验重复5次。
1.2.3实时荧光定量PCR(qPCR)检测miR-152和FOXR2 mRNA的表达 Trizol试剂提取细胞总RNA后,将其进行反转录,然后使用美国Bio-rad公司的 CFX96 qPCR仪进行基因扩增,SYBR Green染料标记产物,以GAPDH为内参,根据荧光强度计算目的基因的相对表达水平,实验重复5次。
1.2.4细胞转染 6孔板中接种106个PC-3细胞,无血清饥饿培养24 h。将转染物(miR-152 mimics、miR-152 inhibitor、FOXR2-siRNA)和lipofectamine 2000分别加入到等体积无血清培养基中,室温孵育5 min,然后将二者混匀后,继续室温孵育20 min,将混合液加入到已倾去培养基的6孔板中,培养箱中孵育6 h,然后更换为含10%胎牛血清的DMEM培养基,继续培养48 h,再进行检测。
1.2.5MTT法检测细胞活性 细胞转染后接种于96孔板,细胞培养箱中孵育48 h,每孔加入20 μL的 MTT溶液,4 h后弃去上清液,每孔加入200 μL的二甲基亚砜,37 ℃摇晃10 min后,490 nm处测定吸光度值(A490),评价细胞活性,用以反映细胞增殖能力。
1.2.6双荧光素酶报告基因检测 miRanda、NBmiRTar等数据库预测miR-152与FOXR2 3′ UTR可能的基因结合序列。将克隆的FOXR2 3′UTR区及其突变体分别插入到pmir-GLO载体,以此构建FOXR2 3′UTR野生型和突变型质粒。将miR-152 mimics、miR-152 inhibitor和miR-152 scramble分别与融合FOXR2 3′UTR区及其突变体的质粒共转染PC-3细胞。转染结束后,培养箱中孵育48 h,弃去液体后加入裂解液,室温放置10 min,-80 ℃冻融1次,离心收集上清液,加入荧光素底物,充分混匀10 s后,检测荧光强度,再加入海参荧光素酶底物,混匀10 s后再次检测荧光素酶活性,计算相对荧光强度,实验重复5次。

2 结 果
2.1RWPE-1和PC-3细胞中miR-152、FOXR2 mRNA的相对表达水平及FOXR2蛋白水平 PC-3细胞中miR-152的相对表达水平为RWPE-1细胞的40.91%(P=0.001);而PC-3细胞中FOXR2 蛋白水平及mRNA的相对表达水平分别为RWPE-1细胞中FOXR2 蛋白及mRNA的205.75%和167.61%(P=0.003、0.003)。见表1、图1。

表1 RWPE-1和PC-3细胞中miR-152和FOXR2 mRNA的相对表达水平及FOXR2蛋白水平
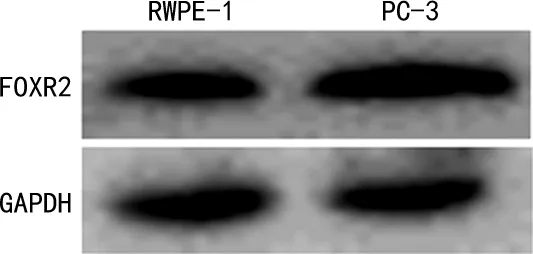
图1 RWPE-1和PC-3细胞中FOXR2蛋白表达的Western blot图
2.2miR-152和FOXR2对PC-3细胞增殖能力的影响 miR-152 mimics、miR-152 inhibitor和FOXR2-siRNA分别转染PC-3细胞后,通过MTT法评价细胞增殖活性,以各组A490值为计算依据,对照组A490值为0.91±0.18,miR-152 mimics、miR-152 inhibitor和FOXR2-siRNA组A490值的分别为0.66±0.88、1.18±0.14和0.59±0.06,该3组的细胞增殖效率与对照组相比,分别降低27.47%、升高29.67%和降低35.16%,差异均有统计学意义(P=0.022、0.029、0.006)。
2.3miR-152对PC-3细胞FOXR2 3′UTR区的影响 分别共转染miR-152 mimics、miR-152 inhibitor、miR-152 scramble和FOXR2 3′UTR突变型质粒后,荧光素酶活性均无显著变化(P=0.542)。miR-152 mimics、miR-152 inhibitor、miR-152 scramble分别与FOXR2 3′UTR野生型质粒共转染PC-3细胞后,荧光素酶活性分别显著降低、升高、无显著变化(P=0.001、0.001、0.428)。
2.4转染miR-152对PC-3细胞中FOXR2 mRNA相对表达水平及蛋白水平的影响 与对照组比较,转染miR-152 mimics后,miR-152 mRNA的相对表达水平升高10倍以上(P<0.001),而FOXR2 mRNA的相对表达水平及蛋白水平分别降低42.40%和29.73%(P<0.001、0.001),细胞活性降低28.74%(P=0.013)。转染miR-152 inhibitor后,miR-152的相对表达水平下降18.64%(P<0.001),而FOXR2 mRNA的相对表达水平及蛋白水平上升61.60%和54.05%(P<0.001、P=0.007),细胞活性增加37.93%(P=0.018)。见表2、图2。

表2 转染miR-152对PC-3细胞中FOXR2 mRNA相对表达水平及蛋白水平的影响

注:A表示转染miR-152 mimics对FOXR2蛋白的影响;B表示转染miR-152 inhibitor对FOXR2蛋白的影响。
3 讨 论
前列腺癌是一种男性泌尿生殖系统恶性肿瘤,全球发病率较高,且缺乏公认的治疗方法[9]。随着分子生物学的快速发展,以miRNA为靶标治疗肿瘤成为研究热点,miRNA通过结合靶基因3′UTR区在转录后水平调控靶基因的表达,与多种肿瘤的发生、发展、转移和预后等密切相关[10]。目前,已有多种miRNA被发现在前列腺癌患者血清或癌组织中异常表达,并且miRNA的相对表达水平与前列腺癌患者临床分级、化疗敏感性和骨转移等显著相关[11]。如miR-618可通过负调控FOXP2抑制前列腺癌的迁移和侵袭能力[12];miR-199a-3p可通过靶向调控Smad1抑制前列腺癌细胞的增殖和侵袭能力[13]。miR-152在其他肿瘤细胞中的作用已有报道,如miR-152-3p在非小细胞肺癌中抑制肿瘤细胞增殖,在子宫内膜癌中抑制肿瘤细胞形成、转移和侵袭[14]。研究表明,前列腺癌细胞中miR-152启动子序列呈高度甲基化,而miR-152异位表达可抑制前列腺癌细胞的增殖、转移和侵袭,且miR-152的相对表达水平降低可导致肿瘤转移增加等不良临床结果[15]。
生物信息学软件预测结果表明,FOXR2可能为miR-152的直接靶基因。FOX属于保守的转录因子家族,能够调控细胞增殖、分化、生长等关键生物学过程,其表达异常与多种肿瘤的发生、发展密切相关[16]。FOXR2是最新发现的一个致癌基因,可促进胶质瘤[17]、结直肠癌[18]、肝细胞癌[19]等多种肿瘤细胞增殖,成为治疗肿瘤的最新研究靶点。研究发现,FOXR2在前列腺癌细胞中过表达,降低FOXR2 mRNA的相对表达水平可显著抑制前列腺癌细胞增殖,有望成为治疗前列腺癌的新靶标[20]。
本研究结果表明,在PC-3细胞系中,miR-152的相对表达水平显著低于RWPE-1细胞系,而FOXR2 mRNA的相对表达水平及蛋白水平显著升高,表明miR-152和FOXR2对于前列腺癌的发生、发展具有重要作用。本研究结果显示,miR-152 mimics和FOXR2-siRNA分别转染PC-3细胞后,细胞增殖均显著降低,而miR-152 inhibitor转染PC-3细胞可使细胞增殖能力升高,该结果说明miR-152和FOXR2能够调控PC-3细胞增殖能力,甚至二者之间可能存在某些调控关系。生物信息学软件预测结果表明,FOXR2可能为miR-152的直接靶基因,而本研究双荧光素报告基因实验证实,miR-152可从基因水平直接负调控FOXR2基因表达。转染实验结果表明,转染miR-152 mimics后可下调FOXR2 mRNA的表达,继而抑制FOXR2蛋白翻译,降低FOXR2蛋白表达;转染miR-152 inhibitor可上调FOXR2 mRNA表达,最终增强FOXR2蛋白翻译能力,表明miR-152可通过直接负调控FOXR2基因转录,继而影响FOXR2蛋白翻译水平。以上结果提示可尝试通过增强前列腺癌细胞中miR-152基因表达,抑制FOXR2基因和蛋白表达,继而抑制细胞增殖,达到缓解前列腺癌的治疗目标。
综上所述,本研究发现上调miR-152表达能够抑制前列腺癌细胞增殖能力,该作用可能与其负调控FOXR2表达有关。

