吉西他滨、顺铂新辅助化疗治疗局部转移晚期膀胱癌的疗效及对抗肿瘤免疫的影响
沈德彬 邱树胜 苏秀玲
福建省龙岩市第二医院药剂科,福建龙岩 364000
膀胱癌是泌尿系统最多见的恶性肿瘤,早期临床表现不显著或者与前列腺增生等良性病变临床症状混淆,导致很大一部分患者临床确诊时已出现局部转移[1-2]。局部转移晚期膀胱癌患者的治疗方案选择直接关系到其最终预后,在术前采取若干疗程的保守化疗为后续肿瘤切除手术创造机会已经成为此类患者治疗的共识。局部转移晚期膀胱癌的新辅助化疗方案较多,其中吉西他滨联合顺铂(gemcitabine cisplatin,GC),甲氨蝶呤、长春花碱、阿霉素联合顺铂(methotrexate, vinblastine,adriamycin cisplatin,MVAC)是目前应用最多的两种[3]。为了明确两种化疗方案的临床应用价值,本研究将以接受术前化疗的局部转移晚期膀胱癌患者为对象,比较两种化疗方案的治疗获益,旨在为制订局部转移晚期膀胱癌患者新辅助化疗方案提供实践依据。
1 资料与方法
1.1 一般资料
回 顾 性 选 取2017年9月 至2020年1月 在龙岩市第二医院接受治疗的局部转移晚期膀胱癌患者77例作为研究对象,按照治疗方案将其分 为 接 受GC化疗的39例为GC组、接受MVAC化疗的38例为MVAC组。GC组患者男28例,女11例,年龄43~78岁,平均(65.74±12.98)岁,体重53~81 kg,平均(68.62±11.09)kg,肿瘤病理性质:膀胱尿路上皮癌33例、膀胱鳞状细胞癌5例、膀胱腺癌0例;MVAC组患者男27例,女11例,年龄45~79岁,平 均(65.69±12.51)岁,体 重55~84 kg,平 均(68.48±11.53)kg,肿瘤病理性质:膀胱尿路上皮癌32例、膀胱鳞状细胞癌5例、膀胱腺癌1例。两组患者的性别、年龄及体重比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准。
1.2 纳入及排除标准
纳入标准:①经膀胱病灶组织病理检查确诊原发性膀胱癌[4],肿瘤分期为局部转移晚期;②首次确诊并入院治疗、院外未行相关治疗;③年龄18~80岁;④全程配合并完成治疗;⑤患者或家属签署知情同意书。
排除标准:①化疗药物严重过敏或者出现无法耐受的不良反应,必须中断化疗;②无特殊情况、未经主管医师同意自主退出治疗;③合并基础性严重自身免疫性疾病;④合并全身感染性疾病;⑤有既往膀胱手术史。
1.3 新辅助化疗方案
GC组患者接受GC方案化疗,吉西他滨(北京协和药厂,国药准字H20103523)1000 mg/m2,静脉滴注,d1、d8;顺铂(德州德药制药有限公司,国药准字H20023236)70 mg/m2、静脉滴注,d1。以21 d为一化疗周期,连续化疗2周期后行膀胱癌手术治疗。
MVAC组患者接受MVAC方案化疗,甲氨蝶呤(广东岭南制药有限公司,国药准字H20074246)30 mg/m2、长春花碱(南京森贝伽生物科技有限公司)3 mg/m2,静脉滴注,d2、d15、d22;阿霉素(上海熹垣生物科技有限公司)30 mg/m2、顺铂70 mg/m2,静脉滴注,d2,以22 d为一化疗周期,连续化疗2周期后行膀胱癌手术治疗。
1.4 疗效评价标准
新辅助化疗完成后、手术实施前,采用实体瘤疗效评价标准判定两组患者的治疗效果,包括完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、稳定(stable disease,SD)、进展(progression disease,PD),有效率(response rate,RR)=(CR+PR)例数/总例数×100%。
1.5 相关免疫指标检测
新辅助化疗前、新辅助化疗完成后(手术实施前),留取两组患者的空腹外周血标本,采用流式细胞仪检测其中Th1细胞、Th2细胞以及Th17细胞、Treg细胞的比例,进一步计算辅助性T细胞(T helper cell,Th)1/T2比值、Th17/调节性T细胞(regulatory T cells,Treg)比值。
1.6 药物不良反应
治疗期间,记录两组药物不良反应的发生情况以及对后续手术影响,具体不良反应包括皮疹、胃肠道反应、骨髓抑制、肝肾功能异常。
1.7 统计学方法
使用SPSS 24.0统计学软件进行统计学处理。计量资料以()表示,采用t检验,计数资料以[n(%)]表示,采用χ2检验,等级资料采用秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组新辅助化疗治疗效果比较
GC组的疗效优于MVAC组,差异有统计学意 义(P<0.05)。且GC组 患 者 的 治 疗 有 效 率(82.05%)高于MVAC组(73.68%),差异有统计学意义(P<0.05)。见表1。

表1 两组新辅助化疗后疗效比较[n(%)]
2.2 两组新辅助化疗前后外周血中Th1、Th2细胞及Th1/Th2比值比较
新辅助化疗前,两组外周血中Th1细胞、Th2细胞比例及Th1/Th2比值比较,差异均无统计学意义(P>0.05)。新辅助化疗完成后,两组患者外周血中Th1细胞比例及Th1/Th2比值均高于新辅助化疗前,Th2细胞比例低于新辅助化疗前(GC组:t=9.192、6.654、7.675,MVAC组:t=5.383、3.955、4.273,均P<0.05);且GC组外周血中Th1细胞比例及Th1/Th2比值高于MVAC组,Th2细胞比例低于MVAC组,差异均有统计学意义(P<0.05)。见表2。
表2 两组新辅助化疗前后外周血中Th1、Th2细胞及Th1/Th2比值比较(±s)

表2 两组新辅助化疗前后外周血中Th1、Th2细胞及Th1/Th2比值比较(±s)
组别 n Th1(%) Th2(%) Th1/Th2新辅助化疗前 新辅助化疗后 新辅助化疗前 新辅助化疗后 新辅助化疗前 新辅助化疗后GC组 39 5.73±0.61 8.12±0.95 4.36±0.49 3.18±0.34 1.43±0.19 2.55±0.29 MVAC组 38 5.69±0.58 6.87±0.75 4.34±0.51 3.87±0.44 1.41±0.18 1.98±0.24 t值 0.295 6.398 0.175 7.712 0.474 9.383 P值 0.385 0.000 0.431 0.000 0.318 0.000
表3 两组新辅助化疗前后外周血中Th17、Treg细胞及Th17/Treg比值比较(±s)

表3 两组新辅助化疗前后外周血中Th17、Treg细胞及Th17/Treg比值比较(±s)
组别 n Treg(%) Treg(%) Th17/Treg新辅助化疗前 新辅助化疗后 新辅助化疗前 新辅助化疗后 新辅助化疗前 新辅助化疗后GC组 39 5.84±0.61 7.11±0.86 7.94±0.86 4.81±0.59 0.68±0.08 1.78±0.23 MVAC组 38 5.81±0.57 6.43±0.72 7.92±0.83 5.76±0.63 0.67±0.09 1.21±0.15 t值 0.223 3.935 0.104 6.832 0.516 3.226 P值 0.412 0.000 0.459 0.000 0.304 0.001
2.3 两组新辅助化疗前后外周血中Th17、Treg细胞及Th17/Treg比值比较
新辅助化疗前,两组外周血中Th17细胞、Treg细胞比例及Th17/Treg比值比较,差异均无统计学意义(P>0.05)。新辅助化疗完成后,两组患者外周血中Th17细胞比例及Th17/Treg比值高于新辅助化疗前,Treg细胞比例低于新辅助化疗前(GC组:t=7.686、9.339、13.492,MVAC组:t=3.847、7.685、11.484,均P<0.05);且GC组外周血中Th17细胞比例及Th17/Treg比值高于MVAC组,Treg细胞比例低于MVAC组,差异均有统计学意义(P<0.05)。见表3。
2.4 两组药物不良反应发生情况比较
治疗期间,两组患者的皮疹、胃肠道反应、骨髓抑制、肝肾功能异常等药物不良反应发生率比较,差异无统计学意义(P>0.05)。见表4。
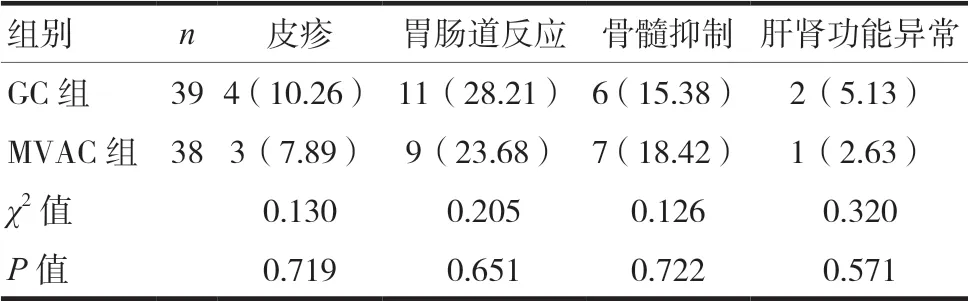
表4 两组药物不良反应发生情况比较[n(%)]
3 讨论
对于临床确诊处于局部转移晚期的原发性膀胱癌患者,采取新辅助化疗联合肿瘤切除手术治疗是最高效可行的方法,各个患者的手术方法相似,而具体新辅助化疗方案则存在较多选择,明确高效可行的新辅助化疗方案是当下临床研究的重点。MVAC属于传统新辅助化疗方案,其抑制肿瘤细胞活性的作用已经被认可,但化疗后造成骨髓抑制等严重毒副作用给患者带来较大伤害,甚至直接影响最终治疗效果的实现。GC是目前较为推崇的新辅助化疗方案,具有不良作用小、交叉无耐药等优势,已经在宫颈癌、卵巢癌等恶性肿瘤的术前化疗中得到成功应用[5-6]。本研究将GC用于局部转移晚期膀胱癌患者的治疗,通过与传统新辅助化疗方案MVAC的治疗效果进行比较,以期明确GC的可行性及有效性,具体从近期宏观疗效、外周血抗肿瘤免疫指标水平等方面展开。
膀胱癌作为一种实体瘤,其治疗后肿瘤体积变化情况是衡量近期疗效的首要标准。本研究两组患者新辅助化疗完成后的疗效差异显著,且GC组患者的治疗有效率达82.05%,显著高于MVAC组的73.68%,说明术前GC化疗方案较MVAC化疗方案在提升局部转移晚期膀胱癌患者近期疗效方面更具优势,宏观说明该化疗方案的高效性[7-8]。
关于GC化疗方案抑制局部转移晚期膀胱癌患者肿瘤恶性程度的具体免疫学机制,从Th1/Th2免疫平衡、Th17/Treg免疫平衡两方面展开研究。T淋巴细胞介导的免疫应答是机体抗肿瘤免疫的重要组成部分,辅助性T淋巴细胞(Th)不仅可以直接杀灭肿瘤细胞且可诱导抗肿瘤免疫应答,通过维持免疫记忆而实现持续性杀灭肿瘤细胞的作用[9-10]。在不同抗原刺激下Th可分化为Th1、Th2,其中Th1主要介导细胞免疫,可增强细胞毒性并介导迟发性超敏反应;Th2细胞则介导体液免疫并促使新抗体产生[11-12]。Th1、Th2细胞相互作用、彼此制衡以维持机体免疫功能正常,若其发生一方偏移则可导致多种疾病发生,在结直肠癌、乳腺癌等多种恶性肿瘤患者均发现存在Th1向Th2偏移,可导致机体抗肿瘤免疫功能受抑制并形成肿瘤免疫逃避,且随肿瘤恶性程度增加,这一偏移趋势随之加剧[13-15]。本研究结果显示,两组患者治疗后外周血中Th1细胞比例增加、Th2细胞比例下降,且Th1/Th2比值增加,其中GC组上述改变更为显著,以上结果说明两种新辅助化疗方案可不同程度逆转局部转移晚期膀胱癌患者的Th1/Th2偏移状态,其中GC新辅助化疗在逆转Th1/Th2偏移方面的作用更为显著,这也可能是GC方案更为有效杀灭肿瘤、缩小肿瘤体积的主要原因之一。
Th17/Treg细胞也参与机体抗肿瘤免疫,目前已在原发性肝癌患者外周血中发现Th17细胞比例下降,推测肿瘤微环境可促使Th17细胞向Treg细胞分化[16-17]。在卵巢癌裸鼠模型中发现,Treg/Th17比例增高可促进肿瘤增殖以及腹腔转移,且Treg细胞比例越高,肿瘤转移出现越早,可能与Treg细胞诱导肿瘤内部多种血管生成相关基因表达增加、肿瘤细胞血供及氧供增加相关[18]。本研究结果显示,两组患者治疗后外周血中Th17细胞比例增加、Treg细胞比例下降,且Th17/Treg比值增加,GC组治疗后上述细胞比例及比值变化更为显著,说明两种新辅助化疗方案均可逆转肿瘤环境下的Th17/Treg表达失衡,GC化疗方案均衡Th17/Treg细胞表达方面的作用更为显著,这也是其近期疗效更卓著的重要原因之一。
文中最后评估两组新辅助化疗方案的药物不良反应发生情况并发现,组间皮疹、胃肠道反应、骨髓抑制、肝肾功能异常等常见不良反应发生率无显著差异,可见两者均有良好的使用安全性。综上所述,局部转移晚期膀胱癌患者接受GC新辅助化疗,相较于传统MVAC新辅助化疗,具有更为卓著的近期疗效,其治疗作用的实现与均衡机体Th1/Th2、Th17/Treg抗肿瘤免疫平衡密切相关。

