刻画反应流程图 快速建立关系式 突破滴定计算题
江苏
(作者单位:苏州高新区第一中学)
一、高考情况分析
当下高考化学试题在高考评价体系框架的引领下,以真实情境为考查载体,科学设置考查内容,保证“四翼”要求,满足高校对高素质人才选拔的需要。化学计算的本质是对化学问题的数学处理过程,即对物质的组成、结构、性质及其变化规律的量化过程,以真实的定量分析实验为基础,根据实验测定的数据,通过计算确定物质的组成或揭示反应的规律,在高考题中备受青睐。近五年有关滴定分析法的考查情况如表1所示。

表1 近五年高考中有关滴定分析的考查
二、常见滴定分析法
通过分析发现,化学计算的考查通常以滴定分析为主,以真实的滴定情境为载体,通过化学计算确定物质的组成或揭示反应的基本规律,基于化学计算的学科应用功能设计试题,考查学生运用实验数据和结果进行化学计算的能力,培养学生从定量视角分析和解决化学实验问题的思维方式。常见滴定类型及对应的反应原理如表2所示。
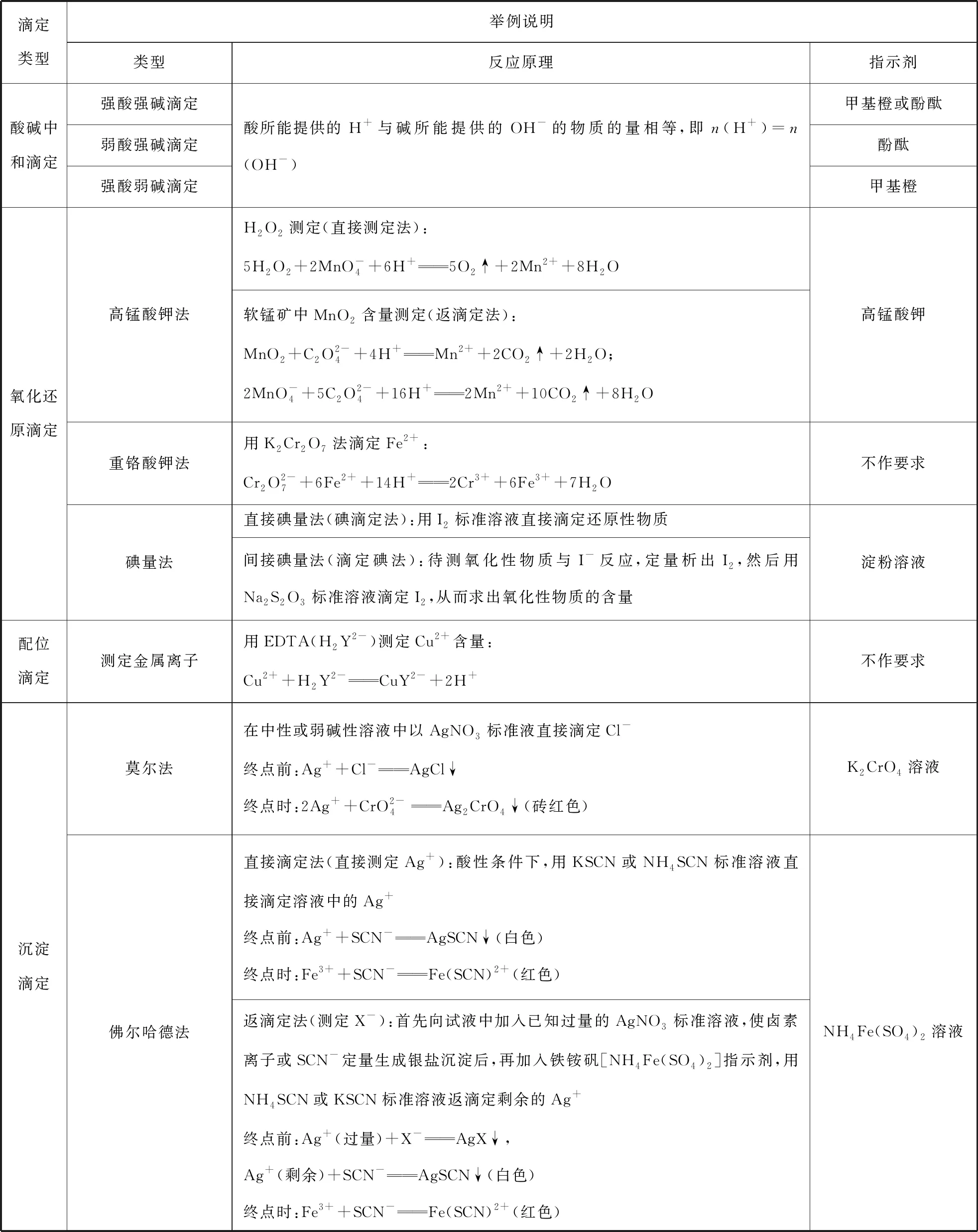
表2 常见滴定分析类型及反应原理
三、滴定分析考查落点
滴定类试题的考查角度主要有滴定曲线分析、指示剂选择、滴定终点判断、数据处理及误差分析等,具体分析如表3所示。

表3 滴定分析考查剖析
四、解题思维模型分析
化学计算的关键即找到已知量与未知量之间的关系,建立关系式进行解答。针对滴定类试题命题思路和意图,归纳总结了解答此类试题的思维模型如图1所示。

图1 化学计算思维模型
“一次性审题”就是一次性完成审题,审时要“边读题边刻画反应流程图”,并在线上标注反应过程、数据等关键信息,目的在于能准确、简洁、清晰地叙述出题意,缩短做题时间。
五、典型例题分析
1.酸碱中和滴定
【例1】(2017·北京卷·27节选)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。尿素溶液浓度影响NO2的转化,测定溶液中尿素[CO(NH2)2,M=60 g·mol-1]含量的方法如下:取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1mLc1mol·L-1H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L-1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________。
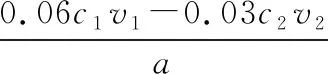
【反应流程分析】快速浏览试题可知,该题属于酸碱滴定计算,目标是计算尿素溶液中溶质的质量分数。对本题滴定分析如图2所示。
图2
【解析】由反应流程图可知,2NH3~H2SO4,2NaOH~H2SO4
H2SO4总量:n(H2SO4)=c1v1×10-3mol
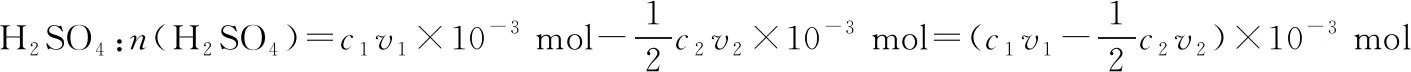
n(NH3)=2n(H2SO4)=(2c1v1×10-3-c2v2×10-3) mol
根据N原子守恒

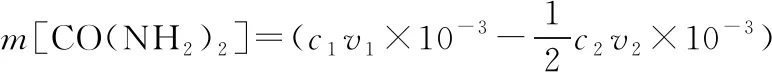
2.氧化还原滴定
【例2】(2019·江苏卷·18)聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(1)将一定量的FeSO4·7H2O溶于稀硫酸,在约70℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为____________________;水解聚合反应会导致溶液的pH________。
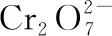
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将________(填“偏大”“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)。

(2)①偏大 ②具体计算过程见解析
【反应流程分析】本题可模仿无机工艺流程题来画反应流程图,如图3所示。
Fe3+、Cr3+
图3
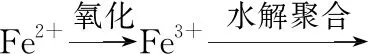
(2)①加入还原剂SnCl2,由Sn2+变为Sn4+,若不除去具有还原性的Sn2+,Sn2+与K2Cr2O7反应,则会消耗更多的K2Cr2O7,使测定的铁的含量偏高。


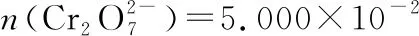
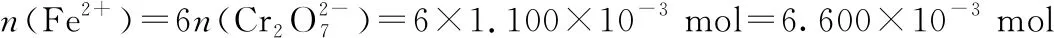
样品中铁元素的质量:
m(Fe)=6.600×10-3mol×56 g·mol-1=0.369 6 g
样品中铁元素的质量分数:
3.配位滴定

(1)制备碱式硫酸铝溶液时,维持反应温度和反应时间不变,提高x值的方法有___________。
(2)碱式硫酸铝溶液吸收SO2过程中,溶液的pH________(填“增大”“减小”或“不变”)。
(3)通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.330 0 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.100 0 mol·L-1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.080 00 mol·L-1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1-x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。
【答案】(1)适当增加CaCO3的量或加快搅拌速率
(2)减小
(3)具体过程见解析
【反应流程分析】该题要注意取样时溶液的倍数关系。
取25.00 mL
x=0.41
取2.50 mL
图4
【解析】25.00 mL溶液中:
2.50 mL溶液中:
n(Al3+)=n(EDTA)-n(Cu2+)=
0.100 0 mol·L-1×25.00 mL×10-3L·mL-1-0.080 00 mol·L-1×20.00 mL×10-3L·mL-1=
9.000×10-4mol
25.00 mL溶液中:n(Al3+)=9.000×10-3mol
1 mol (1-x)Al2(SO4)3·xAl(OH)3中:
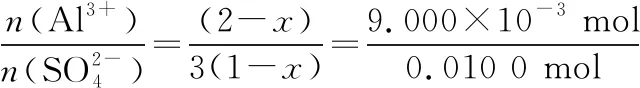
求得x=0.41
4.沉淀滴定
【例4】(2017·天津卷·9)用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.246 8 g(0.025 0 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.100 0 mol·L-1NH4SCN标准溶液,放在棕色试剂瓶中避光保存,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.100 0 mol·L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.100 0 mol·L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如表4:

表4
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有___________。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是___________。
(3)滴定应在pH<0.5的条件下进行,其原因是____________________。
(4)b和c两步操作是否可以颠倒________,说明理由___________。
(5)所消耗的NH4SCN标准溶液平均体积为________mL,测得c(I-)=________mol·L-1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为___________。
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果________。
【答案】(1)250 mL(棕色)容量瓶、胶头滴管
(2)避免AgNO3见光分解
(3)防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解)
(4)否(或不能) 若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点
(5)10.00 0.060 0
(6)用NH4SCN标准溶液进行润洗
(7)偏高 偏高
【反应流程分析】
图5
【解析】具体分析(5)、(6)、(7)
(5)根据所提供的三组数据可以看出第一组数据误差较大,应舍去,第二、三两组数据取平均值即可,所以消耗的NH4SCN标准溶液平均体积为10.00 mL,加入的AgNO3物质的量:n(AgNO3)=0.100 0 mol·L-1×25.00 mL。

n(AgNO3)=0.100 0 mol·L-1×10.00 mL。
则与NaI反应的AgNO3物质的量:
n(AgNO3)=0.100 0 mol·L-1×15.00 mL。

则c(I-)=0.060 0 mol·L-1。
(6)在滴定管中装入NH4SCN标准溶液前应用NH4SCN标准溶液进行润洗。
(7)①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,造成溶质减少,所配制的AgNO3标准溶液浓度偏低,测定结果偏高。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,造成读数偏小,则测定结果偏高。


