硝氮对狐尾藻附着生物膜细菌群落的影响
张松贺,袁 强,陈 洁,张子秋
(河海大学环境学院,江苏 南京 210098)

湿地作为一种经济实用、环保有效的措施广泛应用于污水处理中。水生植物吸收及微生物反硝化是湿地去除硝氮的主要途径[2]。与挺水和浮叶植物相比,沉水植物几乎全株生长在水面下,可直接从水体中积累养分[3]。生物膜是一种由细菌、真菌、藻类以及其他非生物成分组成的复杂微孔生物反应器[4],沉水植物可为其附着生物膜的生长提供合适的附着面以及稳定的有机碳源[2]。生物膜中的微生物在硝化反硝化等营养循环中起着关键作用[5]。然而,关于硝氮负荷下沉水植物附着微生物群落结构及相关反硝化微生物的响应机制仍不清楚。
本文以针状叶、根系不发达的沉水植物狐尾藻(MyriophyllumVerticillatum)为对象,研究不同硝氮浓度条件下狐尾藻叶片及其附着微生物的形态特征变化,利用高通量测序和定量PCR分析技术探讨微生物群落结构和反硝化基因丰度的变化规律,系统分析生物膜在硝态氮转化中的潜在作用,以期为沉水植物生态修复以及水环境保护提供参考。
1 材料与方法
1.1 试验方法
狐尾藻从南京高淳水生植物基地购买。试验装置使用140 L(700 mm×500 mm×400 mm)的水箱,添加7 cm混合均匀的沉积物(取自南京乌龙潭湖)以及30 cm的自来水。稳定一周后,每个水箱种植60株株高约30 cm且形态相近的狐尾藻(种植密度约300株/m2,种植深度为5 cm)。待植物驯化2周后,分别控制水体硝氮浓度为2 mg/L(M2)、8 mg/L(M8)、20 mg/L(M20)和40 mg/L(M40),并设置空白对照组M0。每2 d监测1次硝氮浓度,添加硝酸盐化合物(w(NaNO3)∶w(KNO3)=1∶1)以维持设定浓度。每组试验设置3个平行样,于河海大学浅水湖泊综合治理与资源开发教育部重点试验室温室内进行。
1.2 样品测定
1.2.1 水质及理化指标测定
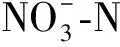
1.2.2 扫描电镜
试验第14天,分别采集M0和M20组的狐尾藻叶片。将植物切片后(5 mm×5 mm),依次使用30%、50%、70%、80%、90%浓度的酒精脱水15 min,再用100%浓度的酒精脱水2次,每次15 min,冷冻干燥12 h后备用。最终使用日立S-4800场发射扫描电镜进行观察。
1.2.3 生物膜采集
在水面下10~20 cm处采集约50 g的狐尾藻叶片,采集过程中注意避免沉积物的污染。将采集后的样品转移到含有500 ml磷酸盐缓冲液(PBS,pH为7.4)的聚乙烯瓶中,超声处理(150 W,40 kHz)1 min,225 r/min转速下振荡30 min后,通过50 μm的筛子去除植物碎屑,最后离心10 min(8 000 rpm)。离心后的生物膜保存在-80 ℃用于提取DNA。
1.2.4 PCR扩增
使用特定引物[2],利用定量聚合酶链反应(qPCR)方法测定生物膜DNA样品中反硝化基因的丰度。采用荧光染料SYBR-Green法,使用MyiQ2实时PCR检测系统(Bio-Rad)在20 μL反应混合物中进行qPCR扩增,反应物包括supermix(10 μL)、上下游引物(0.5 μL)、DNA模板(1 μL)和超纯水(8 μL)。qPCR扩增共包括40个循环。
1.3 数据分析
硝氮去除率及反硝化基因丰度使用Origin 8.0处理制图;利用SPSS(2000版)进行Pearson相关性指数分析和单因素方差分析;使用PAST软件(Version 3.10)基于Bray-Curtis距离在OTU水平上对细菌群落结构聚类分析;βSOR(Sørensen差异性指数)、βSIM和βNES使用R语言(Version 3.5.3)中的betapate软件包计算;生物膜门水平上的细菌群落分布使用R语言中的cirlize软件包分析;利用Heml软件绘制术细菌属水平热图;利用CANOCO(Version 4.5, USA)进行冗余分析;网络分析使用R语言中的psych包,基于Spearman相关系数(|r|>0.6,P<0.05)分析后,使用Gephi软件可视化。
2 结果与讨论
2.1 不同处理组对硝氮去除率及水体理化指标的变化
本研究监测了试验14 d内狐尾藻对硝酸盐的去除效果(图1),结果表明:各处理组前3 d对NO3-N的去除率高达92.11%~94.17%,但随着时间的累积均显著下降,在试验末期低于40%。初期阶段氮的去除可能与狐尾藻对硝氮的吸收吸附作用有关[6]。处理3 d后,M2对硝氮的去除率在13.09%~43.88%之间,但在同一取样时间点都始终大于其他3组的去除效果(2.96%~27.38%)。已有研究表明,沉水植物在过量氮负荷下会吸收比它们营养所需的更多氮,但这种额外的吸收会随着时间推移接近饱和而减少[7]。Li等[8]研究表明,暴露于硝氮浓度为10 mg/L的水体14 d后,沉水植物苦草的生理活性受到显著抑制。这些结果说明高硝氮可能对狐尾藻产生了胁迫。

图1 狐尾藻对硝酸盐去除率的变化Fig.1 Changes of nitrate removal rate by Myriophyllum Verticillatum
试验14 d内监测了各处理组水体理化参数,如表1所示。电导率Ec随硝酸盐浓度升高而升高。与对照M0相比,M2-M40处理组水体的pH、DO和ORP的均值均下降。高浓度硝氮负荷下水体DO和pH的降低与狐尾藻受抑制的光合系统有关,植物减少了对二氧化碳吸收及氧气释放[8];另外,生物膜形成过程中微生物的繁殖也会加大水体耗氧[9]。

表1 试验14 d内对照(M0)及硝酸盐处理组(M2-M40)水体的理化特征
2.2 狐尾藻叶片及表面附着生物膜形态变化
根据电镜图像,对照处理下狐尾藻叶片结构清晰可见,附着了少量微生物,存在有典型的杆菌群落(图2(a));而20 mg/L硝氮处理14 d后,狐尾藻表面附着了大量的细菌(球菌、芽孢杆菌和其他细菌)、微生物聚集团和藻类等微生物,这些微生物通过自身分泌的物质粘连聚集在一起,形成了明显的生物膜群落结构[10](图2(b))。这表明硝氮施加刺激了沉水植物附着生物膜的增长[9],过量附着微生物会影响植物对光的接收,进而抑制沉水植物生长。

图2 狐尾藻叶片表面扫描电镜照片Fig.2 SEM photographs of Myriophyllum Verticillatum leaves surface
2.3 不同处理组狐尾藻附着生物膜细菌群落特征
根据高通量测序结果,对细菌多样性指数进行了分析(表2)。与对照M0相比,M2-M40的细菌物种丰富度(OTU数量)、群落多样性(shannon和simpson指数)和群落均匀度(simpson均匀度)均显著降低(ANOVA,P<0.05)。这些结果说明硝酸盐的富集显著降低了狐尾藻附着生物膜细菌群落的生物多样性。与本研究结果类似,Zhang等[2]发现水体中的硝氮负荷降低了金鱼藻附生生物膜的微生物多样性。

表2 生物膜样品细菌测序α多样性指数
聚类分析将5个生物膜样品分为2组:硝氮处理样品M2-M40聚集为组Ⅰ,而对照M0单独在组Ⅱ内(图3(a)),这表明硝氮的施加显著改变了狐尾藻附着生物膜的细菌群落结构。βSOR多样性可用来描述微生物群落间的差异程度。根据物种的存在与否,βSOR可将生物多样性过程归结于两种生物现象:βNES(生物因死亡或迁移造成的物种损失)和βSIM(物种更替)[11]。研究中βSOR多样性结果表明,硝酸盐胁迫下细菌群落多样性构建过程中(βSOR= 0.60),物种更替现象(βSIM= 0.44)大于物种损失(βNES= 0.16)。

图3 细菌群落OTU水平聚类和主要门/变形菌纲相对丰度Fig.3 OTU level cluster analysis of bacterial community, and relative abundance of major phyla/Proteobacteria
在5个附着生物膜样品中共有12个细菌门占优势(至少在一个生物膜样品中排前10)(图3(b))。Proteobacteria(53.57%~71.92%)是最主要的门,其次是Planctomycetes(9.60%~20.1%)、Cyanobacteria(1.86%~15.12%)、Bacteroidetes(2.37%~5.13%)、Actinobacteria(3.66%~4.80%)、Acidobacteria(1.22%~3.74%)、Firmicutes(0.28%~1.34%)、Verrucomicrobia(1.12%~2.76%)、Chloroflexi(0.04%~1.69%)和Nitrospirae(0.03%~0.70%)等。在Proteobacteria内,5个生物膜样品内均检测到α-proteobacteria(35.94%~53.77%)、β-proteobacteria(11.06%~15.54%)、γ-proteobacteria(3.58%~4.75%)和δ-proteobacteria(0.25%~1.89%)(图3(b))。
与氨氮的施加相比[4],硝酸盐负荷下沉水植物附着生物膜中Nitrospirae和Chloroflexi的相对丰度较低,而Planctomycetes的相对丰度较高。α-proteobacteria和β-proteobacteria在异养反硝化反应器中对硝酸盐的去除起着重要作用[12],其在M2、M8、M20、M40样品中的丰度也显著高于M0(P<0.05)。Planctomycetes含碳水化合物水解基因[2],Bacteroidetes和Actinobacteria能消化植物纤维、水解有机物[13]。这些结果表明硝氮可刺激与硝酸盐转化相关细菌的生长。蓝细菌门Cyanobacteria光合能力较强,是河湖系统中常见的自养细菌[14],其丰度在对照M0中较高。
2.4 优势属及反硝化基因的变化
5个生物膜样品中共监测出23个优势属(至少在一个生物膜样品中排前10)(图4(a))。其中包含7个反硝化细菌属:Rhodobacter(7.53%~27.68%)、Hyphomicrobium(1.09%~5.42%)、Agrobacterium(0.38%~2.59%)、Flavobacterium(0.66%~1.66%)、Acinetobacter(0%~1.06%)、Pseudomonas(0.08%~0.91%)和Bacillus(0.08%~0.31%)[2]。反硝化是自然生态系统中氮循环的重要一环。在本研究中,Rhodobacter是生物膜中最主要的反硝化细菌。Rhodobacter、Acinetobacter和Bacillus的丰度在M2、M8、M20、M40样品中均高于M0。Rhodobacter在异养条件下可去除大量硝态氮[15];Pang等[16]发现Rhodobacter和Acinetobacter也是狐尾藻附着生物膜的优势反硝化细菌;Bacillus是污水处理厂和湿地脱氮中常见的异养反硝化菌[17]。这些结果表明硝氮刺激了上述反硝化细菌的增长,在湿地微生物反硝化过程中发挥了重要作用。
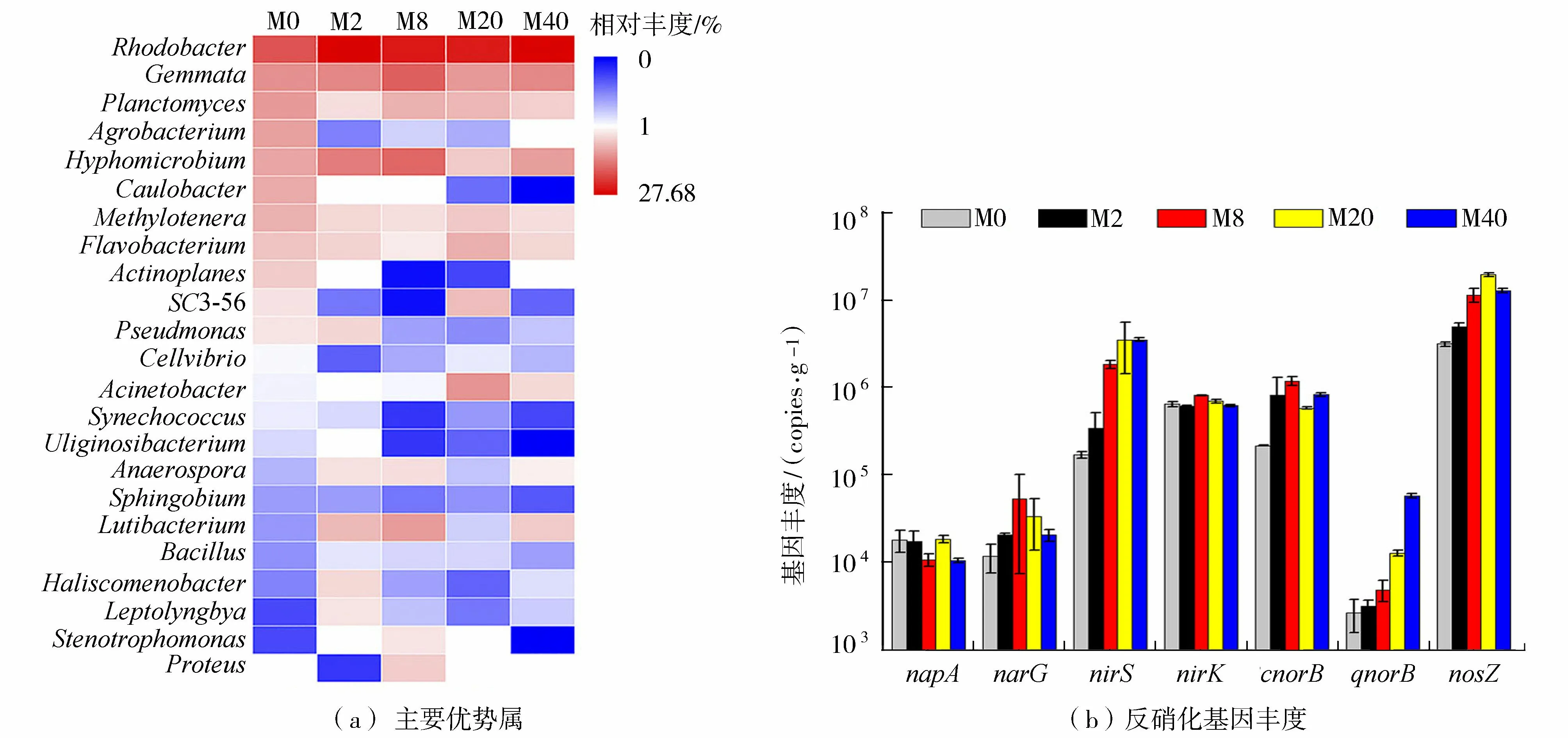
图4 5个生物膜样品中主要优势属及反硝化基因丰度Fig.4 Dominant genera and abundance of denitrification genes in five biofilm samples

2.5 优势属和反硝化基因对环境参数的响应
采用RDA方法描述了环境参数与生物膜内优势属、反硝化基因间的潜在关系(图5),结果显示反硝化细菌(Rhodobacter、Acinetobacter和Bacillus)及反硝化基因(nirS、cnorB、qnorB和nosZ)与硝氮浓度呈正相关,这与Yan等[3]的研究结果总体一致。基因napA需在完全好氧条件下表达及发挥功能[17],好氧反硝化细菌Hyphomicrobium和Pseudomonas[2]及基因napA均与DO呈正相关。pH也是影响反硝化的重要指标,已有研究表明pH值较低的环境会抑制反硝化细菌Agrobacterium[20]和Flavobacterium[21]的增长。在本研究中这两种反硝化菌的丰度也均与pH呈正相关。这些结果说明硝氮负荷下,硝氮浓度、DO和pH是影响湿地反硝化微生物群落的主要环境因素。

图5 优势属和反硝化基因对环境参数响应的冗余分析(RDA)Fig.5 Redundancy analysis (RDA) of the response of dominant genera and denitrification genes to environmental parameters
2.6 优势属和反硝化基因的网络分析
生物膜微生物间存在复杂的相互作用[2],网络共现性分析常用于描述系统内微生物间的相互作用。本研究对23个优势属及7个反硝化基间的相互关系进行了分析(图6),其中每个节点代表一个属/基因,每条边代表其所连接属/基因间的相关性(红色为正相关,蓝色为负相关)。对无任何显著相关性的节点剔除后,共得到25个节点(20个细菌属,5个反硝化基因),74条具有显著相关性边(52条边呈正相关,22条边呈负相关)。参与有机物降解菌Anaerospora[22]和Lutibacterium[23]分别具有8条和7条相关关系边,是本研究生物膜网络结构的关键节点,在营养循环及维持生物膜结构稳定方面起着关键作用[22]。

图6 优势属及反硝化基因之间相互关系网络Fig.6 Relationship network diagram among dominant genera and denitrification genes
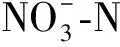
3 结 语
沉水植物狐尾藻对湿地水体中硝态氮的初次去除具有显著效果(92.11%~94.17%),而后去除效率逐步降低。硝酸盐负荷对生物膜的生长具有促进作用,但降低了附着生物膜细菌多样性。βSOR多样性指数表明硝酸盐胁迫下,细菌群落多样性构建过程中物种更替现象(βSIM=0.44)大于物种损失(βNES=0.16);硝酸盐负荷对附着生物膜的细菌微生物群落结构具有显著影响,且刺激了反硝化细菌(Rhodobacter、Acinetobacter和Bacillu)的生长及反硝化基因(napG、nirS、cnorB、qnorB和nosZ)丰度的增加;生物膜微生物间存在复杂的相互作用,参与有机物质降解菌属Anaerospora和Lutibacterium是生物膜网络结构的关键节点。
——以武汉东湖为例
——以武汉紫阳湖为例

