对新修订《药品生产监督管理办法》中药品生产许可延续条款的评析和建议
梁云 邵蓉
中圖分类号 R951 文献标志码 A 文章编号 1001-0408(2021)09-1032-06
DOI 10.6039/j.issn.1001-0408.2021.09.02
摘 要 目的:为有关部门进一步明确药品生产许可延续的定义和适用规则、加强药品生产监督管理提供参考。方法:通过对比研究、文献研究、实证研究与新规章的解读,从药品生产许可延续的定义出发,结合实际案例和基层实践,对《药品生产监督管理办法》中药品生产许可延续的定义、存在问题、修订要点等方面进行全面评析,并提出相应适用建议。结果与结论:在定义方面,药品生产许可延续是指药品生产企业如果还需要在其药品生产许可证有效期届满后继续从事药品生产有关活动的,应当在有效期届满前六个月,向省级药品监督管理部门申请延续其药品生产许可证有效期的行为。在主要问题方面,主要存在行政机关是否可以受理相对人逾期提交的申请不明确、行政机关换发药品生产许可证的审查标准不合理、“视为同意换证”模式许可规则的后续程序不规范等问题。新修订《药品生产监督管理办法》规定,药品生产许可证的换发不再需要按照药品生产企业开办的程序和要求进行审查,而是根据风险管理原则进行审查。这些修订内容体现了强化风险管理、形成风险闭环的原则,明确了药品生产许可延续的审查标准,优化了审批条件和要求,提高了行政许可的效率。在适用情形方面,建议明确药品生产许可延续受理与决定的时限和有效性,赋予行政机关对逾期延续申请受理的自由裁量权。
关键词 药品管理法;药品生产监督管理办法;行政许可法;修订;药品生产许可延续
Comment and Suggestion on the Renewal Clause of the Drug Production License in the Newly Revised Measures for Supervision and Administration of Pharmaceutical Production
LIANG Yun,SHAO Rong(National Drug Policy and Medical Industry Economy Research Center, China Pharmaceutical University, Nanjing 211198, China)
ABSTRACT OBJECTIVE: To provide reference for the relevant departments to further clarify the definition and applicable rules of drug production license renewal, and strengthen the supervision and administration of drug production. METHODS: Through comparative study, literature study, empirical study and the interpretation of new regulations, from the definition of drug production license renewal, combined with actual cases and grass-roots practice, drug production license renewal in the Measures for Supervision and Administration of Pharmaceutical Production were comprehensively evaluated and analyzed in terms of the definition, existing problems and revision points. The relevent application suggestion was put forward. RESULTS & CONCLUSIONS: In terms of definition, the renewal of the drug production license refers to the behavior of a drug manufacturer that needs to continue to engage in drug production activities after the expiration of the validity period, and should apply to the original issuing authority to extend the validity period of the drug production administrative license at 6 months before the expiration of the validity period. In terms of the main problems, there are some problems, such as whether the administrative organ can accept the application submitted after the deadline is not clear; the examination standard of the administrative organ to renew the drug production license is unreasonable; the follow-up procedure of the license rule of the “deemed to agree to renew the license” mode is not standardized. The renewal of the drug production license in the newly revised Measures for the Supervision and Administration of Pharmaceutical Production no longer needs to be reviewed in accordance with the procedures and requirements of the drug manufacturer, but in accordance with the principles of risk management, which reflecting the principle of strengthening risk management and forming risk closed-loop, defining the review standard of drug production license renewal, optimizing the conditions and requirements of approval, and improving the effectiveness of administrative license. In terms of application, it is suggested to clarify the time limit and validity of the acceptance and decision of drug production license renewal, and grant administrative agencies with the discretion to accept the application for overdue renewal.
KEYWORDS Pharmaceutical Administration Law;Measures for Supervision and Administration of Pharmaceutical Production;Administrative License Law;Revise; Drug production license renewal
为贯彻落实2019年新修订《药品管理法》[1],加强药品生产监督管理,国家药品监督管理局对原《药品生产监督管理办法》[2]进行了全面修订,并于2020年7月1日起施行。此次修订的《药品生产监督管理办法》[3],目的在于全面贯彻和落实新修订《药品管理法》对药品生产监督管理的最新要求,解决当前我国药品生产监管所面临的突出问题,进一步强化药品全生命周期管理,守住药品质量安全底线,从而保障人民用药安全[4]。此次《药品生产监督管理办法》的修订在总体思路和具体条款上均有重大调整。其中,对延续药品生产许可证条款,即《药品生产监督管理办法》第十九条也进行了修订,体现了风险管理的原则。笔者将从药品生產许可延续的定义出发,结合实际案例,对药品生产许可延续的定义、存在问题和修订要点等方面进行全面评析,并提出相应适应建议,以期为有关部门进一步明确药品生产许可延续的定义和适用规则、加强药品生产监督管理提供参考。
1 药品生产许可延续的定义
《行政许可法》第五十条第一款规定,“被许可人需要延续依法取得的行政许可的有效期的,应当在该行政许可有效期届满三十日前向作出行政许可决定的行政机关提出申请。但是,法律、法规、规章另有规定的,依照其规定”[5]。由此可知,所谓许可延续一般是指被许可人如果还需要在其行政许可有效期届满后继续从事有关活动的,应当在有效期届满前,向行政机关申请延伸行政许可有效期的行为[6]。
换发药品生产许可证属于行政许可事项,受《行政许可法》的调整。《药品生产监督管理办法》作为部门规章,对如何延续药品生产许可证进行了具体规定。原《药品生产监督管理办法》第十九条规定,药品生产许可证有效期届满,需要继续生产药品的,药品生产企业应当在有效期届满前六个月,向原发证机关申请换发药品生产许可证。原发证机关结合企业遵守法律法规、《药品生产质量管理规范》和质量体系运行情况,按照本办法关于药品生产企业开办的程序和要求进行审查,在药品生产许可证有效期届满前作出是否准予其换证的决定。符合规定准予换证的,收回原证,换发新证;不符合规定的,作出不予换证的书面决定,并说明理由,同时告知申请人享有依法申请行政复议或者提起行政诉讼的权利;逾期未作出决定的,视为同意换证,并予补办相应手续[2]。
综上,笔者认为所谓药品生产许可延续就是指药品生产企业如果还需要在其药品生产许可证有效期届满后继续从事药品生产有关活动的,应当在有效期届满前六个月,向省级药品监督管理部门申请延续其药品生产许可证有效期的行为。
2 原药品生产许可延续条款存在的主要问题
原《药品生产监督管理办法》第十九条规定了药品生产许可延续的相关规则,包括一般规则以及“视为同意换证”的默示许可的特殊规则。看似简单的药品生产许可延续规则,在具体适用中却引发了较多的争议,笔者选取了一些实践执法中发生的典型案例进行评析。
2.1 典型案例
案例1:某省药品监督管理局(以下简称“药监局”)为A药品生产企业换发药品生产许可证,批准生产时间为2015年9月1日至2020年8月31日。2020年8月7日,A药品生产企业向该省药监局提交延续药品生产许可证申请。2020年9月1日,该省药监局作出决定,同意A药品生产企业的药品生产许可证延续申请,并重新发证。甲作为利害关系人,认为A药品生产企业未在法定期限内对药品生产许可证延续提出申请,其药品生产权已经终止,该省药监局超期作出重新发证的决定违法,请求法院撤销该省药监局对A药品生产企业作出的许可延续决定。
案例2:B药品生产企业的药品生产许可证有效期为2011年9月1日至2015年8月31日。在有效期届满前六个月,B药品生产企业向某省药监局提出许可延续申请。该省药监局在受理后根据原《药品生产监督管理办法》的规定,以B药品生产企业没有配备必要的仪器设备为由作出不予行政许可决定。B药品生产企业不服,认为申请延续药品生产许可权行政许可不应适用开办标准的规定,其在药品生产许可有效期内,并没有受到行政机关的行政处罚,应适用原《药品生产监督管理办法》第十九条关于延续的规定,行政机关应当予以重新发证,遂向法院提起行政诉讼。
案例3:2017年11月,夏某通过药品投诉举报电话12331,称C药品生产企业的药品生产许可证已过期。该省药监局告知夏某,C药品生产企业已经在法定期限内向该省药监局提交了许可延续申请,因其申报材料尚需补充完善,该省药监局对其延续申请采取默示许可,其药品生产许可予以延续,但尚未重新发证。夏某不服,向法院提起行政诉讼。
2.2 主要问题分析
上述典型案例反映了药品生产许可延续条款在基层执法实践中主要存在以下问题。
2.2.1 行政机关是否可以受理相对人逾期提交的申请不明确 虽然原《药品生产监督管理办法》第十九条第一款规定,“药品生产企业药品生产许可证有效期届满,需要继续生产药品的,应当在有效期届满前六个月提出延续许可申请”[2]。但是,该款并没有明确规定,如果相对人逾期提交药品生产许可延续申请,省级药品监督管理部门是否能以相对人逾期提交为由不予受理?同时,该款也没有明确申请人逾期提交药品生产许可延续的后果。例如在上述案例1中,A药品生产企业按照原《药品生产监督管理办法》第十九条第一款规定,应当在有效期届满前六个月,即2020年2月29日前提出延续许可申请,但A药品生产企业直到2020年8月7日才提起延续申请,属于逾期申请,但在此案例中,该省药监局还是受理了A药品生产企业的换证申请,这种做法是否违法?而且,该省药监局还作出了重新发证的行政许可决定,该重新发放药品生产许可证的行政许可决定是否有效且合法?上述问题在实际执法中,均存在不同意见,造成基层监管人员的执法困惑。
2.2.2 行政机关换发药品生产许可证的审查标准不合理 《行政许可法》第五十条没有明确规定行政许可延续的审查标准,这为下位法留下了立法空间。原《药品监督管理办法》第十九条明确规定,行政机关应当按照本办法关于药品生产企业开办的程序和要求进行审查。在上述案例2中,B药品生产企业认为换发药品生产许可证时,行政机关用新开办的标准对其进行审查的做法不合理,故诉至法院。那么,在换发药品生产许可证时,行政机关是否有必要一定要按照开办时的要求去审查换证企业?这么做既增加了申请人的负担,又增加了行政许可的成本。如果不按照新开办的标准去审查,那么行政机关应当按照什么标准去审查换证企业,以保证换发药品生产许可证后的企业也符合药品生产条件和要求?审查标准设置的不合理既导致行政机关无法可依,可随意审查,又导致行政许可相对人的困惑,增加了许可成本。
2.2.3 “视为同意换证”默示许可特殊规则的后续程序不规范 原《药品生产监督管理办法》第十九条第二款中“逾期未作出决定的,视为同意重新发证,并予补办相应手续”的规定,源自《行政许可法》第五十条第二款中“视為准予延续”这一行政许可延续的特殊规则,目的在于督促行政机关及时高效地审查许可延续申请[7]。但该项规则在实际执行中仍遇到很多问题,例如在上述案例3中,某省药监局受理了C药品生产企业的换证申请,但逾期未作出行政许可决定,是否可以直接适用该规则认定C药品生产企业直接获得新的药品生产许可证?如果认为C药品生产企业已经获得了新的药品生产许可证又将引发新的问题,即该药品生产许可证是否有效期也是5年?如果该省药监局对C药品生产企业后来又作出了不予换证的决定,而该企业在这段时间生产了药品,该药品如何定性?是属于合法生产的药品还是无证生产的药品?行政机关是否可以对其进行处罚?上述种种问题就是推定默示延续许可缺乏后续程序规范,导致存在超期推定延续效力隐形状态和许可延续效力外化的矛盾[7]。此外,该条款中所提及的“逾期”中的“期”是指药品生产许可证有效期届满的日期还是指行政机关换发药品生产许可证的期限日期?这在实践中会有不同的解读,从而造成执法困惑。
3 新修订《药品生产监督管理办法》中药品生产许可延续条款的修订要点
新修订《药品生产监督管理办法》第十九条规定,“药品生产许可证有效期届满,需要继续生产药品的,应当在有效期届满前六个月,向原发证机关申请重新发放药品生产许可证。原发证机关结合企业遵守药品管理法律法规、药品生产质量管理规范和质量体系运行情况,根据风险管理原则进行审查,在药品生产许可证有效期届满前作出是否准予其重新发证的决定。符合规定准予重新发证的,收回原证,重新发证;不符合规定的,作出不予重新发证的书面决定,并说明理由,同时告知申请人享有依法申请行政复议或者提起行政诉讼的权利;逾期未作出决定的,视为同意重新发证,并予补办相应手续”[3]。与原办法相比,新修订《药品生产监督管理办法》第十九条在简化行政许可材料和程序、提高延续许可效率上有一定的进步,修订的要点主要有以下几个方面。
3.1 明确规定换发药品生产许可的申请期限
新修订《药品生产监督管理办法》规定重新换发药品生产许可证的时限是在“有效期届满前六个月”,这与《行政许可法》规定的“有效期届满三十日前”虽有冲突,但《行政许可法》同时也规定了但书条款,即“但是,法律、法规、规章另有规定的,依照其规定” 。因此,新修订《药品生产监督管理办法》作为部门规章,是可以突破《行政许可法》第五十条第一款的规定,就药品生产许可证延续的特殊情况设置特别时限[8]。
3.2 合理设置行政机关换发药品生产许可证的审查标准
新修订《药品生产监督管理办法》规定原发证机关(即各省药品监督管理部门)重新换发药品生产许可证的审查依据基于以下3点:①企业遵守药品管理法律法规的情况,即换证企业是否有违法违规情况;②药品生产质量管理规范和质量体系运行情况,即换证企业是否有违反《药品生产质量管理规范》(GMP)的情况;③根据风险管理原则进行审查,即按照风险等级对换证企业进行分类管理。对比原办法第十九条的规定,新修订办法第十九条最大的变化就在于此。原《药品生产监督管理办法》第十九条要求发证机关的审查依据是“原发证机关结合企业遵守法律法规、《药品生产质量管理规范》和质量体系运行情况,按照本办法关于药品生产企业开办的程序和要求进行审查”[2]。也就是说,在新修订《药品生产监督管理办法》规定下药品生产许可证的延续不再需要按照药品生产企业开办的程序和要求进行审查,而是根据风险管理原则进行审查。此项规定体现了新修订《药品生产监督管理办法》强化风险管理、形成风险闭环的原则,明确了药品生产许可延续的审查标准,优化了审批条件和要求,提高了行政许可的效率。
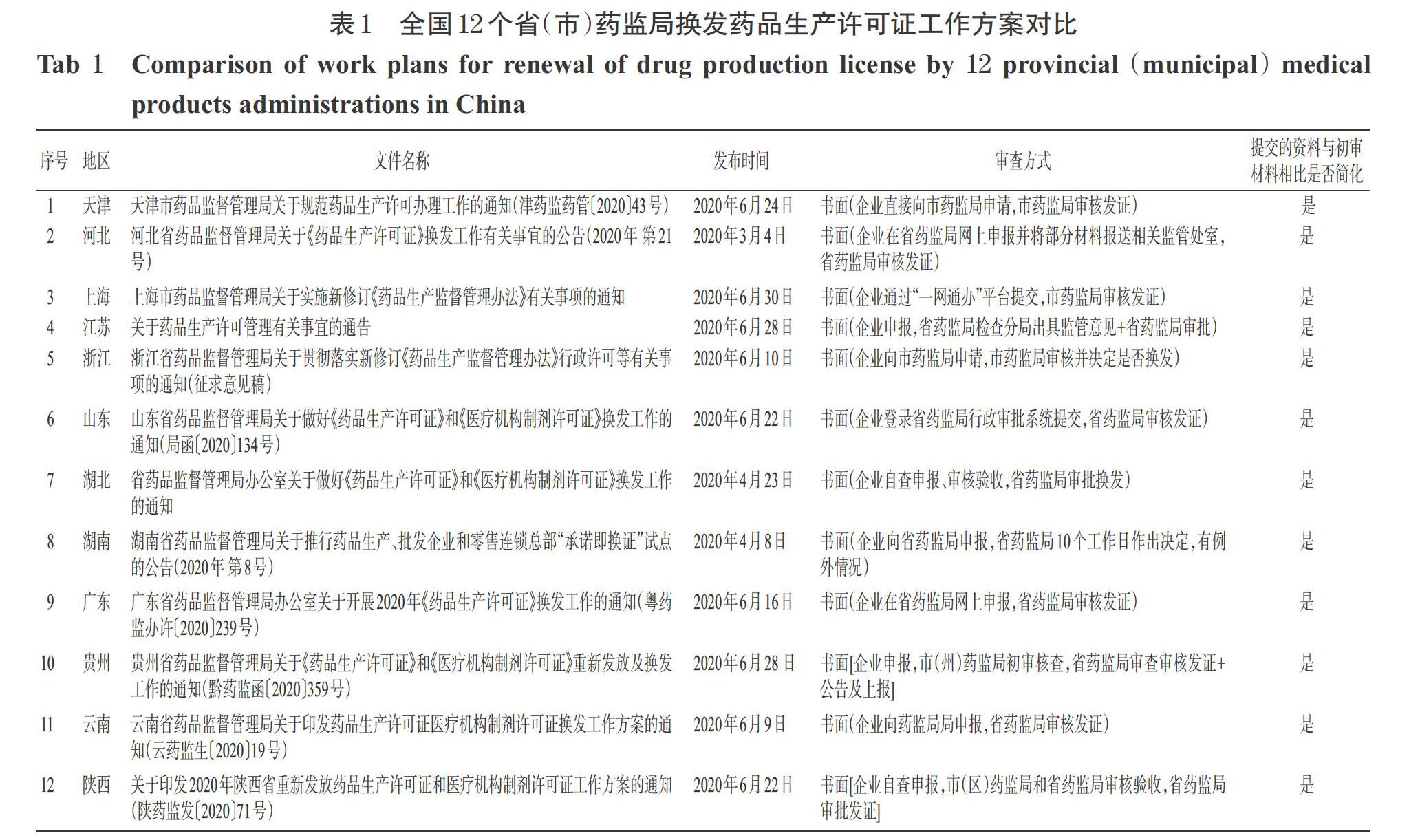
在实际执行中,笔者通过查询全国各省药监局官方网站发现,截至2020年7月13日,共有12个省(市)药监局已经下发了换发药品生产许可证的工作方案通知。笔者对各省(市)药监局通知中的审查方式和提交的资料进行了统计,结果见表1。
从表1可以看出,已发布通知的12个省(市)药监局要求换证企业提交的资料与初审材料相比均有简化,但审查方式有3种模式:第一种模式是“企业向省药监局申报、省药监局发证”模式。根据新修订《药品生产监督管理办法》第五条第二款规定,“省、自治区、直辖市药品监督管理部门负责本行政区域内的药品生产监督管理,承担药品生产环节的许可、检查和处罚等工作”[3]。随着各省新一轮机构改革的落地,不再单独设立市县级药品监督管理部门,药品生产监督管理工作统一由省一级药监局承担,故此种换证模式在实践中多为各省(市)药监局采用,其中天津、河北、上海、江苏、云南、山东、湖北、湖南、广东等地均采用此种模式。第二种模式是“企业向市药监局申报,由市药监局发证”模式,浙江省药监局即采用此种模式。第三种模式是“企业向省药监局申报,先由市药监局和省药监局初审、再由省药监局发证”模式,贵州和陕西省药监局均采用此种模式。
此外,在新修订《药品生产监督管理办法》第十九条中,还明确了发证机关必须在药品生产许可证有效期届满前作出是否准予其重新发证的决定。
3.3 明确规定换发药品生产许可证的3种后果
新修订《药品生产监督管理办法》第十九条中还规定了换发药品生产许可证的3种后果:一是准予换发,即符合规定准予重新发证的,收回原证,重新发证;同时,在《国家药监局关于实施新修订<药品生产监督管理办法>有关事项的公告》第二点中规定,重新发证的有效期自发证之日起计算[9]。二是不予换发,即不符合规定的,作出不予重新发证的书面决定,并说明理由,同时告知申请人享有依法申请行政复议或者提起行政诉讼的权利。三是视为同意换证,即逾期未作出决定的,视为同意重新发证,并予补办相应手续。
4 新修订《药品生产监督管理办法》中药品生产许可延续条款的本质和适用建议
虽然新修订《药品生产监督管理办法》第十九条在简化行政许可材料和程序、减轻被许可人负担、提高行政许可效率上有一定进步,但仍有一些问题并没有得到很好的解决,即便这些问题是上位法《行政许可法》所带来的,但是因为许可法有授权性条款的规定,笔者认为,作为部门规章的《药品生产监督管理办法》是可以在药品生产许可延续条款上作一些探索。
4.1 条款本质
对药品生产许可延续条款进行优化,首先要清楚,究竟药品生产许可延续是一个新的许可还是许可的简单延续?有学者从英文“Renewal”意为“重新建立法律关系或者以新的合同代替旧的合同”这一角度出发,认为延续的实质是重新作出许可决定[10-11]。也有学者通过对比美国的许可证更新制度(License renewal)认为,有数量控制的许可的延续为新的行政许可,而没有数量控制的一般许可延续为原有行政许可有效期的延长[12]。
在实践中,对药品生产许可延续的本质认识,有两种观点:一种观点认为,既然药品生产许可证是重新换发,规章规定了时限和要求,符合《行政许可法》的规定,就是一项新的行政许可;另一种观点认为,换发药品生产许可证只是对药品生产企业生产药品能力的延续性认可,换发后的药品生产许可证编号与原证一样,保持不变,因此不是一项新的行政许可,可以简化流程、缩短时限,甚至只需要告知性备案即可。这些观点固然有其合理性,但是对药品生产许可延续本质的探索还需要追溯到药品生产许可制度设计的初衷,即有效控制药品安全风险、合理配置药品生产资源。药品生产许可最基本的原则和要求就是有效控制药品安全风险:企业新申办药品生产许可必须符合药品生产企业的开办条件,而行政机关根据企业提交的材料和现场审核,判断企业是否能够达到有效控制药品安全风险的要求,从而决定是否发放药品生产许可证。当药品生产许可证有效期届满后,行政机关还需要根据当时的法律法规要求,对企业重新进行评估,再次作出行政许可。因此,从有效控制药品安全风险的角度看,药品生产许可延续的本质是一个新的行政许可行为。但与新申办药品生产许可相比,药品生产许可延续是一项“新”的行政许可。“新”主要体现在时限、申请材料和程序上可以简化:首先,新申办药品生产许可证没有时间限制,而延续药品生产许可证需要在有效期届满前六个月提出;其次,新申办药品生产许可证的审查时限是受理之日起三十日内作出决定、十日内颁发药品生产许可证[8],而延续药品生产许可证只需要在原许可有效期届满之前作出许可决定即可;再次,不论是在新修订《药品生产监督管理办法》第十九条还是在实践中,相较于新申办药品生产许可证,延续的申请材料都较为简单(如河北省药监局在公告中要求企业到期换发许可证的申报资料仅有行政审批事项申请承诺书、法定代表人授权委托书、行政许可申请书、药品生产许可证申请表和自查报告等5項内容[13]);最后,延续药品生产许可证的流程也比新申办药品生产许可证的流程简化很多(如在表1中,大多数省药监局都是采取了“企业向省药监局申报、省药监局发证”模式),大大缩短了审批时限。还有个别省药监局,如湖南省药监局对药品生产、批发企业和零售连锁总部采取“承诺即换证”的方式,所谓“承诺即换证”,是指许可证书有效期即将届满的药品生产、批发企业和零售连锁总部,依法向省药监局提交换证申请和相关资料并作出持续符合许可条件的书面承诺后,省药监局按照法定条件和标准,依法依规进行审查,符合条件的即换发许可证书的工作方式[14]。这是湖南省药监局按照环节最少、资料最简、时限最短的目标,探索改革审批管理方式,提高行政审批服务效能,全面加强事中、事后综合监管,全面落实企业主体责任的一大举措。
4.2 适用建议
以申请人递交延续药品生产许可证申请的时间段来划分,在不同的阶段,药品生产许可延续申请人的权利和许可延续处理效果存在较大区别。
4.2.1 在药品生产许可证有效期届满前六个月阶段申请的适用建议 如果申请人在药品生产许可证有效期届满前六个月提交换证申请的,有关部门应当按照新修订《药品生产监督管理办法》第十九条的规定受理申请,如不予受理,应当说明理由。受理后的处理可能有两种情形:一是有关部门在原证有效期届满前作出决定的——如符合规定,重新发证,收回原证;如不符合规定,不予发证,并说明理由,告知申请人享有依法申请行政复议或者提起行政诉讼的权利。二是有关部门在原证有效期届满后作出决定的。这种情形申请人可以适用“视为同意换证”的默示许可的特殊规则,申请人可以继续从事药品生产行为,直到有关部门作出决定,此间生产药品的行为不按无证生产药品行为处理。如果此后有关部门重新发证,则申请人的生产行为可以延续;如果有关部门不予发证,则申请人应当立即停止生产行为。
4.2.2 在药品生产许可证有效期届满前六个月内至药品生产许可证有效期届满之日之间申请的适用建议 如果申请人在药品生产许可证有效期届满前六个月内至药品生产许可证有效期届满之日之间提交换证申请的,这种情形实际上不符合新修订《药品生产监督管理办法》第十九条的规定,属于逾期提交换证申请,有关部门可以受理,也可以不予受理,有自由裁量的权力。但在实践中,有关部门一般会予以受理。受理后的处理可能有两种情形:一是有关部门在原证有效期届满前作出决定的——如符合规定,重新发证,收回原证;如不符合规定,不予发证,并说明理由,告知申请人享有依法申请行政复议或者提起行政诉讼的权利。二是有关部门在原证有效期届满后作出决定的。这种情形申请人则不适用“视为同意换证”的默示许可的特殊规则,因为申请人逾期申请,导致其原证在有效期届满时失去效力,因此申请人在有关部门作出是否换证决定的期间,不再享有原药品生产许可的权利,如在此期间有生产药品的行为,则按无证生产药品行为处理。如果此后有关部门重新发证,则申请人可以从换证之日起恢复生产行为;如果有关部门不予发证,则申请人不再获得药品生产许可,且有关部门应当及时注销原药品生产许可证。
4.2.3 在药品生产许可证有效期届满之后申请的适用建议 如果申请人在药品生产许可证有效期届满之后递交换证申请的,有关部门应当一律不予受理。此时原被许可人的药品生产许可已经失去效力,许可连贯性已经丧失,不应再适用许可延续条款。行政机关应当注销原药品生产许可证。原被许可人如果想继续从事药品生产的,只能依照新申办情形,重新向有关部门申请药品生产许可。
5 结语
《药品管理法实施条例》第八条规定,药品生产许可证的有效期为五年[15]。2020年是全国药品生产企业集中换证的“大年”,又涉及到新旧《药品管理法》的衔接,如何厘清药品生产许可延续条款,明确药品生产许可延续受理与决定的时限和有效性,赋予行政机关对逾期换证申请受理的自由裁量权,对做好药品生产许可证换发工作具有重要的意义。新修订《药品生产监督管理办法》第十九条立法本意主要是为行政机关留出重新审查换证申请的充分时间,但行政机关完全有能力通过自由裁量权来判断能否受理,如果一概不予受理,可能会中断前后相继两个行政许可的连续性,也增加了行政成本[7]。另外,为更好保障申请人的合法权益,笔者建议在实践中,行政机关首先可以在药品生产许可有效期届满前六个月,通过短信告知或者采取其他信息手段,对药品生产许可证即将到期的申请人进行催告,督促其尽快提交换证申请;其次,如果行政机关受理了申请人提交的逾期换证申请,应当用合适方式告知申请人,在药品生产许可有效期届满之后至行政机关作出延续与否的决定期间不得从事原药品生产行为,否则视为无药品生产许可证生产药品的违法行为而承担相应法律责任,以避免引起行政纠纷。
参考文献
[ 1 ] 全国人民代表大会.中华人民共和国药品管理法[S]. 2019- 08-26.
[ 2 ] 国家食品药品监督管理总局.药品生产监督管理办法[S]. 2017-11-17.
[ 3 ] 国家市场监督管理总局.药品生产监督管理办法[S]. 2020- 01-22.
[ 4 ] 国家市场监督管理总局. 国家市场监督管理总局关于《药品生产监督管理办法(征求意见稿)》《药品经营监督管理办法(征求意见稿)》公开征求意见的公告[EB/OL].(2019-12-10)[2020-07-27]. http://www.samr.gov.cn/hd/zjdc/201912/t20191210_309140.html.
[ 5 ] 全国人民代表大会. 中华人民共和国行政许可法[S]. 2019- 04-23.
[ 6 ] 全国人民代表大会常务委员会.中华人民共和国行政许可法释义[EB/OL]. (2004-10-26)[2020-07-27]. http://www.npc.gov.cn/npc/c2188/200410/9b1a966d2bf24687ad- 2a951cecc95fd7.shtml.
[ 7 ] 呂宁.行政许可延续规则适用的困境与优化:兼评《行政许可法》第50条[J].法律适用,2019(18):89-98.
[ 8 ] 徐晓明.行政许可超期推定延续法律效力问题研究[J].浙江学刊,2015(3):147-155.
[ 9 ] 国家药品监督管理局. 国家药监局关于实施新修订《药品生产监督管理办法》有关事项的公告 [EB/OL].(2020- 03-30)[2020-07-27].http://www.gov.cn/zhengce/zheng- ceku/2020-04/01/content_5497935.htm.
[10] 薛波.元照英美法词典[M].北京:北京大学出版社,2013:1179.
[11] 倪洪涛.论行政特许延续的阻却[J].行政法学研究,2018(1):37-46.
[12] 肖泽晟.论许可证有效期的延续:基于《行政许可法》第五十条的解释[J].浙江学刊,2016(3):146-154.
[13] 河北省药品监督管理局. 河北省药品监督管理局关于《药品生产许可证》换发工作有关事宜的公告 [EB/OL].(2020-03-04)[2020-11-09].http://yjj.hebei.gov.cn/CL0132/ 76187.html.
[14] 湖南省药品监督管理局. 湖南省药品监督管理局关于推行药品生产、批发企业和零售连锁总部“承诺即换证”试点的公告[EB/OL].(2020-04-09)[2020-11-09].http://mpa.hunan.gov.cn/mpa/xxgk/tzgg/wjtz/202004/t20200409_11875098.html.
[15]国务院.药品管理法实施条例[S]. 2019-03-02.
(收稿日期:2020-12-07 修回日期:2021-02-22)
(编辑:刘明伟)

