云南景迈山不同生境茶园根际土壤微生物群落多样性初步研究
杨瑞娟 王桥美 彭文书 龚婉莹 赵苗苗 严亮
摘 要:为了探究景迈山普洱茶区不同生境茶园根际土壤微生物群落结构多样性和差异性,对景迈山普洱茶区的微生物进行溯源,更好地保证景迈山原产地生产的普洱茶微生物的一致性。采用平板涂布分离技术,对从3个有机台地茶园(TS-A、TS-B、TS-C)和景迈山古茶园(GS-D)采集的根际土壤微生物进行培养,并利用分子生物學技术鉴定其种类。在茶园根际土壤微生物中经分离纯化共得到417株细菌和143株真菌,分别归类于27个细菌属和18个真菌属,4个茶园根际微生物多样性不同,细菌多样性和真菌多样性的排序分别为:GS-D>TS-A>TS-C>TS-B和TS-A>TS-B>TS-C>GS-D。4个茶园的微生物群落均含有节细菌属(Arthrobacter)、芽孢杆菌属(Bacillus)、杆菌属(Lysinibacillus)、类芽孢杆菌属(Paenibacillus)、曲霉属(Aspergillus)和青霉菌属(Penicillium),其中芽孢杆菌属(Bacillus)和青霉菌属(Penicillium)为优势菌属。结果表明,景迈山不同生境下的根际土壤微生物群落组成有差异性,3个有机台地茶园的细菌多样性低于古茶园,但真菌多样性高于古茶园。3个有机台地茶园的规律如下:茶树品种一样,套种品种多的茶园的细菌和真菌多样性都高于套种品种少的茶园,套种品种相似的茶园,茶树品种越多,细菌的多样性更高,而真菌多样性更低。
关键词:景迈山;茶园;根际微生物
中图分类号:S571.1 文献标识码:A
A Preliminary Study on the Distribution Diversity of Rhizosphere Soil Microbial Community in Tea Plantations with Different Habitats of Jingmai Mountain, Yunnan, China
YANG Ruijuan1,2,3, WANG Qiaomei2,3,4, PENG Wenshu2,3, GONG Wanying2,3, ZHAO Miaomiao2,3,
YAN Liang2,3*
1. College of Food Science and Technology, Yunnan Agricultural University, Kunming, Yunnan 650201, China; 2. College of Tea (Puer), West Yunnan University of Applied Sciences, Puer, Yunnan 665000, China; 3. Puer Institute of Pu-erh Tea, Puer, Yunnan 665000, China; 4. College of Plant Protection, Yunnan Agricultural University, Kunming, Yunnan 650201, China
Abstract: To explore the diversity and difference of rizosphere soil microbial community structure in tea gardens of different habitats in Pu-erh tea area of Jingmai Mountain, so as to better ensure the consistency of microorganisms in Pu-erh tea production in the original place of Jingmai Mountain, the plate coating separation technology was used to culture the microorganisms collected from three organic terraced tea gardens (TS-A, TS-B, TS-C) and Jingmai Mountain ancient tea garden (GS-D), and the molecular biology technology was used to identify the species. A total of 417 strains of bacteria and 143 strains of fungi were isolated and purified, respectively distributed in 27 bacterial genera and 18 fungal genera. The rizosphere microbial diversity of the four tea gardens was different, the order of bacterial diversity and fungal diversity was GS-D>TS-A>TS-C>TS-B and TS-A>TS-B>TS-C>GS-D, respectively. The soil rizosphere microbial communities of the four tea gardens all contained Arthrobacter, Bacillus, Lysinibacillus, Paenibacillus, Aspergillus and Penicillium, Bacillus and Penicillium were the dominant genera. The results showed that the composition of the rizosphere soil microbial community in different habitats of Jingmai Mountain was different. The bacterial diversity of the three terraced tea gardens was lower than that of the ancient tea garden, but the fungal diversity was higher than that of the ancient tea garden. More intercropped plants would result in higher bacterial diversity and fungal diversity in organic terraced tea gardens. More varieties of tea trees would lead to higher bacterial diversity and lower fungal diversity in terraced tea gardens.
Keywords: Jingmai Mountain; tea garden; rhizosphere microorganism
DOI: 10.3969/j.issn.1000-2561.2021.04.039
景迈山位于中国云南省的西南边陲,坐落于普洱市瀾沧拉祜族自治县惠民乡,地处北纬221205.8,东经1000202.5,以普洱茶盛名,是有名的几大普洱茶山之一,有成片的现代有机茶园,也有占地面积1867 hm2的古茶园。在世界物质文化遗产申报的版图上,景迈山是唯一以古茶林为主体申遗的茶山,这里山高谷深、云雾弥漫、气候温和湿润、土壤肥沃、植被丰富,极适合大叶茶树的自然生长[1]。
土壤中有机质的分解、土壤元素的循环、土壤的矿化等都离不开土壤微生物的作用,土壤微生物维持着农业土壤的健康和生产力[2-4]。根际土壤微生物对植物的生长有很重要的作用,如Walters等[5]发现细菌分泌的激素可提高植物的适应性。根际微生物与根系之间存在适应性协同进化关系,并形成植物-微生物之间的互惠关系[6-7]。茶树根际土壤微生物的群落结构及生态分布对茶叶的生长与质量的影响至关重要,茶树的不同栽培环境和不同的人为管理活动可能造成微生物群落的特殊性,进而影响茶树的生长[7]。近几年来,部分研究者采用稀释平板涂布法、Biolog微平板分析法、微生物定量测定法、磷脂脂肪酸分析法[8-10],对不同海拔、不同生长年限的茶树根际土壤微生物群落展开研究[11-12],初步探索了真菌、细菌、放线菌等微生物大类群与土壤性状、茶树树龄、茶树品种的关系。
目前,植物根际微生物的研究很多,但是茶树根际微生物群落的组成及具体分布的研究比较少。本研究选取景迈山3个不同的有机台地茶园和景迈山古茶园为对象,应用纯培养和测序技术对景迈山普洱茶区的土壤根际微生物群落结构特征进行初探,为进一步研究土壤微生物的功能和开发利用提供理论依据和菌株资源。
1 材料与方法
1.1 材料
1.1.1 样品 土壤样品来自4个茶园。茶园A:茶树品种为传统的普洱茶种,茶园套种20多种不同植物(香樟树、旱冬瓜、西南桦、灯台、金鸡纳、金丝楠、海南黄花梨、橡胶、印度紫檀、柚木樱桃、荔枝、桃子、芒果、小叶紫薇等);茶园B:茶树品种为传统的普洱茶种,套种近10种不同植物(香樟树、旱冬瓜、西南桦、灯台、芒果、桃子、小叶紫薇等);茶园C:茶树品种比较多(传统的普洱茶种、‘雪芽100号‘云抗10号‘矮丰‘乌龙‘长叶白毫等),套种品种与茶园B相似。茶园D:景迈山万亩古茶园,为当地布朗族、傣族先民所驯化、栽培,基本为上千年的茶树,是名副其实的千年万亩古茶园。
1.1.2 试剂 ExTaq(TaKaRa,大连),KOD-fx(TOYOBO,日本),PCR引物由北京睿博兴科生物技术有限公司合成,其他试剂均为国产分析纯。
1.2 方法
1.2.1 根际土壤样品的采集 采样时间分别为2018年4月2—8日,2018年8月8—14日,2018年10月25—31日和2019年1月24—30日。在茶园内随机选择健康的茶树植株,以茶树茎为中心,从横向半径20 cm,深度30 cm的土壤中将茶树的部分须根拔出,轻轻摇动去除松散的土壤,采集紧密附着在根表面的土壤即获得1份根际土壤样品。每3份土样混合成1个土壤混合样(1 kg左右),每个茶园采集10个土壤混合样备用。茶园A、B、C均为景迈山的有机台地茶园,采集的根际土壤样品标记为TS-A、TS-B、TS-C;茶园D为古树茶园,采集的根际土壤样品标记为GS-D。
1.2.2 微生物菌株的分离 先制备以下4种培养基。
LB培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,琼脂18 g/L。
YEPD培养基:酵母粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,琼脂18 g/L。
PDA培养基:马铃薯300 g/L,葡萄糖20 g/L,琼脂15~20 g/L。
高氏培养基:可溶性淀粉20 g/L,氯化钠0.5 g/L,硝酸钾1 g/L,磷酸氢二钾0.5 g/L,硫酸镁0.5 g/L,FeSO4·7H2O 0.01 g/L,琼脂15~20 g/L。
将所采土壤样品置于灭菌的培养皿中自然风干7 d,取10 g于90 mL的无菌水中,振荡20 min,使其中微生物充分分散,得到10?1倍样品稀释液。用无菌移液枪吸取10?1菌悬液1 mL,加入装有9 mL无菌生理盐水的试管中,振荡混匀,配制10?2、10?3、10?4、10?5梯度菌悬液,把10?3、10?5两个梯度的土悬液各取100 μL分别均匀涂于LB、YEPD、PDA和高氏培养基平板中,28、37 ℃倒置恒温培养72 h,挑取培养性状不同的微生物单菌落进行纯化培养,备用。
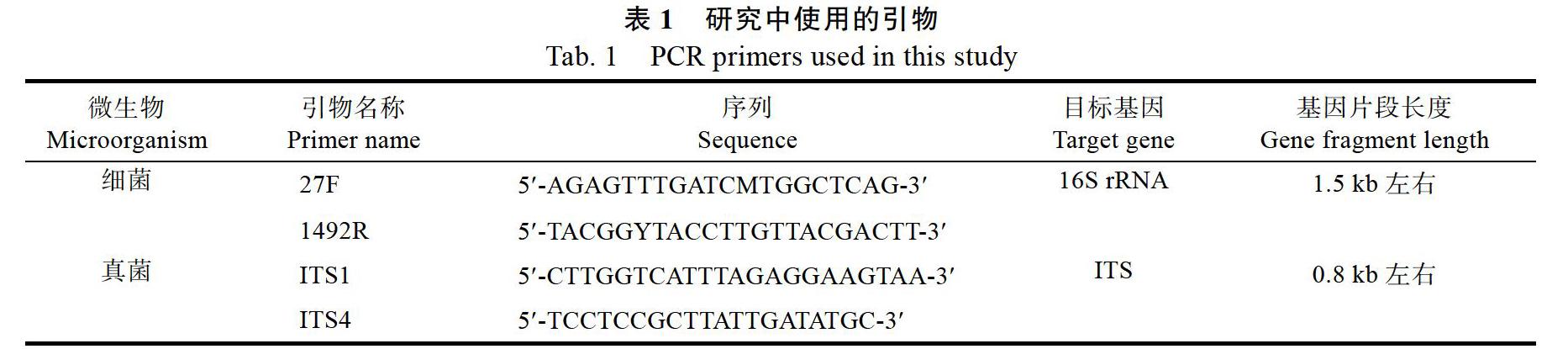
1.2.3 微生物菌株的分子鉴定 将纯化的细菌制成菌悬液,细菌PCR体系为[13]:10×PCR buffer for ExTaq 5 ?L、2 mm dNTP mixture 4 ?L、ExTaq(5.0 U/?L)0.5 ?L、上游引物27F(20 ?mol/L)1 ?L、下游引物1492R(20 ?mol/L)1 ?L(使用的引物见表1)、菌悬液1 ?L、水37.5 ?L。PCR反应条件:94 ℃预变性5 min;96 ℃变性30 s,52 ℃复性(退火)30 s,72 ℃延伸50 s,循环34次;72 ℃ 10 min。4 ℃保温。
将纯化的真菌制成菌悬液,真菌PCR体系为[14]:2×PCR buffer for KOD FX 25 ?L、2 mm dNTP mixture 10 ?L、KOD-fx(1.0 U/?L)1?L、上游引物ITS1(20 ?mol/L)0.75 ?L、下游引物ITS4(20 ?mol/L)0.75 ?L(使用的引物见表1)、菌悬液2.5 ?L、水10 ?L。PCR反应条件:94 ℃预变性5 min;98 ℃变性10 s,50 ℃复性(退火)30 s,68 ℃延伸2 min,循环45次。4 ℃保温。
将扩增成功的样品送至北京睿博兴科生物技术有限公司测序。根据测序结果,在GenBank数据库中进行比对分析,筛选出同源性最高的参考菌株序列,进行分子鉴定。
用多序列对比软件Clustal X 1.81进行同源性比较并匹配排序,然后用系统发育分析MEGA5.1软件包分析,构建邻接(Neighbor-joining,NJ)树进行系统发育分析。NJ树构建采用HKY85距离矩阵,启发式搜索,Bootstrap(1 000次重复)检验,制作系统树[15]。
2 结果与分析
2.1 基于16S rRNA基因系统进化的细菌群落组成分析
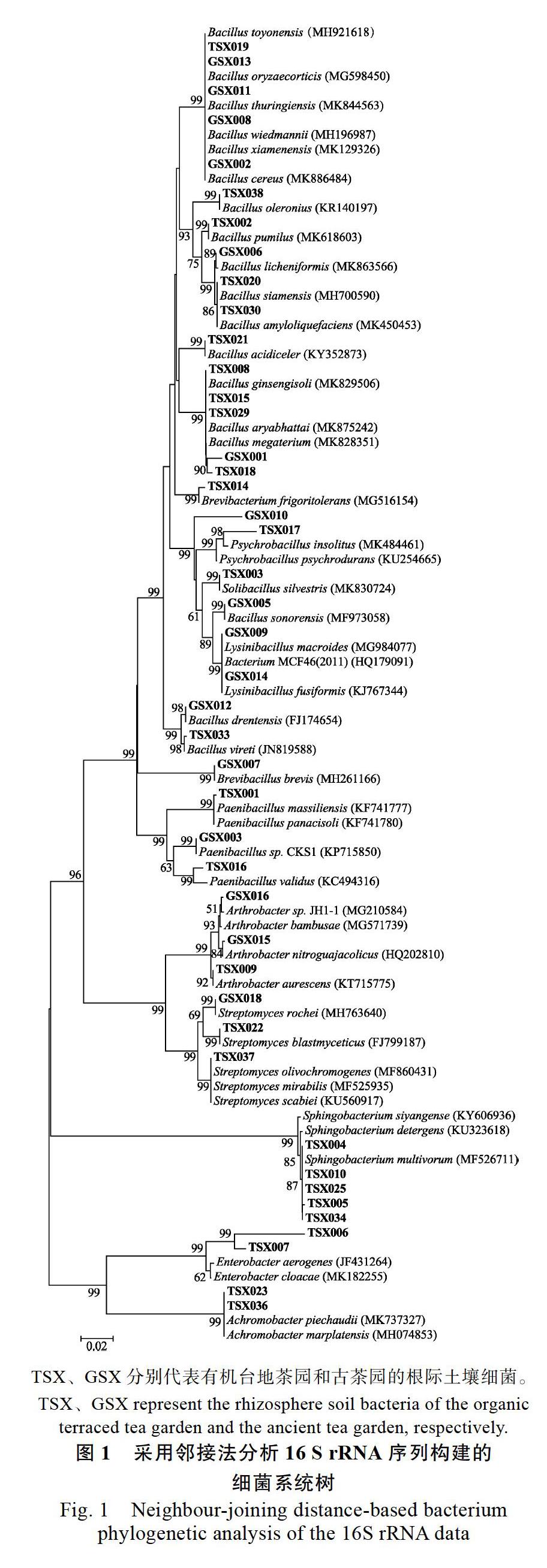
对纯化得到的417株细菌菌株进行16S rRNA基因测序、比对,挑取代表序列构建系统发育树见图1。茶园土壤中的根际细菌可归类到无色杆菌属(Achromobacter)、节细菌属(Arthrobacter)、芽孢杆菌属(Bacillus)、短芽孢杆菌属(Brevibacillus)、短杆菌属(Brevibacterium)、肠杆菌属(Enterobacter)、杆菌属(Lysinibacillus)、类芽孢杆菌属(Paenibacillus)、嗜冷芽孢杆菌属(Psychrobacillus)、土壤芽孢杆菌属(Solibacillus)、鞘氨醇杆菌属(Sphingobacterium)、链霉菌属(Streptomyces)等属中。
2.2 基于ITS基因系统进化的真菌群落组成分析
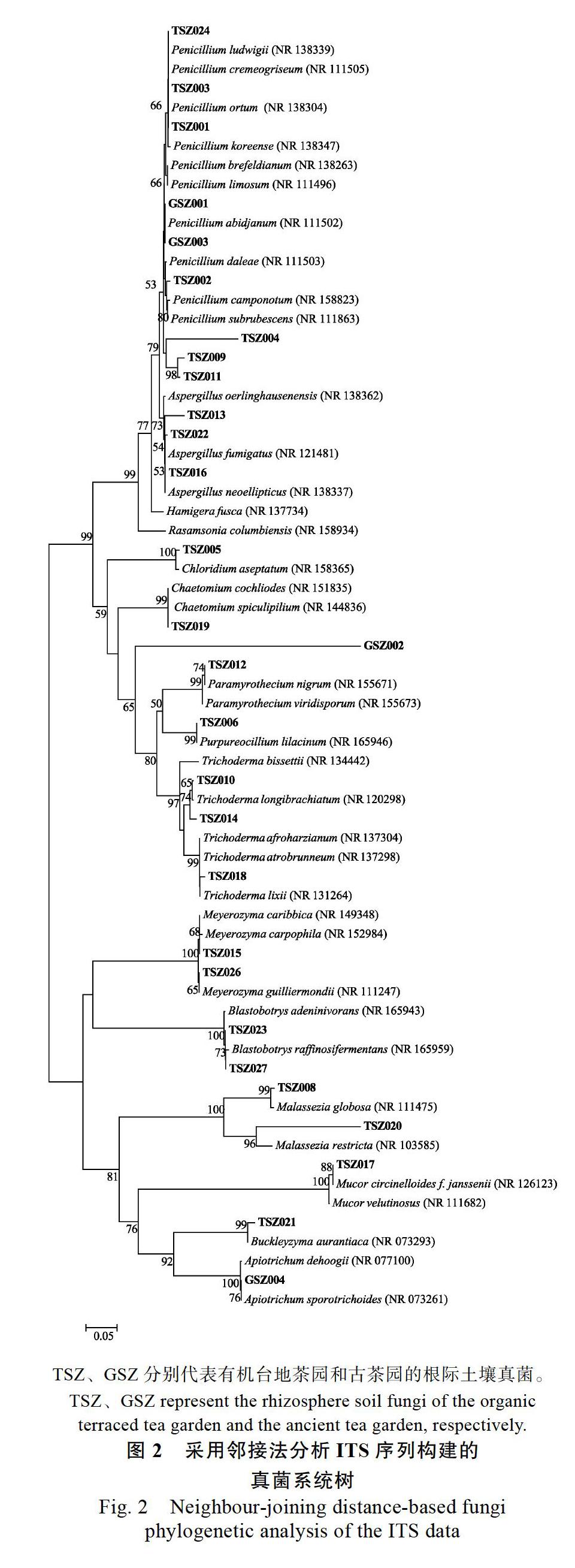
对纯化得到的143株真菌菌株进行ITS基因测序、比对,挑取代表序列构建系统发育树如图2所示。茶园土壤中的根际真菌可以归类到Apiotrichum、Aseptatum、曲霉属(Aspergillus)、Blastobotrys、Buckleyzyma、毛壳菌属(Chaetomium)、Chloridium、Hamigera、马拉色氏霉菌属(Malassezia)、Meyerozyma、毛霉属(Mucor)、Paramyrothecium、青霉菌属(Penicillium)TSX、GSX分别代表有机台地茶园和古茶园的根际土壤细菌。TSX、GSX represent the rhizosphere soil bacteria of the organic terraced tea garden and the ancient tea garden, respectively.
2.3 不同生境茶园根际土壤细菌群落的属间特征
由表2可知,TS-A、TS-B、TS-C、GS-D 4个生境下的细菌群落均含有芽孢杆菌属(Bacillus)、节细菌属(Arthrobacter)、杆菌属(Lysinibacillus)和类芽孢杆菌属(Paenibacillus)。以芽孢杆菌属为优势类群,其相对分离频率分别为45.83%、27.00%、43.75%、38.61%;其次是节细菌属,其相对分离频率分别为10.83%、6.00%、13.54%、8.91%;再次是杆菌属(Lysinibacillus),其相对分离频率分别为6.67%、8.00%、8.33%、8.91%。4个生境下的类芽孢杆菌属含量差异比较大,其相对分离频率分别为5.00%、16.00%、6.25%、5.94%。
除去3个共有的细菌属,TS-A茶树根际土壤生境以链霉菌属(Streptomyces)(10.83%)、土壤芽孢杆菌属(Solibacillus)(4.17%)、鞘氨醇杆菌属(Sphingobacterium)(4.17%)为主要类群;TS-B茶树根际土壤生境以短杆菌属(Brevibacterium)(14.00%)、链霉菌属(Streptomyces)(12.00%)、无色杆菌属(Achromobacter)(5.00%)、Sphingobacterium(5.00%)为主要类群;TS-C茶树根际土壤生境以不动杆菌属(Acinetobacter)(7.29%)、Sinomonas(6.25%)、短芽孢杆菌属(Brevibacillus)(5.21%)、Sphingobacterium(5.21%)为主要类群;GS-D茶树根际土壤生境以链霉菌属(Streptomyces)(7.92%)、产碱杆菌属(Advenella)(6.93%)、无色杆菌属(Achromobacter)(4.95%)、短芽孢杆菌属(Brevibacillus)(4.95%)、类节杆菌属(Paenarthrobacter)(3.96%)为主要类群。
TS-A分离得到细菌120株,TS-B分离得到细菌100株,TS-C分离得到细菌96株,GS-D分离得到细菌101株,从细菌的分离数量来说,TS-A>GS-D>TS-B>TS-C。TS-A分离得到细菌15个属,TS-B分离得到细菌10个属,TS-C分离得到细菌11个属,GS-D分离得到细菌16个属,从细菌的属的多样性来说,GS-D>TS-A>TS-C> TS-B。由此可知,茶树品种一致,套种植物种类多的TS-A的细菌多样性和细菌数量均大于套种植物种类少的TS-B,套种植物种类相似,茶树品种多的TS-C的细菌多样性大于茶树品种单一的TS-B,但是分离得到的细菌数量上更少一些。古茶园GS-D细菌多样性大于有机台地茶园TS-A、TS-B和TS-C。
2.4 不同生境茶园根际土壤真菌群落的属间特征
由表3可知,TS-A、TS-B、TS-C、GS-D 4个生境下的真菌群落均含有青霉菌属(Penicillium)和曲霉属(Aspergillus)。以青霉
菌属为优势类群,其相对分离频率分别为45.45%、10.71%、34.62%、23.53%,其次是曲霉属,其相对分离频率分别为4.55%、7.14%、7.69%、35.29%。除去两个共有的真菌属,TS-A茶树根际土壤生境以木霉属(Trichoderma)(20.45%)、Paramyrothecium(6.82%)、Blastobotrys(4.55%)、Meyerozyma(4.55%)為主要类群;TS-B茶树根际土壤生境以木霉属(Trichoderma)(32.14%)、毛壳菌属(Chaetomium)(16.07%)、毛霉属(Mucor)(14.29%)、Meyerozyma(10.71%)为主要类群;TS-C茶树根际土壤生境以篮状菌属(Talaromyces)(19.23%)、Meyerozyma(11.54%)、Purpureocillium(11.54%)、拟青霉属(Paecilomyces)(7.69%)为主要类群;GS-D茶树根际土壤生境种类比较单一,除了与其他3个生境共有的真菌属,只剩下Blastobotrys(29.41%)和毛孢子菌属(Trichosporon)(11.76%)两个属。
TS-A分離得到真菌44株,TS-B分离得到真菌56株,TS-C分离得到真菌26株,GS-D分离得到真菌17株,从真菌的分离数量来说,TS-B>TS-A>TS-C>GS-D。TS-A分离得到真菌12个属,TS-B分离得到真菌9个属,TS-C分离得到真菌8个属,GS-D分离得到真菌4个属,从真菌的属的多样性来说,TS-A>TS-B>TS-C>GS-D。由此可知,有机台地茶园TS-A、TS-B、TS-C的真菌数量和多样性都要高于古茶园GS-D。
3 讨论
研究表明,由于不同茶园种植模式的不同,茶园间的茶树根际微生物种群产生了较大的差异。景迈古茶园的古树茶树龄古老,没有经过人工矮化,大部分生长在原始丛林之中,在绿水青山、蓝天白云和清新空气的滋润下,全靠自然肥力生长,远离了农药化肥的污染,其土壤细菌种群多样性高于3个有机台地茶园。卢开阳等[7]也研究发现南糯山古茶山的细菌多样性高于台地茶,与本研究结论一致。本研究还发现3个有机台地茶园的真菌多样性要高于古茶园,这说明人为干预对茶树根际土壤微生物种群的组成起到了一定的选择作用。对3个有机台地茶园的研究结果表明,不同茶树品种不同套种植物的茶园土壤微生物多样性的差异较大,这说明植物套种对土壤微生物有显著影响[16],贺国强等[17]在对烟草套种的研究中也得出相似的结论。
TS-A、TS-B、TS-C 3个有机台地茶园含有鞘氨醇杆菌属(Sphingobacterium)、Meyerozyma、Purpureocillium、木霉属(Trichoderma),而古茶园GS-D没有。产碱杆菌属(Advenella)、博代氏杆菌属(Bordetella)、棒状杆菌属(Coryneb act erium)、鲁梅尔芽胞杆菌属(Rummeliibacillus)、单胞菌属(Stenotrophomonas)、Tetrathiobacter、绿芽孢杆菌属(Viridibacillus)、毛孢子菌属(Trichosporon)是古茶园GS-D独有的,TS-A、TS-B、TS-C 3个有机台地茶园中没有。TS-A、TS-B、TS-C、GS-D 4个生境下的微生物群落均含有节细菌属(Arthrobacter)、芽孢杆菌属(Bacillus)、杆菌属(Lysinibacillus)、类芽孢杆菌属(Paenibacillus)、曲霉属(Aspergillus)和青霉菌属(Penicillium),其中芽孢杆菌属(Bacillus)里的苏云金芽胞杆菌(Bacillus thuringiensis)可产生特异性杀虫蛋白,对多种农业害虫具有特异的杀虫活性,在农业生产中极具开发潜力[18],解淀粉芽孢杆菌(Bacillus amyloliquefaciens)对引起黑斑病病原菌有很好的拮抗作用,抑制率达到66.67%[19],具有一定的肥效功能,可用于促生菌剂的研制[20],本研究获得了一批潜在的生防微生物菌株,为下一步的筛选利用提供了菌株资源。
本研究利用平板稀释涂布分离,获取纯的培养物(微生物菌株),再通过分子生物学技术及分类鉴定等手段进行鉴定,进而分析确定纯培养物归属。在研究得到4个不同生境微生物群落组成和差异的同时,保存了大量微生物菌种资源,这与免培养方法相比具有极大优势。后续研究将通过检索相关微生物资源信息及应用,进一步探究人为干预与无干预古树茶生境下具有特定功能的微生物变化对茶树生长及品质的影响。如曲霉属(Aspergillus)是普洱茶发酵过程中的优势微生物,对普洱茶品质的影响很关键[21-22],且黑曲霉(Aspergillus niger)可以促进茶多糖的高效产出[23],研究过程中在4个不同生境茶园中都分离得到了曲霉属菌株,这些菌株是否参与普洱茶的发酵作用并对品质有重要影响,也将是下一步的研究要点。
参考文献
[1]陈耀华, 张 欧. 世界遗产视野下普洱景迈山古茶林的价值探究[J]. 热带地理, 2015, 35(4): 541-548.
[2]Leff J W, Jones S E, Prober S M, et al. Consistent responses of soil microbial communities to elevated nutrient inputs in grasslands across the globe[J]. Proceedings of the National Academy of Sciences, 2015, 112(35): 10967-10972.
[3]Carini P, Marsden P J, Leff J W, et al. Relic DNA is abundant in soil and obscures estimates of soil microbial diver sity[J]. Nature Microbiology, 2017, 2(3): 16242.
[4]Lange M, Eisenhauer N, Sierra C A, et al. Plant diversity increases soil microbial activity and soil carbon storage[J]. Nature Communications, 2015, 6: 6707.
[5]Walters W A, Jin Z, Youngblut N, et al. Large-scale repli cated field study of maize rhizosphere identifies heritable microbes[J]. Proceedings of the National Academy of Sciences, 2018, 115(28): 7368-7373.
[6]Bakker M G, Chaparro J M, Manter D K, et al. Impacts of bulk soil microbial community structure on rhizosphere mi crobiomes of Zea mays[J]. Plant and Soil, 2015, 392(1-2): 115-126.
[7]卢开阳, 张云峰, 贾 鳗, 等. 基于16S rRNA序列分析南糯山不同生境茶树根际土壤细菌群落分布多样性[J]. 昆明理工大学学报(自然科学版), 2016, 41(2): 89-95.
[8]Amann R L, Ludwig W, Schleiffer K H. Phylogenetic identi fication and in situ detection of individual microbial cells without cultivation[J]. Microbiological Reviews, 1995, 59(1): 143-146.
[9]林 生, 莊家强, 陈 婷, 等. 福建安溪不同年限茶树土壤养分与微生物Biolog功能多样性的差异分析[J]. 中国生态农业学报, 2012, 20(11): 1471-1477.
[10]Torsvik V, ?vreas L. Microbiol diversity and function in soil: From genes to ecosystems[J]. Current Opinion in MicRobi ology, 2002, 5(3): 240-245.
[11]郑雪芳, 苏远科, 刘 波, 等. 不同海拔茶树根系土壤微生物群落多样性分析[J]. 中国生态农业学报, 2010, 18(4): 866-871.
[12]谢光新, 张荣先, 黄雪飞, 等. 不同生长年限茶树根际微生物分布的差异[J]. 湖北农业科学, 2012, 51(15): 3176-3179.
[13]李晨晨, 吕 杰, 杨瑞娟, 等. 普洱茶渥堆发酵过程中嗜热细菌的分离和鉴定[J]. 北京化工大学学报(自然科学版), 2012, 39(2): 74-78.
[14]杨瑞娟, 吕 杰, 严 亮, 等. 普洱茶渥堆发酵中嗜热真菌的分离和鉴定[J]. 茶叶科学, 2011, 31(4): 371-378.
[15]严 亮, 杨瑞娟, 王桥美. 云南铁皮石斛内生菌的分离与鉴定[J]. 云南农业大学学报(自然科学), 2015, 30(5): 760-765.
[16]周 泉, 王龙昌, 邢 毅, 等. 间作紫云英下油菜根际土壤微生物群落功能特征[J]. 应用生态学报, 2018, 29(3): 909-914.
[17]贺国强, 赵冬雪, 李恒全, 等. 烟草套作对土壤微生物群落多样性的影响[J]. 浙江农业科学, 2019, 60(12): 2200- 2205.
[18]宋海洋. 苏云金芽胞杆菌在不同植物叶片分布差异的研究[D]. 合肥: 安徽农业大学, 2019.
[19]李书颖, 朱天辉. 杜仲黑斑病菌(Pestalotiopsis trachicarpicola)拮抗细菌的分离和鉴定[J]. 微生物学通报, 2020, 47(2): 469-480.
[20]赵卫松, 郭庆港, 于稳欠, 等. 解淀粉芽胞杆菌PHODB35的溶磷特性及其对番茄的促生作用[J]. 微生物学报, 2020(7):1370-1383.
[21]方 欣, 骆爱国, 涂 青, 等. 普洱茶(熟茶)发酵过程各层间真菌群落的动态变化[J]. 食品科技, 2019, 44(5): 37-42.
[22]周才碧, 陈文品, 吴钟玲, 等. 普洱茶优势菌株黑曲霉的分离及其功能和安全性研究[J]. 食品安全质量检测学报, 2015, 6(3): 1006-1010.
[23]王洪振, 马存强, 任小盈, 等. 普洱茶发酵产茶多糖菌株的筛选与鉴定[J]. 食品工业科技, 2017, 38(7): 156-160, 170.
责任编辑:沈德发

