急性缺血性脑卒中患者外周血NLRP3炎性小体表达变化及临床意义*
苏诗涵,娄方丽
解放军联勤保障部队第九二〇医院神经内科,云南昆明 650032
根据最新的中国脑卒中防治报告显示,脑卒中是造成我国居民致残和死亡的主要原因之一,并且随着我国人口老年化的进展,其发病率呈明显上升趋势[1]。其中,急性缺血性脑卒中(AIS)占据了所有脑卒中病例的80%,针对AIS的防治,显得尤为重要[2]。近年来,相关研究显示,机体炎性反应的激活与放大是AIS发生与进展的重要因素[3],因此,抑制炎性反应作为AIS免疫治疗的手段之一,是临床研究的重要方向。核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎性小体及下游信号通路的激活是机体炎性反应持续及放大的重要原因之一,该信号通路与众多炎症性疾病的发生、进展密切相关,如自身免疫性疾病、恶性肿瘤、动脉粥样硬化等[4-6]。有研究显示,NLRP3炎性小体的激活可产生炎症级联反应,引起组织细胞损伤及器官功能不全,主要信号通路包括促进下游白细胞介素(IL)-1β和IL-18的合成与分泌,激活半胱氨酸蛋白酶1(Caspase-1)焦亡通路[7]。AIS的发生、发展与机体炎性反应密切相关,而其体内NLRP3炎性小体表达水平如何,目前少见报道,现将研究结果报道如下。
1 资料与方法
1.1一般资料 选取2016年1月至2020年1月本院收治的185例AIS患者作为观察组,并选择同期门诊体检健康者50例为对照组。入选标准:所有观察组患者均满足AIS的诊断标准[8]。排除标准:既往已存在严重肝肾功能不全的患者;合并自身免疫系统疾病的患者;合并脑出血的患者;合并恶性肿瘤的患者。依据美国国立卫生研究院卒中量表(NIHSS)对观察组患者病情严重程度进行评分,并根据评分结果将其分为3组,NIHSS评分≤4分为轻度组(59例);NIHSS评分5~15分为中度组(62例);NIHSS评分≥l6分为重度组(64例)。根据改良的Rankin量表(mRS)评分对患者临床预后进行评估,将其分为预后良好组(143例)与预后不良组(42例)。观察组185例中男102例、女83例,年龄56~78岁、平均(67.1±9.5)岁,体质量指数19.0~26.4 kg/m2、平均(22.9±2.8)kg/m2,有吸烟史92例;对照组50例中男28例、女22例,年龄54~75岁、平均(65.8±8.9)岁,体质量指数19.3~26.0 kg/m2、平均(22.6±3.0)kg/m2,有吸烟史24例。观察组与对照组性别、年龄、体质量指数、吸烟史比较,差异无统计学意义(P>0.05),具有可比性。该研究征得了患者及家属书面知情同意,并经医院伦理委员会审核批准。
1.2方法
1.2.1外周血单个核细胞(PBMCs)NLRP3和Caspase-1 mRNA相对表达水平的检测 在一试管中加入2 mL人外周血淋巴细胞分离液,同时在EDTA抗凝管加入静脉血2 mL。将静脉血加入淋巴细胞分离液中,混匀后以3 000 r/min离心5 min,用毛细吸管吸出细胞,得到PBMCs。在各组PBMCs试管中加入1 mL Trizol(美国Invitrogen公司),提取总RNA,采用美国赛默飞公司Thermo Scientific NanoDrop One超微量紫外-可见光分光光度计测定RNA水平。然后进行RNA反转录,其方法按反转录试剂盒(美国赛默飞公司)说明书进行。将反转录产物进行PCR反应,依据荧光定量PCR试剂盒说明书(美国赛默飞公司)建立25 μL反应体系,包括经焦碳酸二乙酯处理的水17.5 μL、10×Taq缓冲液2.5 μL、氯化镁2.0 μL、脱氧核糖核苷三磷酸混合物0.5 μL、上下游引物各0.5 μL、Tap酶0.5 μL。反应条件参考相关文献[9]。结果以GAPDH为内参,计算相应基因mRNA的相对表达水平。
1.2.2PBMCs NLRP3、Caspase-1蛋白表达水平的检测 提取各组PBMCs总蛋白,测定蛋白水平。按参考文献[10]方法进行免疫印迹,检测NLRP3、Caspase-1蛋白表达水平。方法简述如下:取50 μg蛋白于电泳分离、转膜、封闭,孵育一抗NLRP3抗体(1∶400)、Caspase-1抗体(1∶400)及抗GAPDH抗体(1∶500)过夜。次日孵育二抗(1∶10 000),测定蛋白条带灰度值,计算目的条带与GAPDH灰度比值。
1.2.3外周血IL-1β和IL-18的检测 采用酶联免疫吸附试验法检测各组外周血IL-1β和IL-18水平,具体操作见试剂盒说明书(上海信帆生物公司)。简要步骤如下:取各组研究对象空腹静脉血4 mL,制备样品;设置标准孔和空白孔,标准孔加入不同浓度样品,空白孔仅加入显色液和终止液;经室温孵育、洗涤后,加入抗体工作液(每孔100 μL)、显色液(每孔100 μL)、终止液(每孔50 μL),最后测定各组A450值。

2 结 果
2.1观察组与对照组PBMCs NLRP3、Caspase-1 mRNA相对表达水平及蛋白表达水平比较 与对照组比较,观察组PBMCs NLRP3、Caspase-1 mRNA相对表达水平及蛋白表达水平升高,差异有统计学意义(P<0.05),见图1、图2。
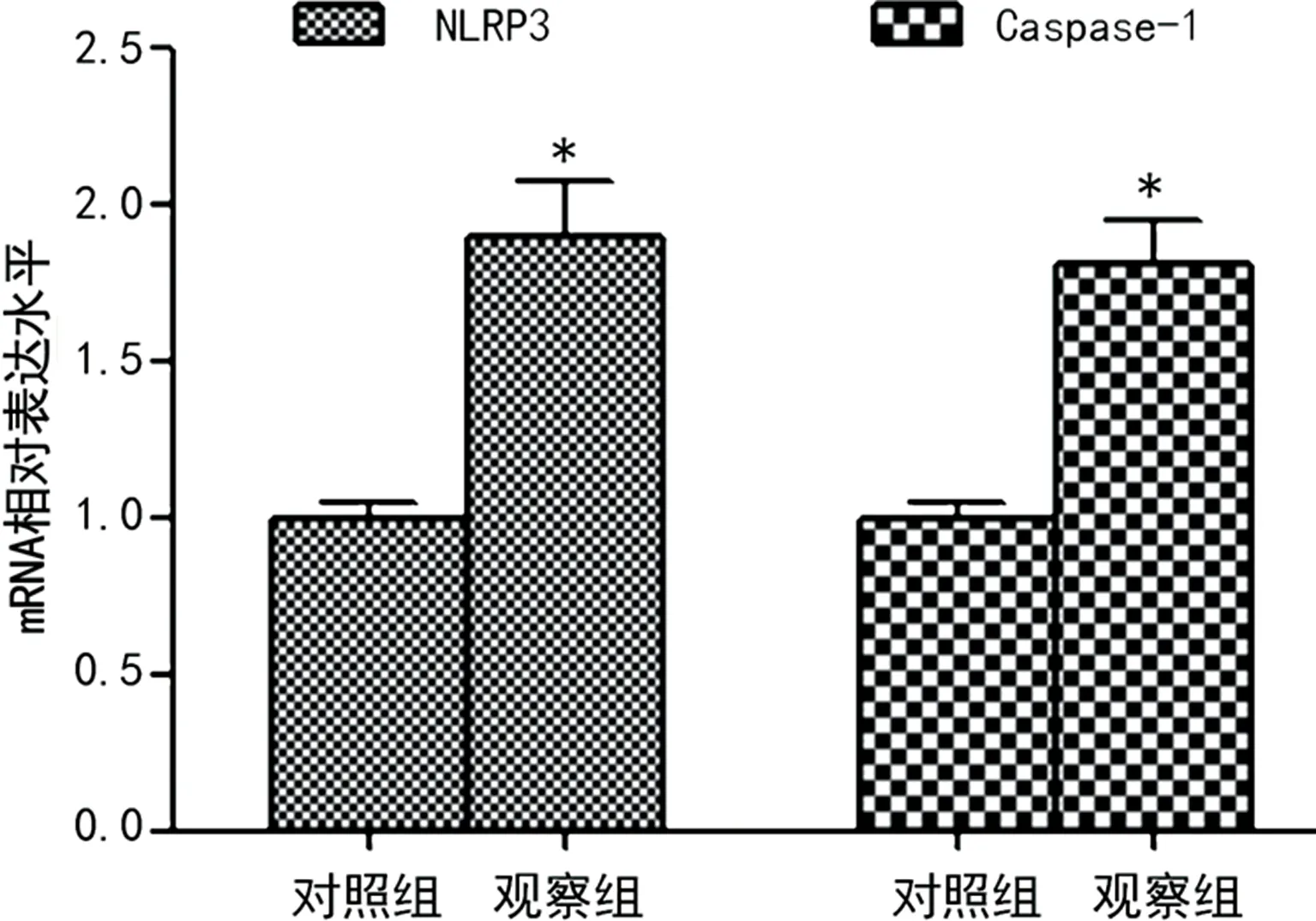
注:与对照组比较,*P<0.05。
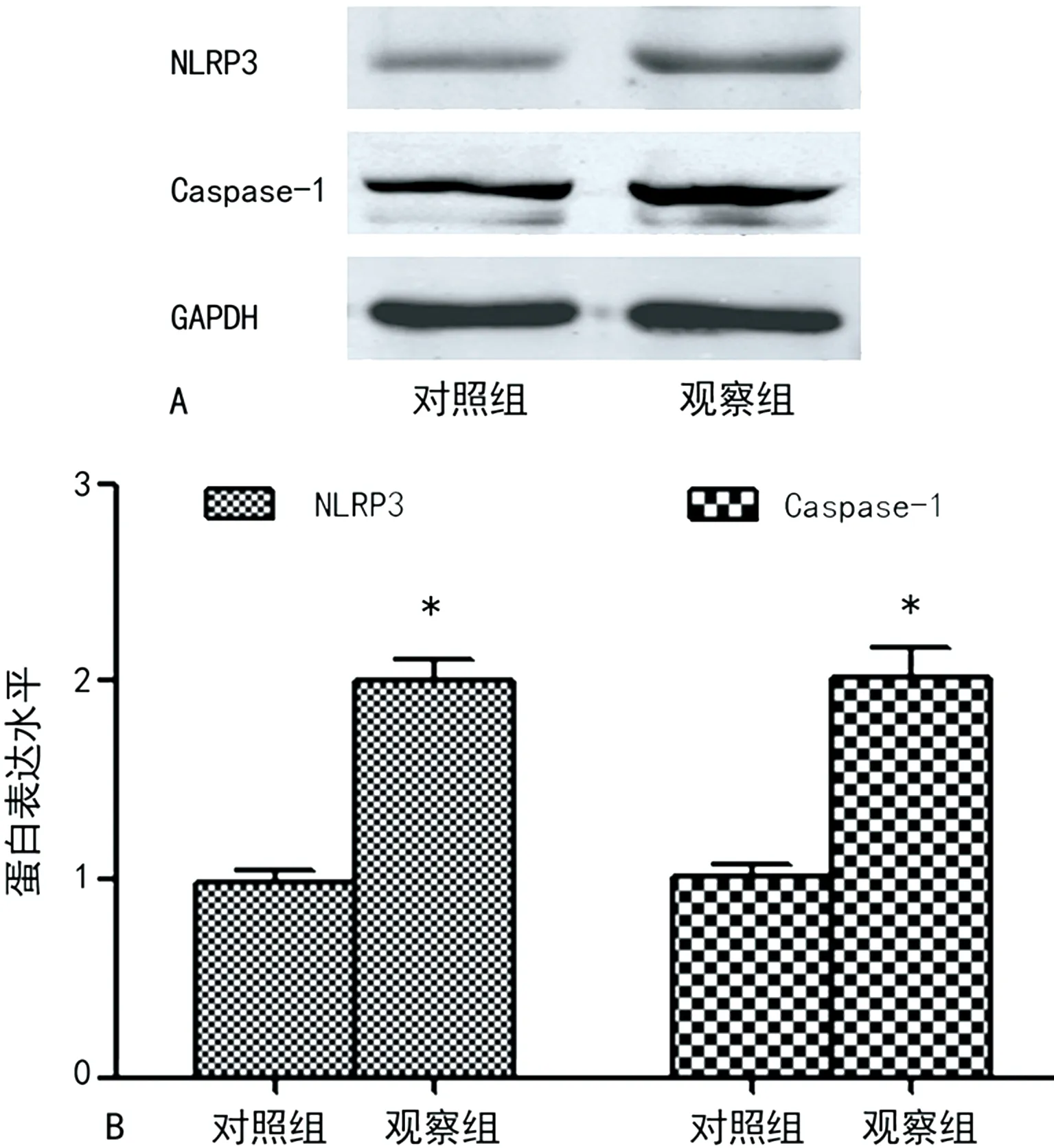
注:A为免疫印迹检测NLRP3、Caspase-1蛋白表达水平,B为观察组与对照组NLRP3、Caspase-1蛋白表达水平柱状图;与对照组比较,*P<0.05。
2.2不同严重程度AIS患者间PBMCs NLRP3、Caspase-1 mRNA相对表达水平及IL-1β、IL-18水平比较 轻度组、中度组、重度组患者间PBMCs NLRP3、Caspase-1 mRNA相对表达水平及IL-1β、IL-18水平比较,重度组最高,中度组次之,轻度组最低,差异均有统计学意义(P<0.05),见表1。

表1 不同严重程度AIS患者间PBMCs NLRP3、Caspase-1 mRNA相对表达水平及IL-1β、IL-18水平比较
2.3不同预后AIS患者间PBMCs NLRP3、Caspase-1 mRNA相对表达水平及IL-1β、IL-18水平比较 预后不良组患者PBMCs NLRP3、Caspase-1 mRNA相对表达水平及IL-1β、IL-18水平均高于预后良好组,差异均有统计学意义(P<0.05),见表2。

表2 不同预后AIS患者间NLRP3、Caspase-1 mRNA相对表达水平及IL-1β、IL-18水平比较
2.4相关性分析 Pearson相关性分析显示,AIS患者PBMCs NLRP3 mRNA相对表达水平与Caspase-1 mRNA、IL-1β、IL-18呈正相关(r=0.760,P<0.001;r=0.712,P<0.001;r=0.640,P=0.008),也与NIHSS评分和mRS评分呈正相关(r=0.730,P<0.001;r=0.690,P<0.001)。
2.5PBMCs NLRP3 mRNA相对表达水平、mRS和NIHSS评分对AIS患者预后不良的预测价值 ROC曲线分析显示,PBMCs NLRP3 mRNA相对表达水平、mRS和NIHSS评分预测AIS患者预后不良的AUC为0.894(95%CI0.821~0.967)、0.780(0.626~0.934)和0.783(0.708~0.858),最佳临界值为1.84、3.70分和14.20分,灵敏度为81.08%、78.57%和68.57%,特异度为82.50%、73.68%和73.42%。NLRP3 mRNA相对表达水平预测AIS患者预后不良的效能优于mRS、NIHSS评分的预测效能。见图3、表3。
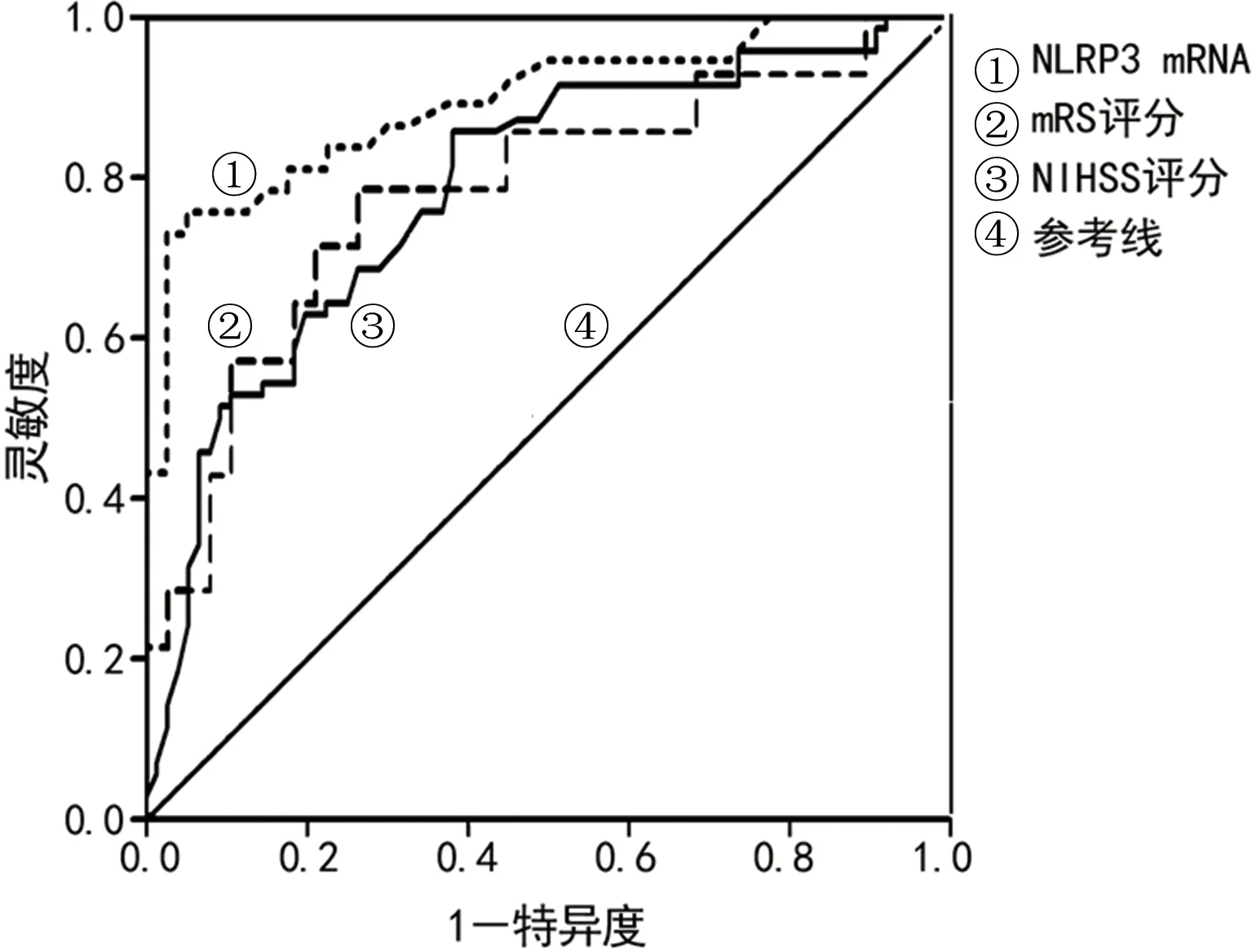
图3 NLRP3 mRNA相对表达水平及mRS、NIHSS评分预测AIS患者预后不良的ROC曲线

表3 各指标评估AIS患者预后不良的ROC曲线分析
3 讨 论
随着我国人口老龄化进程的加快,AIS已成为导致我国居民致死和致残的重要疾病之一,并且发生率呈逐年上升趋势。目前,对于AIS病情及预后的评估,临床常采用NIHSS和mRS评分等,但该方法往往存在一定的滞后性。近年来,随着相关研究的不断深入,有学者发现炎性反应的激活参与了AIS的发生、发展过程。NLRP3炎性小体作为炎性反应的重要启动因子,其与AIS患者病情及预后的关系如何,目前,少见相关研究报道。
免疫炎性小体的激活是促进下游炎症级联反应的启动因子之一,在免疫炎性小体分类方面,NLRP3是重要成员之一,参与了天然免疫系统的构建[11]。NLRP3在细胞及动物实验中,研究较为广泛而深入,它可激活下游Caspase-1/IL-1β及IL-18通路,是促进炎性反应的重要信号通路之一[12]。相关研究显示,NLRP3相关通路的激活与炎症性疾病的发生、发展密切相关,同时其可作为潜在的治疗靶点[9]。本研究结果显示,AIS患者机体NLRP3及相关下游信号通路呈激活状态,主要表现为PBMCs NLRP3、Caspase-1 mRNA相对表达水平及蛋白表达水平明显升高(P<0.05)。随着AIS患者病情的进展,患者PBMCs NLRP3及相关下游信号通路进行性升高或激活。为进一步明确PBMCs NLRP3 mRNA相对表达水平与NIHSS评分及相关炎性细胞因子的关系,通过相关性分析,结果显示AIS患者PBMCs NLRP3 mRNA相对表达水平与NIHSS评分及下游炎性细胞因子水平呈正相关(P<0.05),提示AIS患者外周血NLRP3炎性小体水平越高,其病情越危重。外周血NLRP3炎性小体水平升高引起AIS的发生、进展,可能与多种因素相互作用有关。有研究证实,外周血NLRP3炎性小体可直接促进低密度脂蛋白的氧化及脂质的过氧化,引起氧自由基生成明显增加,从而损伤内皮细胞,导致内皮素及炎性因子的释放,促进了动脉粥样硬化的形成,从而导致脑卒中的发生[13]。其次,外周血NLRP3炎性小体可激活体内血小板,促进血小板的黏附与聚集,导致血栓形成[14]。
为进一步分析外周血NLRP3炎性小体与AIS患者预后的关系,将AIS患者分为预后良好组与预后不良组,分析这2组中PBMCs NLRP3 mRNA相对表达水平的差异。本研究结果显示,预后不良组PBMCs NLRP3 mRNA相对表达水平高于预后良好组(P<0.05),同时与mRS评分呈正相关(P<0.05),提示外周血NLRP3炎性小体水平可有效地反映AIS患者临床预后,ROC曲线分析也显示其对AIS患者预后不良的预测价值较高。对于炎症性疾病的有效治疗,是困扰临床的重大问题,所以抑制NLRP3及相关下游通路激活可能是相关新药研究的重要方向[15]。
综上所述,NLRP3炎性小体与AIS的病情进展密切相关。通过检测外周血NLRP3炎性小体表达水平,可有效地评估AIS患者病情严重程度及预后。但本研究也存在一定的局限性,由于AIS患者样本量偏少,需要进一步加大样本量,采取多中心联合的方式对外周血NLRP3炎性小体预测AIS患者病情严重程度及预后的临床价值做进一步的研究。

