羟基氧化铁对太湖底泥中多氯联苯微生物厌氧脱氯的影响
韩雪欣, 林娜娜, 刘 莎, 许 妍
东南大学土木工程学院, 江苏 南京 210096
20世纪30年代至80年代曾广泛用于工业生产的多氯联苯(PCBs)是一种典型的持久性有机物. PCBs因具有疏水性和难降解性,易通过食物链积累,从而对人体健康造成危害[1]. 研究显示,PCBs具有致癌性、致突变性,同时会对内分泌系统、神经系统造成不良影响[2-4]. 此外,人体摄入PCBs还会增大患糖尿病、心血管疾病的风险[5-6].
目前,传统的PCBs修复方法有植物修复、好氧微生物降解、厌氧微生物脱氯、化学试剂脱氯等[7]. 其中,微生物降解法成本低、环境友好,具有较好的应用前景[8-9]. 低氯代PCBs(氯原子取代数≤3)较易被好氧微生物降解[10],但环境中大多存在的是较高氯代程度的PCBs,在一定程度上限制了好氧降解反应的进行. 微生物在厌氧环境下可将高氯代PCBs脱氯降解为低氯代产物,提高PCBs的原位修复潜力,因此得到日益广泛的关注.

PCBs在厌氧条件下的脱氯速率、脱氯程度、脱氯历程受到多种物理和化学因素的影响,目前关注较多的有温度、pH、电子供体、电子受体、碳源等[17-18]. 在厌氧脱氯过程中,PCBs作为电子受体发生还原反应. 天然底泥中存在的Fe(Ⅲ)等电子受体与PCBs存在竞争关系. Morris等[19]首次研究了FeOOH对哈德逊河底泥中PCBs脱氯的影响,发现FeOOH使PCBs的脱氯程度降低了12%. WEI等[20-21]研究表明,Fe(Ⅲ)与三氯乙烯(TCE)竞争电子供体,可部分抑制脱氯作用. XU等[22]指出,FeOOH抑制了哈德逊河和格拉斯河底泥中PCBs的脱氯降解,同时对底泥中脱氯相关的Dehalococcoides菌的生长产生了消极影响. 然而,LIU等[23]利用广东省龙塘河流中的底泥,在研究生物电化学反应器中Fe(Ⅲ)对PCB 61脱氯的影响时发现,加入Fe(Ⅲ)显著提高了PCB 61的脱氯速率和脱氯程度. 杨文斌等[24]测定得到太湖沉积物中的Fe元素含量为 25 250~31 570 mg/kg,相较于国内外的其他水域[25-28],太湖底泥中Fe元素的含量较高. 因此,研究Fe(Ⅲ)对太湖底泥中PCBs厌氧脱氯和底泥微生物群落的影响具有实际意义.
该研究拟在太湖底泥微环境中添加PCBs和羟基氧化铁(FeOOH),探究竞争性电子受体FeOOH对太湖底泥微环境下PCBs厌氧脱氯速率、脱氯程度的影响以及2种微环境(未添加FeOOH的对照组和添加了FeOOH的试验组)下PCBs脱氯过程中微生物群落的变化,以揭示太湖底泥PCBs脱氯降解潜能,为监测自然衰减法原位修复PCBs提供参考.
1 材料与方法
1.1 仪器与试剂
主要仪器:安捷伦7890A配微电子捕获检测器(GC-μECD,美国安捷伦科技有限公司);致微GI54DS高压灭菌器(美国致微仪器公司);N-12008旋转蒸发仪(东京理化器械株式会);A-1000s水流抽气泵(东京理化器械株式会);ZX3涡旋仪(美国赛默飞世尔科技公司).
试剂与药品:正己烷(n-Hexane 95%)、丙酮(Acetone)、二氯甲烷(Dichloromethane),均采购自天地高纯溶剂有限公司,均为色谱纯;异丙醇(Isopropanol,色谱纯),采购自上海阿拉丁生化科技股份有限公司;弗罗里土(Florisil,60~80目),采购自美国赛默飞世尔科技公司;无水硫酸钠(Na2SO4)、氯化钠(NaCl)、亚硫酸钠(Na2SO3)、四丁基硫酸氢铵(TBA),均采购自美国西格玛奥德里奇公司,均为分析纯; PCB单体标准物质及混标采购自美国AccuStandard公司.
1.2 样品采集及处理
在太湖竺山湾布设4个采样点(见图1),使用抓斗式采泥器采集表层(0~5 cm)底泥,在4 ℃下于棕色玻璃瓶中水封保存.

图1 太湖底泥样品采样点分布示意Fig.1 The location of sediment sampling sites in Taihu Lake
取适量底泥于室温20 ℃下自然风干,剔除砾石、杂草等杂质后充分研磨,过100目(150 μm)筛. 预处理后进行底泥理化性质的测定,测定方法及仪器见表1.
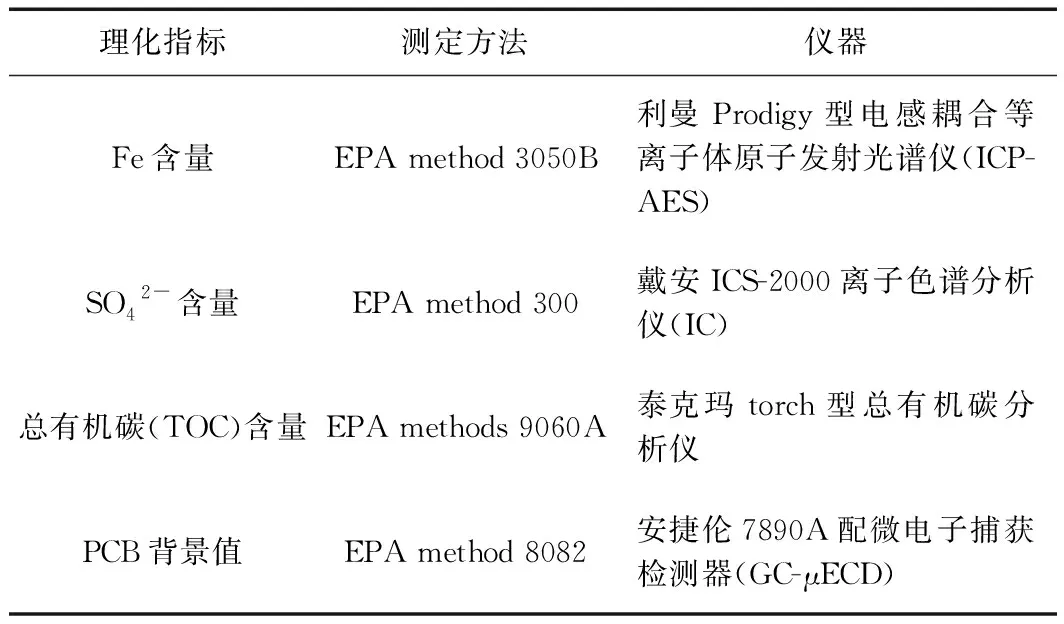
表1 底泥理化性质测定方法及仪器
1.3 底泥微环境配制


表2 PCBs母体组成
T-1对照组的设置:在厌氧条件下于30 mL血清瓶中添加4.1 g湿泥(干质量为2.0 g)、2.0 g外加PCBs的干泥和13.9 g新鲜配制的RAMM培养液(配制方法参照文献[29-30]),泥浆总质量为20 g,其中干泥和湿泥均为4个采样点底泥等质量混合所得. PCBs总含量为50 mg/kg(以泥浆计). T-Fe试验组同样在血清瓶中添加4.1 g湿泥和2.0 g外加PCBs的干泥,然后加入0.696 mL FeOOH胶体储备液(1.15 mol/L,配制方法参照文献[31]),再加入适量RAMM培养液,使瓶内泥浆混合物总质量为20 g,PCBs总含量为50 mg/kg,FeOOH含量为40 mmol/kg(以泥浆计). 灭菌组的配制方法同T-1对照组,但添加的湿泥需在121 ℃、103.4 kPa条件下灭菌45 min,连续灭菌3 d. 血清瓶加塞特氟龙涂层灰丁基橡胶塞,并用铝箔密封. 将配制好的血清瓶于100 r/min下振荡混匀12 h. 振荡完成时为第一个采样点,记为第0天. 模拟底泥自然环境,将混匀的血清瓶置于避光条件下室温〔(22±2)℃〕静置反应. 0~168 d内每21 d取样1次,此后于第210天取样1次,每次均采集3个平行样,测定泥浆中二价铁〔Fe(Ⅱ)〕的浓度,并进行PCBs的提取与分析以及实时荧光定量PCR分析.
1.4 Fe(Ⅱ)浓度的测定
使用菲洛嗪试剂测定体系中Fe(Ⅱ)的浓度[32]. 首先取0.2 mL泥浆,加入0.8 mL 1 mol/L的盐酸充分反应;离心(1 000 r/min,1 min)后取0.1 mL上清液,再加入4.9 mL菲洛嗪溶液,反应后过滤. 使用紫外分光光度计在波长562 nm处测定滤后溶液的吸光度. 该方法加标回收率为97%~102%.
1.5 PCBs提纯与分析
PCBs的提取、提纯净化及分析方法参照文献[33]:在2.0 g泥浆中加入10 mL丙酮萃取1次,10 mL丙酮、正己烷混合液(二者体积比1∶1)萃取2次,再用3 mL正己烷萃取1次,将萃取液合并. 向萃取液中加入8 mL质量分数为2%的氯化钠溶液,然后分离提纯正己烷层,并氮吹至2 mL. 向氮吹后的正己烷溶液中加入1 mL四丁基硫酸试剂和2 mL异丙醇除硫,涡旋1 min,再加入0.1 g亚硫酸钠. 分离正己烷层,并氮吹至1 mL,液体过弗洛里土层析柱(由上至下装填1.8 g无水硫酸钠和3.0 g弗洛里土,10 mm内径). 然后用30 mL正己烷洗脱,再用30 mL体积比为4∶1的正己烷和二氯甲烷混合液洗脱. 将洗脱液旋转蒸发至4 mL,正己烷定容至8 mL,用于气相色谱分析. 209种PCBs单体的气相色谱分析使用安捷伦7890A配微电子捕获检测器(GC-μECD)进行. 在采样的泥浆中加入200 μL 5 μg/mL的PCB 209作为替代物,各PCB单体的浓度均通过替代物回收率校正.
1.6 16S rDNA的提取与qPCR分析
使用美国MoBio公司的PowerSoil DNA提取试剂盒提取底泥DNA,提取方法参照试剂盒说明书. 该试验分析了重要的脱氯细菌Dehalococcoides16S rRNA 基因数量随时间的变化趋势,从而定量表现其在两种微环境下PCBs脱氯过程中的变化规律. 目标菌群研究使用的引物为DHC1200F/DHC1271R[34]. 质粒委托上海生工进行制备,采用pUCm-T载体插入目标基因. qPCR的反应体系为25 μL. 循环条件:95 ℃ 预变性120 s;95 ℃变性15 s,60 ℃延伸60 s,共40个循环;溶解程序设置为60~95 ℃.
1.7 高通量测序分析
底泥样品总DNA提取方法同1.6节,高通量测序工作委托广州美格基因公司完成,使用Illumina Hiseq 2500平台进行测序. 使用QIIME软件包(版本1.9.1)计算两种多样性指数(Shannon-Wiener指数和Simpson指数),比较群落物种多样性. 以Greengenes数据库为参照,使用RDP Classifier对每个OTU(operational taxonomic unit,操作分类单位)的代表序列进行物种分类,并用R软件(版本2.15.3)统计OTU各分类等级所占比例,绘制成柱形图.
2 结果与讨论
2.1 太湖底泥理化性质分析
太湖地区4个采样点底泥样品的含水率为38.86%~62.71%,Fe含量为 24 930.46~34 882.2 mg/kg(以该试验微环境中的泥浆计,为89.04~124.58 mmol/kg),总有机碳(TOC)含量为0.52%~1.27%(以干泥计),PCBs背景值为13~84 ng/g(以干泥计). 根据加拿大《沉积物环境质量标准》,Z3、Z4采样点底泥中PCBs含量低于ISQG,其所在区域内PCBs对生物体的威胁在可接受范围内;Z1、Z2采样点底泥PCBs背景值介于ISQG与PEL(可能效应水平值,277 ng/g)之间,其所在区域内PCBs对生物体存在潜在威胁,这与袁旭音等[35]对太湖沉积物PCBs风险评价结果相一致.
2.2 PCBs厌氧脱氯结果分析
2.2.1PCBs脱氯速率及脱氯程度分析
微环境中总PCBs质量浓度的变化可直观地反映其脱氯情况. 在210 d的反应周期内,灭菌组总PCBs质量浓度维持在(49.03±0.48)mmol/kg范围内,随时间无显著变化,且无脱氯产物被检测到,证明脱氯是微生物过程. T-1对照组与T-Fe试验组中总PCBs质量浓度随时间的变化情况(见图2)显示,2种反应条件下均有脱氯反应的发生. T-1对照组中,反应滞后期约为21 d,21~126 d为PCBs快速降解期,126~210 d脱氯速率减慢,但仍未到达平台期,表明210 d后,太湖底泥微环境中仍存在PCBs脱氯潜能. 在210 d内,T-Fe试验组中PCBs的脱氯效率远低于T-1对照组,反应滞后期较长,为42~63 d. 至第210天,T-1对照组的总PCBs质量浓度降低了13.38%,而T-Fe试验组仅降低了4.80%. 这表明Fe(Ⅲ)对PCBs的还原脱氯具有一定的抑制作用,降低了脱氯程度与脱氯速率,但并未完全抑制,这与XU等[22]对格拉斯河底泥的研究结果相同. 哈德逊河底泥中TOC含量与太湖底泥相近,Fe元素背景值(5 310 mg/kg)远低于太湖底泥,但添加相同浓度的FeOOH使哈德逊河底泥中的PCBs厌氧脱氯反应完全被抑制[22],表明Fe(Ⅲ)对PCBs脱氯的影响是一个复杂的作用过程,受到诸多物理化学和生物因素的共同影响.

图2 微环境中总PCBs质量浓度随时间的变化Fig.2 Total PCBs mass concentrations over time in the microcosms

根据在PCBs上的位置,氯可以分为3类——邻位(ortho-)、对位(para-)、间位(meta-)氯,这3种氯随时间的变化情况见图3. 由图3可知,T-1对照组中,间位(meta-)氯的脱氯滞后期短(21~42 d),脱氯速率快. 在T-Fe试验组中,间位氯在第147天才开始减少,第210天时的脱氯程度也远低于T-1对照组(T-1对照组为27.2%,T-Fe试验组为8.9%). 0~210 d内,对位(para-)氯在T-1对照组中减少了17.9%,但在T-Fe试验组中仅减少了4.9%. 由此可见,FeOOH显著抑制了间位和对位氯的脱除(P<0.05). XU等[22]则指出,在格拉斯河底泥中,FeOOH显著抑制了对位氯的脱氯作用,但对间位脱氯的抑制非常有限. 底泥理化性质和微生物群落均可能是导致上述研究结果存在差异的原因. 在T-1对照组和T-Fe试验组中每联苯平均邻位氯原子数目(OCPB)略有上升,主要原因是PCB 12的完全脱氯导致了PCBs分子数量的减少. 在两种微环境中的脱氯偏好顺序均是间位(meta-)>对位(para-)>邻位(ortho-),说明FeOOH并未改变PCBs的脱氯偏好. WEI等[20]研究显示,氨三乙酸络合Fe(Ⅲ)也未使三氯乙烯的脱氯偏好产生明显变化,但水羟合铁使三氯乙烯的脱氯子产物分布发生了较大改变,表明Fe(Ⅲ)的种类也会对脱氯偏好产生影响.

图3 每联苯平均邻位(ortho-)、间位(meta-)、对位(para-)氯数目随时间的变化Fig.3 Changes of ortho-, meta-, para- chlorines per biphenyl over time
2.2.2PCBs产物分析
灭菌组在210 d的反应周期内未检测到PCBs脱氯产物,表明无脱氯反应发生. T-1对照组中,第42天开始出现9种母体外的子产物,说明脱氯启动于21~42 d期间. T-Fe试验组中第63天检测到脱氯产物,表明T-Fe试验组的脱氯滞后期为42~63 d. 这也与图2中总PCBs质量浓度的变化趋势一致. 由此可见,FeOOH使脱氯滞后期延长,这与Paul等[21]的研究结果相同.
初始状态(第0天)与反应进行至第210天时,T-1对照组与T-Fe试验组中PCB单体的组成分布如图4所示. 结果表明,第210天时,T-1对照组中,5种高氯代的PCBs母体(PCB 105、PCB 114、PCB 149、PCB 153、PCB 170)降解程度较高,PCB 1(2-)、PCB 2(3-)、PCB 13(3-4)、PCB 25(24-3)、PCB 32(26-4)、PCB 47(24-24)、PCB 49(24-25)、PCB 52(25-25)等低氯代的子产物大量累积. 这些子产物联苯上剩余的氯原子均无侧位氯取代,表明存在侧位氯的氯原子较易被脱除,而无侧位氯的氯原子较难被取代. T-Fe试验组中,5种高氯代的PCBs母体的降解程度较低,积累的低氯代子产物的种类及其浓度也低于T-1对照组,其中PCB 32、PCB 47、PCB 49、PCB 52的浓度远低于T-1对照组.

注:含量低于0.1 mg/kg的PCB单体不显示编号. 图4 第0天与第210天微环境中PCB单体组成分布对比Fig.4 Comparison of the PCB congener profile at day 0 and day 210 in the microcosms
微环境中PCBs的主要脱氯路径见图5. 如图5所示,PCB 32是PCB 64和PCB 71的一代子产物,与T-1对照组相比,T-Fe试验组中PCB 64的降解程度明显较低,这可能是PCB 32在T-Fe试验组中未大量积累的原因. PCB 47、PCB 49、PCB 52是PCB 153的二代子产物,而FeOOH抑制了PCB 153的降解,因此使子产物的浓度较低. 值得注意的是,T-1对照组中出现了PCB 25的邻位脱氯子产物PCB 13,表明太湖底泥中具有邻位脱氯路径. 而T-Fe试验组中未检测到PCB 13,无邻位脱氯过程,这可能是因为Fe(Ⅲ)抑制了邻位脱氯进程. 然而,XU等[22]发现,添加FeOOH并未抑制格拉斯河底泥中的邻位脱氯过程,这可能与格拉斯河底泥中有机物含量较高(TOC为5.73%)有关.
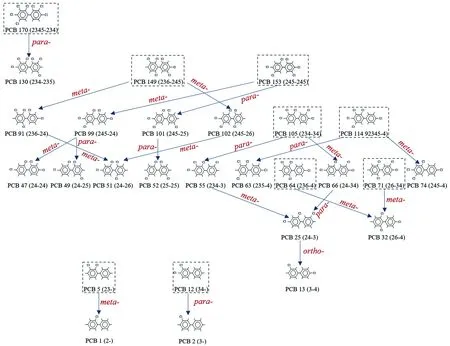
注:ortho-—邻位脱氯; meta-—间位脱氯; para-—对位脱氯. 虚线框表示外加PCB母体.图5 微环境中多氯联苯的主要脱氯路径Fig.5 The main dechlorination pathways of PCBs in the microcosms
2.3 Fe(Ⅲ)还原分析
Fe(Ⅲ)的还原程度可通过微环境中Fe(Ⅱ)的浓度予以反映,两个体系中Fe(Ⅱ)的浓度变化如图6 所示. T-1对照组中Fe(Ⅱ)浓度的增加来源于太湖底泥中内源Fe(Ⅲ)的还原,T-Fe试验组中则为内源和外加Fe(Ⅲ)还原的共同结果. 因此,T-Fe试验组和T-1对照组中Fe(Ⅱ)浓度的差值可反映外加FeOOH的还原程度. 第21天时,T-Fe和T-1中Fe(Ⅱ)含量的差值为11.50 mmol/kg,说明FeOOH的还原已于0~21 d启动,优先于PCBs还原脱氯反应. 至第210天,T-1对照组和T-Fe试验组中Fe(Ⅱ)含量的差值始终小于40 mmol/kg,说明T-Fe试验组中外加的FeOOH未完全被还原. 由此可见,PCBs脱氯与Fe(Ⅲ)还原可同时进行. WEI等[20]的研究同样表明三氯乙烯脱氯和Fe(Ⅲ)还原可同时发生.
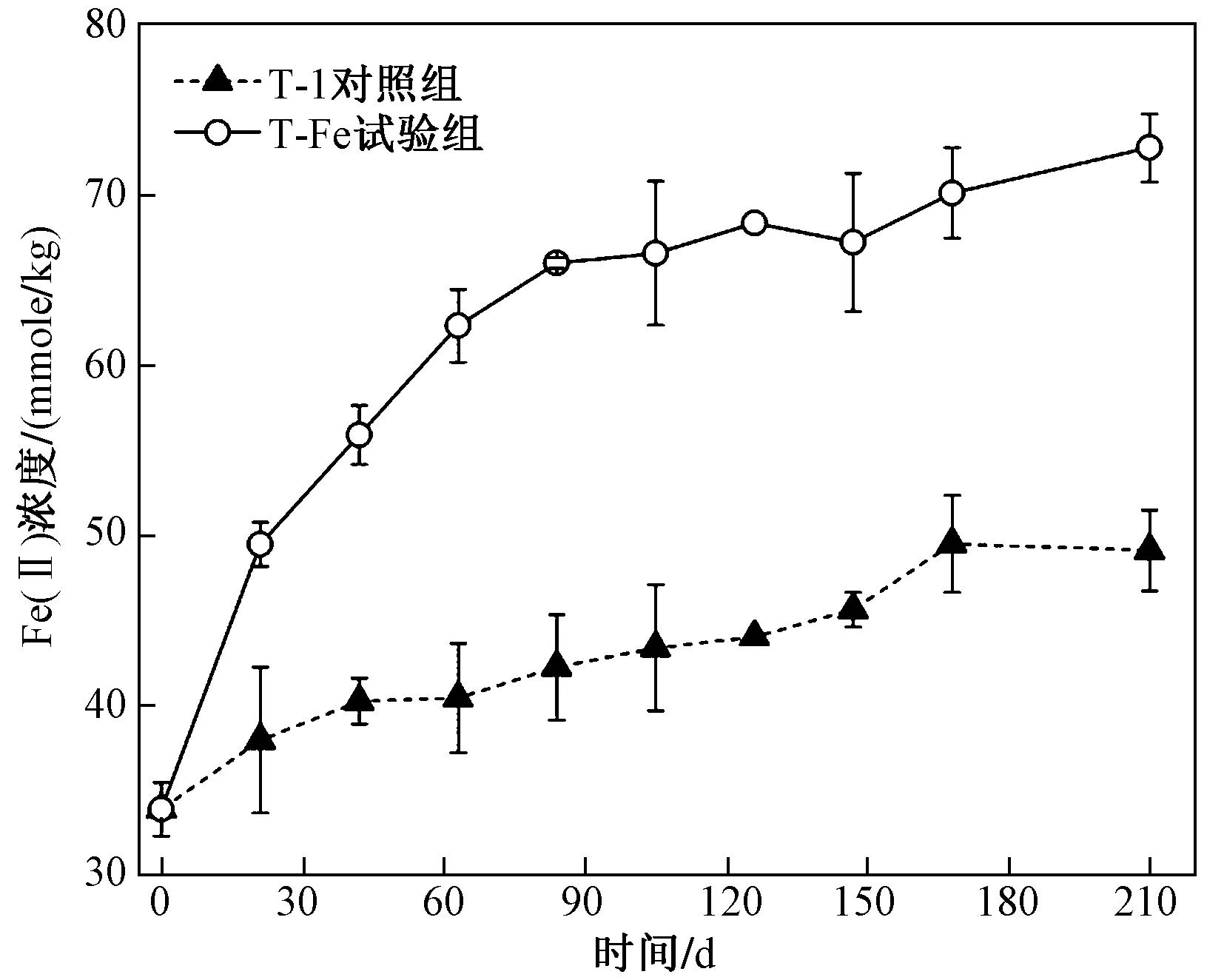
图6 两个微环境体系中Fe(Ⅱ)浓度随时间的变化Fig.6 The concentration of Fe (Ⅱ) over time in the two microcosms
2.4 高通量测序结果分析
该试验对第0、42、168天两组微环境中底泥样品的16S rDNA基因V3~V4可变区进行高通量测序. 序列相似度≥97%则归为1个OTU,各样品的序列数及OTU数见表3. Shannon-Wiener指数和Simpson指数可以综合反映群落中物种的丰富度和均匀度,二者值越大,表明群落多样性越高. 由表3可见,初始状态底泥样品中微生物群落多样性最高,两组的微生物群落多样性均随时间的延长而逐渐降低,且T-Fe试验组的群落多样性低于同时段的T-1对照组.

表3 各样品OTUs及α-多样性指数统计
各组底泥中优势细菌在门水平上的相对丰度如图7所示. 由图7可见,第0天时T-1对照组中,变形菌门(Proteobacteria)相对丰度(46.46%)最高,其次为拟杆菌门(Bacteroidete,相对丰度为16.57%)、绿弯菌门(Chloroflexi,相对丰度为9.64%)、厚壁菌门(Firmicutes,相对丰度9.62%). 添加PCBs后,T-1对照组中厚壁菌门的相对丰度呈上升趋势,在第168天时达37.71%,成为群落中相对丰度最高的门类,这与杨凯[36]的研究结果一致. T-Fe试验组中厚壁菌门的相对丰度呈更加明显的升高趋势,第168天时达55.95%,同样在微环境群落中占比最高. 杨凯[36]指出,厚壁菌门的大量富集表明该门类中可能存在与PCBs转化和消减密切相关的微生物.

图7 门水平优势细菌的相对丰度随时间的变化Fig.7 Changes of relative abundance of preponderant bacteria phyla over time
T-1对照组中,变形菌门(Proteobacteria)的相对丰度随脱氯反应的进行逐渐降低,第168天时占总细菌的27.72%,优势菌地位下降. T-Fe试验组的Fe(Ⅲ)还原条件下,变形菌门的相对丰度呈现更加明显的下降趋势,第168天时占比仅为14.96%. 虽然变形菌门在各体系中的相对丰度降低,但δ变形菌亚门(δ-Proteobacteria)在变形菌门内的占比呈上升趋势,T-1对照组中由第0天的31.43%增至第168天的53.65%,T-Fe试验组中第168天时其占比达61.95%.δ-Proteobacteria中的脱硫单胞菌属(Desulfuromonas)、脱硫细菌属(Desulfuromusa)、地杆菌属(Geobacter)和幽门杆菌属(Pelobacter)可作用于Fe(Ⅲ)还原[37],部分Fe(Ⅲ)还原菌可使三氯乙烯、四氯乙烯脱氯降解[38-40],但目前尚未发现使PCBs厌氧脱氯的铁还原菌.
目前已知的PCBs脱氯菌大多隶属于绿弯菌门(Chloroflexi)[41-43],其相对丰度在T-1对照组、T-Fe试验组中均有一定程度的提高,由第0天的9.64%分别增至第168天的11.57%和12.70%. 初始状态下,Chloroflexi门类内相对丰度最高的是厌氧绳菌纲(Anaerolineae,相对丰度为94.33%),其次为Dehalococcoidetes(相对丰度为4.2%). T-1对照组中,已知与PCBs脱氯相关的Dehalococcoidales在Chloroflexi中的占比大幅提升,由第0天的3.42%增至第168天的26.27%. T-Fe试验组中Dehalococcoidales/Chloroflexi的增幅较小,第168天时比值为10.55%. 各微环境中,第0天时未启动脱氯反应,Dehalococcoides也在各体系中未被检出. T-1对照组在第42天检出Dehalococcoides,占总OTUs的0.01%,但在T-Fe试验组仍未检出,对应该时间点下T-1对照组中脱氯反应启动,而T-Fe试验组中PCBs脱氯仍处于滞后期. 在脱氯速率较快的第168天,T-1对照组、T-Fe试验组中Dehalococcoides的占比分别为0.78%和0.18%,表明该菌属会随时间发生富集,并对太湖底泥微环境中PCBs的厌氧脱氯具有重要作用,这与Matturro等[44]对意大利马可波罗海洋底泥的相关研究结果相同.
2.5 实时荧光定量PCR结果分析
目前,已有研究发现的PCBs还原脱氯细菌主要是Dehalococcoides属细菌[42-43],各微环境下Dehalococcoides的16S rRNA基因数随时间的变化情况如图8所示. 由图8可见,T-1对照组中Dehalococcoides16S rRNA的基因数从21~42 d开始明显增长,而21~42 d T-1对照组中的PCBs脱氯也开始启动,至210 d 16S rRNA基因数一直保持在较高水平,该时段内的PCBs脱氯也具有较高的速率. 这表明太湖底泥沉积物中,Dehalococcoides的生长与PCBs的还原脱氯密切相关,该结果与高通量测序的结论一致. T-Fe试验组中Dehalococcoides的16S rRNA基因数一直维持在较低水平,即使是在图2所示脱氯速率较快的84~126 d,该基因水平仍无明显增长. 这表明在太湖底泥沉积物中可能存在其他PCBs脱氯相关的细菌种群. 0~42 d T-Fe试验组中Dehalococcoides的基因数高于T-1对照组,该现象也发现于格拉斯河底泥[22]的研究中,其原因可能是一些三价铁还原菌与氢氧化菌互营共生或发酵产氢[45],氢气作为Dehalococcoides的首选电子供体,促进了其在底泥微环境中的富集[46],但此时T-Fe试验组中脱氯反应并未启动,这可能是Dehalococcoides属中的相关细菌利用Fe(Ⅲ)作为替代电子受体进行生长代谢导致的[47]. 63~210 d的培养周期内,与T-1对照组相比,T-Fe试验组中Dehalococcoides的基因数处于较低水平,这与哈德逊河底泥[22]中的结果相一致.
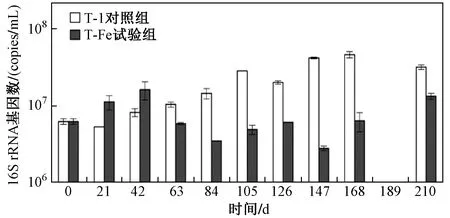
图8 两个微环境体系中Dehalococcoides的16S rRNA基因数随时间的变化Fig.8 Changes of Dehalococcoides 16S rRNA genes over time in the two microcosms
3 结论
a) 太湖底泥中PCBs背景值为13~84 ng/g,Z1、Z2采样点所在区域内PCBs对生物体存在潜在威胁.
b) 40 mmol/kg的FeOOH对PCBs的还原脱氯有一定的抑制作用,延长了脱氯滞后期,降低了脱氯程度和脱氯速率.

d) FeOOH显著抑制了间位和对位氯的脱除(P<0.05). 在两种还原条件下的脱氯偏好均是间位(meta-)>对位(para-)>邻位(ortho-),说明FeOOH并未改变PCBs的脱氯偏好. 对照组中存在邻位脱氯路径,而FeOOH还原体系中210 d内未发生邻位脱氯,这可能是FeOOH抑制了邻位脱氯进程.
e) PCBs脱氯与Fe(Ⅲ)还原可同时进行,但Fe(Ⅲ)还原先于PCBs脱氯反应发生.
f) 培养过程中,两个体系中的微生物多样性均逐渐降低,且Fe(Ⅲ)还原条件下的生物多样性低于对照组. 添加PCBs后,厚壁菌门成为2种微环境中相对丰度最高的门类,而变形菌门的优势地位下降. 此外,绿弯菌门的占比在对照组和FeOOH试验组中均有一定程度的提高.Dehalococcoides会随时间的延长而富集,并对太湖底泥微环境中PCBs的厌氧脱氯具有重要作用. 太湖底泥沉积物中可能还存在其他PCBs脱氯相关的细菌种群.
参考文献(References):
[1] DOMINGO J L.Concentrations of environmental organic contaminants in meat and meat products and human dietary exposure:a review[J].Food and Chemical Toxicology,2017,107:20-26.
[2] SAFE S.Polychlorinated-biphenyls(PCBs)-mutagenicity and carcinogenicity[J].Mutation Research,1989,220(1):31-47.
[3] LANGER P,KOCAN A,TAJTAKOVA M,etal.Fish from industrially polluted freshwater as the main source of organochlorinated pollutants and increased frequency of thyroid disorders and dysglycemia[J].Chemosphere,2007,67(9):S379-S385.
[4] JACOBSON J L,JACOBSON S W.Intellectual impairment in children exposed to polychlorinated biphenyls in utero[J].New England Journal of Medicine,1996,335(11):783-789.
[5] WANG Shuli,TSAI P C,YANG C Y,etal.Increased risk of diabetes and polychlorinated biphenyls and dioxins-a 24-year follow-up study of the Yucheng cohort[J].Diabetes Care,2008,31(8):1574-1579.
[6] GUO Wenjing,PAN Bohu,SAKKIAH S,etal.Persistent organic pollutants in food:contamination sources,health effects and detection methods[J].International Journal of Environmental Research and Public Health,2019,16(22):1-29.
[7] JING Ran,FUSI S,KJELLERUP B V.Remediation of polychlorinated biphenyls(PCBs) in contaminated soils and sediment:state of knowledge and perspectives[J].Frontiers in Environmental Science,2018,6:1-17.
[8] 段靖禹,周长志,曹柳,等.生物炭复合青霉菌修复砷污染土壤对其微生物群落功能多样性的影响[J].环境科学研究,2020,33(4):1037-1044.
DUAN Jingyu,ZHOU Changzhi,CAO Liu,etal.Effects of biochar composite penicillium on functional diversity of microbial community in arsenic-contaminated soil[J].Research of Environmental Sciences,2020,33(4):1037-1044.
[9] 孙仲平,吴乃瑾,魏文侠,等.电子供体刺激下厌氧微生物对1,2-二氯乙烷的降解效果[J].环境科学研究,2018,31(8):1431-1438.
SUN Zhongping,WU Naijin,WEI Wenxia,etal.Effect of anaerobic microbial degradation of 1,2-dichloroethane stimulated by electron donor[J].Research of Environmental Sciences,2018,31(8):1431-1438.
[10] BORJA J,TALEON D M,AURESENIA J,etal.Polychlorinated biphenyls and their biodegradation[J].Process Biochemistry,2005,40(6):1999-2013.
[11] 陈燕燕,尹颖,王晓蓉,等.太湖表层沉积物中PAHs和PCBs的分布及风险评价[J].中国环境科学,2009,29(2):118-124.
CHEN Yanyan,YIN Ying,WANG Xiaorong,etal.Polycyclic aromatic hydrocarbons and polychlorinated biphenyl in surface sediments of Taihu Lake:the distribution,sources and risk assessment[J].China Environmental Science,2009,29(2):118-124.
[12] 于英鹏,刘敏.太湖流域水源地多氯联苯分布特征与污染水平[J].生态毒理学报,2018,13(1):147-153.
YU Yingpeng,LIU Min.Distribution characteristics and pollution level of PCBs in water source area of Taihu River Basin[J].Asian Journal of Ecotoxicology,2018,13(1):147-153.
[13] YIN Ge,ZHOU Yihui,STRID A,etal.Spatial distribution and bioaccumulation of polychlorinated biphenyls(PCBs) and polybrominated diphenyl ethers(PBDEs) in snails(Bellamya aeruginosa) and sediments from Taihu Lake Area,China[J].Environmental Science and Pollution Research,2017,24(8):7740-7751.
[14] HARRAD S J,SEWART A P,ALCOCK R,etal.Polychlorinated biphenyls(PCBs) in the British environment:sinks,sources and temporal trends[J].Environmental Pollution,1994,85(2):131-146.
[15] XU Yan,WEI Si,QIN Qingdong,etal.AhR-mediated activities and compounds in sediments of Meiliang Bay,Taihu Lake,China determined by in vitro bioassay and instrumental analysis[J].RSC Advances,2015,5(69):55746-55755.

MA Zhaohui,JIN Jun,QI Xuekui,etal.Vertical distribution of PBDEs and DL-PCBs in sediments of Taihu Lake[J].Environmental Science,2013,34(3):1136-1141.
[17] WIEGEL J,WU Q Z.Microbial reductive dehalogenation of polychlorinated biphenyls[J].FEMS Microbiology Ecology,2000,32(1):1-15.
[18] 许妍,傅大放.多氯联苯微生物厌氧脱氯研究进展[J].环境化学,2014,33(6):908-914.
XU Yan,FU Dafang.A review on microbial-catalyzed reductive dechlorination of polychlorinated biphenyls[J].Environmental Chemistry,2014,33(6):908-914.
[19] MORRIS P J,MOHN W W,QUENSEN J F,etal.Establishment of a polychlorinated biphenyl-degrading enrichment culture with predominantly meta dechlorination[J].Applied and Environmental Microbiology,1992,58(9):3088-3094.
[20] WEI Na,FINNERAN K T.Influence of ferric iron on complete dechlorination of trichloroethylene(TCE) to ethene:Fe(Ⅲ) reduction does not always inhibit complete dechlorination[J].Environmental Science & Technology,2011,45(17):7422-7430.
[21] PAUL L,HERRMANN S,KOCH C B,etal.Inhibition of microbial trichloroethylene dechorination by Fe(Ⅲ) reduction depends on Fe mineralogy:a batch study using the bioaugmentation culture KB-1[J].Water Research,2013,47(7):2543-2554.
[22] XU Yan,GREGORY K B,VANBRIESEN J M.Effects of ferric oxyhydroxide on anaerobic microbial dechlorination of polychlorinated biphenyls in Hudson and Grasse River sediment microcosms:dechlorination extent,preferences,ortho removal,and its enhancement[J].Frontiers in Microbiology,2018,9:1-16.
[23] LIU Xiaoping,WAN Hui,XUE Yuzhou,etal.Addition of iron oxides in sediments enhances 2,3,4,5-tetrachlorobiphenyl(PCB 61) dechlorination by low-voltage electric fields[J].RSC Advances,2017,7(42):26019-26027.
[24] 杨文斌,唐皓,韩超,等.太湖沉积物铁形态分布特征及磷铁相关性分析[J].中国环境科学,2016,36(4):1145-1156.
YANG Wenbin,TANG Hao,HAN Chao,etal.Distribution of iron forms and their correlations analysis with phosphorus forms in the sedimentary profiles of Taihu Lake[J].China Environmental Science,2016,36(4):1145-1156.
[25] 杨宏伟,吴亚丽,马旭阳.黄河干流表层沉积物铁形态的分布特征及相关性分析[J].中国环境科学,2015,35(12):3663-3669.
YANG Hongwei,WU Yali,MA Xuyang.Distribution characteristics and correlation analysis of Fe speciation in the surface sediments from different reaches along Yellow River[J].China Environmental Science,2015,35(12):3663-3669.
[26] 彭翠英,李志良,黄微,等.湘江中游衡阳-株洲段沉积物几种典型重金属的污染特征及其生态风险评价[J].南华大学学报(自然科学版),2019,33(4):89-96.
PENG Cuiying,LI Zhiliang,HUANG Wei,etal.Heavy metal pollution characteristics and potential ecological risk assessment of sediments in Hengyang-Zhuzhou Section of Xiangjiang River[J].Journal of University of South China(Science and Technology),2019,33(4):89-96.
[27] 王晨晨,潘大为,韩海涛,等.烟台四十里湾潮间带表层沉积物中铁的形态研究[J].海洋环境科学,2019,38(4):555-560.
WANG Chenchen,PAN Dawei,HAN Haitao,etal.Research on iron speciation in surface sediments in intertidal zone of Yantai Sishili Bay[J].Marine Environmental Science,2019,38(4):555-560.
[28] XU Yan,GREGORY K B,VANBRIESEN J M.Reduction in sulfate inhibition of microbial dechlorination of polychlorinated biphenyls in Hudson and Grasse River sediments through fatty acid supplementation[J].Chemosphere,2019,233:81-91.
[29] SHELTON D R,TIEDJE J M.General-method for determining anaerobic biodegradation potential[J].Applied and Environmental Microbiology,1984,47(4):850-857.
[30] YAN T,TIMOTHY M L,PAIGE J N.The impact of sediment characteristics on polychlorinated biphenyl-dechlorinating cultures:implications for bioaugmentation[J].Bioremediation Journal,2006,10(4):143-151.
[31] LOVLEY D R,PHILLIPS E J P.Organic-matter mineralization with reduction of ferric iron in anaerobic sediments[J].Applied and Environmental Microbiology,1986,51(4):683-689.
[32] SORENSEN J.Reduction of ferric iron in anaerobic,marine sediment and interaction with reduction of nitrate and sulfate[J].Applied and Environmental Microbiology,1982,43(2):319-324.
[33] 徐磊,刘莎,秦庆东,等.太湖竺山湾及入湖河流沉积物中多氯联苯单体分布及源解析[J].中国环境科学,2017,37(11):4333-4341.
XU Lei,LIU Sha,QIN Qingdong,etal.Distribution and source apportionment of polychlorinated biphenyl congeners in surface sediments from Zhushan Bay and the inflow rivers of Lake Taihu[J].China Environmental Science,2017,37(11):4333-4341.
[34] MUYZER G,DEWAAL E C,UITTERLINDEN A G.Profiling of complex microbial-populations by denaturing gradient gel-electrophoresis analysis of polymerase chain reaction-amplified genes-coding for 16S ribosomal-RNA[J].Applied and Environmental Microbiology,1993,59(3):695-700.
[35] 袁旭音,王禹,孙成,等.太湖底泥中多氯联苯的特征与环境效应[J].长江流域资源与环境,2004,13(3):272-276.
YUAN Xuyin,WANG Yu,SUN Cheng,etal.Characteristics and environmental effects of polychlorinated biphenyls in sediments from Taihu Lake[J].Resources and Environment in the Yangtze Basin,2004,13(3):272-276.
[36] 杨凯.水稻土有机质矿化过程中多氯联苯的厌氧生物脱氯研究[D].杭州:浙江大学,2015.
[37] LONERGAN D J,JENTER H L,COATES J D,etal.Phylogenetic analysis of dissimilatory Fe(Ⅲ)-reducing bacteria[J].Journal of Bacteriology,1996,178(8):2402-2408.
[38] KRUMHOLZ L R.Desulfuromonaschloroethenicasp.nov.uses tetrachloroethylene and trichloroethylene as electron acceptors[J].International Journal of Systematic Bacteriology,1997,47(4):1262-1263.
[39] SUNG Y,RITALAHTI K M,SANFORD R A,etal.Characterization of two tetrachloroethene-reducing,acetate-oxidizing anaerobic bacteria and their description asDesulfuromonasmichiganensissp.Nov.[J].Applied and Environmental Microbiology,2003,69(5):2964-2974.
[40] SUNG Y,FLETCHER K F,RITALALITI K M,etal.Geobacterlovleyisp.Nov.strain SZ,a novel metal-reducing and tetrachloroethene-dechlorinating bacterium[J].Applied and Environmental Microbiology,2006,72(4):2775-2782.
[41] WU Q Z,WATTS J E M,SOWERS K R,etal.Identification of a bacterium that specifically catalyzes the reductive dechlorination of polychlorinated biphenyls with doubly flanked chlorines[J].Applied and Environmental Microbiology,2002,68(2):807-812.
[42] FENNELL D E,NIJENHUIS I,WILSON S F,etal.Dehalococcoidesethenogenesstrain 195 reductively dechlorinates diverse chlorinated aromatic pollutants[J].Environmental Science & Technology,2004,38(7):2075-2081.
[43] ADRIAN L,DUDKOVA V,DEMNEROVA K,etal.‘Dehalococcoides’ sp. strain CBDB1 extensively dechlorinates the commercial polychlorinated biphenyl mixture Aroclor 1260[J].Applied and Environmental Microbiology,2009,75(13):4516- 4524.
[44] MATTURRO B,UBALDI C,ROSSETTI S.Microbiome dynamics of a polychlorobiphenyl(PCB) historically contaminated marine sediment under conditions promoting reductive dechlorination[J].Frontiers in Microbiology,2016,7:1-14.
[45] CORD-RUWISCH R,LOVLEY D R,SCHINK B.Growth of Geobacter sulfurreducens with acetate in syntrophic cooperation with hydrogen-oxidizing anaerobic partners[J].Applied and Environmental Microbiology,1998,64(6):2232-2236.
[46] HE J,RITALAHTI K,AIELLO M,etal.Complete detoxification of vinyl chloride by an anaerobic enrichment culture and identification of the reductively dechlorinating population as aDehalococcoidesspecies[J].Applied and Environmental Microbiology,2003,69(2):996-1003.
[47] HORI T,AOYAGI T,ITOH H,etal.Isolation of microorganisms involved in reduction of crystalline iron(Ⅲ) oxides in natural environments[J].Frontiers in Microbiology,2015,6:1-16.

