原核生物中生物素代谢调控因子研究进展
陈昱宏,吴 杭,张部昌
(安徽大学 物质科学与信息技术研究院 生命科学学院,合肥 230601)
生物素(也称维生素H或B7)是一种重要的微量营养素,可作为生物素依赖性酶(生物素依赖性羧化酶、脱羧酶和转羧酶)的辅助因子,它通过共价键与赖氨酸残基相连,参与脂肪酸合成、氨基酸代谢和糖异生等代谢过程[1-2]。原核生物通常通过外界摄取或自身合成两种途径获得生物素,但部分原核生物(生物素营养缺陷型)体内不具有完整的生物素代谢途径,因此只能摄取外界生物素[3-4]。原核生物中常见的生物素依赖性酶有丙酮酸羧化酶[5]和丙酰辅酶A羧化酶[6]等。在大肠杆菌(Escherichiacoli)中,存在单一的生物素依赖性酶,即乙酰辅酶A羧化酶,催化脂肪酸生物合成途径的第一步[7-8]。当缺乏生物素时,细胞活力降低,甚至导致死亡[9-10]。而生物素充足时,细胞内代谢过程加快,产生大量的代谢产物[4]。
在多数原核生物中,编码生物素的生物合成酶基因通常聚集成操纵子[11],这些基因具有较高的保守性,见图1(a)[2,12]。目前,对大肠杆菌和枯草芽孢杆菌(Bacillussubtilis)的生物素合成途径研究比较深入,大体分为庚二酰-CoA的合成和双环的组装两个部分[2]。如图1(b)所示,庚二酰-CoA的合成途径主要分为两种,包括以大肠杆菌为代表的BioC-BioH途径[13-14]和以枯草芽孢杆菌为代表的BioI-BioW途径[15-16]。有些原核微生物进化出BioV[17]、BioZ[18]等,可代替BioH的功能。而双环的组装相对保守[2],其过程近年来也逐渐被揭示[1-2]。7-酮基-8-氨基壬酸(KAPA)是该过程的第一个中间产物,由7-酮基-8-氨基壬酸合酶(BioF)将L-丙氨酸组装到庚二酰-CoA而成。7,8-二氨基壬酸合成酶(BioA)可使SAM的氨基转移至KAPA,从而生成7,8-二氨基壬酸(DAPA)。脱硫生物素合成酶(BioD)催化脲基环闭合,形成脱硫生物素(DTB)后,由生物素合成酶(BioB)催化噻吩杂环的闭合,形成生物素(Biotin)。最近也有报道BioU代替BioA发挥功能的情况[19]。生物素的生物合成不仅需要上述4种酶的参与,还需消耗20个ATP,是一个高耗能的过程[20-22]。鉴于生物素从头合成成本较高,因此需要严格控制生物素生物合成酶的转录。目前发现原核生物中存在多种类型的调控因子,可参与控制生物素的代谢过程。本文根据已有报道对调控因子类型、分布及生物学功能进行综述。

(a)不同微生物中生物素合成基因分布示意图;(b)微生物中生物素合成的过程
1 生物素代谢调控因子的类型
目前研究显示,原核生物中生物素代谢的调控因子主要有3种类型:BirA、BioR和BioQ。最早发现的生物素调控因子是BirA[11],它由生物素蛋白连接酶(Biotin Protein Ligase,BPL)和DNA结合结构域(DNA binding domain,DBD)两部分组成,因此BirA既是转录调控因子又是负责蛋白质生物素化的酶[3]。迄今已在金黄色葡萄球菌(Staphylococcusaureus)[23]和超嗜热古菌(PyrococcushorikoshiiOT3)[24]等原核生物中解析了BirA蛋白的结构,发现所有BirA都具有BPL,但只有部分BirA具有DBD[9](图2)。基于此,研究人员将BirA分为两种类型。
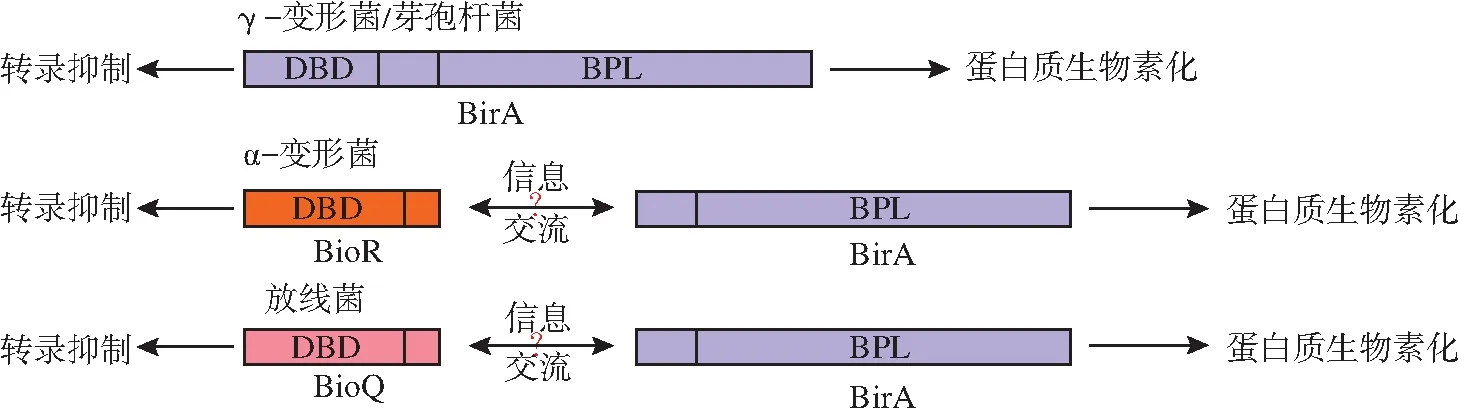
图2 原核生物中3种类型的生物素代谢调控因子
Ⅰ型BirA的N-末端缺失DBD,仅由蛋白质生物素化所需的保守催化模块组成。因此生物素生物合成的转录调控必须由其他调控因子完成。在α-变形菌中,GntR家族转录调控因子BioR可替代BirA行使其转录调控作用[25]。而在放线菌中,TetR家族转录调控因子BioQ可充当BirA的DBD[4, 20]。BirA与BioR/BioQ之间似乎可通过某种信息交流相互影响(图2),进而影响生物素代谢,但其作用机理至今尚不清楚。Ⅱ型BirA同时含有BPL和DBD,具有生物素连接酶和转录抑制子活性,因此是一种双功能蛋白。该类BirA存在于γ-变形菌、芽孢杆菌及各种古菌等原核生物中。在Ⅱ型BirA中,大肠杆菌的BirA被广泛研究,已经成为BirA结构、遗传和生物物理学研究的主要对象[26-27]。
2 生物素代谢调控因子的功能
2.1 BirA的双功能
BirA催化蛋白质生物素化是通过两步反应实现的[9],BPL含有两个保守的结构催化核心,负责生物素-5′-AMP的合成和蛋白质生物素化[28]。在第一部分反应中,生物素和ATP形成生物素-5′-AMP(Holo-BirA)。在含有Ⅱ型BirA的原核生物中,Holo-BirA具有两种不同的命运[29-30](图3)。一方面,Holo-BirA可以二聚化并结合DNA,起生物素生物合成操纵子的转录因子的作用,从而抑制生物素的合成。Satiaputra等[23]在金黄色葡萄球菌中还发现,BirA(或Holo-BirA)可先以单体的形式结合到DNA上,再进行二聚化。另一方面,Holo-BirA中的BPL可以识别并靶向结合生物素羧基载体蛋白(BCCP)上的赖氨酸残基,使蛋白质生物素化。蛋白质生物素化是精准且特异的,如大肠杆菌的BirA仅修饰4 000种蛋白中的一种[31]。不同生物的BPL和BCCP通常可以相互结合[32]。这表明生物进化过程中BPL的催化机制以及酶与底物之间的蛋白质相互作用都高度保守[33-35]。
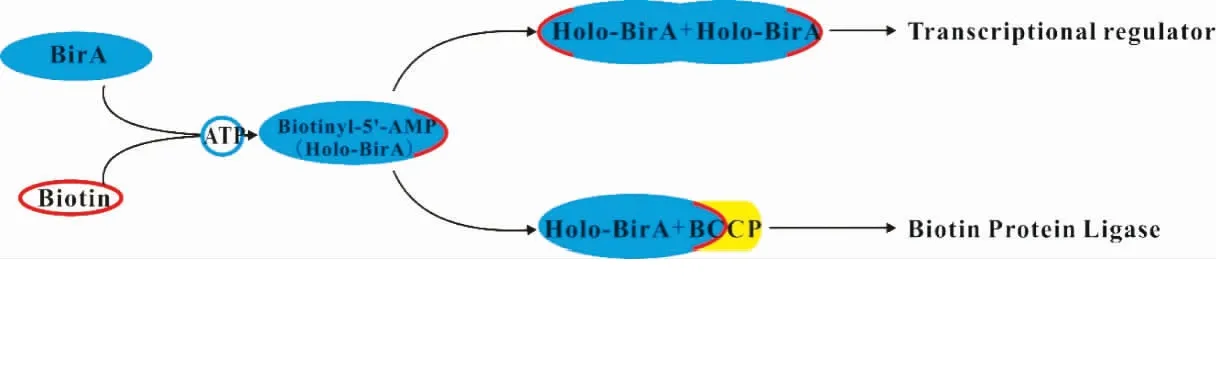
图3 BirA的双功能
目前有两种关于Holo-BirA功能选择的假说(图4)。Pendini和Weaver等[36-37]认为,当存在过量的BCCP时,Holo-BirA将优先结合BCCP,从而阻止了Holo-BirA二聚化;当BCCP浓度低时,Holo-BirA会积累并二聚化,导致DNA结合并随后抑制转录,在该模型中,Holo-BirA的功能转换是由Holo-BirA和BCCP的相互竞争导致。但Solbiati等[38]认为这种竞争并不是Holo-BirA功能选择的关键,他们认为BCCP与Holo-BirA具有更强的亲和力,BCCP可以酶底物的形式解除Holo-BirA的二聚化,使其发挥生物素蛋白连接酶功能。酶与底物的反应是短暂的,当BCCP与Holo-BirA分开后,Holo-BirA以单体形式存在,而单体Holo-BirA积累后易发生二聚化,从而发挥转录阻遏功能。

图4 BirA的功能选择
2.2 BioR的调控功能
对α-变形菌基因组序列的生物信息学分析表明,这些原核生物生物素的合成受BioR调控[25]。同时,在生物素转运蛋白bioY基因的上游发现了BioR的DNA识别序列。在布鲁氏杆菌(Brucellamelitensis)和脱氮副球菌(Paracoccusdenitrificans)中,bioR基因的启动子区发现了BioR识别序列[22, 39],证明BioR具有BirA所没有的自我调控特征,但根瘤农杆菌(Agrobacteriumtumefaciens)中bioR基因的上游不存在BioR识别序列[21],因此这种调控并不完全保守(图5)。

图5 不同α-变形菌中BioR的识别位点
Feng等[21-22]进一步研究了BioR在生物素合成中的调控作用,除了结合自身基因的识别序列外,根瘤农杆菌的BioR还能与其他菌的DNA序列结合[21]。而布鲁氏杆菌的BioR能够在体内抑制根瘤农杆菌bioB的表达[22]。这表明BioR在α-变形菌中具有较高的保守性[9]。根瘤农杆菌中,BioR只能结合bioB启动子区的识别位点,对生物素合成基因的转录起到抑制功能[21]。而在布鲁氏杆菌中,BioR识别序列位于编码bioR和bioY的上游,实验表明BioR不仅具有自我调控功能,还可介导生物素转运蛋白的表达[22]。同时,bioBFDAZ操纵子的上游也存在两个BioR识别位点,实验证实BioR对其具有转录抑制功能[22]。这些结果说明BioR介导的生物素代谢具有复杂调控方式。
在脱氮副球菌中,发现了两个BioR同源物,分别称为BioR1(Pden_1431)和BioR2(Pden_2922)[39],并发现该菌基因组中存在6个BioR结合位点,其中两个bioR启动子区各有一个位点,两个生物素代谢操纵子(bioBFDAGC和bioYB)启动子区各有两个串联的位点。BioR1和BioR2可以共同调控生物素的合成和转运,同时它们之间也可以相互调控与自我调控[39]。外源添加生物素刺激了bioYB的表达,同时抑制了bioBFDAGC的转录,这同样表明BioR调控生物素代谢基因的复杂性[39]。
从BioR中完全去除或添加生物素对其体外DNA结合没有影响,说明生物素并不是BioR的配体[21-22],而发现各种生物素代谢中间产物,也不是BioR的配体[22, 39]。因此,BioR配体可能要在生物素代谢的上下游中寻找。
2.3 BioQ的调控功能
放线菌中生物素代谢的调控模式类似于α-变形菌,但是由BioQ行使调控功能。在谷氨酸棒状杆菌(Corynebacteriumglutamicum)中,生物素合成途径不完整,从而使其生物素营养缺陷。但是,在谷氨酸棒杆菌中发现一种TFR(BioQ),可以调控生物素代谢[4]。Brune等[4]通过生物信息学分析,在谷氨酸棒状杆菌中定位了bioQ基因和生物素合成基因,发现bioQ和生物素转运蛋白(BioY)基因启动子中均含有BioQ的识别序列(图6),并实验证实BioQ可调控这两个基因的表达,这表明该转录因子具有自我调控功能,同时对生物素的转运也具有调控作用,这对于生物素营养缺陷型谷氨酸棒杆菌至关重要。
在耻垢分枝杆菌(Mycobacteriumsmegmatis)中,BioQ的识别位点位于bioF和bioQ/B基因的上游(图6),实验证实BioQ可抑制生物素代谢基因的转录,同时具有自我调控功能[20]。此外,生物素水平的增加导致野生型细菌生物素生物合成基因bioF、bioD和bioB的表达降低,说明BioQ对生物素浓度具有感知能力。Yan等[40]对该BioQ的蛋白结构进行解析,确定了BioQ与DNA探针结合的关键氨基酸(R27A和Y41A),同时发现BioQ保守结合序列(5′-TGAACnnnGTTCA-3′)中任何碱基的改变都会影响BioQ的靶DNA结合能力。
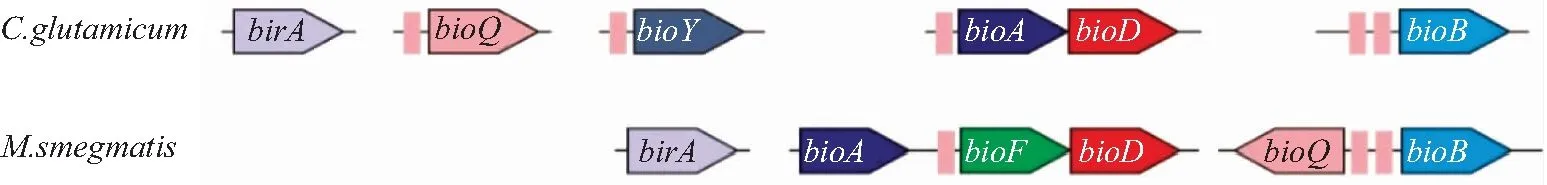
图6 不同放线菌中BioQ的识别位点
研究发现,生物素及其代谢途径中产物均不是BioQ的配体[20],但丙酸和乙酰磷酸(AcP)似乎可以影响BioQ与靶基因的结合[41-42],这表明BioQ配体的研究也应往生物素代谢的上下游寻找。
3 总结与展望
目前原核生物中已发现3种类型的生物素代谢调控因子(BirA、BioR和BioQ),可控制不同原核生物中生物素的合成、转运及利用等代谢过程,而不同物种的同一种类型调控因子存在交互调控作用,这表明生物素的代谢途径较为保守。目前仅发现一例多拷贝BioR共同调控生物素代谢基因,即来源于脱氮副球菌的双拷贝BioR[39],这进一步展现了原核生物中生物素代谢的多元调控网络。
近年来,原核生物中生物素代谢调控因子的研究已逐步深入,但还有很多问题亟待解决。在含有I型BirA的生物体中,BioR(或BioQ)可替代BirA发挥调控作用,但它们与BirA之间的联系还不清楚。BioQ相较其他TetR家族调控因子,其C端配体结合结构域较为柔性[40],暗示其可能存在多种配体,但迄今尚未见到相关研究报道。近期发现,BioQ的乙酰化修饰可影响其DNA结合能力,证实蛋白翻译后修饰对BioQ发挥调控功能至关重要[41],但其复杂的分子机制有待进一步探索。相信随着相关功能研究的进一步深入并对上述问题进行解答,将有助于理解原核生物中生物素代谢调控的复杂网络,为新型药物靶点鉴定、合成生物学元件开发以及代谢产物水平提高等奠定理论基础。

