太子参谷胱甘肽S转移酶基因家族生物信息学及表达分析
毕艳 郑伟 周涛 江维克 杨昌贵 肖承鸿 周太敏

摘 要: GSTs (glutathione-S-transferases)是一個普遍存在于植物体内,多基因家族编码的多功能蛋白酶。为研究GSTs基因家族在太子参中对其生长发育以及活性成分合成调控的潜在功能,该文基于隐马尔可夫模型在太子参中鉴定到30个谷胱甘肽-S-转移酶(PhGSTs)的基因家族成员。结果表明:30个PhGSTs基因同时具有高度保守的N-端结构域和复杂多变的C-端结构域,分属于6个亚家族,有10个motif区,其中motif 1、motif 2、motif 3同属于所有家族,motif 4仅属于Tua亚家族。PhGST蛋白质三级结构有明显的相似之处,N端主要由3个α螺旋和4个β折叠构成βαβαββα结构域,C端均由α螺旋构成,不同亚家族的C端α螺旋数目及组合方式各不相同,但始终维持相似的三维结构。PhGST基因在太子参植物中具有不同的组织表达特异性,PhGSTU1、PhGSTU8、PhGSTU9等在太子参块根中优势表达,PhGSTF2在茎和叶中优势表达。水分胁迫处理后有4个基因积极响应干旱胁迫,PhGSTZ1的响应最为明显;同时也有PhGSTU8、PhEFB1γ3等4个基因随土壤含水量增加呈上调表达。该文鉴定出30个PhGST基因,并分析了其在太子参中的表达模式,为PhGSTs基因家族在太子参活性成分的合成调控及逆境响应等生理过程中的功能研究奠定理论基础。
关键词: 太子参, GSTs, 基因家族, 生物信息学分析, 表达分析
中图分类号: Q941
文献标识码: A
文章编号: 1000-3142(2021)04-0535-11
Abstract: GSTs (glutathione-S-transferases) is a multi-functional protease commonly existing in plants and encoded by multi-gene family. In order to study the potential function of GSTs gene family in regulating the growth and development of Pseudostellaria heterophylla and the synthesis of active components, 30 glutathione-S-transferase (PhGSTs) gene family members were identified in P. heterophylla based on hidden Markov model. The results were as follows: 30 PhGSTs genes had both highly conserved N-terminal domain and complex and changeable C-terminal domain, which belonged to six subfamilies and ten motif regions, among which motif 1, motif 2 and motif 3 belonged to all families, motif 4 belonged only to Tua subfamily. There were obvious similarities in the tertiary structure of PhGST protein. The N-terminal mainly consisted of three α helices and four β folds to form βαβαββα domain. The C-terminal consisted of α helices. The number and combination of C-terminal α helices of different subfamilies were different, but the similar three-dimensional structure was always maintained. PhGST gene had different tissue expression specificities in P. heterophylla plants. For example, PhGSTU1, PhGSTU8, PhGSTU9 and other genes were preferentially expressed in the root tuber of P. heterophylla, and PhGSTF2 was preferentially expressed in stems and leaves. Four genes responded positively to drought stress after water stress treatment, and PhGSTZ1 showed the most obvious response. At the same time, four genes were up-regulated with the increase of soil water content, such as PhGSTU8 and PhEFB1γ3. In this paper, 30 PhGST genes were identified and their expression patterns in P. heterophylla were analyzed, which laid a theoretical foundation for the functional research of PhGSTs gene family in physiological processes such as synthesis regulation of active components in P. heterophylla and stress response.
Key words: Pseudostellaria heterophylla, GSTs, gene family, bioinformatics analysis, expression analysis
中药太子参来源于石竹科植物孩儿参(Pseudostellaria heterophylla)的干燥块根,有效物质基础包含多糖、皂苷和环肽类物质。前人研究发现,在太子参的种植中,植株生长代谢受到遗传及环境等因素的影响,次生代谢成分在太子参的不同组织部位含量具有显著差异,并且这些活性成分含量与年均降水量具有密切联系(曾丽娜等,2014;康传志等,2016;边丽华等,2018)。已有研究认为,谷胱甘
肽-S-转移酶(glutathione-S-transferase genes,GSTs,EC2.5.1.18)在植物中具有逆境响应、参与次生代谢产物的合成调控等作用(Dixon et al., 2010)。
谷胱甘肽-S-转移酶(GSTs)是一种普遍存在于生物体内,具有不同生物学功能的基因家族。在高等植物中,被分为Phi(GSTF)、Tau(GSTU)、Lambda(GSTL)、Theta(GSTT)、Zeta(GSTZ),dehydroascorbate reductase(DHAR)、elongation factor 1 gamma(EF1Bγ)及tetrachlorohydroquinone dehalogenase(TCHQD)八个亚家族(Mohsenzadeh et al., 2011)。典型的GST蛋白包含两个活性位点:一个是高度保守的N端结构域的GSH结合位点(G-site);另一个是复杂多变的C端共底物结合域(H-site)。G-位点对谷胱甘肽(glutathione,GSH)有特异性,而H-位点能特异性结合不同底物而催化相应的生化反应(Dixon et al., 2002)。自20世纪70年代在玉米中首次发现植物谷胱甘肽-S-转移酶以来(Shimabukuro et al., 1970),许多植物中的GST也都相继被挖掘。目前,已通过转录组或全基因组分析从拟南芥(Jing et al., 2018)、水稻(Hu et al., 2011)、毛果杨(Qi et al., 2019)、鹅掌楸(成彦丽等,2018)、火把梨(刘迪秋等,2012)等植物中鉴定到超过58个GST基因家族成员。然而关于GST基因家族在太子参中对其生长发育以及活性成分合成调控的潜在功能研究尚未见报道。
本文对太子参的转录组数据进行挖掘与分析,全面筛选出太子参GST候选基因,系统分析太子参GST基因家族的基本理化性质、保守结构域信息、进化关系及表达模式等,以期为GST基因家族在太子参环肽、多糖及皂苷等活性成分的合成调控以及逆境响应的研究奠定生物信息学基础和数据支持。
1 材料与方法
1.1 构建太子参转录组数据库
课题组前期通过Illumina测序平台对太子参根、茎、叶、花等组织的RNA进行测序,并将其组装成有127 334个太子参高质量转录本的转录组数据库(Jun et al., 2016),命名为DB1。2018年4月下旬,于贵州省黄平县太子参种植基地采集太子参苗,单株移栽至花盆中。土壤配方为:V(基地自然土壤)∶V(营养土)∶V(蛭石)∶V(珍珠岩)=3∶3∶1∶1,花盆外径23.5 cm,移栽后正常浇水,待太子参长至块根快速膨大期(6—7月)开始处理。选择长势一致的太子参种苗33株,分为30%(drought stress,DS)和100%(waterlogging stress,WS)的土壤水分2个处理组和60%土壤水分(Control)的对照组,又将30% 和100% 处理组各分为5个小组,每组3株,处理时间分别为1~15 d、16~30 d、31~45 d、46~60 d、1~60 d。处理60 d后单株采挖太子参,分离地上与地下部分,以流水将块根洗净后,置液氮中速冻5 min,-80 ℃保存用于转录组测序。利用Illumina二代测序技术对不同水分胁迫处理后的太子参块根进行转录组测序,获得1个含有258 427个转录本的太子参水分胁迫转录组数据库,命名为DB2。
1.2 PhGST基因的筛选及基本信息分析
运用PFAM(http://pfam.xfam.org)在线软件,以GST为关键词进行检索,下载GST结构域蛋白序列,用该结构域HMM文件,使用HMMER3.0软件(http://hmmer.janelia.org/)对DB1数据库中注释基因序列进行GST基因的比对搜索,筛选出具备GST保守域的GST基因序列;通过ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)软件对候选GST基因进行ORF预测分析,筛选出具有完整的ORF区的太子参GST基因;用CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/docs/cdd_search.html)软件对筛选出的候选基因是否具有GST保守结构域进一步确认。
运用ExPASy-ProtParam tool在线分析工具(http://web.expasy.org/protparam/)对所得GST基因编码蛋白的氨基酸残基长度(aa)、分子量(Da)、等电点(pI)等基本性质进行分析。
1.3 系统发育树的构建和保守基序分析
运用MEGA7.0(molecular evolutionary genetics analysis program)對鉴定出的太子参GST蛋白序列进行比对分析,使用邻接法(neighbour-joining method,NJ)(其中Bootstrap分析进行了1 000次重复)构建系统发育树。使用在线软件MEME(http://meme-suite.org/)对太子参GST基因的保守基序进行分析,保守基序数目设置为10,其他参数设置为默认值。
1.4 PhGST蛋白保守域序列分析
运用DNAMAN 5.0和WebLogo 3软件分析PhGST蛋白的保守序列;利用SWISS-MODEL对PhGST蛋白保守域的3D结构进行模型匹配,swiss-pdbviewer 4.10软件将3D结构可视化。
1.5 PhGST基因在不同组织中的表达模式分析
提取DB1数据库中PhGST基因序列在根、茎、叶、花等不同组织中的FPKM值,运用TBtools软件进行聚类分析,所有数据均通过log变换进行调整,选择层次聚类分析作为计算方法,完全连锁作为聚类方法。
1.6 不同水分胁迫下PhGST基因在根中表达模式分析
通过本地BLAST在DB2数据库中比对在DB1数据库中检索到的PhGST基因序列,选择相似度为100%的转录本,提取PhGST基因序列在不同水分胁迫处理下的FPKM值,利用TBtools软件进行聚类分析,所有数据均通过log变换进行调整,选择层次聚类分析作为计算方法,完全连锁作为聚类方法。
1.7 不同水分胁迫下太子参次生代谢产物的积累
参考闫亮等(2005)、康传志等(2016)的方法,分别测定粗多糖、总皂苷、太子参环肽HB的含量。
1.8 PhGSTs基因的表达量与太子参次生代谢产物含量的相关性分析
利用GraphPad Prism 8对PhGSTs基因的表达量与太子参次生代谢产物含量进行相关性分析。
2 结果与分析
2.1 太子参转录组GST基因的筛选与基本信息分析
以GST为关键词在PFAM中进行检索,共下载了6条GST保守域的蛋白序列(PF00043、PF02798、PF13409、PF13410、PF13417、PF14497、PF14834、PF17171、PF17172),使用HMMER3.0软件对DB1数据库中的注释基因序列进行GST基因序列比对搜索,得到66条具有GST-N或GST-C结构域的GST基因序列,其中有15条只具有GST-N结构域,有11条只具有GST-C结构域;经进一步筛选,获得40条同时具备GST-N和GST-C结构域的基因序列。最终通过ORF Finder筛选出30条具有完整ORF区的GST基因序列。太子参GST基因家族30个基因编码蛋白的氨基酸长度为180~417 aa;除EF1Bγ家族的相对分子质量大于40 kDa,其余GST蛋白的相对分子质量多在23~33 kDa之间,这和Frova(2010)总结的GST蛋白质结构的结论类似,即大多数可溶性GST以同源或异源二聚体的形式发挥催化活性,单体大小在20~30 kDa左右;理论等电点pI范围为4.88~9.11,80%的均在5.30~6.72之间(表1)。
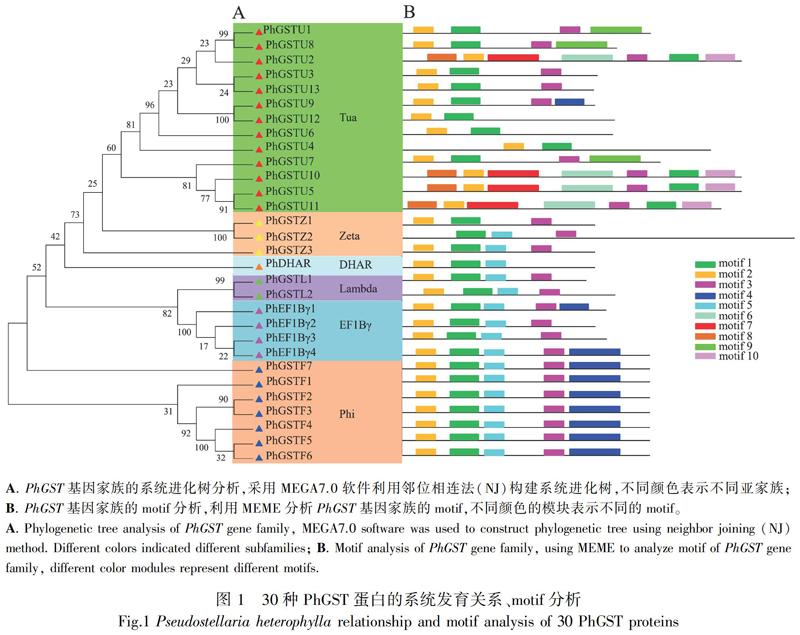
2.2 系统发育树的构建和保守域基序motif分析
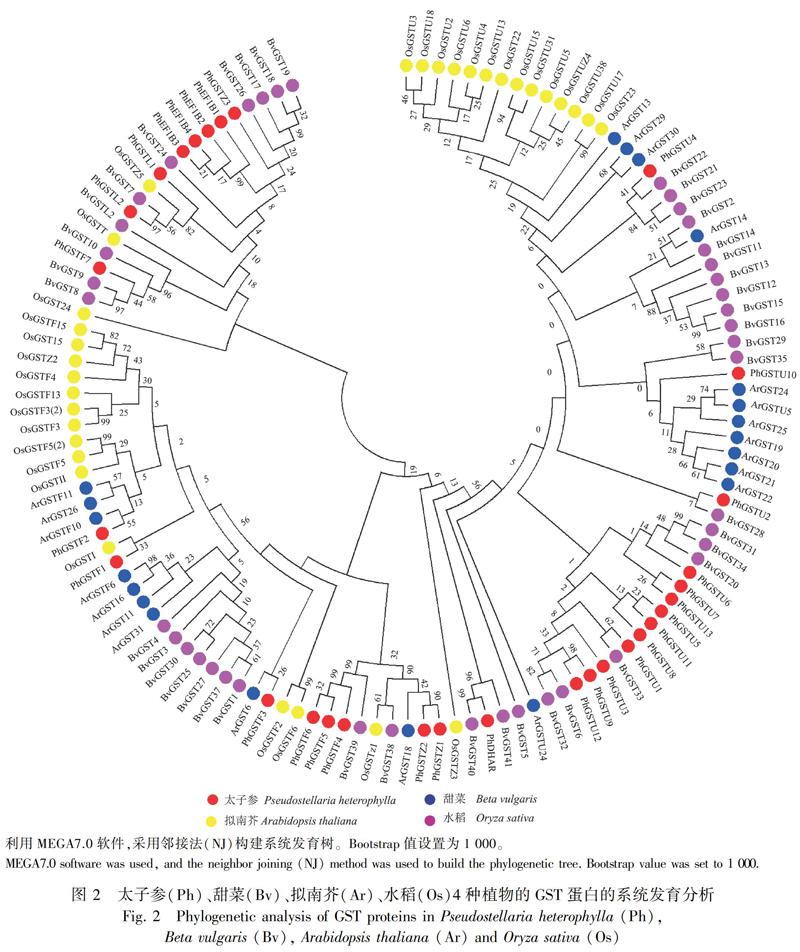
将太子参30个GST蛋白进行分类并命名,显示30个PhGST蛋白共聚成了6个亚家族,包括13个Tua类、7个Phi类、4个EF1Bγ类、3个Zeta类、2个Lambda类、1个DHAR类(图1:A)。利用MEME对30个PhGST基因的motif进行预测,结果显示每个亚家族中motif的排列是相似的,但不同亚家族中motif的排列不同(图1:B)。其中,motif 1、motif 2、motif 3同属于所有家族,motif 6、motif 7、motif 8、motif 9、motif 10为Phi和EFB1γ家族特有,motif 4为Tua家族特有。进一步比较太子参与甜菜、拟南芥、水稻中GST蛋白的系统发育关系,发现所有植物的GST蛋白聚为1大支,Tua是4种植物中最大的一个亚家族,占每个植物GST基因总数的一半以上,Theta和DHAR在所有植物中数量均较少,在太子参中尚未鉴定出Theta家族的成员,DHAR家族仅鉴定到1个基因(图2)。
2.3 PhGST蛋白保守域序列分析
图3结果表明,PhGST家族存在GST-N、GST-N2、GST-N3、GST-C、GST-C2、GST-C3等多个保守结构域。GST-N结构域高度保守(图3:A),结构域为GST-N的仅有Tua类,结构域为GST-N2的有EFB1γ和DHAR 2个亚家族,结构域为GST-N3的有Phi、Lambda、Zeta 3个亚家族;C端结构域变异较大(图3:B),结构域为GST-C的有Tua和Phi两个亚家族,结构域为GST-C2的有Tua、EF1Bγ、Lambda、DHAR 4个亚家族,结构域为GST-C3的有Phi、EF1Bγ、Zeta 3个亚家族。
预测PhGST蛋白三级结构的结果见图4。从图4可以看出,相似之处包括N端与C端2个主要的结构域。N端主要包括3个α螺旋和4个β折叠结构,α螺旋和β折叠的连接顺序为βαβαββα,构成βαβαββα结构域;随后通过一个短的多肽连接C端,C端全部为α螺旋。以PhGSTU1、PhGSTF1、PhEF1Bγ1、PhGSTL1、PhDHAR、PhGSTZ1蛋白為例,对其晶体结构数据进行分析。其中PhGSTU1与杨柳科植物毛果杨的GST蛋白(PtGSTU30)的晶体结构相似,预测Ser25、Phe27、Lys52、Lys64、Gln65、Ile66、Glu78和Ser79是PhGSTU1的关键活性G位点;PhGSTF1与PtGSTF5蛋白的晶体结构相似,预测Ser11、Thr12、Asn13、Arg16、Leu35、His40、Lys41、Asn49、Gln53、Val54、Pro55、Glu66、 Ser67和Arg68是PhGSTF1的关键活性G位点;PhEF1Bγ1与乳酸的yghu蛋白的晶体结构相似,预测Ala11、Asn13、Phe35、His40、Lys41、Gln53、Val54、Pro55、Glu66、Ser67和Arg68是PhEF1Bγ1的关键活性G位点;PhGSTL1与PtGSTL1蛋白的晶体结构相似,预测Cys36、Pro37、Tyr38、Leu62、Arg65、Asn77、Lys78、Val79、Pro80、Glu91和Ser92是PhGSTL1的关键活性G位点;PhDHAR与PtGSH蛋白的晶体结构相似,预测Lys8、Cys20、Pro21、Phe22、Arg25、Leu44、Lys47、Gly58、Lys59、Val60、Pro61、Asp72、Ser73、Asp74和Lys209是PhDHAR的关键活性G位点;PhGSTZ1与拟南芥ArGSTZ蛋白的晶体结构相似,预测His95、Lys96、Asn153和Cys154是PhGSTZ1的关键活性G位点。
2.4 PhGST基因在不同器官组织中的表达模式分析
基因在植物组织中的特异性表达,决定了其发挥的功能,对于同一个基因家族的不同成员,往往表现为时间和空间的表达特异性。对PhGST基因在太子参植株根、茎、叶、花中的表达情况进行分析,结果见图5:A。结果显示,30个PhGST基因在不同器官中均呈现差异表达。PhGSTU1、PhGSTU8、PhGSTU9、PhGSTU11、PhGSTZ1、PhGSTZ2、PhEFB1γ、PhGSTF7等基因在太子参植株中具有相同的表达模式,均在根中有优势表达,在茎、叶、花等器官几乎不表达;PhGSTF2在茎和叶中呈优势表达;PhGSTF7、PhGSTZ3则呈现综合表达模式,即根、莖、叶、花等部位均具有较高的表达,猜测这两个基因可能在器官的生长发育调控过程中具有重要作用;也有部分PhGST基因在太子参各组织器官中均不表达,如Phi家族的成员及PhGSTU2、PhGSTU10、PhGSTL2等基因(图5:A)。
2.5 水分胁迫下PhGST基因在根中表达模式分析
水分是影响太子参药材品质的主要环境因素之一,GST基因家族参与植物的逆境响应等生理过
程。对30个PhGST基因在水分胁迫下的表达模式进行分析,结果显示,水分胁迫处理后PhGST基因在太子参块根中的表达模式基本相似,呈组成型上调或下调表达,且上调表达的基因对所有水分胁迫处理都有一定的响应(图5:B)。结合PhGST基因在植株各组织中的表达情况分析,发现PhGSTU1、PhGSTU8、PhGSTU9等基因正常情况下在根中有较高的表达,水分胁迫处理后此类基因仍在根中有表达;其中有部分基因随土壤含水量的增加呈上调表达,如PhGSTU8、PhEFB1γ3;有些基因随土壤含水量的增加呈下调表达,如PhGSTZ1、PhGSTU9;有部分基因在水分胁迫处理情况后出现表达量极低或几乎不表达的现象,如PhGSTU5、PhGSTU12、PhEFB1γ2等基因(图5:C)。
2.6 不同水分胁迫下太子参次生代谢产物的积累
对不同水分胁迫处理后的太子参环肽HB、总皂苷、粗多糖进行检测,结果显示,以土壤相对含水量60%为对照组,水滞胁迫下太子参环肽HB显著高于干旱胁迫组和对照组(图6:A);对太子参进行水分胁迫处理后,其总皂苷含量显著高于对照组(图6:B),但其粗多糖含量在经过水分胁迫处理后的积累量低于对照组(图6:C)。
2.7 PhGSTs基因的表达量与太子参次生代谢产物含量的相关性分析
利用GraphPad Prism 8对PhGSTs基因的表达量与太子参次生代谢产物含量进行相关性分析。水分胁迫下,PhGSTL1及PhEF1Bγ4与环肽HB的积累量呈显著正相关,PhGSTF1与环肽HB的积累量呈显著负相关,PhGSTU1与PhGSTU11总皂苷的积累量呈极显著负相关,PhGSTZ3及PhGSTU6与总多糖的积累量呈显著正相关。
3 讨论与结论
GSTs是一个庞大且多样的基因家族,普遍存在于各种生物体内。目前,已分别从拟南芥、水稻、甜菜、毛果杨及马铃薯等植物中鉴定出多个GST基因,Tau类及Phi类是植物中具有较多成员数目的两个亚家族(Han et al.,2018; Ding et al.,2017)。本文从太子参转录组数据库中鉴定到30个同时具备GST-N和GST-C结构域、具有完整开放阅读框的GST蛋白酶基因,分属于6个亚家族,占高等植物GSTs基因家族的75%,表明太子参能够抵御多种环境胁迫,其广泛的生态适应性与丰富的GSTs基因家族有关。其中Tau亚家族和Phi亚家族包含的GST基因数量最多,分别为13个和7个,这与其他植物GST基因家族中Tau和Phi 2个亚家族最多相一致。从物种亲缘关系看,太子参和甜菜同属于原始花被亚纲中央种子目,亲缘关系相比于拟南芥、水稻等要近;本文将30个PhGST基因序列与拟南芥、水稻、甜菜等植物中的GST基因家族进行系统进化分析,显示PhGST基因可分别与其他植物中同亚家族的GST基因聚为一支,且PhGST基因与甜菜中GST基因的距离最近,说明GST基因家族成员保守性与物种的进化程度具有很大的相关性。Tua和EF1Bγ两个亚家族基因在太子参块根中优势表达,推测这两个亚家族在抵抗与土壤有关的逆境中发挥主导作用,可能参与了太子参药材品质的形成。
对PhGST基因家族在水分胁迫下的表达模式分析发现,Phi家族的部分基因对环肽HB的积累有正调控作用,EF1Bγ和Lambda家族的部分基因对环肽HB的积累有负调控作用,Tua和Zeta 2个亚家族的部分基因对总多糖的积累量有正调控作用,推测Tua、Zeta可以通过调节总多糖积累促进太子参块根的膨大;Tua亚家族的部分基因对总皂苷的积累量有负调控作用。本文鉴定到的Tau和Zeta家族的基因与拟南芥、水稻及甜菜等报道的GST基因家族具有较高同源性,从水稻中克隆到的Tau家族成员Osgstu30受PEG诱导表达,表明GSTs与植物水分胁迫响应相关(Dipali et al., 2019),侧面反映出太子参Tau家族可能在水分胁迫过程中发挥重要作用。康传志等(2016)研究发现太子参环肽HB与年均降水量显著正相关,因此我们推测PhGSTU8、PhEFB1γ3等基因可能参与了水分胁迫下环肽HB的合成调控,此两类基因在太子参植物抗逆过程中可能发挥着重要作用,这为此类基因在太子参中的功能研究提供了方向。
参考文献:
CHENG YL, WANG X, SI WJ, et al., 2018. Cloning and expression analysis of GST family genes in Liriodendron[J]. Acta Bot Boreal Occident Sin, 38(3): 445-455.[成彦丽, 王曦, 司卫杰, 等, 2018. 鹅掌楸属GST家族基因的克隆与表达分析[J]. 西北植物学报, 38(3): 445-455.]
DIPALI, SRIVASTAVA, GITI, et al., 2019. Rice (Oryza sativa L.) tau class glutathione-S-transferase (OsGSTU30) overexpression in Arabidopsis thaliana modulates a regulatory network leading to heavy metal and drought stress tolerance[J]. Metallomics: Integr Biom Sci.
DIXON DP, LAPTHORN A, EDWARDS R, 2002. Plant glutathione transferases[J]. Gen Biol, 3(3):1-10.
FROVA C, 2010. The plant glutathione transferase gene family: genomic structure, functions, expression and evolution[J]. Physiol Plant, 119(4): 469-479.
HAN XM, YANG ZL, LIU YJ, et al., 2018. Genome-wide profiling of expression and biochemical functions of the Medicago glutathione-S-transferase gene family[J]. Plant Physiol Biochem, 126: 126-133.
HU TZ, HE S, HUANG XY, et al., 2011. Cloning, molecular characterization and heterologous expression of a glutathione-S-transferase gene in rice[J]. Bioorg Khim, 37(3):386-392.
KANG CZ, ZHOU T, JIANG WK, et al., 2016. Research on quality regionalization of cultivated Pseudostellaria heterophylla based on climate factors[J] Chin J Trad Chin Med, 41(13): 2386-2390.[康傳志, 周涛, 江维克, 等, 2016. 基于气候因子的全国栽培太子参品质区划分析[J]. 中国中药杂志, 41(13): 2386-2390.]
LIU DQ, WANG GY, WANG JL, et al., 2012. Cloning and expression of glutathione-S-transferase gene from Pyrus pyrifolia Nakai cv. Huobali[J]. Acta Bot Boreal Occident Sin, 32(1): 29-34.[刘迪秋, 王光勇, 王继磊, 等, 2012. 火把梨谷胱甘肽S-转移酶基因的克隆与表达[J]. 西北植物学报, 32(1): 29-34.]
LI J, ZHEN W, LONG DK, et al., 2016. De novo sequencing and assembly analysis of the Pseudostellaria heterophylla transcriptome[J]. PLoS ONE, 11(10): 1-19.
MOHSENZADEH S, ESMAEILI M, MOOSAVI F, et al., 2011. Plant glutathione-S-transferase classification, structure and evolution[J]. Afr J Biotechnol, 10(8): 8160-8165.
SHIMABUKURO RH, SWANSON HR, WALSH WC, 1970. Glutathione conjugation: Atrazine detoxication mechanism in Corn[J]. Plant Physiol, 46(1): 103-107.
XU J, ZHENG AQ, XING XJ, et al., 2018. Transgenic arabidopsis plants expressing grape glutathione S-transferase gene (vvgstf13) show enhanced tolerance to abiotic stress[J]. Biochemistry, 83(6): 755-765.
YAN L, QIN MJ, HE DX, et al., 2005. Dynamic study on accumulation of polysaccharides and saponins of Pseudostellaria heterophylla[J]. Res Pract Mod Chin Med, 19(6): 10-13.[闫亮, 秦民坚, 贺定翔, 等, 2005. 太子参多糖及皂苷的积累动态研究[J]. 现代中药研究与实践, 19(6): 10-13.]
YANG Q, HAN XM, ZENG QY, et al., 2019. Functional and structural profiles of GST gene family from three Populus species reveal the sequence-function decoupling of orthologous genes[J]. New Phytol, 221(2): 386-392.
ZENG LN, YUAN YH, HUANG SY, et al., 2014. A comparison of effective medicinal ingredients content of Pseudostellaria heterophlla in different harvest times and medicina[J]. Fujian For, (2): 25-26.[曾丽娜, 袁玉虹, 黄淑燕, 等, 2014. 不同采收时间、不同入药部位太子参有效药用成分含量的比较[J]. 福建林业, (2): 25-26.]
(责任编辑 何永艳)

