羽扇豆醇抗肿瘤作用研究进展
韦燕飞,金丽杰,刘莎莎,陈婉君,成 桃,刘 红,刘 欢
(广西中医药大学 1.基础医学院,广西 南宁 530200;2.第一附属医院,广西 南宁 530024)
随着人口的增长和老龄化以及社会经济的发展,全球癌症发病率和死亡率快速增长,肿瘤已成为威胁人类健康的主要因素。天然产物是抗肿瘤药物的重要来源,在人类防治肿瘤及其他疾病中起到十分重要的作用。目前化疗药物是临床治疗恶性肿瘤重要手段之一,然而由于耐药性、细胞毒性等方面的影响,患者容易出现副作用和预后不良等情况。那么寻找高效、低毒,甚至是对肿瘤细胞具有靶向作用的新型抗肿瘤药物便成为当前研究的热点。
1 羽扇豆醇简介
羽扇豆醇(lupeol)是一种存在于橄榄、芒果、榆木、芦荟等多种食源性植物和羽扇豆、鹅不食草、星刺卫矛、鹿藿等中草药中的三萜烯,其化学式为C30H50O,结构式如Fig 1所示。近年来的研究结果显示,羽扇豆醇具有抗炎、抗肿瘤、抗氧化、促进伤口愈合等作用,并对关节炎、糖尿病、心脏病、肾毒性损伤和肝毒性损伤具有一定的疗效。在抗肿瘤方面,许多研究结果表明羽扇豆醇可抑制肝癌、肺癌、结肠癌、前列腺癌、骨肉瘤、胰腺癌、胃癌、黑色素瘤等恶性肿瘤,其药理学活性主要体现在抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、诱导细胞周期阻滞、抑制肿瘤细胞迁移及侵袭、诱导肿瘤细胞分化、抑制肿瘤血管生成等方面。本文通过搜集近年来国内外有关羽扇豆醇抗肿瘤的体内外基础研究,对羽扇豆醇的抗肿瘤作用及其分子机制作一综述,为羽扇豆醇的抗肿瘤药理作用及其机制的进一步研究和临床应用开发提供一定的理论参考。
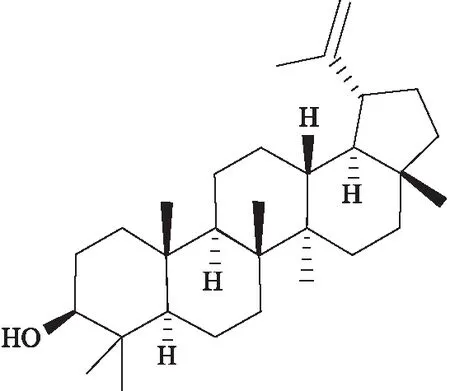
Fig 1 The chemical formula of lupeol
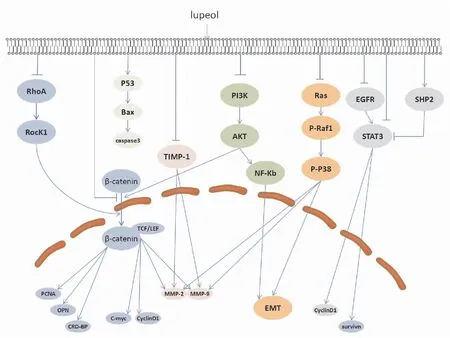
Fig 2 Schematic presentation of mechanisms for anticancer activities of lupeol
2 抗肿瘤作用
2.1 抑制肿瘤细胞增殖肿瘤细胞的增殖能力体现了其恶性程度,寻找一种能够抑制其细胞增殖的药物对于治疗癌症是首要任务。已有的研究指出,羽扇豆醇可通过Ras同源基因家族A(Ras homolog gene family member A,RhoA)-Rho激酶1(Rho associated kinases1,ROCK1)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、Wnt/β-连环蛋白(β-catenin)等多个信号通路抑制肿瘤细胞增殖。羽扇豆醇通过下调结肠癌细胞HCT116、SW620内RhoA、ROCK1及β-catenin蛋白表达水平,使得RhoA-ROCK1-β-Catenin信号通路蛋白受到抑制,进而抑制结肠癌细胞的增殖[1]。研究发现羽扇豆醇对人乳腺癌MCF-7细胞的增殖具有显著的抑制作用,其机制可能与提高细胞外调节蛋白激酶1/2(exracellular regulated protein kinases 1 and 2,ERK1/2)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、p38等MAPK信号通路相关调控蛋白的磷酸化水平有关[2]。羽扇豆醇作用于黑色素瘤细胞Mel 928、Mel1241之后,细胞内β-catenin的转录活性及核转位受到抑制,且Wnt信号通路的靶基因c-Myc、细胞周期蛋白D1(Cyclin D1)显著下调[3]。
2.2 诱导肿瘤细胞凋亡细胞凋亡是由一系列凋亡相关基因严密控制,为应对衰老、损伤等情况而做出的程序性死亡过程。而肿瘤细胞往往可以避免这种程序性死亡过程,因而获得无限增殖能力。近几十年来,通过诱导细胞凋亡以有效消除体内肿瘤细胞一直是癌症治疗的热点之一。细胞凋亡的启动可通过内源的线粒体途径和外源的死亡受体途径进行,细胞凋亡信号通路与其他信号通路的相互作用也可以诱导细胞凋亡。大量研究显示,羽扇豆醇可以显著诱导多种类型肿瘤细胞的凋亡,且对正常细胞无明显毒副作用,具有很大的临床应用潜力。目前已发现多个信号通路参与羽扇豆醇诱导肿瘤细胞凋亡过程:(1)p53内源性途径:羽扇豆醇可以上调p53表达,进而诱导Bax蛋白表达和激活caspase-3,引起头颈癌细胞凋亡[4]。(2)信号转导与转录激活因子3(signal transducers and activators of transcription, STAT3)途径:Min等利用分子对接分析发现,羽扇豆醇可直接结合表皮生长因子受体(epidermal growth factor receptor,EGFR)的酪氨酸激酶活性域;随后抑制EGFR及其下游效应分子STAT3的磷酸化,导致STAT3靶基因凋亡抑制蛋白(survivin)及细胞周期蛋白Cyclin D1转录水平下降,进而诱导非小细胞肺癌(non-small cell lung cancer,NSCLC)细胞凋亡[5]。在肝癌的研究中发现,羽扇豆醇也可通过抑制STAT3的磷酸化及核转位,进而诱导细胞凋亡。然而不同于直接结合作用,羽扇豆醇对STAT3活性的抑制作用是通过上调肝癌细胞内磷酸酶SHP-2的表达而实现的[6],提示羽扇豆醇对肿瘤细胞STAT3的活性具有多种作用方式。(3)Wnt/β-catenin信号通路:在经典的Wnt/β-catenin信号通路中,β-catenin是控制Wnt信号通路开关的中心分子,该蛋白的生物学作用与磷酸化修饰和核定位密切相关[7]。Tarapore等[8]研究指出羽扇豆醇抑制结肠癌细胞增殖、诱导细胞凋亡的作用主要源于对Wnt/β-catenin信号通路的抑制作用。在前列腺癌细胞、黑色素瘤细胞等研究中也发现,羽扇豆醇对肿瘤细胞内β-catenin的磷酸化及核定位具有抑制作用[3, 9]。鉴于羽扇豆醇对于β-catenin活性的显著抑制作用及Wnt/β-catenin信号通路在肿瘤细胞增殖、分化和凋亡过程的重要功能,提示该通路可能是羽扇豆醇重要的作用靶点之一。(4)MAPK信号通路:羽扇豆醇处理肝癌细胞后,Bcl-2表达下降,Bax、caspase-3、8、9等蛋白表达上调;与此同时,细胞内p38和JNK2蛋白磷酸化水平升高,提示MAPK信号通路参与了该过程[10]。(5)死亡受体途径:细胞FLICE样抑制蛋白(cellular FLICE-like inhibitory protein,cFLIP)是一种凋亡抑制蛋白,它的过表达会抑制细胞凋亡,并且使细胞对肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)产生耐受性。Murtaza等[11]研究指出,羽扇豆醇通过下调cFLIP以提高胰腺癌细胞对TRAIL的敏感性,促进细胞凋亡。
2.3 调控肿瘤细胞周期细胞周期是由细胞周期相关蛋白(Cyclins)、细胞周期依赖性激酶(cyclin-dependent kinases,CDKs)以及部分抑制因子(Ink4、Cip、Kip)等严密调控的生理学过程。然而由于基因突变或者表观遗传学变异,肿瘤细胞的细胞周期通常处于失控状态,从而满足无限增殖的需求。羽扇豆醇可引起多种肿瘤细胞内周期相关蛋白表达变化,进而导致细胞周期阻滞和凋亡。羽扇豆醇可将宫颈癌HeLa细胞周期阻滞于S期,细胞内S期调控蛋白Cyclin E、Cyclin A、CDK2表达下调,以及CDK抑制因子p21表达上调[12]。在头颈癌的研究中指出,羽扇豆醇可诱导G1期细胞周期阻滞,可能是通过上调细胞内多重肿瘤抑制基因CDKN2A,进而抑制CyclinD1的表达而实现的[4]。与之类似,羽扇豆醇同样可导致黑色素瘤细胞G1期周期阻滞和CyclinD1、CyclinD2蛋白、CDK2表达下调[13]。由此可知,对于不同的肿瘤细胞,羽扇豆醇均发挥一定的细胞周期阻滞作用,然而具体阻滞的周期不尽相同。
2.4 抑制肿瘤细胞迁移、侵袭肿瘤的转移是肿瘤治疗失败的主要原因,也是导致癌症患者死亡的主要因素。王明等[14]发现羽扇豆醇在体外能够有效地抑制人乳腺癌 MDAMB-231细胞侵袭和转移,磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/核转录因子(nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)信号通路可能是羽扇豆醇抑制乳腺癌侵袭、转移的作用途径。刘博佳等[15]通过体内体外实验证实羽扇豆醇可抑制肝癌细胞的迁移、侵袭作用,诱导上皮-间质转化(epithelial-mesenchymal transition,EMT)相关蛋白上皮型钙黏蛋白素(E-cadherin)表达,而神经型钙黏附素(N-cadherin)、血管平滑肌肌动蛋白(α-SMA)、波形蛋白(vimentin)和金属基质蛋白9(matrix metalloproteinase 9,MMP-9)表达下降,提示羽扇豆醇抑制肝癌细胞侵袭转移可能是通过调控EMT进行的。另外一项研究中,羽扇豆醇可通过P38 MAPK和PI3K/AKT信号通路调控EMT抑制人骨肉瘤细胞的侵袭转移[16]。近期研究发现,羽扇豆醇和微小RNA-145-5p(miR-145-5p)均可抑制前列腺癌细胞的增殖,迁移和侵袭,并且羽扇豆醇可以增强miR-145-5p诱导前列腺癌细胞凋亡的作用,提示羽扇豆醇可与microRNA联合发挥作用[17]。
2.5 诱导肿瘤细胞分化肿瘤的恶性程度与其分化程度有关,羽扇豆醇可以通过诱导肿瘤细胞分化,达到抗肿瘤作用。黑色素分泌及树突状形态改变是黑色素瘤细胞的分化标志,Hata等[18-19]的研究中,羽扇豆醇作用于黑色素瘤细胞,使其形态上产生树突状改变,并且通过激活MAPK信号通路诱导黑色素的分泌。当黑色素细胞受到紫外线照射等刺激作用时,黑素小体被运输到树突的顶端,并分泌到周围的角质形成细胞中,保护其免受紫外线引起的损伤,在此过程需要黑素小体运输蛋白(肌动蛋白-va、Slac2-a、Rab27a等)的参与。Ogiwara等[20]又进一步研究了羽扇豆醇对黑素小体运输蛋白的影响,结果显示羽扇豆醇显著提高肌动蛋白-va和Rab27a的表达。
2.6 提高免疫细胞的肿瘤杀伤活性肿瘤细胞对于机体本身属于有害异物,机体自身所具备的的免疫细胞可以防御杀伤肿瘤细胞。研究表明,羽扇豆醇可以通过提高机体的免疫作用发挥抗肿瘤作用。γδT细胞以MHC非限制性方式杀伤癌细胞,具有抗肿瘤和抗感染作用,是人体固有免疫系统的重要组成部分。罗冠琴等[21]研究发现,羽扇豆醇可以明显抑制胰腺癌细胞的生长,并且有望通过促进γδT细胞增殖来非特异性免疫杀伤胰腺癌细胞。在常规细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)培养基中加入细胞因子,将细胞因子刺激后得到的T细胞称为共刺激细胞。毕亭亭等[22]的研究中,一定浓度下的羽扇豆醇可以促进共刺激细胞的增殖,并且可以提高共刺激细胞对结肠癌细胞的杀伤活性。羽扇豆醇可以抑制结肠癌细胞增殖,经过羽扇豆醇处理后的结肠癌细胞对共刺激细胞的敏感性也有显著提高。自然杀伤细胞(natural killer cell,NK细胞)是一种先天免疫细胞,它们具有广泛的免疫功能,参与适应性免疫反应,是抗肿瘤的关键因素[23]。Wu等[24]的研究中,羽扇豆醇通过提高NK细胞对胃癌细胞的杀伤作用来抑制癌细胞增殖。由此可见,羽扇豆醇通过不同方式提高免疫细胞肿瘤杀伤活性,利用羽扇豆醇与免疫治疗相结合的方法可能会产生协同作用,为抗肿瘤治疗提供新的思路。
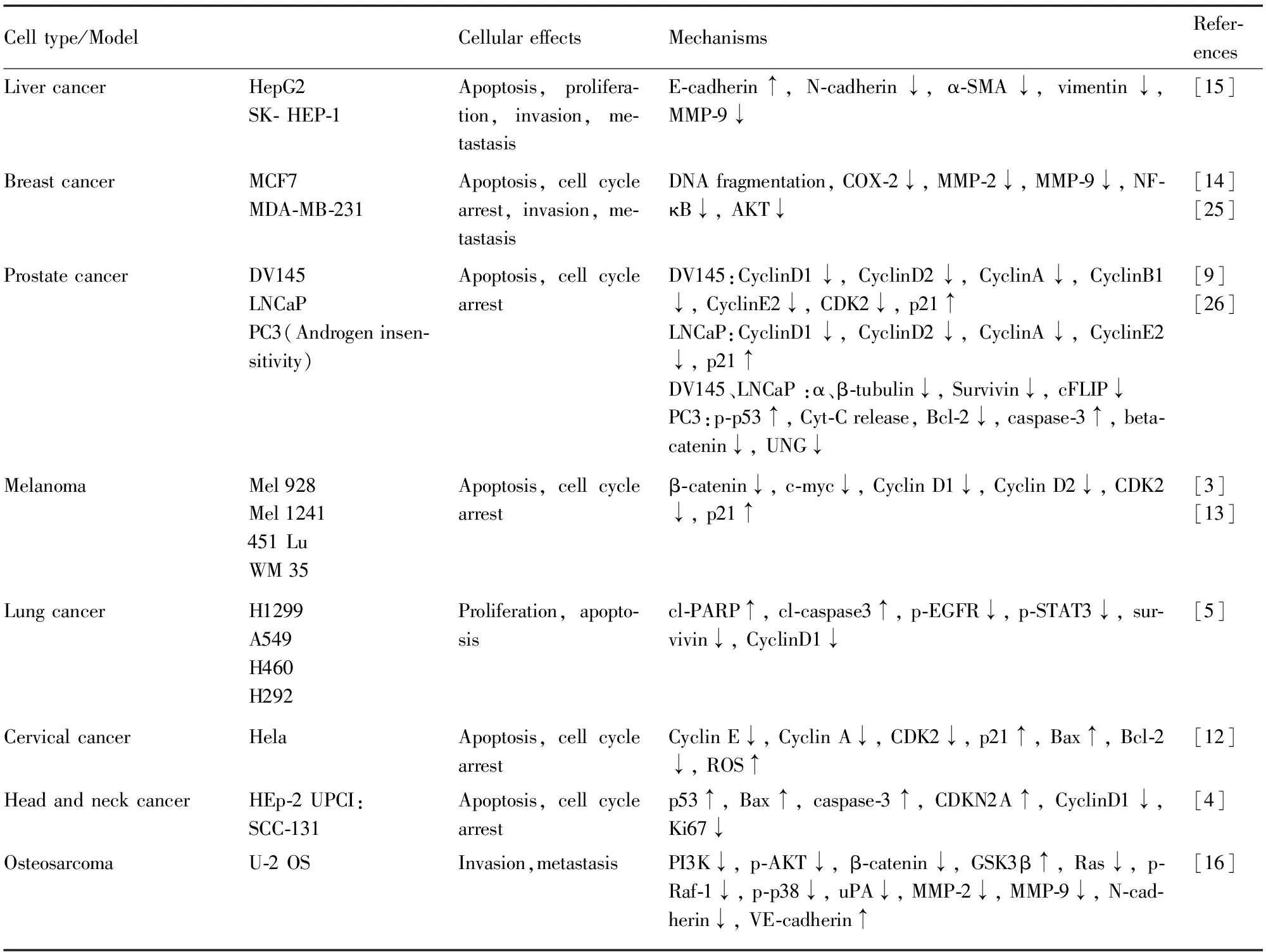
Tab 1 Anticancer effects and mechanisms of lupeol in vitro
3 其他作用
3.1 抗炎作用Beserra等[27-28]的研究中发现羽扇豆醇在促进大鼠伤口愈合的同时具有抗炎作用,并显著增加了促血管生成和再上皮化的标志物。同时对高血糖大鼠的伤口愈合具有类似作用,抑制炎症介质和生长因子的产生与活性。Ahmad等[29]的体内实验中,羽扇豆醇对胸腔积液中白细胞介素-2(interleukin-2,IL-2)、IFN-γ和TNF-α均有剂量依赖性抑制作用,其中以100 mg·kg-1剂量作用最明显。对IL-4、IL-5水平无明显抑制作用。
3.2 抗氧化应激作用Prasad等[30]表明,羽扇豆醇对雄激素诱导的氧化应激具有保护作用。口服羽扇豆醇和芒果果肉提取物给注射睾酮的瑞士白化小鼠,可以抑制睾酮诱导的小鼠前列腺活性氧水平的增加,耗尽过氧化氢酶和超氧化物歧化酶等抗氧化酶,并增加小鼠前列腺的脂质过氧化。
4 总结与展望
羽扇豆醇作为一种来源于中草药及食源性植物中的单体化合物,具有抗炎、抗氧化应激等作用,并且可以通过多种信号转导途径诱导癌细胞凋亡,抑制其增殖,侵袭,转移,血管生成,发挥抗肿瘤作用。Min等[5]用羽扇豆醇处理NSCLC细胞和WI38人肺成纤维细胞,发现成纤维细胞的活力高于肿瘤细胞,提示羽扇豆醇对正常细胞安全无毒或毒性较低。长期慢性炎症是肿瘤发生的原因之一,羽扇豆醇具有很强的抗炎作用,将抗炎与抗肿瘤研究结合在一起,使羽扇豆醇有望成为强效、安全、无毒、副作用低的抗癌药。然而目前的研究多集中在体外实验,细胞株单一,无法模拟肿瘤患者实际病理状态,因此开展相应的体内实验以及临床试验将有力的促进羽扇豆醇的抗肿瘤作用的研究。

