不同处理对小米分离蛋白溶解性及亚基带分布的影响
侯超凡,陈振家,郝利平
(山西农业大学 食品科学与工程学院,山西 晋中 030801)
小米又称粟,由谷子脱壳而成,是我国北方广泛种植的作物之一[1]。小米所含的各种营养素丰富,口感良好,深受北方人的喜爱[2]。小米中营养素比例比较均衡,是一种良好的饮食来源。相较于其他常见的谷物,小米的营养价值更优,与水稻、玉米等谷物相比,小米的蛋白质含量更高[3];与大米和小麦等谷物相比,小米中所含的钙、膳食纤维也更多[4]。同时,小米蛋白也是优质蛋白的来源,其消化率高达83.4%,可用于食品调味品、营养强化剂、添加剂等多个领域[5]。
近年来,许多水解后的植物蛋白被用于加工成各种增加产品风味的调味品[6],常见的有豆类蛋白[7]和谷类蛋白[8],这得益于其水解后产生的游离氨基酸。小米中含有丰富的蛋白质,其蛋白具有低过敏性的特点,分解后可产生大量的游离氨基酸产物,可用于调味品及其他添加剂的研究[9]。小米蛋白质的氨基酸组成模式中赖氨酸和苏氨酸是限制性氨基酸,但其必需氨基酸的含量高于稻米和小麦[10]。在实际的食品生产加工过程中,蛋白质容易受到诸多因素的影响,蛋白的加工处理极易破坏蛋白质的结构,使得蛋白质结构发生变化,发生聚集行为,从而影响蛋白质的功能特性,进而影响食品的感官品质。其中,蛋白的溶解度作为蛋白与溶剂之间平衡的性质,是蛋白功能性质中最为重要的性质,蛋白质的起泡性及起泡稳定性、乳化性及乳化稳定性都会受到溶解度的影响[11]。离子浓度、pH和温度对蛋白质的加工影响巨大,然而目前这3种处理对小米分离蛋白的影响报道较少。
本试验主要研究不同离子浓度、pH、温度对小米分离蛋白溶解性及亚基带分布的影响,以期为小米分离蛋白及其加工产品的开发提供理论依据。
1 材料与方法
1.1 材料与设备
晋谷21号小米:山西晋中乐民恒星杂粮加工厂;考马斯亮蓝G250:Solarbio公司;5x非还原型蛋白上样缓冲液、SDS-PAGE凝胶制备试剂盒:Servicebio公司。
YS-04A小型高速粉碎机 北京燕山正德机械设备有限公司;KDC-1044L大容量低速离心机、HC-2064高速离心机 安徽中科中佳科学仪器有限公司。
1.2 样品的制备
将小米粉碎、过筛,用石油醚对小米粉进行脱脂,干燥后采用碱提酸沉法提取小米分离蛋白,50 ℃恒温水浴下用0.1 mol/L的NaOH调溶液pH为12溶出分离蛋白,再用0.1 mol/L的HCl使蛋白沉淀,中和溶液pH后透析除盐,用液氮对蛋白进行速冻,再经真空冷冻干燥制得小米分离蛋白[12-14],提取出的小米分离蛋白主要含有谷蛋白、清蛋白和球蛋白[15]。
1.3 牛血清蛋白标准曲线的绘制
采用考马斯亮蓝比色法[16]测定上清液中蛋白质浓度,以不同质量浓度的牛血清蛋白为横坐标,其吸光度为纵坐标,绘制标准曲线,其线性方程为:
A595=0.5451×C+0.0173。
式中:A595为595 nm处的吸光值,C为蛋白质的质量浓度,R2=0.9997。
1.4 不同处理对小米分离蛋白溶解度的影响
1.4.1 盐离子浓度对小米分离蛋白溶解度的影响
使用盐离子浓度为0.01,0.05,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 mol/L的NaCl溶液溶解分离蛋白,测定不同盐离子浓度对小米分离蛋白溶解性的影响。
1.4.2 pH对小米分离蛋白溶解度的影响
配制质量浓度为10 mg/mL的小米分离蛋白溶液,加0.1 mol/L的HCl和NaOH分别调整溶液pH为2.0,3.0,4.0,4.5,5.0,6.0,7.0,8.0,9.0,10.0,11.0,12.0,测定不同pH对小米分离蛋白溶解度的影响。
1.4.3 温度对小米分离蛋白溶解度的影响
配制质量浓度为10 mg/mL的小米分离蛋白溶液,将溶液置于50,60,70,80,90,100 ℃的恒温水浴锅中,加热处理1 h后取出迅速冷却至室温,测定不同温度对小米分离蛋白溶解度的影响。
1.5 分离蛋白SDS-PAGE分析
参考Laemmli[17]的SDS-PAGE法对小米分离蛋白进行分析,将蛋白样品溶解于非还原型上样缓冲液中,振荡完全后离心备用,在非还原型上样缓冲液中加入20 μL的β-巯基乙醇,制得还原型上样缓冲液。电泳胶采用12%的分离胶和5%的浓缩胶制得,在电泳槽位依次加入5 μL的低分子量Marker蛋白标样以及20 μL的蛋白上样缓冲液(非还原型与还原型)。浓缩胶电压为100 V,分离胶电压为150 V,条带距底部1 cm处电泳停止。将电泳胶进行染色及脱色操作后扫描成图分析。
1.6 数据统计与分析
本研究均进行3次重复试验,并使用Origin 9.1软件作图分析。
2 结果与分析
2.1 不同处理对小米分离蛋白溶解度的影响
2.1.1 盐离子浓度对小米分离蛋白溶解度的影响

图1 盐离子浓度对分离蛋白溶解度的影响Fig.1 Effect of salt ion content on the solubility of protein isolate
由图1可知,随着离子浓度的增加,蛋白的质量浓度呈现先迅速降低后迅速增高再趋于稳定的趋势,未加盐离子的蛋白溶液质量浓度最高。盐离子浓度为0.01 mol/L时,质量浓度开始下降,0.05 mol/L时达到最低,之后又开始上升,0.3 mol/L时蛋白质量浓度趋于稳定。这说明低盐离子浓度对小米蛋白聚集性影响显著,而中、高盐离子浓度会降低蛋白的溶解度,这种变化可能是由于低盐离子会影响蛋白质的表面电荷,产生电荷屏蔽效应[18],如果蛋白质有较高的非极性区域,屏蔽效应会引起蛋白质抵御外来盐离子的影响并发生聚集反应,从而导致蛋白溶解度迅速降低,许雪儿等[19]发现低盐离子浓度会促进玉米醇溶蛋白和负载生育酚结合,产生电荷屏蔽效应、抵御盐离子的影响。
2.1.2 pH对小米分离蛋白溶解度的影响

图2 pH对分离蛋白溶解度的影响Fig.2 Effect of pH on the solubility of protein isolate
由图2可知,随着pH值的不断增高,蛋白质量浓度呈现先减小后升高最终趋于稳定的趋势。在pH值为4,4.5,5时蛋白质量浓度相对较低,pH为5时达到最低,说明小米蛋白质的等电点位于pH 5附近,这与碱提酸沉法的原理相似[20]。在等电点时,蛋白质分子以两性离子形式存在,其正负电荷相等,此时蛋白质分子在溶液中因为没有相同电荷的相互排斥,分子作用力减弱,蛋白质分子碰撞几率增大,随之凝聚而产生沉淀,而pH不断偏离等电点时,蛋白质分子所带电荷数增多,会产生静电作用使蛋白质分子之间不容易碰撞结合[21]。所以,蛋白质在等电点时,其溶解度最小,最易形成沉淀物。高晓莉等[22]同样发现当pH处于等电点附近时,燕麦蛋白的溶解度最低。
2.1.3 温度对小米分离蛋白溶解度的影响

图3 温度对小米蛋白溶解度的影响Fig.3 Effect of temperature on the solubility of millet protein
由图3可知,随着温度的升高,蛋白质量浓度先升高,在60~80 ℃质量浓度呈下降趋势,80 ℃时蛋白溶解度达到最低,90 ℃时又有所回升。这是由于大多数蛋白质均对60 ℃以上的温度敏感,随着温度升高,蛋白逐渐变性,蛋白质结构被打开,蛋白质分子之间、蛋白质分子与界面之间的相互作用力都会改变,进而发生热聚集反应,致使蛋白质溶解度下降[23]。但随着温度继续升高,高温条件会使已经形成的热聚集体发生热分解,从而使蛋白溶解度增加。Hussain等[24]发现高温条件使乳清蛋白的热聚集体发生分解效应,因此,温度在90 ℃之后质量浓度又有了一定程度的升高。
2.2 不同处理对小米分离蛋白亚基分布的影响
2.2.1 盐离子浓度对小米分离蛋白亚基分布的影响

图4 盐离子浓度对小米蛋白上清液亚基带分布的影响Fig.4 Effect of salt ion content on the subunit distribution of millet protein supernatant 注:0为低分子量Marker,1~12依次为不同盐离子浓度处理后的小米蛋白上清液(0.01,0.05,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 mol/L),N为非还原样品,R为还原样品。

图5 盐离子浓度对小米蛋白沉淀亚基带分布的影响Fig.5 Effect of salt ion content on the subunit distribution of millet protein precipitation 注:0为低分子量蛋白Marker,1~12依次为不同盐离子浓度处理后的小米蛋白沉淀(0.01,0.05,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 mol/L),N为非还原样品,R为还原样品。
由图4和图5可知,上清液和沉淀样品经过β-巯基乙醇还原后,电泳中66.2 kDa以上的亚基带消失不见,31~66.2 kDa之间的亚基条带颜色加深,这表明蛋白样品在经过还原后,66.2 kDa以上亚基带的消失与β-巯基乙醇的还原作用有关,β-巯基乙醇具有极强的还原作用,它可以使部分亚基带中的二硫键打断,破坏蛋白质的一级结构,从而造成亚基带下移[25]。
由图4和图5可知,低盐离子浓度下沉淀样品的泳带比上清液更加清晰,这说明在低盐离子浓度下上清液中溶解的蛋白较少,沉淀中所含的蛋白较多,这恰好对应了图1中所得的结果,证实了低盐离子浓度会影响蛋白质表面上的电荷,产生电荷屏蔽效应,进而引起蛋白质的聚集沉淀。
2.2.2 不同pH值下离心后小米蛋白电泳图谱
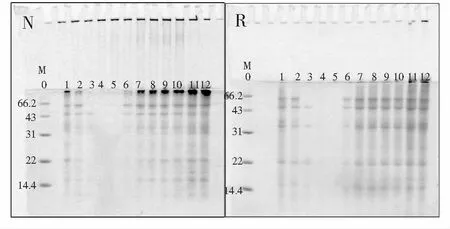
图6 pH对小米蛋白上清液亚基分布的影响Fig.6 Effect of pH on the subunit distribution of millet protein supernatant 注:0为低分子量蛋白Marker,1~12依次为不同pH处理后的小米蛋白上清液(pH为2,3,4,4.5,5,6,7,8,9,10,11,12),N为非还原样品,R为还原样品。

图7 pH对小米蛋白沉淀亚基带分布的影响Fig.7 Effect of pH on the subunit distribution of millet protein precipitation 注:0为低分子量蛋白Marker,1~12依次为不同pH处理后的小米蛋白沉淀(pH为2,3,4,4.5,5,6,7,8,9,10,11,12),N为非还原样品,R为还原样品。
pH对分离蛋白上清液的影响见图6,泳带4和5(pH为5和6)几乎没有亚基带分布,其他泳带的亚基带明显清晰,这一现象说明当溶液pH处于蛋白的等电点附近时,上清液中绝大多数的蛋白会发生聚集,从而导致上清液样品中不含亚基带分布,这是由于蛋白处于等电点时分子间作用力减弱,不断碰撞聚集形成沉淀,而等电点的位置与三级结构中氨基酸残基的组成有关,上清液电泳带消失与图2所得的结果一致。继续观察图7中pH对分离蛋白沉淀的影响,可以发现沉淀在等电点处的泳带都有亚基带,这表明等电点处上清液中的蛋白聚集体整体迁移到了蛋白沉淀中,这进一步验证了之前所得到的结论。通过比较非还原和还原的电泳图,发现在样品经过还原后,66.2 kDa以上的亚基带消失,而14.4~66.2 kDa的亚基带颜色变深,这说明蛋白在经过β-巯基乙醇还原后二硫键被打断,分裂形成了低分子亚基带。
2.2.3 不同温度下小米蛋白电泳图谱

图8 温度对小米蛋白上清液和沉淀亚基带分布的影响Fig.8 Effect of temperature on the subunit distribution of millet protein supernatant and precipitation 注:0 为低分子量蛋白Marker,1~6依次为不同温度处理后的小米蛋白上清液(50,60,70,80,90,100 ℃);①~⑥依次为不同温度处理后的小米蛋白沉淀(50,60,70,80,90,100 ℃),N为非还原样品,R为还原样品。
由图8可知,当温度升高到60 ℃时,上清液亚基带颜色加深,温度继续升高到80 ℃时,亚基带颜色不断变浅,再将温度提高到90 ℃时颜色开始加深,这一现象说明上清液中蛋白浓度先升高再下降最后又回升,这与图3所得到的结果一致。造成此现象的原因可能是适当的温度可以促进蛋白的溶解度,当温度继续升高使得蛋白变性,蛋白会发生热聚集反应,再将温度提高到一定程度,蛋白热聚集体会被高温破坏,从而发生热分解。通过比较非还原和还原电泳图可以发现,66.2 kDa以上的亚基带消失不见,31~66.2 kDa间的亚基带颜色加深,这同样证实了β-巯基乙醇有打断二硫键的还原作用。
3 结论
通过使用离子浓度、pH及温度对小米分离蛋白进行处理,结果表明低离子浓度蛋白可能使蛋白发生电荷屏蔽效应,该效应会使小米分离蛋白抵御外来盐离子的影响,从而聚集在一起产生大量蛋白沉淀,溶解度严重降低,而中、高盐离子浓度会降低蛋白的溶解性,当蛋白溶液的pH位于等电点附近时,蛋白所带电荷相等,分子间作用力减弱,分子不断碰撞进而产生强烈的聚集反应,温度适当地提高可以促进蛋白的溶解,而中、高温会使蛋白发生变性,产生热聚集作用,但高温会剧烈破坏热聚集体的结构,一定程度上增加了蛋白的溶解性。蛋白样品经过β-巯基乙醇的还原,大分子量的亚基带消失,二硫键被打断,形成了新的小分子量亚基带。

