苦荞蛋白磷酸酶2C家族的鉴定及表达分析
刘耀东, 肖书雅, 王安虎, 刘 宇, 方 阳, 李小意, 刘志斌, 李旭峰, 王健美, 杨 毅
(1.四川大学生命科学学院生物资源与生态环境教育部重点实验室, 成都 610065; 2.西昌学院, 西昌 615000)
1 引 言
蛋白磷酸酶2C(protein phosphatases 2C, PP2C)依赖于Mg2+/Mn2+离子,是蛋白磷酸酶中极其重要的一支[1]. 从原核生物到真核生物,PP2C参与各种有意义的生命调控活动,在植物中,PP2C是蛋白磷酸酶最大的一个分支[2]. 植物PP2C被认为是蛋白信号级联反应中的负调控因子,也在激素信号转导过程中扮演重要角色[3]. 此外,植物PP2C还能调控植物的生长发育,包括种子萌发和根系发育[4-5]. 植物PP2C基因家族之前有很多研究,例如拟南芥(Arabidopsisthaliana)、水稻(Oryzasativa)和大豆(Glycinemax)[6-8]. 但是苦荞PP2C基因家族的研究未见报道.
苦荞(Fagopyrumtataricum)是一种药食兼用的粮食,与甜荞(Fagopyrumesculentum)相比,它更富含维生素B和芦丁,这些成分有助于降低高血压和缓解动脉硬化[9],并且苦荞对恶劣环境有很强的耐受力,而PP2C的A亚族是ABA信号通路中的核心成员,参与植物逆境胁迫应答[10-12]. 苦荞的基因组测序已经完成,加快了苦荞抗逆的机制研究. 本研究参考拟南芥PP2C基因家族信息,通过生物信息学方法在苦荞中全基因组中鉴定出81个PP2C成员,并分析了理化性质、基因结构、保守结构域、保守基序分布、染色体定位、进化情况等. 同时,通过qRT-PCR对苦荞PP2C的A亚族基因组织特异性表达和ABA处理后受诱导情况进行了分析. 这些结果对苦荞PP2C基因家族的后续研究奠定了基础.
2 材料和方法
2.1 材 料
实验使用的苦荞种子为西荞1号,由西昌学院王安虎老师提供. 所有的实验材料在四川大学生命科学学院阳台上的无菌土壤中进行培养,培养土壤为蛭石和土壤的混合物(1∶3, v/v). 在相同生长条件下选择生长情况相同的样品进行处理. 将收集到的植物样品用液氮处理后保存在-80 ℃的冰箱中用以进一步实验.
苦荞的基因组完整信息下载自TBGP数据库(http://www.mbkbase.org/Pinku1/). 作为参考的拟南芥PP2C家族成员从已发表文献中获取,蛋白质序列和CDS序列从Ensembl Plants数据库(http://plants.ensembl.org/index.html)下载.
2.2 方 法
2.2.1 苦荞中PP2C家族成员的鉴定 通过参考拟南芥PP2C家族成员的蛋白质序列和苦荞其他基因家族的鉴定方法及参数选择[7,13],使用BLAST软件[14]搜索苦荞中PP2C家族的候选序列(score≥100 and e-value≤10-10),并通过HMMER[15]软件搜索PP2C结构域辅以搜索候选序列(e-value≤10-2). PP2C结构域的隐马尔可夫模型文件(HMM)下载自PFAM数据库(http://pfam.xfam.org/):PF00481. 候选序列通过搜索PFAM数据库验证是否含PP2C结构域以进一步筛选. 筛选后的序列中去掉基因的可变剪切,最终确认了81个苦荞PP2C家族成员. 理论等电点(pI)和理论分子量(MW)等信息通过ExPasy网站(https://web.expasy.org/compute_pi/)上传蛋白质序列进行分析.
2.2.2 基于系统发育分析对苦荞PP2C家族进行分类 通过构建苦荞和拟南芥PP2C的系统发育树,并参考拟南芥PP2C家族的分类,根据它们在树上的相对位置,将苦荞PP2C分为不同的亚族. 其中,通过使用MUSCLE软件(默认参数)进行序列比对,用RAxML-NG软件[16](--all --msa input_file --model VT+I+G4+F --prefix at_ft --seed 678 --threads 4 --bs-tree autoMREs)构建极大似然(ML)系统发育树. 建树的模型通过Modeltest-NG软件分析,选择“VT+I+G4+F”模型. 系统发育树的可视化通过iTOL网站(https://itol.embl.de/)完成.
2.2.3 苦荞PP2C家族的基因结构分析和序列特征分析 苦荞PP2C家族的基因结构分析通过GSDS2.0网站(http://gsds.gao-lab.org/)完成,蛋白质保守基序分析通过使用MEME工具(http://meme-suite.org/tools/meme)完成,MEME的参数调整为数目20,基序长度参数调整为6至200.
2.2.4 苦荞PP2C家族的染色体定位和基因重复事件分析 苦荞PP2C家族的染色体定位基于苦荞基因组信息完成. 苦荞PP2C家族的基因重复事件分析使用BLAST软件进行序列比对,MCScanX软件[17]进行线性分析(默认参数),得到苦荞PP2C家族的串联重复事件和区段重复事件.
2.2.5 实时荧光定量PCR 为了分析苦荞PP2C的9个A亚族基因的组织特异性表达,通过qRT-PCR对它们在苦荞根、茎、叶、花、果实五个器官中的表达进行分析,并进行三组生物学重复. 为了分析苦荞PP2C的A亚族基因的受ABA诱导情况,用50 μmol/L ABA处理7日龄的苦荞幼苗后通过qRT-PCR进行分析,其中,处理时长分别为0 h、0.5 h、2 h、4 h、8 h、12 h、24 h,用吸水纸干燥表面后使用RNA提取试剂盒(Tiangen)的方法从植物材料中提取总RNA,并通过使用Prime Script RT试剂盒(Takara)的方法合成cDNA. 在qRT-PCR实验中,引物通过Primer3程序(http://frodo.wi.mit.edu/)获取(表1),使用FtH3基因作为内部参考基因. 之后通过2-(ΔΔCt)方法分析获得的mRNA的表达情况.
3 结 果
3.1 苦荞81个PP2C家族成员的鉴定
用BLAST软件[14]和HMMER软件[15]筛选出600多个候选序列,通过是否含PP2C结构域进一步筛选出88个序列,在去除可变剪切的情况后,确认了81个苦荞PP2C家族成员. 根据它们在染色体上的位置,从上往下依次命名为FtPP2C01至FtPP2C81,相关结果提供下载(https://github.com/felixlyd/ftpp2c),其中,苦荞PP2C的A亚族序列特征信息如表2所示. 在苦荞PP2C家族中,蛋白质序列长度从125(FtPP2C06)至1 098(FtPP2C15),平均长度为400;理论等电点(pI)分布在4.34(FtPP2C31)至9.6(FtPP2C60)之间;理论分子量在13 975.72 kD(FtPP2C06)至123 818.42 kD(FtPP2C15)之间.
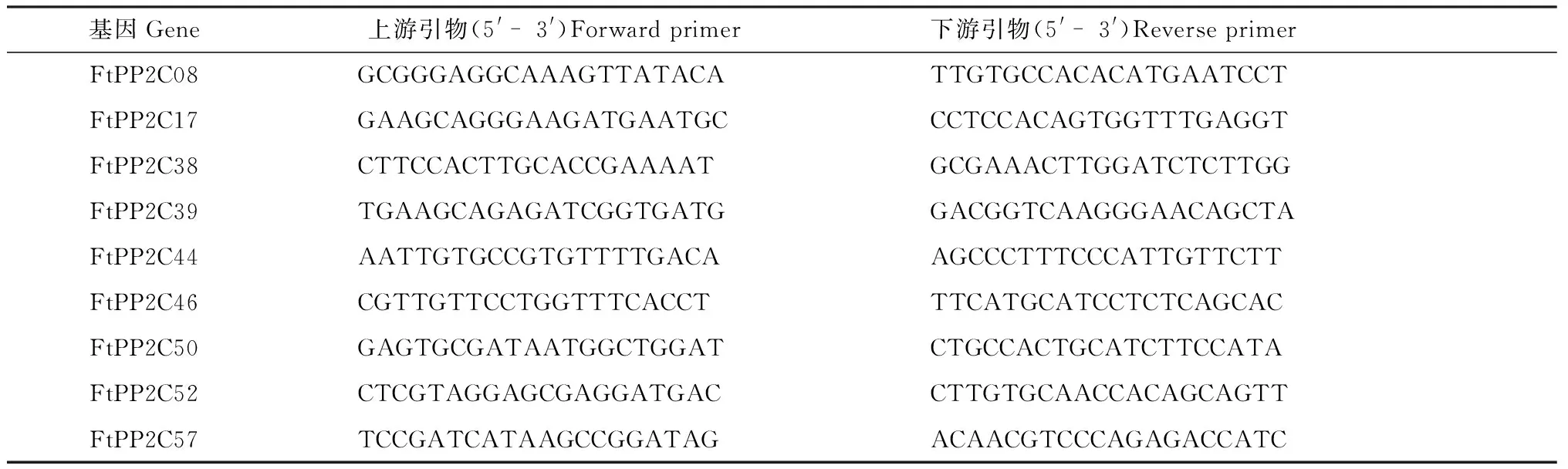
表1 苦荞PP2C的A亚族基因表达分析的实时荧光定量引物

表2 苦荞PP2C家族的A亚族基因的序列特征信息
3.2 苦荞PP2C家族基因的分类
161个PP2C基因的系统发育树通过ML方法构建(图1),其中,苦荞PP2C基因数目为81,拟南芥PP2C基因数目为80. 根据拟南芥PP2C基因的分类[6],将苦荞PP2C基因分为从A至K共11个亚族,标识“other”表示那些未分类的PP2C基因,其中,苦荞PP2C的A亚族有9个基因. Bootstrap值用来标识分类的可靠性. C亚族和D亚族的bootstrap值为99%,被分类为2个亚族;F亚族的两个子亚族bootstrap值为92%,但这些基因被分类至F亚族. 这样的分类方法是依据拟南芥PP2C的分类推导出的. 在进化树中,最大的亚族是E亚族,有13个苦荞PP2C基因和14个拟南芥PP2C基因;最小的亚族是J亚族,只有1个苦荞PP2C基因和2个拟南芥PP2C基因. 此外,结果表明苦荞和拟南芥PP2C基因在各亚族的数目分布上趋近相同.

表3 苦荞PP2C的保守基序信息
3.3 苦荞PP2C家族的基因结构和保守基序分析
基因结构分析主要为外显子和内含子分布分析(图 2b). 结果表明苦荞PP2C家族基因中,内含子的数目最小为0(FtPP2C25),最大为19(FtPP2C15),但大多数分布在3至5之间,其中有27个苦荞PP2C基因内含子数目为3,占比三分之一;外显子的数目分布为1(FtPP2C25)至20(FtPP2C15),但大多数分布在4至6之间,其中有37个苦荞PP2C基因外显子数目为4,占比45.7%. 此外,在不同亚族间,外显子和内含子的分布有一定差异,但在同亚族中,苦荞PP2C基因之间的外显子和内含子分布接近.
在苦荞PP2C中找到了20个保守基序(motif)(图 2a,表3). 除FtPP2C78、FtPP2C07、FtPP2C60、FtPP2C12、FtPP2C24外,其他苦荞PP2C均含motif4. 除D亚族和K亚族外,其他亚族均含motif6. 苦荞PP2C的A亚族的保守基序分布模式基本为motif14、motif4、motif18、motif1、motif7、motif6、motif2、motif20、motif10(除FtPP2C39和FtPP2C52不含motif14而FtPP2C44含额外的motif17). 其他亚族中的保守基序分布也极为接近,例如G亚族保守基序均为motif14、motif4、motif1、motif7、motif6、motif2、motif20、motif10;D亚族保守基序分布模式基本为motif 8、motif 4、motif 9、motif 1、motif 5、motif 15、motif 2、motif 3(FtPP2C45、FtPP2C48、FtPP2C41不含motif15;FtPP2C03不含motif8;FtPP2C54不含motif2和motif3).
基因结构分析结果和保守基序分析结果可验证苦荞PP2C家族分类的正确性,根据这些结果可以推测出苦荞PP2C不同亚族间的基因功能有一定差异.

图2 81个苦荞PP2C基因的保守基序分布和基因结构分析 (a) 苦荞PP2C的保守基序, (b)苦荞PP2C基因的基因结构.Fig.2 The conserved protein motifs and gene structures of the 81FtPP2C genes (a)The conserved motifs of the FtPP2C proteins, (b)the gene structures of the FtPP2C genes.
3.4 苦荞PP2C家族的染色体定位和基因重复事件分析
基于苦荞基因组信息对苦荞PP2C基因进行染色体定位,结果表明苦荞PP2C基因在苦荞的8个染色体上均有分布,并且分布情况相对均匀(图 3a). 苦荞PP2C基因在染色体上的分布数量分别为:15(Ft1)、10(Ft2)、9(Ft3)、9(Ft4)、4(Ft5)、8(Ft6)、10(Ft7)、16(Ft8). 基因重复事件分析结果表明苦荞PP2C家族没有串联重复事件,但是有14次分布在苦荞不同染色体上的区段重复事件(图3b). 这表明区段重复事件是苦荞PP2C基因数量增多的重要途径.

图3 苦荞PP2C基因的染色体分布及线性分析
3.5 苦荞PP2C的A亚族基因的组织特异性表达分析
通过qRT-PCR分析了苦荞PP2C的A亚族基因在苦荞根、茎、叶、花、果实五个器官中的表达模式,结果表明它们在所有器官中均有表达. 其中,除FtPP2C44外,8个基因在苦荞生殖器官尤其是果实中,表达量比较高(图4a),例如FtPP2C08主要在花和果实中表达,FtPP2C38在果实中的表达量是在叶中的1 715倍. 此外,FtPP2C39在根中表达量比较高,其他基因在根中表达量较低. 据此推测苦荞PP2C家族的A亚族基因主要在苦荞生殖器官中表达并发挥一定作用,这与之前拟南芥[6]、水稻[7]、大豆[8]中的研究一致.
3.6 苦荞PP2C的A亚族基因受ABA诱导的表达情况
通过qRT-PCR分析了苦荞PP2C的A亚族基因在ABA处理下的表达情况,其中,处理条件分别为0 h、0.5 h、2 h、4 h、8 h、12 h、24 h(图 4b). 结果表明除FtPP2C08外,8个基因均受ABA诱导表达量显著上调. 其中,在ABA诱导下4 h时,8个基因受ABA诱导表达量最高;FtPP2C39在所有处理条件下表达量都较高. 从而推测,苦荞PP2C的A亚族基因在ABA处理后表达量上调具有一定生物学意义,而FtPP2C39发挥的作用可能较为重要.

图4 苦荞PP2C的A亚族基因的表达分析
4 讨 论
过去的研究表明PP2C基因家族在植物中具有关键作用,但是目前有关苦荞PP2C基因家族的研究很少. 本文从苦荞全基因组中鉴定出81个PP2C家族成员,与拟南芥80个PP2C家族成员在数量上非常接近[7]. 对苦荞和拟南芥PP2C进行系统发育分析,将苦荞PP2C分类为从A-K的11个亚族,其中苦荞PP2C的A亚族有9个成员. 结果还表明除AT4G11040外,拟南芥PP2C其他分类结果与以前的研究一致. 这可能是因为构建系统发育树的方法不同,以前的研究[7]使用了邻接法(NJ)而此处使用了极大似然法(ML). 此外,与拟南芥PP2C家族相比,苦荞PP2C家族中C、D、K亚族的成员更多,而A、B、E、G、J亚族的成员更少. 基因重复事件分析结果表明苦荞PP2C家族有14次区段重复事件,而拟南芥中则是13次,数值非常接近. 基因重复事件与基因家族的扩增有关,从而推测这可能是两者PP2C数量上十分接近的原因. 出现这种情况的原因可能是植物PP2C的基因功能在进化过程中相对保守[18].
保守基序分析结果表明苦荞PP2C家族在保守基序分布上有一定差异,但它们均含保守的PP2C结构域. 而且在相同亚族中,蛋白质保守基序的组成相近. 特定的保守基序分布可以代表特定的功能,例如拟南芥中PP2C的A亚族成员参与调控ABA应答过程[7],而它们的保守基序组成类似. 苦荞PP2C的A亚族也具有相似的保守基序组成,与拟南芥PP2C的A亚族亲缘性较高,从而推测苦荞PP2C的A亚族也参与调控ABA应答过程. 而qRT-PCR分析结果表明苦荞PP2C的A亚族基因在ABA处理后除FtPP2C08外均受诱导表达显著上调,上调的原因可能是因为ABF结合PP2C启动子调控其表达[19]. 因此推测苦荞PP2C的A亚族基因在苦荞ABA应答过程中发挥一定作用.
qRT-PCR分析结果还表明苦荞PP2C的9个A亚族基因在根、茎、叶、花、果中均有一定表达,其中,FtPP2C08、FtPP2C17、FtPP2C38在花和果实中的表达量较高;FtPP2C39在根中表达量很高. 此外,FtPP2C39与拟南芥AT4G11040(又名DOG18)基因同源性较高,而拟南芥种子休眠和萌发受到DOG18的调控[20],据此推测FtPP2C39在苦荞种子休眠和萌发过程中发挥一定作用.
综上所述,本文通过生物信息学方法对苦荞PP2C家族进行分析,并通过qRT-PCR对苦荞PP2C的A亚族基因进行了组织特异性表达和ABA处理后受诱导情况分析,这些结果为进一步挖掘和研究苦荞PP2C家族的基因功能奠定了基础,有利于进一步对苦荞抗逆的机制研究.
- 四川大学学报(自然科学版)的其它文章
- 一类二阶非线性常微分方程组边值问题解的存在唯一性
- Pullback attractors for lattice FitzHugh-Nagumo systems with fast-varying delays
- 定常Navier-Stokes方程的三个梯度-散度稳定化Taylor-Hood有限元
- On the crossing periodic orbits of a piecewise linear Liénard-like system with symmetric admissible foci
- 激光波形优化产生水窗区单阶谐波
- 基于多模板模糊竞争的涉案财物关系抽取方法

