超声辅助酶法提取无籽刺梨果渣中黄酮的工艺优化及其抗氧化活性
杨宗玲,李 晗,范方宇,郭 磊,王振兴,杨代勇,何晓雪,林仫发
(1.西南林业大学林学院,云南昆明 650224;2.西南林业大学生命科学学院,云南昆明 650224;3.云南省昆明市生产力促进中心,云南昆明 650224)
无籽刺梨(Rosa sterilisS.D.Shi)属蔷薇科蔷薇属多年生落叶攀缘类果树,广泛分布于亚热带及暖温带地区,我国主要分布在四川、贵州、云南等地,其成熟后表面果刺脱落,种子败育,无果核或少许果核,故名无籽刺梨[1−4]。近年来,随着刺梨产业越来越受国家和地方的重视,以贵州省为主的刺梨产量也逐年提高。目前,刺梨加工类食品主要有果脯、果酒、果酱、饮料、果奶、刺梨糕等。随大量刺梨加工产品出现,其加工副产物—刺梨果渣也逐年上升。刺梨果渣约占果实质量的50%[5]。初步估计仅贵州省每年产刺梨果渣达7500 吨以上[6]。为减少资源浪费和环境污染。刺梨果渣深加工的相关研究也相继出现,如以刺梨果渣为原料提取膳食纤维[7]、多糖[8]、制备刺梨果渣超微粉[9]、发酵果醋[10]、生产饲料[11]等。
无籽刺梨果渣富含多种活性成分如超氧化物歧化酶、多酚、多糖、胡萝卜素、三萜、苷类、维生素C、黄酮类化合物,具有免疫调节、抗氧化、抗癌、抗疲劳及延缓衰老等作用[12−14]。据报道,刺梨经榨汁后80%以上的黄酮留在刺梨渣中[11]。王振伟等[15]利用超声波辅助提取刺梨中黄酮,结果表明,超声波辅助提取刺梨黄酮较常规回流提取法,黄酮得率被有效提高;李侠等[16]以绿豆皮为原料,比较了单独超声提取和酶法提取绿豆皮中总黄酮,结果表明,在相同超声条件下,超声波-酶法提取绿豆皮中黄酮类化合物得率提高了18.54%。采用超声辅助酶法提取无籽刺梨中黄酮的研究鲜有报道。本文采用超声辅助酶法提取无籽刺梨果渣中黄酮并对其抗氧化活性进行研究,以期为无籽刺梨中黄酮的进一步研究提供参考。
1 材料与方法
1.1 材料与仪器
无籽刺梨果渣 云南曲靖昆钢金副食品有限公司;芦丁标准品 HPLC≥98%,上海源叶生物科技公司;盐酸 分析纯,云南杨林工业开发区汕滇药业有限公司;三羟甲基氨基甲烷(Tris)纯度≥99.5%,北京鼎国昌盛生物技术有限责任公司;亚硝酸钠、无水乙醇、硝酸铝、抗坏血酸、氢氧化钠、磷酸二氢钾、铁氰化钾、水杨酸、过氧化氢 分析纯,天津市风船化学试剂科技有限公司;纤维素酶(CAS 9012-54-8) 酶活力≥35U/mg(BR级别),南京都南生物公司;DPPH(96%)、三氯乙酸、三氯化铁、邻苯三酚 分析纯,上海麦克林生化科技有限公布公司;七水合硫酸亚铁 分析纯,广东光华科技股份有限公司。
DHG-9240A电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;BJ-800A粉碎机 永康市铂欧五金制品有限公司;DT-1 电子天平 赛多利斯科学仪器公司;DK-98-2 恒温水浴锅 天津市泰斯特仪器有限公司;SB25-12DTDS超声波清洗机 宁波新艺超声设备有限公司;UV-2600 紫外可见分光光度计日本岛津公司;Sigma3K15 离心机 德国西格玛离心机有限公司。
1.2 实验方法
1.2.1 无籽刺梨果渣中总黄酮提取研究
1.2.1.1 无籽刺梨果渣处理 采用60 ℃烘箱干燥无籽刺梨果渣24 h,粉碎,过60 目筛,储存于4 ℃冰箱中备用。
1.2.1.2 无籽刺梨果渣中黄酮提取工艺 准确称量2.00 g无籽刺梨果渣粉,按设定液料比加入所需浓度的乙醇,用1 mol/L NaOH和10%醋酸调节pH为4.5(纤维素酶酶解适宜pH),设置超声参数(超声温度为60 ℃)进行超声提取,超声提取结束后,按底物浓度加入设定质量分数的纤维素酶,于水浴锅中50 ℃水浴酶解,酶解结束后,于90~95 ℃水浴灭酶5 min,5500 r/min于离心机中离心10 min。取上清液用相应提取浓度的溶剂于容量瓶中定容至100 mL得黄酮粗提取液。
1.2.1.3 黄酮含量测定 参考刘畅等[17]的方法,绘制芦丁标准曲线,得回归直线方程为y=12.962x−0.014,R2=0.99924。取1 mL1.2.1.2 中制备的黄酮粗提液于25 mL的容量瓶中,用相应提取浓度的乙醇定容使其稀释25 倍,再于稀释液中取1 mL于10 mL容量瓶中。按绘制标准曲线的方法加入相应试剂显色后于510 nm处测定吸光度值。根据标准曲线方程计算黄酮浓度,采用式(1)计算黄酮得率。
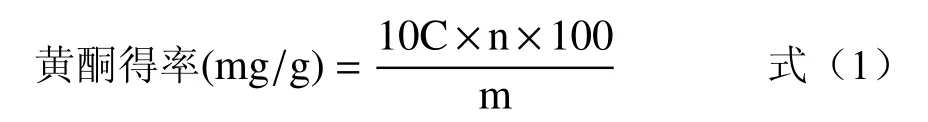
式中:10 为1 mL稀释液加试剂显色后的总体积,mL;C为1 mL稀释液加试剂显色后溶液中黄酮的浓度,mg/mL;n为稀释倍数,25;100 为黄酮粗提液体积,mL;m为无籽刺梨果渣粉质量,g。
1.2.1.4 无籽刺梨果渣黄酮提取单因素实验 以液料比30 mL/g、乙醇浓度60%、超声时间40 min、超声功率250 W、酶解时间40 min、加酶量0.2%为基本条件,改变液料比(10、20、30、40、50 mL/g)、乙醇浓度(30%、40%、50%、60%、70%、80%)、超声时间(30、40、50、60、70 min)、超声功率(150、200、250、300、350 W)、酶解时间(20、30、40、50、60 min)、加酶量(0.0%、0.1%、0.2%、0.3%、0.4%、0.5%)六个因素条件,考察各个因素对超声辅助酶法提取无籽刺梨果渣中黄酮得率的影响。
1.2.1.5 无籽刺梨果渣黄酮提取响应面优化试验根据单因素实验结果,选取影响超声辅助酶法提取无籽刺梨果渣中黄酮得率的主要因素液料比、乙醇浓度、超声时间和加酶量作为自变量,无籽刺梨果渣中黄酮得率为响应值,利用软件Design-Expert.V8.0.6.1中Box-Behnken试验原理,设计四因素三水平的优化试验。因素及水平编码如表1所示。
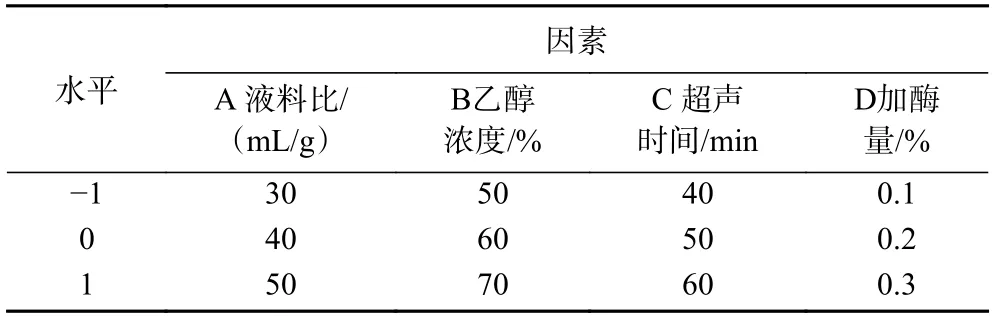
表1 响应面试验因素水平设计Table 1 Factors and levels of response surface methodology
1.2.2 无籽刺梨果渣黄酮纯度计算 将优化工艺条件下制备的无籽刺梨果渣黄酮粗提液使用旋转蒸发仪浓缩至浸膏,冷冻干燥,称取4.40 mg黄酮粗提物,用55%乙醇溶解并定容至25 mL作为待测液,取1 mL待测样液按1.2.1.3 中的方法计算待测液中的黄酮含量。黄酮纯度采用式(2)计算。本研究提取无籽刺梨果渣黄酮纯度为25.5%。
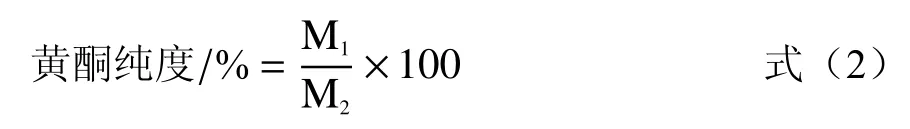
式中M1为待测样液中黄酮含量,mg;M2为黄酮粗提物质量,mg。
1.2.3 无籽刺梨果渣中黄酮抗氧化活性研究 无籽刺梨果渣中黄酮抗氧化活性强弱以样品清除率为50%时所对应的浓度(EC50,mg/mL)来判断,EC50值越低表示抗氧化性越强。EC50采用Origin 8.0 回归分析计算。
1.2.3.1 DPPH·清除率测定 参照谭钦铎[18]的方法,将1.2.1 部分中超声辅助酶法提取无籽刺梨果渣中黄酮优化工艺参数为提取条件提取黄酮,所得黄酮粗提液使用旋转蒸发仪浓缩至浸膏,然后冷冻干燥。冻干粉采用55%的乙醇复溶,配制黄酮浓度为0.005、0.01、0.02、0.03、0.04、0.05、0.06、0.08、0.1 mg/mL,取2 mL不同质量浓度的样品液于试管中加入0.08 mg/mL的DPPH溶液,采用漩涡震荡仪混匀,避光反应30 min后,测定在517 nm处样品的吸光度值(A0);取2 mL不同浓度的样品液于试管中,加入2 mL无水乙醇作为对照组,测定在517 nm处的吸光度值(A1);以2 mL无水乙醇和2 mL DPPH溶液反应设置空白组,测定在517 nm处的吸光度值(A2)。以同浓度的VC为对照。DPPH·清除率采用式(3)计算。
抗逆力(resilience,又被翻译为“复原力”、“心理韧性”等)是个人面对生活逆境时,能够理性做出正向的、建设性的选择方法和应对策略的能力③。抗逆力是20 世纪50 年代以来欧美各国心理学领域的一个热点问题。抗逆力理论主张从积极心理学视角挖掘个人的内在潜能,不再单纯关注问题的负面影响,而是强调人在面对压力、逆境时的潜能激发和自我超越④。
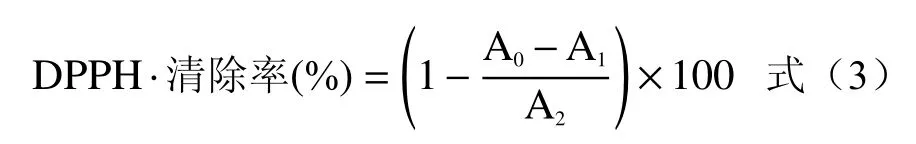
1.2.3.2 ·OH清除率测定 参考张倩茹[19]的方法,配制无籽刺梨果渣黄酮浓度为分别0.05、0.1、0.15、0.2、0.3、0.4、0.8、1.2、1.6 mg/mL,于试管中依次加入1.0 mL样液、1.0 mLFeSO4(9.0 mol/L)、1.0 mLH2O2(8.8 mmol/L),采用漩涡震荡仪混匀,室温反应10 min,再加入1.0 mL水杨酸乙醇溶液(9.0 mmol/L),室温静置反应30 min,5000 r/min于离心机中离心5 min,取上清液测定510 nm处吸光度值为A0。取相同浓度的VC为对照。·OH清除率采用式(4)计算。
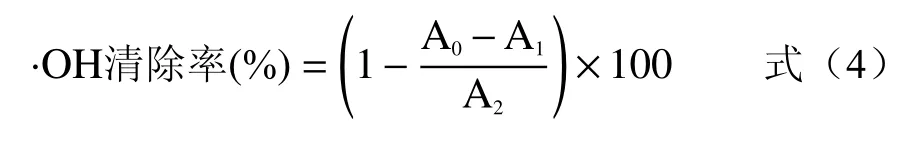
式中:A1为蒸馏水代替FeSO4吸光度值;A2为55%乙醇代替样液吸光度值。
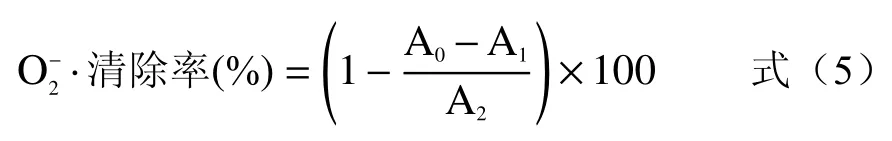
式中:A0为样液和邻苯三酚的吸光度值;A1为不加邻苯三酚添加样品的吸光度值;A2为添加邻苯三酚不加样品的吸光值。
1.2.3.4 还原力测定 参照孟娜等[21]的方法,利用铁氰化钾还原法,样品还原力的强弱通过测定吸光度值判断,吸光度值越大,还原力越强。具体方法为:配制无籽刺梨果渣黄酮浓度分别为0.02、0.04、0.06、0.08、0.1、0.2、0.3、0.4、0.5mg/mL,于试管中依次加入2.5 mL样液、2.5 mL磷酸缓冲溶液(0.2 mol/L,pH6.6)、2.5 mL1%铁氰化钾水溶液,50 ℃水浴20 min,取出后迅速冷却,加入10%三氯乙酸水溶液2.5 mL,离心(3000 r/min,10 min),依次取5.0 mL上清液、4.0 mL蒸馏水、1.0 mL0.1%三氯化铁水溶液混合均匀,测定700 nm处吸光度值。取相同浓度的VC为对照。
1.3 数据处理
以上处理均做3 次平行实验,图表中数据为3 次实验数据的平均值。利用软件Design-Expert.V8.0.6.1 进行实验设计,软件IBM SPSS Statistics 20 对实验数据进行显著性分析,软件Origin 8.0 对实验数据进行绘图。
2 结果与分析
2.1 单因素实验
2.1.1 液料比对无籽刺梨果渣黄酮提取的影响 由图1 可知,在液料比10~30 mL/g范围内,黄酮得率随液料比增大呈显著(P<0.05)上升趋势;液料比40 mL/g时,黄酮得率达到最大值,为83.45 mg/g;继续提高液料比黄酮得率差异不显著(P>0.05)。原因为液料比过低,原料与提取溶剂接触不充分,黄酮未被有效溶出;增大液料比,原料被充分浸没在提取溶剂中,在超声波作用下黄酮被充分溶出,得率提高;液料比过大时,体系中的可溶性物质会与黄酮竞争溶剂,影响黄酮提取,另外,过高的液料比会使超声波的能量过多消耗在溶剂上,而原料吸收的能量较低,黄酮得率下降[22]。本文选择液料比水平30、40、50 mL/g进行响应面优化试验。
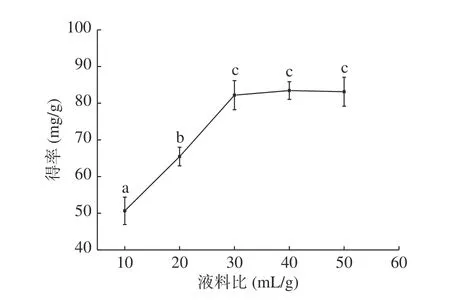
图1 液料比对黄酮提取的影响Fig.1 Effect of liquid-material radio on the extraction of flavonoids
2.1.2 乙醇浓度对无籽刺梨果渣黄酮提取的影响 由图2 可知,在乙醇浓度30%~60%范围内,黄酮得率随乙醇浓度升高逐渐增加,黄酮得率在乙醇浓度60%时达到最大,为83.45 mg/g,继续增大乙醇浓度,黄酮得率呈显著(P<0.05)下降趋势。主要原因为乙醇浓度的高低直接影响细胞内外的浓度差,浓度差越大越有利于黄酮浸出,黄酮得率提高[22];但乙醇浓度过高时,体系中一些脂溶性物质增多与黄酮竞争性地浸出,另外,乙醇浓度过高会使纤维素酶活性降低,导致黄酮得率下降[23]。本文选乙醇浓度50%、60%、70%进行响应面优化试验。
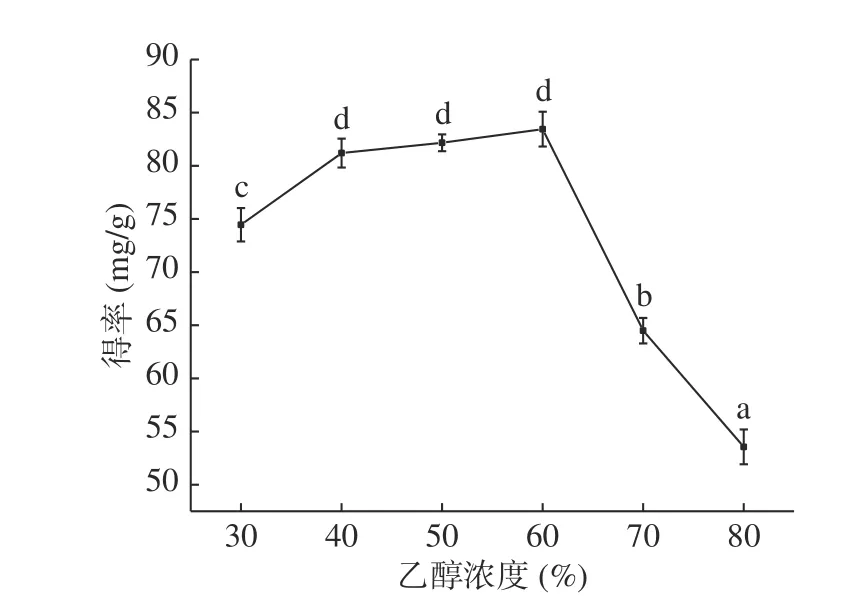
图2 乙醇浓度对黄酮提取的影响Fig.2 Effect of ethanol concentration on extraction of flavonoids
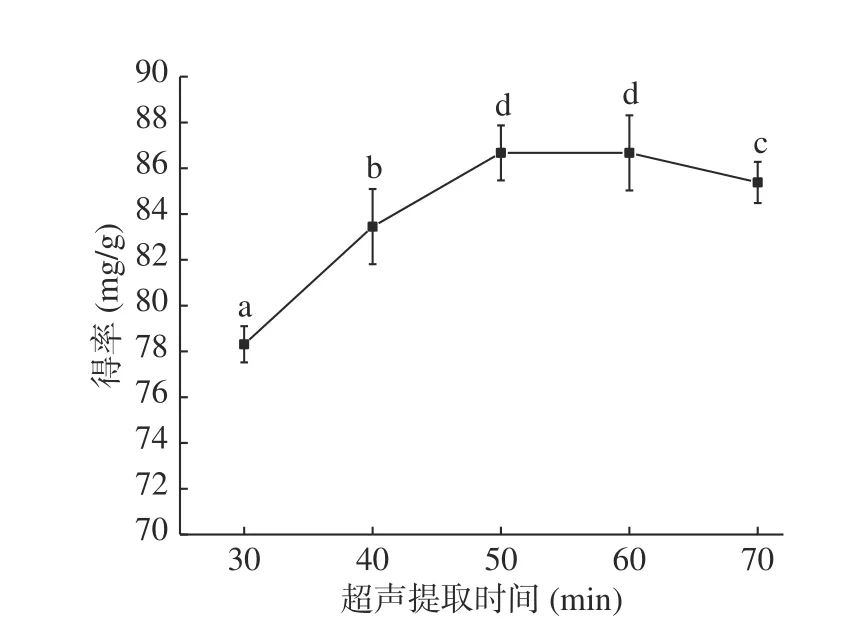
图3 超声时间对黄酮提取的影响Fig.3 Effect of ultrasonic time on extraction of flavonoids
2.1.4 超声功率对无籽刺梨果渣黄酮提取的影响图4 可知,在150~300 W的超声功率范围内,随超声功率的增大,黄酮得率逐渐增加,超声功率300 W时黄酮得率达到最大,为83.77 mg/g;当超声功率大于300 W时,黄酮得率显著(P<0.05)降低。原因为超声功率较弱产生的机械及空化效应对细胞壁的破坏程度小,黄酮得率低;而较强的超声功率产生的空化效应和机械波动效应可增强细胞壁破坏的作用,提高黄酮得率;功率过大,超声热效应产生大量热量使活性成分结构破坏,也有学者认为较高的超声功率产生强大的机械振动作用,使提取剂流动加快导致超声波的停留时间减小,同时空化作用增强后产生的大量无用空化泡会增加超声波的散射衰减,得率降低[26]。因此,超声功率选择300 W为宜。
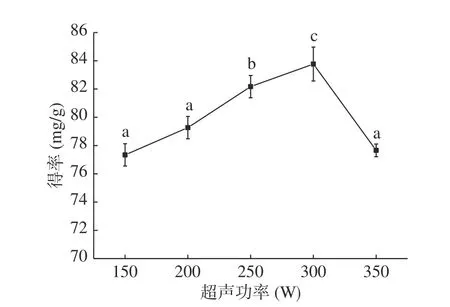
图4 超声功率对黄酮提取的影响Fig.4 Effect of ultrasonic power on extraction of flavonoids
2.1.5 酶解时间对无籽刺梨果渣黄酮提取的影响 由图5 可知,黄酮得率在酶解时间20~40 min内随酶解时间的增大逐渐增大,40 min时达到最大值,为81.84 mg/g;当酶解时间超过40 min,黄酮得率显著(P<0.05)下降。原因为酶解时间过短,纤维素酶对细胞壁的破碎不完全,黄酮未被有效提取;随酶解时间延长,细胞壁被充分破碎,黄酮被有效释放,黄酮得率增加;酶解时间过长,底物浓度不断降低或产物的积累对酶的活性有反馈抑制作用,酶促反应降低,黄酮得率降低[27]。因此,酶解时间选择40 min为宜。
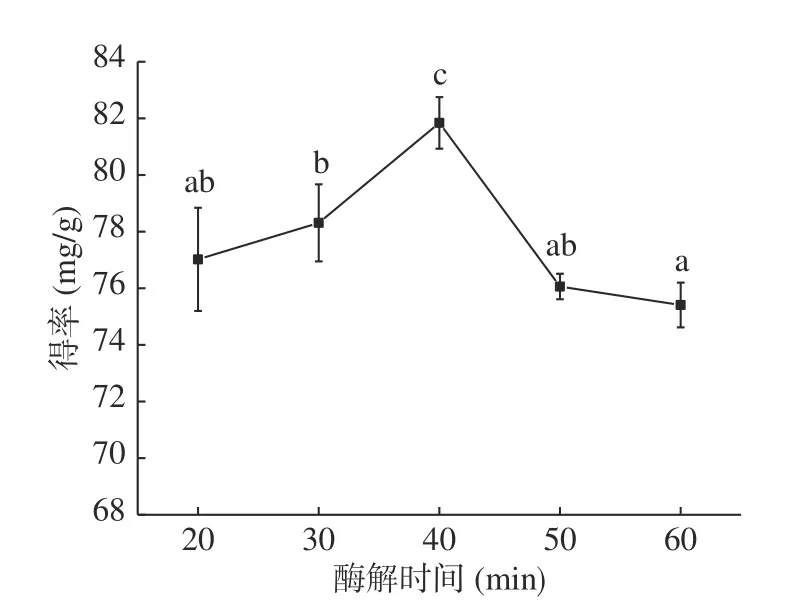
图5 酶解时间对黄酮提取的影响Fig.5 Effect of enzymolysis time on extraction of flavonoids
2.1.6 加酶量对无籽刺梨果渣黄酮提取的影响 由图6 可知,在加酶量0.0%~0.2%范围,随着加酶量的增加,黄酮得率逐渐增加,0.2%时黄酮得率最大,为84.09 mg/g,当加酶量大于0.2%,黄酮得率随加酶量的增加显著(P<0.05)减少。原因为添加纤维素酶可将纤维素水解成水溶性糖,使细胞壁水解破裂增加细胞通透性,促进黄酮向主体溶剂中扩散,提高黄酮得率[26]。然而,过量的酶添加量会使大量的酶附着在无籽刺梨果渣粉表面,堵塞黄酮的溶出通道,影响黄酮化合物的溶出,黄酮得率降低[28]。因此,选择加酶量0.1%、0.2%、0.3%三个水平进行响应面试验。
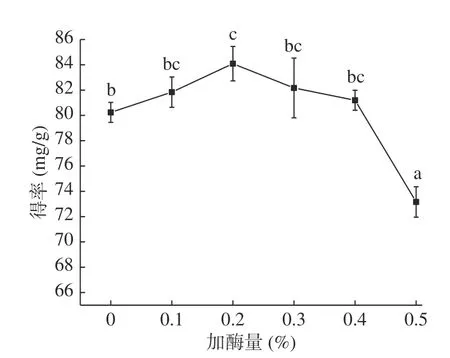
图6 加酶量对黄酮提取的影响Fig.6 Effect of enzyme dosage on extraction of flavonoids
2.2 响应面优化试验
2.2.1 响应面设计结果及回归模型方差分析 根据单因素实验结果,选择因素液料比(A)、乙醇浓度(B)、超声时间(C)、加酶量(D)为考察对象,无籽刺梨果渣粉中黄酮得率(Y)为响应值,采用软件Design-Expert.V8.0.6.1 对无籽刺梨果渣粉中黄酮提取工艺进行优化,表2 为响应面试验设计及结果。通过回归拟合得液料比、乙醇浓度、超声时间和加酶量分析模型的二次多元回归方程为:
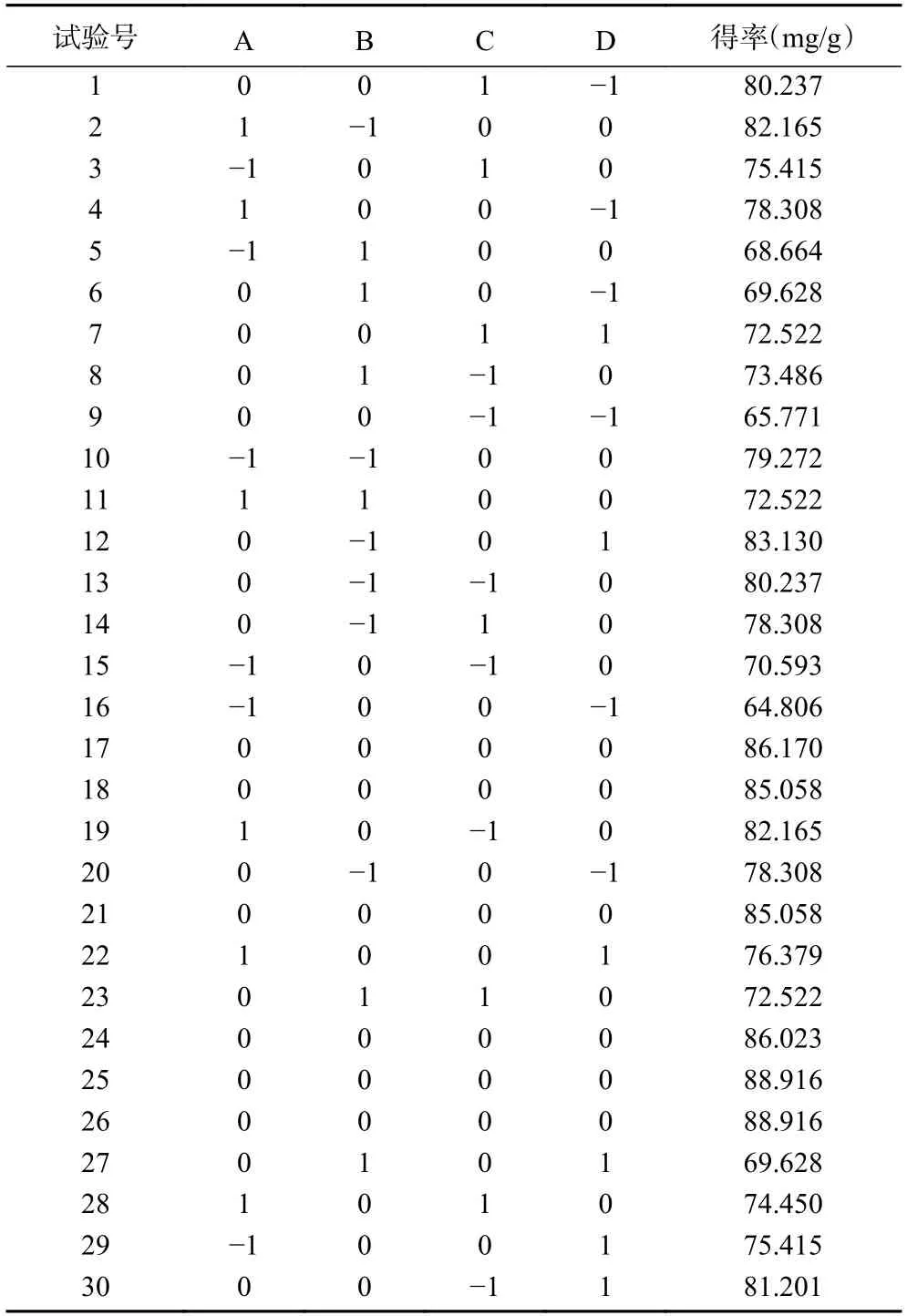
表2 响应面试验设计及结果Table 2 Test design and result of response surface methodology
Y=86.28+2.38A−4.37B−0.27C+1.97D−0.38AB−2.33AC−3.75AD−0.38BC−0.59BD−6.41CD−5.67A2−4.80B2−4.82C2−6.36D2
表3 为对回归方程进行方差分析的结果。由表3可知,模型中F=17.84,P<0.0001,模型差异极显著,方程与实际情况拟合良好,能反应黄酮得率与各因素之间的关系。失拟项F=1.79,失拟项差异不显著(P=0.2702>0.05),表明模型与试验因素拟合较好,可用该模型和方程优化无籽刺梨中黄酮的提取工艺。决定系数R2为0.9434,在响应面方差分析中,该值越大,表明实际值与模型预测值之间的相关性越高。各因素对黄酮得率的影响可用F值判断,F值越大,影响作用越强[29−30]。模型结果表明,因素液料比、乙醇浓度和加酶量对无籽刺梨果渣中黄酮得率影响均显著(P<0.05),影响无籽刺梨果渣中黄酮提取的因素顺序为:乙醇浓度>液料比>加酶量>超声时间。交互因素AD、CD以及二次项A2、B2、C2、D2均显著(P<0.05)。变异系数(C.V.)值越小,试验可靠性越高,本试验中C.V.=2.85%,表明试验结果可靠。精密度=12.907>4,表明试验可靠。

表3 响应面二次模型方差分析Table 3 Analysis of variance of response surface quadratic model
2.2.2 因素交互作用 响应面图形是通过Box-Behnken试验得到的多元二次回归模型所作三维空间(3D)的曲面图。在其他试验因素固定不变情况下,考察交互项对响应值的影响,其可直观反应因素间的交互作用。各因素对无籽刺梨果渣中黄酮得率影响的大小可通过响应面3D图曲面图陡峭程度判断,曲面越陡峭,影响越大,反之则越小。图7 为各因素交互作用对黄酮得率影响的3D图曲面图,交互作用项液料比和加酶量与交互作用项加酶量和超声时间的3D图曲面较其它交互作用项更陡峭,表明两组交互作用项对无籽刺梨果渣中黄酮得率的影响均显著,这与表3 方差分析中回归模型系数显著性检验结果一致。根据表3 的分析结果,各交互因素对无籽刺梨果渣中黄酮得率影响程度排序为:CD>AD>AC>BD>AB=BC。研究建立的模型具有最大值,根据模型拟合的结果,酶-超声提取无籽刺梨果渣中黄酮较优提取工艺为液料比42 mL/g、乙醇浓度55%、超声时间48 min、加酶量0.2%,在此条件下黄酮的得率预测值为87.78 mg/g。为验证响应面试验结果是否可靠,根据得到的优化条件选择液料比42 mL/g、乙醇浓度55%、超声时间48 min、加酶量0.2%提取无籽刺梨果渣中的黄酮,进行3 次平行试验,提取黄酮得率为87.52 mg/g,此结果与模型预测值相差0.26 mg/g,模型重复性较好,基于响应面试验所得优化工艺参数具有可靠性。
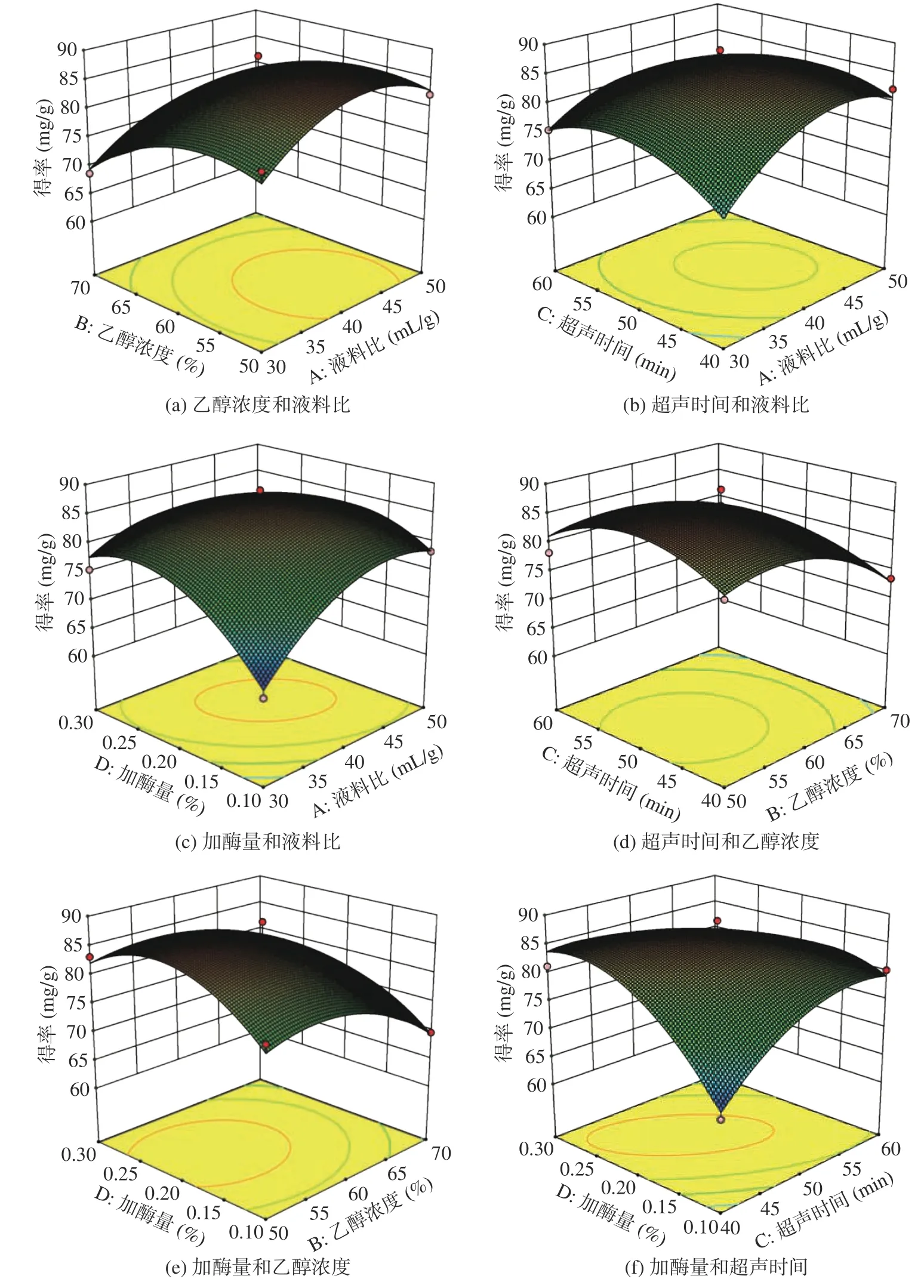
图7 各因素交互作用对黄酮得率影响的响应面图Fig.7 Surface graph of the effect of interaction on the yield of flavonoids
2.3 无籽刺梨果渣中黄酮抗氧化活性
2.3.1 清除DPPH·能力 图8 为无籽刺梨果渣黄酮和VC对DPPH·清除率,由图8 可知,在浓度0.005~0.02 mg/mL范围内,VC对DPPH·清除率随浓度升高显著(P<0.05)上升(43%~96%),当VC浓度大于0.02 mg/mL后,VC对DPPH·的清除率维持在95%~96%,各浓度间清除率无显著差异(P>0.05)。VC对DPPH·清除率EC50值为0.00628 mg/mL;在浓度0.005~0.05 mg/mL范围内,无籽刺梨果渣黄酮对DPPH·清除率显著(P<0.05)上升(18%~92%),当浓度大于0.05 mg/mL,黄酮对DPPH·的清除率为93%~94%,各浓度间清除率无显著差异(P>0.05),其对DPPH·的EC50值为0.0139 mg/mL,该值小于10 mg/mL,表明无籽刺梨果渣中黄酮有较好的抗氧化活性。周艺等[31]研究刺梨茶中总黄酮对DPPH·清除率EC50为0.01227 mg/mL,结合本试验,刺梨果渣中黄酮对DPPH·清除率略低于刺梨茶中黄酮,原因为在刺梨经加工成果渣过程,活性物质受不同程度损伤,抗氧化活性降低。
2.3.2 清除·OH能力 ·OH是对生物体危害最大的一种自由基,能使蛋白质、核酸、糖类等物质发化生氧化和损伤,导致细胞坏死或突变,与衰老、肿瘤和细胞吞噬等作用有密切联系[32]。图9 为无籽刺梨果渣黄酮和VC对·OH清除率,由图9 可知,随浓度增加,黄酮粗提物和VC对·OH清除率均呈显著(P<0.05)上升趋势,在浓度0.05~0.4 mg/mL范围内,无籽刺梨果渣黄酮对·OH的清除率高于VC;在浓度0.8~1.6 mg/mL范围内,无籽刺梨果渣黄酮对·OH的清除能力略低于VC。无籽刺梨果渣黄酮对·OH清除率的EC50值为0.30788 mg/mL,VC对·OH清除率的EC50值为0.32076 mg/mL,根据EC50,无籽刺梨果渣黄酮对·OH的清除率略高于VC。
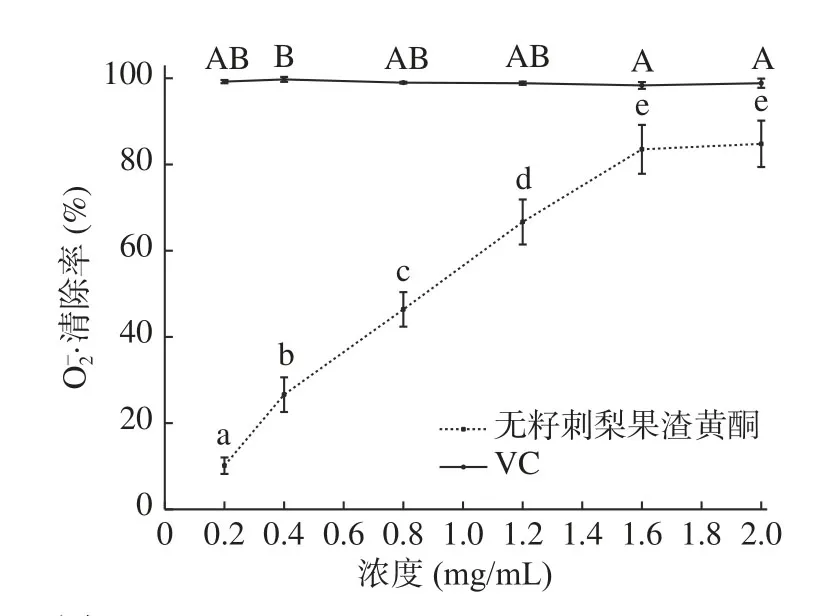
图10 无籽刺梨果渣黄酮和VC对清除率Fig.10 Scavenging effect of flavonoids from Rosa sterilis pomace and VC on
2.3.4 还原力 具有还原力的物质能够将Fe3+还原为Fe2+,Fe2+再与三氯化铁反应生成普鲁士蓝,生成物在700 nm波长处有最大吸光度,因而700 nm波长处吸光度大小反映了总还原力的强弱,吸光度越大,则样品还原力越强[32,34]。图11 为无籽刺梨果渣黄酮粗和VC的还原力能力,由图11 可知,无籽刺梨果渣黄酮和VC的还原力随浓度增大显著(P<0.05)增强。在浓度0.02~0.06 mg/mL范围内,无籽刺梨果渣黄酮的还原力与VC相当,在浓度为0.06 mg/mL时,无籽刺梨果渣黄酮和VC对应的吸光度分别为0.77±0.01、0.73±0.04。随着浓度升高,无籽刺梨果渣黄酮的还原能力不及VC,且VC还原力随浓度的升高显著(P<0.05)下降,原因可能为浓度0.3 mg/mL时,反应体系中Fe3+被全部还原,继续增大VC浓度,过量的VC影响了生成物普鲁士蓝的颜色,导致吸光度下降。
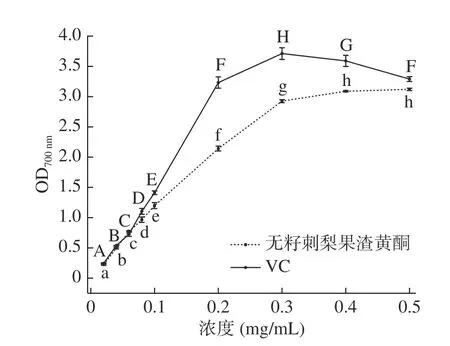
图11 无籽刺梨果渣黄酮和VC的还原力Fig.11 Reducing power of flavonoids from Rosa sterilis pomace and VC
3 结论
本文对酶-超声提取无籽刺梨果渣中黄酮影响因素进行单因素实验分析,采用Box-Behnken法优化无籽刺梨果渣中黄酮的提取工艺,得到最佳工艺参数:液料比42 mL/g、乙醇浓度55%、超声时间48 min、超声功率300 W、酶解时间40 min、加酶量0.2%。超声辅助酶法提取无籽刺梨果渣中黄酮得率达到87.52 mg/g,回归模型的实测值与预测值(87.78 mg/g)接近,模型可靠。抗氧化实验表明,无籽刺梨果渣中黄酮对DPPH·、·OH、均具有一定的清除能力,其对DPPH·、·OH、的EC50值分别为0.0139、0.30788、0.94291 mg/mL,还原力实验结果表明,低浓度下(0.02~0.06 mg/mL)的还原力与VC相当,浓度0.2~0.5 mg/mL范围内,其还原力不及VC,无籽刺梨果渣中黄酮可作为天然食品抗氧化剂应用。

