长江中下游麦区小麦低多酚氧化酶活性种质的初步鉴定
蔡瑾 杨继书 翟文玲 付必胜 张巧凤 吴纪中
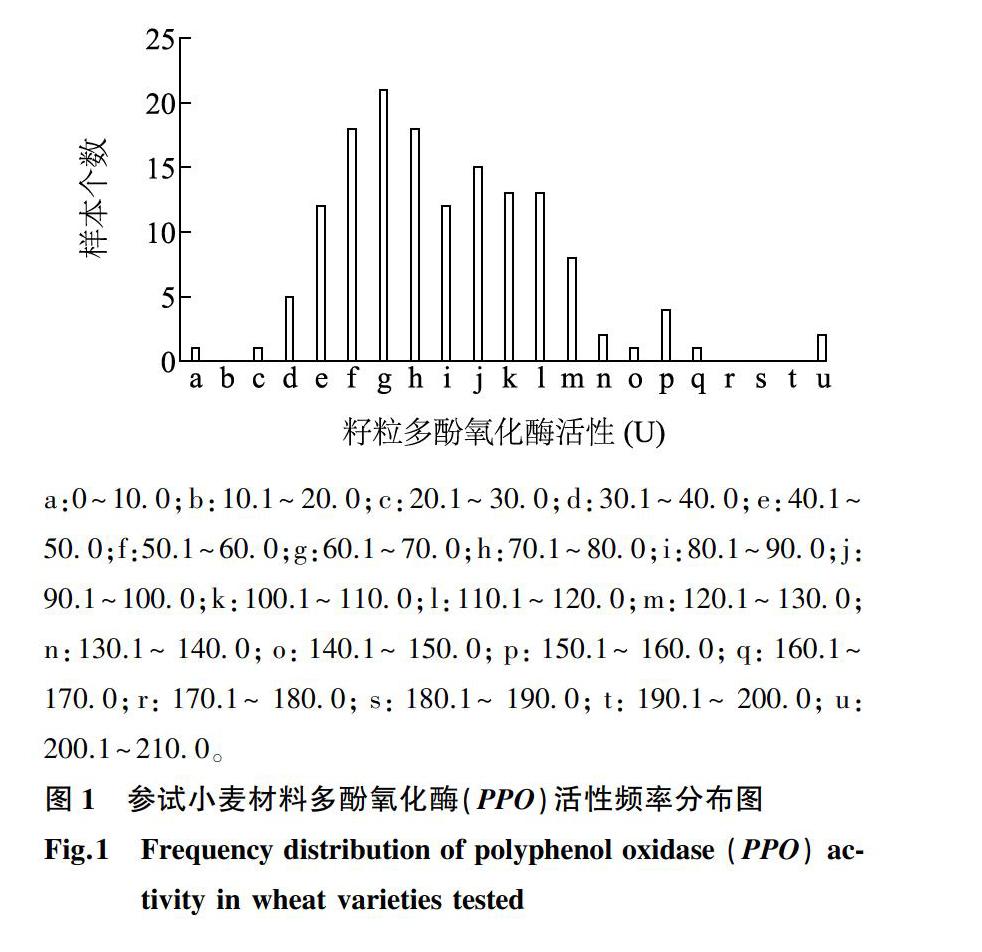

摘要: 选取145份长江中下游麦区小麦种质以及1份美国种质和1份意大利种质进行籽粒多酚氧化酶 (PPO)活性分析及2个主效基因等位研究。结果表明长江中下游麦区种质间籽粒PPO活性差异明显,具有很大的遗传改良潜力;运用2个PPO活性主效基因的功能标记检测上述147份种质,发现4种基因型PPO活性均值大小顺序为:Ppo-D1aPpo-D1aPpo-A1bPpo-A1b (L1L1L2L2) 关键词: 小麦;多酚氧化酶活性;种质资源 中图分类号: S512.102.4 文献标识码: A 文章编号: 1000-4440(2021)03-0545-10 Preliminary identification of wheat germplasm with low polyphenol oxidase activity in the wheat region of the middle and lower reaches of Yangtze River valley CAI Jin, YANG Ji-shu, ZHAI Wen-ling, FU Bi-sheng, ZHANG Qiao-feng, WU Ji-zhong (Institute of Germplasm Resources and Biotechnology, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China) Abstract: 145 wheat germplasms of the wheat region in the middle and lower reaches of the Yangtze River, an American germplasm and an Italian germplasm were selected for the analysis of grain polyphenol oxidase (PPO) activity and the study of two allelic variation of major genes. The results showed that, the grain PPO activities between different wheat germplasms of the wheat region in the middle and lower reaches of the Yangtze River varied obviously and had great potential in genetic improvement. After detecting the above 147 germplasms by two functional markers of major genes related to PPO activity, average PPO activities of four genotypes showed the following order: Ppo-D1aPpo-D1aPpo-A1bPpo-A1b (L1L1L2L2) Key words: wheat;polyphenol oxidase activity;germplasm 小麦面粉及面制品白度是小麦品质改良的重要评价指标。在面粉贮藏与面制品加工過程中,褐变现象非常普遍。褐变不仅会降低面粉或面制品的白度,而且会影响其营养价值[1]。小麦籽粒中高含量多酚氧化酶(PPO)是引起面团酶促褐变的主要原因[2]。在有氧条件下,PPO能够催化酚类底物形成醌,醌在植物体中进一步氧化聚合生成褐色色素,从而导致面团褐变[2-3]。小麦籽粒中PPO活性可以解释面团色泽稳定性的50%~70%[4]。因此,通过遗传育种途径降低PPO活性,对提升小麦面粉白度、保障食品安全具有重要意义。 小麦籽粒PPO活性是多基因控制的数量性状[5-6]。前人通过对多个不同遗传群体以及基因表达分析发现,控制小麦籽粒PPO活性的主效基因位于第2部分同源群染色体上,且2A染色体长臂(2AL)上的Ppo-A1对小麦籽粒PPO活性的影响要大于2D染色体长臂(2DL)上的Ppo-D1[7-12]。同时在其他染色体(例如3B、3D、4B和6B)上也定位到一些微效基因 [8-9,13-16]。国内外多位研究者报道了与PPO活性紧密连锁的分子标记。早在2005年,Raman等[9]利用小麦Chara/WW2449 DH(Double Haploid)群体鉴定出2AL上控制PPO活性的主效QTL的3个SSR标记,Xgwm294、Xwmc170和Xgwm312。Sun等[11]依据2A上PPO基因的DNA序列设计了STS标记PPO18,其685 bp(Ppo-A1a)扩增条带对应高PPO活性, 而876 bp(Ppo-A1b)对应低PPO活性,这个标记被认为是检测Ppo-A1基因的有效标记。He等[17]运用Ppo-D1基因的2个等位变异分别开发了互补显性STS标记PPO16和PPO29。王小波等[18]又运用2D上小麦籽粒PPO mRNA序列(AY15506)开发了功能标记STS01,可以作为PPO16的替代标记。近年来开发的与小麦籽粒PPO活性相关的功能标记还有位于2A上的PPO05[19]、 PPO30和PPO33[17]、F4[20]、WPPO-1[21]和PPO8[22],位于2B上的F8[23]、MG8和MG3[24],以及位于2D上的PPO43[17]和WPPO-2[21]。其中,Ppo-A1基因的功能性标记PPO18,Ppo-D1基因的功能性标记STS01与PPO16、PPO29可靠、 实用、高效,广泛应用于小麦分子标记辅助选择育种。 中国科研人员从本世纪初开始进行低PPO活性小麦种质资源的鉴定工作[21,25-27]。中国当前大面积推广品种的PPO活性普遍偏高,而低PPO活性种质严重缺乏,因此,低PPO活性种质的鉴定是新PPO基因发掘和低PPO活性小麦育种的前提与关键。目前,国内外众多学者已经鉴定出宁麦9号、CA9632、Funo、Lolo等一批低PPO活性的小麦种质[13,27-31]。本单位引自美国Idaho州农业试验站的小麦种质 IDO580籽粒PPO活性极低,比美国低PPO活性品种IDO377s、Lolo 以及Jefferson 低50%以上[32-33]。但是,前人对低PPO活性种质资源的筛选工作大多针对中国北方麦区或全国多个麦区的比较。本研究致力于对长江中下游麦区种质资源进行筛选,进一步发掘长江中下游麦区的低PPO活性小麦种质,为该麦区以及全国低PPO活性小麦育种提供新的亲本资源。 1 材料与方法 1.1 试验材料 参试材料共147份,包括长江中下游麦区各地收集的小麦种质145份以及1份美国种质和1份意大利种质(表1),由江苏省农业科学院种质资源与生物技术研究所种质资源评价与创新研究室保存与提供。 1.2 田间种植 147份参试材料种植于江苏省农业科学院六合试验基地,播种时间为2019年10月25日。每个材料种植5行,点播,行距0.25 m,行長2 m,每行均匀播种40粒,出苗后保证每行密度相同,田间管理同大田。 1.3 DNA提取及功能标记检测 基因组DNA的提取参照Saghai-Maroof等[34]的CTAB提取法。采用中国农业科学院作物科学研究所开发的Ppo-A1基因功能性标记PPO18[11]、Ppo-D1基因功能标记PPO16[17]和安徽农业大学开发的Ppo-D1基因功能性标记STS01[18]标记序列及扩增条件。所有引物由上海生物工程技术服务有限公司合成。 1.4 小麦籽粒PPO活性检测 采用多巴(L-DOPA/MOPS)为底物, PPO催化L-DOPA形成醌类物质,进而引起褐变。活性测定按照Anderson等[14]的方法,并略作修改。反应底物为现配的10 mmol/L L-DOPA (L-3,4-Dihydroxyphenylalanine, Sigma-Aldrich Co.)与50 mmol/L MOPS[3-(N-morpholino) propanesulfonic acid, Sigma- Aldrich Co.]缓冲液(pH6.5)。对每份材料设8个重复和1个空白对照,选取无破损、无病害的籽粒,称质量后放入酶标板中,每孔加入上述反应底物15 μl。在37 ℃条件下匀速振荡60 min后(100 r/min),在EPOCH微孔板分光光度计(BioTek Instruments, Winooski, VT, USA)475 nm处读取其吸光值。PPO活性值为△A/(60×m×10-3),其中 △A为样品吸光值与空白吸光值的差值,60为反应时间60 min,m表示单粒种子的质量(g)。数据处理及分析采用Excel和SAS9.2软件。 2 结果与分析 2.1 小麦种质间PPO活性的变异 参照Anderson等[14]方法对145份长江中下游麦区种质以及1份美国种质和1份意大利种质籽粒PPO活性进行了检测。结果表明,上述材料的籽粒PPO活性分布广泛(表1、图1),变幅在4.56 U到208.98 U之间,平均PPO活性为84.23 U,最高、最低PPO活性相差45.8倍,高于平均数的种质68份,低于平均数的种质79份,总体呈正态分布,峰值略偏向低PPO活性端。方差分析结果表明PPO活性在种质间的差异极显著(P<0.000 1),而各个种质重复之间的差异不显著(表2),说明该147份参试材料PPO活性的表型变异较为明显,而各种质重复之间的一致性较好。 基因型中L1表示Ppo-D1a等位基因,H1表示Ppo-D1b等位基因,L2表示Ppo-A1b等位基因,H2表示Ppo-A1a等位基因。鄂麦6号、华1151、苏夫、农丰125、苏麦198、扬辐麦2049、扬辐麦2330、望水白、矮苏麦3号、华麦9026、光明麦1319、剑子麦、白蒲(落青)13份材料未扩增出任何条带,表明这些材料可能为Ppo-D1a、Ppo-D1b、Ppo-A1b、Ppo-A1a以外的其他等位变异类型。 上述147份小麦种质的籽粒PPO活性差异很大,说明品种具有很大的改良潜力。种质籽粒PPO活性整体上呈正态分布,根据PPO活性平均值和标准方差(s)将147份小麦材料分为5组。以平均值84.23 U为界,PPO活性小于17.88 U(-3s)的只有1份,为极低PPO活性种质;PPO活性为17.88~51.05 U(-2s)的有18份,为低PPO活性种质(表3)。PPO活性为51.06~117.40 U(-1s~+1s)的有108份,为中等PPO活性种质;PPO活性为117.41~183.74 U(+2s~+3s)的有18份,为高PPO活性材料;PPO活性高于183.74 U(+4s)的种质有2份,为极高PPO活性种质(表3)。 2.2 PPO基因分子标记检测结果与等位基因分析 利用Ppo-A1基因的功能标记PPO18[11]和Ppo-D1基因的功能性标记STS01[18]、PPO16 [17]对147份种质进行基因检测。其中,STS01(图2b)与PPO16(图2c)互为替代,为显性标记。STS01与PPO16标记分别在560 bp和713 bp处扩增出一条低PPO活性条带的为Ppo-D1a等位基因,而无条带扩增的则为Ppo-D1b等位基因,分别以L1和H1表示;PPO18(图2a)为共显性标记,分别扩增Ppo-A1基因的Ppo-A1b(876 bp)和Ppo-A1a(685 bp)2种等位基因,分别以L2和H2表示。携L1等位基因的种质64份,平均PPO活性为72.83 U,携H1等位基因的种质70份,平均PPO活性为96.14 U,方差分析结果表明2种类型間差异显著(P<0.05)(图3a)。分别携L2和H2等位基因的种质为73和61份,平均PPO活性分别为69.02 U和104.13 U,方差分析结果表明二者差异显著(P<0.05)(图3a)。共13份材料未扩增出任何条带,即未含Ppo-D1a、Ppo-D1b、Ppo-A1b、Ppo-A1a等位基因。 通过基因标记对上述小麦种质进行检测,共出现L1L1L2L2、L1L1H2H2、H1H1L2L2、H1H1H2H2 4种基因型。计算不同基因型的PPO活性均值并进行多重比较,结果(表4、图3b)表明,不同基因型种质PPO活性均值的高低顺序为:L1L1L2L2 2.3 小麦种质等位基因的地区分布 对147份小麦种质进行了等位基因地区分布分析,种质分别来自湖北、湖南、江苏、上海、浙江、河南和安徽7个省(市),2份种质分别引自美国和意大利。因上海、河南2省(市)以及美国和意大利各自的样本量较少(<5份),本研究不进行比较分析。在Ppo-D1和Ppo-A1位点上控制低PPO活性的等位基因L1和L2,在供试种质中出现的平均频率分别为43.54%和49.66%,后者比前者高6.12个百分点。其中,L1等位基因的频率低于相对应控制高PPO活性的H1等位基因频率,而L2等位基因的频率高于H2等位基因。 在Ppo-D1和Ppo-A1位点的4种基因型中,L1L1L2L2的PPO活性最低,该基因型在湖北、湖南、江苏、浙江和安徽5个省份的参试材料中平均出现频率为26.19%,略高于4种基因型类型的平均值25.00%,其中,湖南省和浙江省的频率最高,为33.33%,其次是江苏省26.09%,而湖北省最低,为18.18%(表5)。 2.4 小麦低PPO活性种质资源筛选 在147份种质材料中,极低PPO活性种质IDO580的基因型检测为L1L1L2L2型,低PPO活性品种宁麦资69、阿夫、宁麦9号、扬辐麦2054、宁麦13、农丰88、鄂麦16、鄂恩1号和镇麦8号等基因型为L1L1L2L2,极高PPO活性品系铁秆麦选系和高山麦选系以及高PPO活性品种华麦2668、扬麦16、扬麦23、光明麦1307、中农28和华东3号等基因型为H1H1H2H2。上述材料,尤其是一些大面积推广的小麦品种PPO活性差异很大,变异范围广,表明这些品种的改良潜力很大,通过育种途径改善面粉及面制品的颜色褐变现象是可行的。例如,系谱中含有低PPO活性种质宁麦9号的小麦品种宁麦13、宁麦16、扬辐麦4号、扬辐麦2166、镇麦6号和宁麦资66等的PPO活性都相对比较低。系谱中含有极低PPO活性种质IDO580的小麦创新种质宁麦资69的PPO活性也极低。本研究筛选出IDO580、宁麦资69、阿夫、宁麦9号、扬辐麦2054、宁麦13和农丰88等13份L1L1L2L2基因型种质, PPO活性低于51.05 U,可以为小麦品质育种提供一批低PPO活性材料(表6)。 3 讨论 本研究通过对长江中下游麦区种质的PPO活性分析发现,当前该麦区生产应用的品种PPO活性差异极大,不同PPO活性的种质频次分布呈正态分布,峰值略倾向低PPO活性一端。然而当前大面积推广小麦品种,如镇麦9号、扬麦13、扬麦21、扬麦158、鄂麦9和鄂麦11等品种的PPO活性较高(>100 U),扬麦16和扬麦23等品种的PPO活性则高达150 U以上,说明中国长江中下游麦区当前大面积推广品种的PPO活性普遍偏高,急需导入低PPO活性基因,进行小麦面粉白度品质的遗传改良。前人报道的低PPO活性品种宁麦9号、阿夫和江东门等均为长江中下游麦区的种质。本研究中鉴定出的宁麦13、宁麦16、扬辐麦4号、镇麦6号、扬辐麦2166和宁麦资66的PPO活性相对较低或中等偏低,它们的系谱中都含有宁麦9号,而宁麦资69的系谱中含有引自美国的极低PPO活性种质IDO580,它的PPO活性仅为23.67 U。说明种质资源在新品种选育中非常重要。同时也说明有意识地利用低PPO活性种质可以降低小麦籽粒的PPO活性。目前,国内鉴定出的低PPO活性种质与国外引进的低PPO活性种质IDO580相比,其PPO活性普遍要高出8~9倍,因此在小麦低多酚氧化酶活性的遗传改良上,IDO580可能会有更好地利用前景。 本研究運用Ppo-A1与Ppo-D1基因的功能标记对145份长江中下游麦区小麦种质以及1份美国种质和1份意大利种质进行检测。结果表明: 携等位基因H1和L1种质PPO活性具有极显著的差异(P<0.000 1),携等位基因H2和L2种质PPO活性也存在极显著差异(P<0.000 1)。但是,携等位基因Ppo-A1b(L2)平均PPO活性(69.02 U)要低于携等位基因Ppo-D1a(L1)种质平均PPO活性(72.83 U)。因此,Ppo-A1和Ppo-D1这2个控制小麦PPO活性的主效基因中,Ppo-A1基因对小麦籽粒PPO活性的影响要大于Ppo-D1基因,此结果也印证了前人对Ppo-A1和Ppo-D1这2个基因的研究结果[7-12]。然而,L1L1L2L2基因型小麦种质的平均PPO活性虽然低至55.66 U,但是变幅较大(4.56~113.01 U),其中,IDO580的PPO活性仅为4.56 U,而湘1629和苏麦3号2个品种的PPO活性接近或高于100 U。相同基因型品种间PPO活性差异仍然较大,说明可能还存在其他影响小麦籽粒PPO活性的基因,因此仍需进一步发掘影响小麦PPO活性的新基因,并明确这些基因对小麦籽粒PPO活性的影响。本研究中发现的极低PPO活性的品种就是引自美国的IDO580,该品种的Ppo-A1基因的等位基因为L2,用STS01标记检测为无条带Ppo-D1基因的等位基因为Ppo-D1b(H1),然而,用PPO16标记检测结果为等位基因Ppo-D1a(L1)。因此,STS01标记与PPO16标记的检测结果并不完全一致,以这2个标记相互替换能够更加准确地检测Ppo-D1的等位基因。此外,IDO580的PPO活性极低,只有公认的低PPO活性种质宁麦9号PPO活性的1/9,说明该种质可能存在其他未经报道的主效基因或等位变异,值得进一步研究。 通过对PPO活性基因等位基因的检测,发现等位基因频率在不同省份间的差异较大。低PPO活性等位基因Ppo-D1a(L1)和Ppo-A1b(L2)出现的频率范围均为33.33%~60.00%,L1、L2同时出现的频率范围为18.18%~33.33%。因此,在培育低PPO活性小麦品种(系)中,不同省份在选育策略上应该因地制宜。其中,安徽省品种中低PPO活性基因Ppo-D1a(L1)出现的频率最高(60.00%),其次是江苏省品种中Ppo-D1a(L1),频率为46.74%,比陈泠等[31]的报道低,而江苏省品种中低PPO活性基因Ppo-A1b(L2)出现的频率最高(54.35%),与陈泠等[31]的报道较为一致。长江中下游麦区当前大面积推广品种中L1L1L2L2基因型的比例仍然较低,PPO活性普遍偏高。在L1L1L2L2基因型的品种中,湖北省的分布频率最低(18.18%),其平均PPO活性高达94.57 U,说明该地区小麦品质改良尤其应加强对低PPO活性的选育。湖南、江苏和浙江3省的L1L1L2L2基因型频率高于湖北省,其平均PPO活性也相对较低,分别为83.37 U、82.57 U和80.41 U,说明长江中下游麦区应进一步挖掘新的籽粒低PPO活性基因,并加速这些基因的聚合,从而增强长江中下游麦区品种的白度品质。 虽然中国在本世纪初已经开始了小麦籽粒低PPO活性种质资源的筛选工作,但是,目前筛选的种质在小麦白度品质育种中仍然不足。本研究通过对长江中下游麦区145份小麦种质以及1份美国种质和1份意大利种质进行PPO活性与功能标记检测,初步筛选出了IDO580、宁麦资69、扬辐麦2054、宁麦13和农丰88等13份低PPO活性种质,其中,从美国引进的IDO580的PPO活性极低,丰富了国内低多酚氧化酶活性种质资源。 参考文献: [1] KRUGER J E, HATCHER D W, DEPAUW R A. Whole seed assay for polyphenol oxidase in Canadian prairie spring wheats and its usefulness as a measure of noodle darkening [J]. Cereal Chemistry, 1994, 71: 324-326. [2] MAYER A M, HAREL E. Polyphenol oxidases in plants [J]. Phytochemistry, 1979, 18:193-215. [3] TARANTO F, PASQUALONE A, MANGINI G, et al. Polyphenol oxidases in crops: biochemical, physiological and genetic aspects [J]. International Journal of Molecular Science, 2017, 18: 377. [4] KRUGER J E. Effects of flour refinement on raw Cantonese noodle color and texture [J]. Cereal Chemistry, 1994, 71:177-182. [5] MARTIN J M, BERG J E, HOFER P, et al. Allelic variation of polyphenol oxidase genes impacts on Chinese raw noodle color [J]. Journal of Cereal Science, 2011, 54:387-394. [6] BEECHER B S, CARTER A H, SEE D R. Genetic mapping of a new family of seed-expressed polyphenol oxidase genes in wheat (Triticum aestivumL.) [J]. Theoretical and Applied Genetics, 2012, 124:1463-1473. [7] 葛秀秀,張立平,何中虎,等. 冬小麦PPO活性的主基因+多基因混合遗传分析 [J]. 作物学报, 2004, 30(1):18-20. [8] 张立平,葛秀秀,何中虎,等. 普通小麦多酚氧化酶活性的QTL分析 [J]. 作物学报, 2005, 25(1):7-10. [9] RAMAN R, RAMAN H, JOHNSTONE K, et al. Genetic and in silico comparative mapping of the polyphenol oxidase gene in bread wheat (Triticum aestivum L.) [J]. Functional & Integrative Genomics, 2005,5:185-200. [10]BEECHER B S, SKINNER D. Molecular cloning and expression analysis of multiple polyphenol oxidase genes in developing wheat (Triticum aestivum) kernels [J]. Journal of Cereal Science, 2011, 53:371-378. [11]SUN D J, HE Z H, XIA X C, et al. A novel STS marker for polyphenol oxidase activity in bread wheat [J]. Molecular Breeding, 2005, 16:209-218. [12]NILTHONG S, GRAYBOSCH R A, BAENZIGER P S. Enzyme activity in wheat breeding lines derived from matings of low polyphenol oxidase parents [J]. Euphytica, 2013, 190:65-73. [13]DEMEKE T, MORRIS C F. Wheat polyphenol oxidase: distribution and genetic mapping in three inbred line populations [J]. Crop Science, 2001, 41:1750-1757. [14]ANDERSON J V, MORRIS C F. An improved whole-seed assay for screening wheat germplasm for polyphenol oxidase activity [J]. Crop Science, 2001, 41:1697-1705. [15]WATANABE N, TAKEUCHI A, NAKAYAMA A. Inheritance and chromosomal location of the homoelogous genes affecting phenol colour of kernels in durum wheat [J]. Euphytica, 2004, 139:87-93. [16]ZHAI S N, HE Z H, WEN W E, et al. Genome-wide linkage mapping of flour color-related traits and polyphenol oxidase activity in common wheat [J]. Theoretical and Applied Genetics, 2016, 129(2):377-394. [17]HE X Y, HE Z H, ZHANG L P, et al. Allelic variation of polyphenol oxidase (PPO) genes located on chromosomes 2A and 2D and development of functional markers for the PPO genes in common wheat [J]. Theoretical and Applied Genetics, 2007, 115:47-58. [18]王小波,马传喜,何克勤,等. 小麦2D染色体上多酚氧化酶(PPO)基因STS标记的开发与应用 [J]. 中国农业科学, 2008, 41(6):1583-1590. [19]WANG X B, MA C X, SI H Q, et al. Gene markers for grain polyphenol oxidase activity in common wheat [J]. Molecular Breeding, 2009, 23(1):163-170. [20]周志良,司红起,闫小燕,等. 小麦籽粒2A染色体PPO基因新分子标记的开发与应用[J]. 分子植物育种, 2011, 9(1):81-86. [21]常 成. 小麦及近缘种属籽粒硬度、多酚氧化酶性状的分子机理研究[D]. 北京:中国农业大学. 2005. [22]SUN Y, HE Z, MA W, et al. Alternative splicing in the coding region of Ppo-A1 directly influences the polyphenol oxidase activity in common wheat (Triticum aestivum L.) [J]. Functional & Integrative Genomics, 2011, 11: 85-93. [23]SI H, ZHOU Z, WANG X, et al. A novel molecular marker for the polyphenol oxidase gene located on chromosome 2B in common wheat [J]. Molecular Breeding, 2012, 30(3):1371-1378. [24]TARANTO F, MANGINI G, PASQUALONE A, et al. Mapping and allelic variation of Ppo-B1 and Ppo-B2 gene-related polyphenol oxidase activity in durum wheat [J]. Molecular Breeding, 2015, 35:80 [25]PARK W J, SHELTON D R, PETERSON C J, et al. Variation in polyphenol oxidase activity and quality characteristics among hard white wheat and hard red winter wheat samples[J]. Cereal Chem, 1997, 74:7-11. [26]葛秀秀,何中虎,杨 金,等. 我国小麦品种多酚氧化酶活性的遗传变异及其与品质的相关分析 [J]. 作物学报, 2003, 29(4): 481-485. [27]肖永贵,何心尧,刘建军,等. 中国冬小麦品种多酚氧化酶活性基因等位变异检测及其分布规律研究 [J]. 中国农业科学, 2008, 41(4): 954-960. [28]BAIK B K, CZUEHJOWSKA Z, POMERANZ Y. Comparison of polyphenol oxidase activities in wheats and flours from Australian and U.S. cultivars [J]. Journal of Cereal Science, 1994, 19: 291- 296. [29]马传喜,王晓波,司红起,等. 小麦多酚氧化酶活性的品种间差异及其遗传分析研究进展 [J]. 安徽农业大学学报, 2007, 34(3): 305-310. [30]何克勤,馬传喜,王晓波,等. 小麦低多酚氧化酶活性品种资源的筛选 [J]. 麦类作物学报, 2007, 27(4): 603-606. [31]陈 泠,高春保,朱展望,等. 小麦黄色素含量与多酚氧化酶活性相关基因的分子标记检测及分布差异 [J]. 湖北农业科学, 2017, 56(24): 4893-4898. [32]SOUZA E J, GUTTIERI M J, UDALL J A. Registration of ‘IDO580 spring wheat germplasm [J]. Crop Science, 2005,45: 429-430. [33]ONTO S. Genetics of polyphenol oxidase (PPO) activity in wheat (Triticum aestivumL.) [D]. Nebraska, USA: University of Nebraska, 2011. [34]SAGHAI-MAROOF M A, SOLIMAN K M, JORGENSEN RA, et al. Ribosomal DNA spacer-length polymorphisms in barley: Mendelian inheritance, chromosomal location, and population dynamics [J]. Proceeding of National Academy Science, USA, 1984, 81:8014-8018. (责任编辑:张震林)

