水稻基腐病菌拮抗菌解淀粉芽孢杆菌E3菌株的鉴定及抑菌活性
梁丽琼,黄少莉,邵 杭,王庆伟,王 鑫,王俊霞,徐领会
(华南农业大学 群体微生物研究中心/广东省微生物信号与作物病害防控重点实验室,广东 广州 510642)
水稻基腐病是由玉米狄克氏菌Dickeya zeae引起的水稻重要病害之一[1-2]。该病在东南亚一些国家及中国的15个省水稻产区均有报道,近年来其在我国有不断蔓延和加重的趋势[3],是影响我国水稻生产安全的潜在威胁之一。培育抗病品种和喷施化学药剂是目前防控水稻基腐病的主要途径。水稻细菌性基腐病的发生流行快,容易错过最佳防治时间,导致防治效果不佳[4]。同时化学农药的普遍使用和用量增加也带来了一系列问题,包括病原细菌抗药性增强和环境污染等。近年来有关生防菌防治植物病害的报道方兴未艾,生防菌已成为植物病害生物防治的研究热点[5]。绝大多数芽孢杆菌属细菌是非致病菌或益生菌,其广泛栖息在自然环境中。该属约5%~8%的基因合成次生代谢产物,产生几十种拮抗其他病原菌的活性物质,并具有促进植物生长的作用[6],有关芽孢杆菌防治水稻细菌性基腐病的研究鲜见报道。芽孢杆菌分泌的抗菌物质主要有脂肽类化合物[7]、挥发性化合物[8]和抗菌蛋白[9]
1 材料与方法
等。研究表明芽孢杆菌产生的 Fengycin 类和 Iturin类家族的脂肽类化合物在抑制真菌病害中起着重要作用[10]。Cho 等[11]研究表明,枯草芽胞杆菌KS03产生的主要抗菌化合物Iturin A 能有效抑制炭疽病菌生长,具有强抗真菌活性。研究表明F engycins能破坏病原真菌菌丝的超微结构,Fengycins 处理后,真菌细胞膜表面的张力降低,形成微孔,细胞壁遭到破坏[12-13]。Surfactin是一类强大的生物表面活性剂,能诱导植株产生系统抗性[14-15]。Cawoy等[16]研究发现,枯草芽孢杆菌S499产生Surfactin的能力与其产生诱导抗性物质能力、对灰霉病Botrytis cinerea的抵御能力均呈正相关。目前有关水稻基腐病生防菌的研究报道很少,开展对解淀粉芽孢杆菌抗菌物质机理的研究可以为水稻基腐病菌的生物防治提供新的资源,为研制和发掘新型抗菌药物提供理论基础。
本研究从柑橘根际土壤中筛选和鉴定1株拮抗水稻基腐病菌Dickeya zeaeEC1生长的Bacillus amyloliquefaciensE3菌株,对其抑菌谱、生防能力、次级代谢产物进行研究,为该菌株的进一步开发应用奠定基础。
1.1 材料
Dickeya zeaeEC1 菌株[17]由华南农业大学群体微生物研究中心张炼辉老师课题组馈赠。黑曲霉Aspergillus niger、黄曲霉Aspergillus flavus、茄病镰刀菌Fusarium solani、雪腐镰刀菌Fusarium nival、洋葱伯克氏菌Burkholderia cenocepaciaH111、香蕉基腐病菌Dickeya zeaeMS1、柑橘溃疡病菌Xanthomonas citripv. citri菌株jx-6、水稻基腐病菌Dickeya zeaeEC1、茄科劳尔氏菌Ralstonia solanacearumGMI1000、大肠埃希菌Escherichia coliDH5α均由群体微生物研究中心实验室保存。
NYD 培养基:牛肉膏 8 g/L,酵母提取物 3 g/L,葡萄糖 1 g/L;YPG 培养基:酵母提取物 10 g/L,蛋白胨 20 g/L,葡萄糖 20 g/L;YPD 培养基:酵母提取物 10 g/L,胰蛋白胨 20 g/L,葡萄糖 20 g/L;YSB 培养基:蔗糖 20 g/L,酵母提取物 20 g/L,牛肉膏 15 g/L,MgSO4·7H2O 0.06 g/L,FeSO4·7H2O 0.009 g/L;BYP 培养基:牛肉膏 5 g/L,蛋白胨 10 g/L,酵母提取物 5 g/L,葡萄糖 10 g/L,NaCl 5 g/L;LB 培养基:酵母提取物 5 g/L,蛋白胨 20 g/L,NaCl 20 g/L,固体培养基则在1 L LB液体培养基的基础上加15 g琼脂粉。
Bio-RAD C1000 Touch PCR 仪 (美国 Biorad公司生产),G154DWS立式压力蒸汽灭菌锅[致微(厦门)仪器有限公司],LYNX 6000大型台式冷冻离心机 (美国 Thermo 公司生产),Waters 2998 制备型液相色谱(美国Waters世公司生产),Agilent 1260 infinity 高效液相色谱仪 (美国 Agilent公司生产),色谱柱为 Durashell C18 柱 (10 mm×250 mm×5 μm),多功能酶标仪 (BioTek 公司生产)。
1.2 方法
1.2.1 水稻基腐病菌拮抗菌株筛选D. zeaeEC1拮抗菌的筛选以水稻基腐病菌D. zeaeEC1为指示菌,该菌株全长基因组序列已在N C B I GenBank上公开,序列号为 NCBI Reference Sequence: NZ_CP006929 (https://www.ncbi.nlm.nih.gov/nuccore/NZ_CP006929.1),采用平板扩散法筛选拮抗菌株。将D. zeaeEC1单菌落接种于LB液体培养基,28 ℃、200 r/min 震荡培养至D600 nm约1.0时,以1∶100的体积比将D. zeaeEC1菌液加入约40 ℃的15 g/L的LB琼脂培养基内,混匀后每个培养皿内倒入15 mL的培养基,得到含D. zeaeEC1的LB固体培养基。
取湖南省1个柑橘园的根际土壤1 g加到10 mL无菌水中,以 28 ℃、200 r/min 振荡培养 30 min 后,用水稀释,稀释梯度为 10×、100×和 1000×,取 100 μL各梯度的稀释液涂布于已经配制好的含有D. zeaeEC1的LB固体培养板上。平板风干后放置于28 ℃培养箱内静置培养48 h后,选取有抑菌圈的单菌落划线于新的LB固体培养板上培养至长出单菌落,保存菌种用于进一步的验证。
挑取初筛得到的拮抗菌株单菌落,分别接种于含有200 μL LB液体培养基的96孔培养板中,置于 28 ℃ 摇床振荡培养 12 h 后,分别取 10 μL 菌液,加入含有D. zeaeEC1的LB固体培养皿中央的直径 5 mm 的孔内,28 ℃ 培养箱静置培养 24 h,检测是否有抑菌圈,并检测其直径大小。试验共筛选到产生抑菌圈的菌株19株,本研究选取其中抑菌圈最大,直径约20 mm的菌株为研究对象,保存该菌株,并命名为E3。
1.2.2 E3 菌株的形态、生理生化特征测定及 16S rDNA序列分析 将菌株E3划线到LB培养基上,28 ℃条件下培养24 h观察菌落形态。按照标准方法参照MS(i)/C005-C01[18-19],对菌株E3进行生理生化检测。测定的生化指标包括接触酶、苯丙氨酸脱氢酶、氧化酶活性等。
参照文献[20]的方法,以E3菌株基因组DNA 为模板,选用引物 F27 (5′-AGAGTTTGATCA TGGCTCAG-3′)和 R1492 (5′-TACGGTTA CCTTGTTACGACTT-3′),PCR 扩增 16S rDNA 基因片段。PCR 产物用DNA 凝胶回收纯化试剂盒纯化后,委托北京擎科生物科技有限公司测序。将所得序列通过NCBI数据库进行Blast同源性分析,并采用MEGA5.0软件构建系统发育树。结合菌落菌体形态及其生理生化特征,对E3菌株进行分类鉴定。
根据文献[21]的方法合成2对引物Bsu-man-1F:5′-CAGGCTCACACTTTGTCTTG-3′、Bsu-man-1R:5′-TGAACACAGTCCTGGGTTAG-3′和 Bamman-1F:5′-TCGGTTT CACATCCTTCATC-3′、Bamman-1R:5′-TTTGTCAGCGTGTCTTCTG-3′。引物由北京擎科生物科技有限公司合成。
1.2.3 E3菌株无菌培养液抑菌活性最优培养基的筛选 根据文献[22]的方法,筛选抑菌物质活性最优的培养基。配制了NYD、YPG、YPD、YSB和BPY 5种培养基。将E3接种到含有20 mL培养基的50 mL三角瓶中,28 ℃、200 r/min 培养 72 h。E3 培养液 8 000 r/min 离心 15 min,弃沉淀收集上清液,上清液用 0.2 μm的细菌过滤器过滤,吸取10 μL无菌培养液,采用琼脂扩散法测试抑菌活性,每种培养基重复3次,记录抑菌圈直径,用GraphPad绘制图表。
1.2.4 E3 菌株无菌培养液对D. zeaeEC1 侵染水稻种子能力的影响 采用纸培法[23]测定E3菌株对D. zeaeEC1侵染水稻种子能力的影响。选取健康饱满的水稻种子(‘金刚30’),用双蒸水冲洗4次备用。首先,准备9份水稻种子,每份包含30粒种子;其中8份用于接种D. zeaeEC1并分为接种对照组(4份)和接种试验组(4份),每组的4份种子进行相同的接种程序,分别用 1.4×106、1.4×105、1.4×104和 1.4×103CFU/mL 的D. zeaeEC1 菌液浸泡,在28 ℃条件下浸泡5 h后,用无菌水冲洗种子3次;另外1份用无菌水处理作为空白对照。将这9份种子分别置于垫有3~4张滤纸(无菌水湿润)的培养皿中,放入恒温培养箱,培养设置参数为:昼夜温度为 30 ℃/20 ℃,光照时间为 16 h。在保湿培养24 h 后,接种试验组的种子喷洒 2 mL 无菌 E3 培养液,使每一粒种子均匀覆盖培养液,接种对照组和空白对照则采用相同方法用YPG培养基处理。置于培养箱保湿培养每天观察种子萌发情况,4 d 后统计种子萌发情况,计算萌芽率。试验重复3次。
1.2.5 E3菌株分泌的脂肽类物质提取及活性测定 采用盐酸沉淀结合丙酮抽提的方法来提取脂肽类物质[24-25]。接种E3单菌落至500 mLYPG液体培养基,在 28 ℃、200 r/min 条件下,振荡培养 3 d。取E3 菌株 YPG 培养液,于 8 000 r/min 离心 15 min后,弃沉淀,取上清液,边搅拌边缓慢加入HCl,调整 pH 至 2.0,4 ℃ 条件下静置过夜。8 000 r/min 离心15 min,倒去上清液,收集沉淀物,用5倍体积的丙酮重悬后,8 000 r/min 离心 15 min,收集丙酮有机相,沉淀再次用丙酮重悬、离心,重复收集抽提液。混合2次丙酮抽提液,放置于通风橱内风干后,得到脂肽粗提物干粉。用甲醇溶解后,采用0.2 μm的有机滤膜过滤器除菌,得到E3脂肽粗提物溶液,采用Abbkine BCA蛋白定量试剂盒测量质量浓度。采用琼脂扩散法测定其抑菌活性。
1.2.6 E3菌株粗提脂肽类物质的抑菌谱测定 参照文献[26],采用平板对峙法测定E3菌株对真菌的抑菌活性。在PDA平板上选取适当的位置放置2块菌饼,在菌饼中间位置用5 mm的打孔器打孔,加 10 μL 粗提脂肽溶液,质量浓度为 5583.5 μg/mL,28 ℃条件下培养3~5 d后观测并记录有无抑菌带产生。细菌抑菌活性测试采用琼脂扩散法,测试粗提脂肽对大肠埃希菌、柑橘溃疡菌、水稻基腐病菌、茄科劳尔氏菌、洋葱伯克氏菌、香蕉基腐病菌的抑菌活性,在含有相应病原菌的LB平板上用5 mm的打孔器打孔,加10 μL粗提脂肽溶液,质量浓度为 5583.5 μg/mL,28 ℃ 条件下培养,观察有无抑菌圈产生。
1.2.7 E3菌株抑菌脂肽类物质的最小抑菌浓度(MIC)测定 挑取EC1单菌落于10 mL LB培养基中,28 ℃、200 r/min 培养过夜,将培养好的 EC1 菌液,按照1∶100的体积比接种到新鲜的LB培养基中,混匀后,取100 μL加入到96微孔板中。取100 μL 脂肽类溶液 (浓度为 5583.5 μg/mL)与微板孔的培养基混合均匀,梯度稀释从20到2−12,设置仅 200 μL LB 培养基和 200 μL 粗提脂肽类物质溶液为阴性对照,接种EC1的LB作为阳性对照,将96 孔板置于 28 ℃、200 r/min 的摇床中培养 24 h,用酶标仪测量D600 nm,记录数据并用GraphPad作图。
1.2.8 E3菌株抑菌脂肽类物质的分离纯化 脂肽粗提物经琼脂扩散法抗菌活性检测后,采用半制备型高效液相色谱 (美国 Agilent 1260 Infinity I 液相色谱系统)进行进一步的分离纯化。色谱柱为C18 柱 (5 μm×10 mm×250 mm),流动相 A:体积分数为0.1%的甲酸水溶液,B:乙腈;等梯度洗脱:V(A)∶V(B) = 20∶80;检测波长:UV 200~400 nm,流速:3 mL/min。每 5 min收集 1 管,共收集 8 个组分,浓缩后进行抑菌活性测定。
1.2.9 E3 菌株抑菌活性物质的鉴定 ESI-MS 技术是分析脂肽化合物复合体中各组分的相对分子质量及分子结构的有效工具。对于相对分子质量小于1 000的小分子,ESI-MS技术会产生[M+H]+或[M−H]−离子,选择相应的正离子或负离子形式进行检测,就可得到其相对分子质量[27]。本研究采用Thermo UPLC-Q Exactive Focus Orbitrap 液相质谱联用分析仪进行LC-ESI-MS分析,色谱检测条件:色谱柱:Waters HSS T3 柱 (2.1 mm × 100 mm ×1.8 μm);流速 0.3 mL/min,溶剂:流动相 A 为纯水(加体积分数0.1%的甲酸),流动相B为乙腈,洗脱程序为:0~15 min: 80%~100% B,15~20 min: 100%B。质谱检测条件:离子源:H-ESI, 喷雾电压 4.0 kV,鞘气流速:40 psi,辅气流速:10 psi,离子传输管温度:320 ℃;电离模式:Positive;全扫描模式,扫描范围m/z:850~2000。
2 结果与分析
2.1 水稻基腐病菌拮抗菌株的鉴定
采用平板抑菌法从湖南柑橘果园根际土壤中分离、筛选拮抗水稻基腐病菌生长的细菌,共筛选到19个菌株,其中,E3菌株抑菌圈直径最大,达20 mm,因此选其作为研究对象。E3菌株在LB平板划线,28 ℃条件下培养2 d后,菌落呈白色不透明、圆形、边缘不整齐,呈锯齿状、表面干燥、有褶皱(图1)。对该菌株进行生理生化分析(表1)发现,E3菌株接触酶、V-P试验和硝酸盐还原反应呈阳性,耐高盐,适宜生长的pH范围为5.7~6.8,可以利用柠檬酸和酪蛋白作为能量来源,并能够降解淀粉、明胶和酪素。
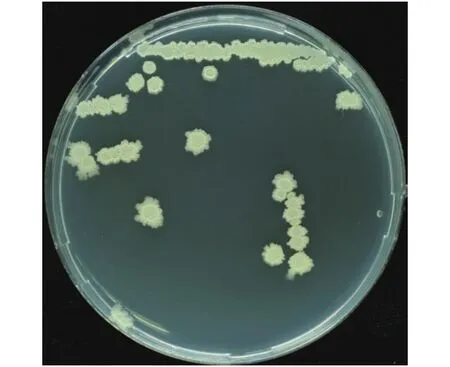
图 1 E3菌落形态图Fig. 1 Colony morphology of strain E3

表 1 水稻基腐病菌拮抗菌 E3菌株的主要生理生化特性Table 1 The main physiological and biochemical characteristics of Bacillus amyloliquefaciens E3 strain
对E3菌株的16S rDNA 序列进行相似性分析以及构建菌株亲缘关系发育树,发现该菌株与已公布的Bacillus amyloliquefacies(GenBank 登录号为MN756640.1)亲缘关系最近(图2)。进一步研究发现E3菌株基因组DNA可以扩增解淀粉芽胞杆菌而不是枯草芽孢菌特异的β-甘露聚糖酶基因片段(图3)。根据菌株的菌落表型、生理生化特征,结合16S rDNA 序列分析和特异扩增解淀粉芽胞杆菌β-甘露聚糖酶基因片段结果,确定菌株E3为解淀粉芽胞杆菌Bacillus amyloliquefaciens,并将该菌株命名为B. amyloliquefaciensE3,16S rDNA 序列已提交至NCBI,GenBank登录号为MW130122。该菌株于2017年12月7日保藏于中国武汉市武汉大学的中国典型培养物保藏中心(CCTCC),保藏编号为 CCTCC No:M 2017768。

图 2 依据16S rDNA序列构建的E3菌株系统发育树Fig. 2 The phylogenetic tree of E3 strain based on 16S rDNA sequence

图 3 β-甘露聚糖酶基因序列特异性扩增电泳结果Fig. 3 The electrophoresis results of specific amplification of β-mannanase gene sequence
2.2 B. amyloliquefaciens E3培养液产抑菌活性的最优培养基
芽孢杆菌可以分泌多种抗菌活性物质到胞外拮抗其他微生物的生长,而拮抗物质的表达分泌受外界环境条件的诱导和影响[28]。为确定E3产抑菌物质的最优培养基,通过比较E3无菌培养液抑菌圈的大小,从5种常用培养基中筛选了E3产抑菌活性物质最多的培养基(图4)。从图4可以看出,在营养丰富的YPG培养基中,E3菌株无菌培养液的抑菌圈最大,表明其分泌到胞外的抑菌活性物质最多,故选择YPG培养基培养E3菌株提取抗菌活性物质。

图 4 以无细胞上清液的抗菌活性为指标的培养基优化结果Fig. 4 Results of medium optimization based on the antibacterial activity of cell-free supernatant
2.3 B. amyloliquefaciens E3降低D. zeae EC1对萌发种子的侵染能力
在水稻种子的萌发阶段,水稻基腐病菌D. zeaeEC1可以成功侵染,造成种子萌芽腐烂,使种子萌芽率降低,甚至完全不萌发[29]。本研究开展了无菌E3培养液拮抗D. zeaeEC1侵染水稻种子的防效试验,以确定E3菌株是否可以降低D. zeaeEC1对萌发种子的侵染能力。水稻种子接种不同剂量的D.zeaeEC1,同时设置无菌水处理种子为空白对照;每一个浓度处理的试验组种子与无菌E3培养液混匀,而对照组则与等量YPG培养基混匀;种子置于昼夜温度分别为30、20 ℃的培养箱保湿培养4 d后,比较试验组与对照组的萌芽率。由图5可以看出,与空白对照相比,接种了1.4×105和1.4×104CFU/mL 的D. zeaeEC1 对照组种子萌芽率分别降低至20.0%和37.8%,而同时接种了无菌E3培养液对应剂量的试验组种子,萌芽率则大大提高,分别达到63.3%和85.6%,这表明无菌E3培养液可以显著降低D. zeaeEC1抑制水稻种子萌发的能力。这些结果表明E3菌株分泌到胞外的抗菌物质可以部分拮抗水稻基腐细菌D. zeaeEC1抑制水稻种子萌发的能力。

图 5 Bacillus amyloliquefacions E3菌株无菌培养液对Dickeya zeae EC1抑制水稻种子萌芽率的拮抗效果Fig. 5 Antagonism effect of the sterile culture medium of Bacillus amyloliquefaciens E3 strain on the inhibition of rice seeds germination by Dickeya zeae EC1
2.4 B. amyloliquefaciens E3抑菌活性物质及最小抑菌浓度(MIC)
采用盐酸沉淀后丙酮抽提的方法,提取E3无菌培养液中的脂肽类物质,用BCA蛋白定量试剂盒测得脂肽粗提物质量浓度为5583.9 mg/mL。对脂肽粗提物进行抑菌活性测定,以无菌培养液为阳性对照,以甲醇作为阴性对照,抑菌效果如图6所示。从图6可以看出,脂肽粗提物和无菌培养液均具有较强的抑菌活性,而对照甲醇没有活性,表明E3的抑菌活性物质主要为脂肽类物质。

图 6 Bacillus amyloliquefaciens E3菌株粗提脂肽的抑菌活性Fig. 6 Antimicrobial activity of crude lipopeptides extracted from Bacillus amyloliquefaciens E3 strain
为了测定E3抑菌脂肽粗提物的MIC, 将粗提脂肽(5583.5 μg/mL)以2的倍数进行梯度稀释从20到 2−12,与等量的D. zeaeEC1 混合加入 96 孔培养板内,振荡共培养24 h后利用酶标仪测定D600 nm。由图7可以看出,E3粗提脂肽质量浓度由1.36 μg/mL升到 174.48 μg/mL 时,D600 nm与阳性对照 (0 μg/mL+EC1)无显著差异,表明其不能抑制D. zeaeEC1的生长;而当浓度升高到348.97 μg/mL及以上时,D600 nm与阴性对照(LB培养基)无显著差异,表明其几乎完全抑制了D. zeaeEC1的生长。阴性对照LB培养基D600 nm为0,说明LB不存在其他微生物的污染。这些结果表明E3脂肽粗提物可以有效抑制D. zeaeEC1 的生长,最小抑菌浓度为 348.97 μg/mL。

图 7 Bacillus amyloliquefaciens E3菌株脂肽粗提物对Dickeya zeae EC1的抑制作用Fig. 7 Inhibitory effect of crude lipopeptides extracted from Bacillus amyloliquefaciens E3 strain against Dickeya zeae EC1
2.5 B. amyloliquefaciens E3抑菌活性物质抑菌谱
采用平板对峙法检测E3菌株对真菌的拮抗作用,采用琼脂扩散法检测E3菌株对细菌的拮抗作用。结果(图8)发现,除了抑制水稻基腐病菌D. zeaeEC1的生长外,E3脂肽粗提物也拮抗茄病镰刀菌、香蕉基腐病菌、柑橘溃疡病菌、茄科劳尔氏菌和大肠埃希菌的生长,但是对黑曲霉、黄曲霉、雪腐镰刀菌和洋葱伯克氏菌的生长则没有任何抑制作用。由此可见,B. amyloliquefaciensE3粗提脂肽类物质对多种植物细菌和真菌都有一定的抑制作用,具有广谱的抑菌活性。

图 8 Bacillus amyloliquefaciens E3菌株的抗真菌谱Fig. 8 The antimicrobial spectrum of strain Bacillus amyloliquefaciens E3 strain
2.6 B. amyloliquefaciens E3抑菌活性物质的HPLC分离纯化结果
为了进一步分离鉴定 E3分泌的拮抗D. zeaeEC1的主要抑菌活性物质的化学成分,将E3脂肽粗提物用高效液相色谱柱C18柱进行分离, 按时间收集各馏分,每5 min收集1管,共得到8个馏分,采用琼脂扩散法分别检测这8个馏分的抑菌活性。根据抑菌圈的大小来判断,发现馏分2 (5~10 min)和馏分5 (20~25 min)具有抗菌活性,而且抑菌活性成分主要集中在馏分5 (图9)。将馏分2和馏分5旋转蒸发浓缩,进行下一步的LC-MS分析。

图 9 HPLC 纯化分离抑菌物质各馏分活性检测图Fig. 9 Determination of antibacterial activity of each fraction isolated and purified by HPLC
2.7 B. amyloliquefaciens E3抑菌活性物质的LCESI-MS鉴定结果
收集具有抗菌活性的馏分2和馏分5,用LCESI-MS鉴定各馏分的主要化学成分(图10)。馏分2中检测到主要的分子离子峰[M+H]+为1435.77、1449.79、1463.80、1477.82 和 1491.83,相对分子质量相差14,恰好是一个亚甲基—CH2的相对分子质量。通过对比抗菌脂肽类化合物的理论相对分子质量,可以推测该组物质属于Fengycin类化合物(图10B)。在分析活性馏分5的质谱图时发现,其主要的分子离子峰 [M+H]+为 994.64、1008.66、1022.67、1036.69 和 1050.70,与脂肽物质Surfactin的相对分子质量相吻合,据此推断该组物质为Surfactin类化合物或者其同系物(图10D);另外馏分 5 还发现了 [M+H]+为 1058.67、1072.69、1086.70,它们属于 C15~C17 的 Iturin B 类化合物的质子加合峰。脂肽类抗生素质谱峰的分析参考陈华等[27]和 Vater等[30]研究。

图 10 馏分2和馏分5 的HPLC-ESI-MS分析Fig. 10 HPLC-ESI-MS analysis of fraction 2 and 5
根据以上质谱分析结果判断,馏分2的主要抑菌物质包括Fengycin A和Fengycin B,馏分5的主要抑菌物质包括Surfactin和Iturin类化合物。由此可以推断,B. amyloliquefaciensE3产生的主要抑菌物质为Fengycin、Surfactin和Iturin 3种脂肽类抗生素,且馏分5鉴定的Surfactin可能起主要的抑菌活性。至于是否还有其他的抑菌活性物质,还需进一步的验证分析。
3 讨论与结论
众多研究表明,许多根际土壤分离的微生物是根际促生菌 (Plant growth promoting rhizobacteria,PGPR),这类微生物在适应环境生长过程中分泌多种具有生物活性的次生代谢物,具有抗菌、竞争性抑制病原菌生长或诱导植物产生系统抗性等作用,有效拮抗病原菌的侵染,并能促进植物生长,可以作为生防菌防治植物病害,因而受到植物病理学家的广泛重视[31-32]。近年来,有关分离及鉴定根际促生菌并将其用于防治植物病害的研究日趋广泛和深入,逐渐成为生物防治领域的有效途径[33]。芽孢杆菌属Bacillus细菌是一种典型的根际促生菌,抗逆性强,能产生环状脂肽、聚酮类、挥发性化合物和抗菌肽等多种抑菌活性物质,具有很好的生防应用潜力[34]。解淀粉芽孢杆菌B. amyloliquefaciensFZB42是研究最深入的根际促生菌模式菌株,具有广谱抗性,已经在农业上广泛用于防治番茄、棉花、草莓和马铃薯等多种植物病害[35]。众多研究表明芽孢杆菌分泌的环状脂肽Surfactin、Fengycin 和Iturin不仅拮抗镰刀菌Fusarium、立枯丝核菌Rhizoctonia solani、海枣曲霉菌Aspergillus phoenicis、禾草离蠕孢菌Bipolaris sorokiniana等多种植物病原真菌生长,还具有诱导植物产生抗性的功能。Chowdhury等[36]研究表明,解淀粉芽孢杆菌 FZB42能够产生 Surfactin、Fengycin 和 Bacillomycin D,抑制立枯丝核菌的生长,在生菜遇到病原菌侵染时还能够介导植株产生防御性反应;向亚萍等[37]从解淀粉芽孢杆菌B. amyloliquefaciensB1619菌株发酵物中分离出3种脂肽类抗生素,其中,Bacillomycin L 和Fengycin是抑制番茄枯萎病菌Fusarium oxysporumf.sp.lycopersici生长的主要物质。Surfactin可以抑制丁香假单胞菌Pseudomonas syringae和多种黄单胞菌Xanthomonas等病原菌的生长[38]。Zeriouh等[39]发现2株枯草芽孢杆菌B. subtilisUMAF6614和UMAF6639 可以拮抗黄单胞菌Xanthomonas campestris pv.cucurbitae和果胶杆菌Pectobacterium carotovorumsubsp.生长,主要抑菌活性成分为Iturin。Cao等[40]分离得到贝莱斯芽孢杆菌B. velezensisY6 菌株,并发现该菌株分泌的Fengycin和Surfactin是抑制细菌性青枯菌Ralstonia solanacearum生长的主要物质,而Iturin则是抑制尖孢镰刀菌Fusarium oxysporum孢子萌发的主要物质。这些研究进展表明脂肽类物质在生物防治病原细菌方面有巨大的潜力。
玉米狄克氏细菌Dickeya zeae,异名为菊花欧文氏菌Erwinia chrysanthemipv.zeae,除感染水稻引起水稻基腐病外,还侵染玉米、马铃薯、香蕉等多种双子叶和单子叶植物,引起茎腐病和软腐病等多种细菌性病害,给农业生产造成严重的经济损失。Hadizadeh 等[41]发现黏性沙雷氏菌Serratia plymuthicaA3菌株可以拮抗Dickeya solani生长,可减轻马铃薯在低温贮藏过程中软腐病发病率,以及田间栽培过程中病原菌从母薯向子薯的传播。Chen 等[42]报道解淀粉芽孢杆菌B. amyloliquefaciensD2WM菌株能够抑制引起软腐病的D. chrysanthemi生长,并发现多酮类化合物 Macrolactin为其主要抑菌活性物质。Li等[43]筛选并鉴定了对Dickeya zeae有拮抗作用的3个菌株Pseudomonas fluorescensSC3、P. parafulvaSC11 和B. velezensis3-10,室内接种试验表明3个菌株均具有作为生防菌的潜力。本研究从柑橘根际土壤中筛选到1株拮抗水稻基腐菌的B. amyloliquefaciens菌株,鉴定并命名为E3。研究发现该菌株培养液可以有效降低水稻基腐病菌对水稻种子的侵染能力,其分泌的Surfactin、Fengycin和Iturin 3种脂肽类物质为主要抑菌活性成分。本研究结果进一步丰富了解淀粉芽孢菌拮抗植物病原细菌的资源库,也为防治水稻基腐病寻找安全、环保新型生物农药提供了新的依据。

