大豆GmPIN2b调控根系响应低磷胁迫的功能研究
刘国选,陈 康,陆 星,田 江,梁翠月
(华南农业大学 资源环境学院/根系生物学研究中心,广东 广州 510642)
大豆Glycine max是重要的粮油作物,在世界范围内广泛种植,为食品和畜牧业提供了重要的蛋白和油脂来源,也是生物柴油生产的主要原料[1-2]。我国南方水热条件充足,但土壤大多呈酸性,酸性土壤中磷的有效性低是限制大豆生产的重要因子[3-4]。研究发现改变根系形态构型是大豆适应低磷胁迫的重要机制之一[5-6]。低磷条件下,大豆根冠比、根长度、根毛密度以及侧根数量均显著提高。根系形态构型的这些变化,增加了植物根系与土壤接触的面积,促进了植株对土壤磷的吸收和利用[7]。另外,赵静等[8]研究表明,浅根型大豆品种的生物量、磷含量和产量均明显高于深根型大豆品种,说明浅根型大豆对耕层土壤磷的吸收效率更高。因此,根系的向重性反应对于植株利用土壤中异质分布的磷至关重要[9-12]。
生长素是植物根系形态建成中的重要调控因子[13]。前期研究显示,生长素的不对称分布在植物的根系生长和根系向重性反应中均起到了重要的调控作用[13-14]。植物的PIN(PIN-FORMED)基因家族是介导植物根系生长素不对称分布的重要因子[15]。模式植物拟南芥Arabidopsis thaliana的基因组中存在8个AtPIN同源基因[16]。其中,AtPIN2介导了生长素从根尖侧皮层细胞到根伸长区皮层细胞的极性运输[17]。研究显示,在拟南芥根系向重性反应的过程中,根尖细胞的AtPIN2蛋白发生不对称分布,使生长素在根系向地面的伸长区积累,抑制了向地侧伸长区细胞的伸长,最终导致根系生长弯曲,产生向重性反应[14, 18]。因此,AtPIN2突变后,突变体根部下侧的生长素分布受到抑制,根系的向地性功能明显缺失[19]。水稻、番茄、玉米、毛白杨、葡萄和桉树等植物的PIN2同源基因也有类似的保守结构或功能[20-23]。例如,水稻的同源基因OsPIN2可以回补拟南芥突变体Atpin2的表型缺陷,且OsPIN2的回补表达可以恢复突变体Atpin2在向重情况下根尖生长素的极性分布,说明OsPIN2通过影响根尖生长素的极性转运调控了根系生长夹角,在水稻根系的重力反应中起重要作用[20, 24-25]。
虽然关于PIN2基因在其他植物中的功能已取得较大的研究进展,但大豆中PIN2的同源基因是否也具有类似的功能,且是否参与了低磷胁迫对大豆根系形态建成的调控尚未清楚。因此,本研究首先对大豆GmPIN基因家族进行生物信息学分析;然后,选取与拟南芥AtPIN2同源性较高的GmPIN2b作为研究对象,利用实时荧光定量PCR测定该基因响应低磷胁迫的表达模式;进一步在拟南芥Atpin2突变体中回补表达该基因,并对转基因植株的生长和根系向重性进行分析。
1 材料与方法
1.1 材料
本试验采用的大豆材料为‘粤春03-3’,供试拟南芥为哥伦比亚野生型Col-0和Atpin2突变体CS8058。拟南芥Atpin2突变体由浙江大学生命科学学院毛传澡教授课题组惠赠。
1.2 试验方法
1.2.1 生物信息学分析 以 AtPIN2 氨基酸序列为参考,在植物基因组数据库Phytozome (http://www.phytozome.org/index.php)中通过BLAST比对获得拟南芥、大豆和水稻Oryza sativaL.等植物的PIN同源基因的氨基酸序列,再利用软件MEGA5.05的邻接法(Neighbor-joining method)生成进化树。在SOYBASE数据库(https://www.soybase.org/soyseq/)中获得GmPIN基因的组织表达数据,在已发表的大豆根系转录组测序结果[26]中获得不同磷处理条件下GmPIN基因的表达水平的数据,通过TBtools软件将这些数据制作成表达模式热图。
1.2.2 大豆低磷胁迫处理 挑选种皮无破损、大小均一的大豆种子,利用10%(φ)次氯酸钠溶液表皮消毒后,在沙子中萌发。待幼苗子叶张开,将幼苗转移至Hoagland营养液中进行不同磷水平的处理。其中,高磷处理的KH2PO4浓度为250 μmol/L,低磷处理的 KH2PO4浓度为 25 μmol/L。处理 3、6、12和15 d后,分析植株鲜质量、总根长和根冠比,其中根冠比的计算方法为地下部鲜质量与地上部鲜质量的比值;同时收取根系样品用液氮速冻后用于基因表达水平的测定。每个处理设4次重复。
1.2.3 大豆GmPIN2b基因的克隆 从 Phytozome数据库中获得大豆GmPIN2b(Glyma.17G057300)的CDS序列,根据该序列设计正向引物(ATGATC ACTGGTAAGGATATTTATG)和反向引物(TTAAACTCCAAGCAGCACGTA)。以大豆‘粤春03-3’根系cDNA为模板,扩增GmPIN2b基因,将所得的PCR产物连接T载体,测序验证,选取阳性克隆保存备用。
1.2.4 回补表达GmPIN2b的拟南芥Atpin2突变体材料的构建 以拟南芥根系基因组DNA为模板,设计正向引物(TATGACCATGATTACGAATTCG CCCCTAGACCAAAATAATATGG)和反向引物(CATAAATATCCTTACCAGTGATCATTTTGATT TACTTTTTCCGGC)扩增拟南芥AtPIN2基因,翻译起始密码子上游3 229 bp的启动子片段。以大豆根系cDNA为模板,设计正向引物(GCTACAAACCC TGCATTAACCATGATCACTGGTAAGGATATTT ATG)和反向引物(CCGGGTACCGAGCTCGAATTC TTAAACTCCAAGCAGCACGTA)扩增GmPIN2b基因编码框全长。将扩增产物进行凝胶电泳,利用琼脂糖凝胶DNA回收试剂盒(美基生物,上海)进行纯化回收。用SalI对目标载体pCAMBIA1300进行酶切,获得线性化的载体。用Exnase®Multis(诺唯赞生物,中国)将上述PCR纯化产物与线性化pCAMBIA1300进行多片段连接,转化大肠埃希菌,经过测序无误后抽取质粒转化农杆菌GV3101。
将GV3101平板划线活化,挑取单克隆接种于添加卡那霉素和利福平添加剂量均为10 μg/mL的10 mL YEP 培养液中,放置培养箱于 180 r/min、28 ℃条件下培养过夜。之后取3 mL菌液转入100 mL YEP 培养液中扩大培养,然后 5000 r/min离心10 min,收集菌体,用等体积的1/4MS培养液重悬菌体并加入0.02%(φ)SilwetL-77配成拟南芥转化液。利用花絮浸染法转化拟南芥突变体Atpin2,获得pAtPIN2::GmPIN2b回补表达的拟南芥转基因株系,T3代纯合后用于进一步试验分析。拟南芥AtPIN2基因的检测引物为At-F(正向引物):CCTTGCTTGGTCCCTTGTCT,At-R(反向引物):ATCGCAAACCCTGCTACTGA;pAtPIN2::GmPIN2b回补表达的拟南芥转基因株系的检测引物为 At-F1(正向引物):GTGCATGAACGACTA CAATGG,Gm-R1(反向引物):GAAAGAA G T G G A A C T G C G A A C;转基因拟南芥中GmPIN2基因表达水平的检测引物为Gm-F2(正向引物):GATTTCTATGCCATGTTCGCAA,Gm-R2(反向引物):CTCAATCAATTCGTGAACAGCT。
1.2.5GmPIN2b回补拟南芥Atpin2突变体表型和根系向重性的分析 将野生型、Atpin2突变体以及pAtPIN2::GmPIN2b转基因株系的种子表皮灭菌后,在1/2MS固体培养基中萌发。待幼苗根长至1.5 cm左右,将生长一致的幼苗转移到新的1/2MS固体培养基中进行不同磷水平处理。其中高磷处理含 KH2PO41 250 μmol/L,低磷处理含 KH2PO425 μmol/L;培养箱温度为 24 ℃;光周期为 16 h/8 h。磷处理8 d后,分析植株鲜质量、主根长和侧根数。另外,将长势一致的幼苗转移到新的1/2MS固体培养基中进行上述磷处理,然后将培养皿逆时针旋转90°放置,处理30 h后扫描植株根系,并用ImageJ(National Institutes of Health,美国)测定根系弯曲角度。每个处理设4次重复,每次重复8棵植株。
1.2.6 植物RNA的提取及反转录 取约0.1~0.2 g植物鲜样用液氮研磨,根据Trizol(Omega,美国)的说明书在样品中加入预冷的1 mL Trizol震荡混匀;再加入0.2 mL氯仿,震荡混匀后,室温静置5 min。离心后吸取0.5 mL上清液,往上清液中加入等体积的异丙醇,冰上静置后离心,所得的沉淀用75%(φ)乙醇溶液洗涤2次,沉淀风干后加入无RNA酶的灭菌水溶解RNA。用分光光度计(IMPLEN,美国)测定RNA浓度,然后参照反转录试剂盒(Promega,美国)说明书,合成cDNA第1链,反应结束后,−20 ℃保存备用。
1.2.7 实时荧光定量 PCR 设计GmPIN2b的定量PCR引物为F(正向引物):AATTGCATTGCCCATAA CCATACTC,R(反向引物):ATTTCCCTTCATC CACCCCGC;大豆看家基因GmEF1a的定量PCR引物为F(正向引物):TGCAAAGGAGGCT GCTAACT,R(反向引物):CAGCATCACCGTT CTTCAAA和拟南芥AtEF1a的定量PCR引物为F(正向引物):GTCGATTCTGGAAAGTCGACC,R(反向引物):AATGTCAATGGTGATACCACGC。将所得第1链稀释20倍做为定量PCR反应模板;适量原液做梯度稀释为标准曲线模板。定量PCR 反应体系:10 μL 2× Go Taq®qPCR master mix(Promega,美国);正向引物和反向引物各 0.4 μL;2 μL 模板;0.2 μL CXR Reference;补 H2O 至 20 μL。反应程序:95 ℃ 预变性 10 min;95 ℃ 15 s,58 ℃15 s,72 ℃ 1 min,40 个循环。反应结束后用实时荧光定量PCR仪(Thermo Fisher,美国)携带的Real-Time Analysis Software 6.0 计算每个样品的表达量。相对表达量为目的基因的表达量与看家基因表达量的比值。
1.2.8 数据统计与分析 本文所有数据均使用Microsoft Excel 2016(Microsoft Company,美国)和IBM SPSS Statistics V21.0(IBM SPSS,美国)进行处理及统计分析。利用TBtools软件分析基因的表达模式和制作基因表达模式热图。
2 结果与分析
2.1 大豆GmPIN的系统进化分析及组织表达模式分析
利用MEAG 5.05对大豆、水稻和拟南芥的PIN蛋白进行系统进化树的构建。进化树分析结果显示,拟南芥、水稻和大豆的PIN家族在进化树上可分为7个亚族(图1)。其中,大豆GmPIN2a和GmPIN2b与拟南芥AtPIN2位于同一亚族,二者相似性超过90%。对SOYBASE数据库中23个大豆GmPIN基因的组织表达水平构建表达模式热图,结果(图 2)显示,GmPIN1e、GmPIN3b、GmPIN1a和GmPIN1c等基因在各组织部位中均有较高的表达水平;而GmPIN2b、GmPIN2a与GmPIN5b等基因在根部的表达水平较高。

图 1 GmPIN系统进化分析Fig. 1 Phylogenetic analysis of GmPIN

图 2 GmPIN基因组织表达模式Fig. 2 Tissue expression pattern of GmPIN genes
2.2 低磷胁迫对GmPIN家族成员在大豆根系中表达模式的影响
利用已报道的大豆根系转录组数据[26],对低磷调控的19个GmPIN基因的表达模式进行了分析。结果 (图 3)表明,GmPIN9d、GmPIN8d、GmPIN8a、GmPIN2a与GmPIN2b这5个基因均受低磷胁迫上调表达,其中,低磷条件下GmPIN2b的表达量是高磷对照的 1.2倍;相反,GmPIN3d、GmPIN9b、GmPIN5a与GmPIN6b这4个基因受低磷胁迫下调表达,其中,GmPIN3d的表达水平在低磷条件下仅为高磷对照的50%;除此之外,其他GmPIN基因成员的表达水平不受低磷胁迫的影响。
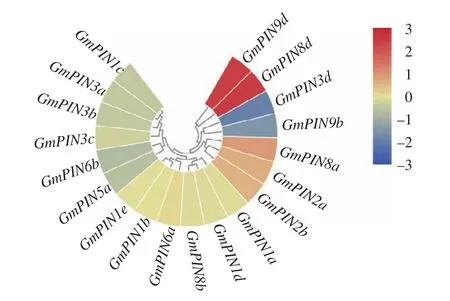
图 3 低磷胁迫下大豆根系中GmPIN基因表达模式Fig. 3 Expression pattern of GmPIN genes in soybean roots in response to low phosphorus stress
2.3 不同低磷胁迫时间对大豆生长和根系中GmPIN2b表达水平的影响
根据SOYBASE数据库中GmPIN同源基因的组织表达模式,选取在根组织(包括根和根瘤)中均有表达的GmPIN2b作为研究对象,进一步分析不同磷处理时间对该基因表达水平的影响。植物表型分析结果(图4)显示,低磷处理12和15 d后,与高磷对照相比,大豆单株鲜质量分别降低了11%和33%(P<0.01)(图4A);单株总根长分别为高磷对照的1.18和1.32倍(P<0.05)(图4B);根冠比极显著增加,分别为高磷对照的1.43和1.99倍(P<0.01)(图4C)。定量PCR结果显示,低磷处理6、12和15 d后,大豆根系中GmPIN2b的表达水平均显著上调,分别是高磷对照的4.19、1.77和1.93倍(P<0.05)(图 4D)。
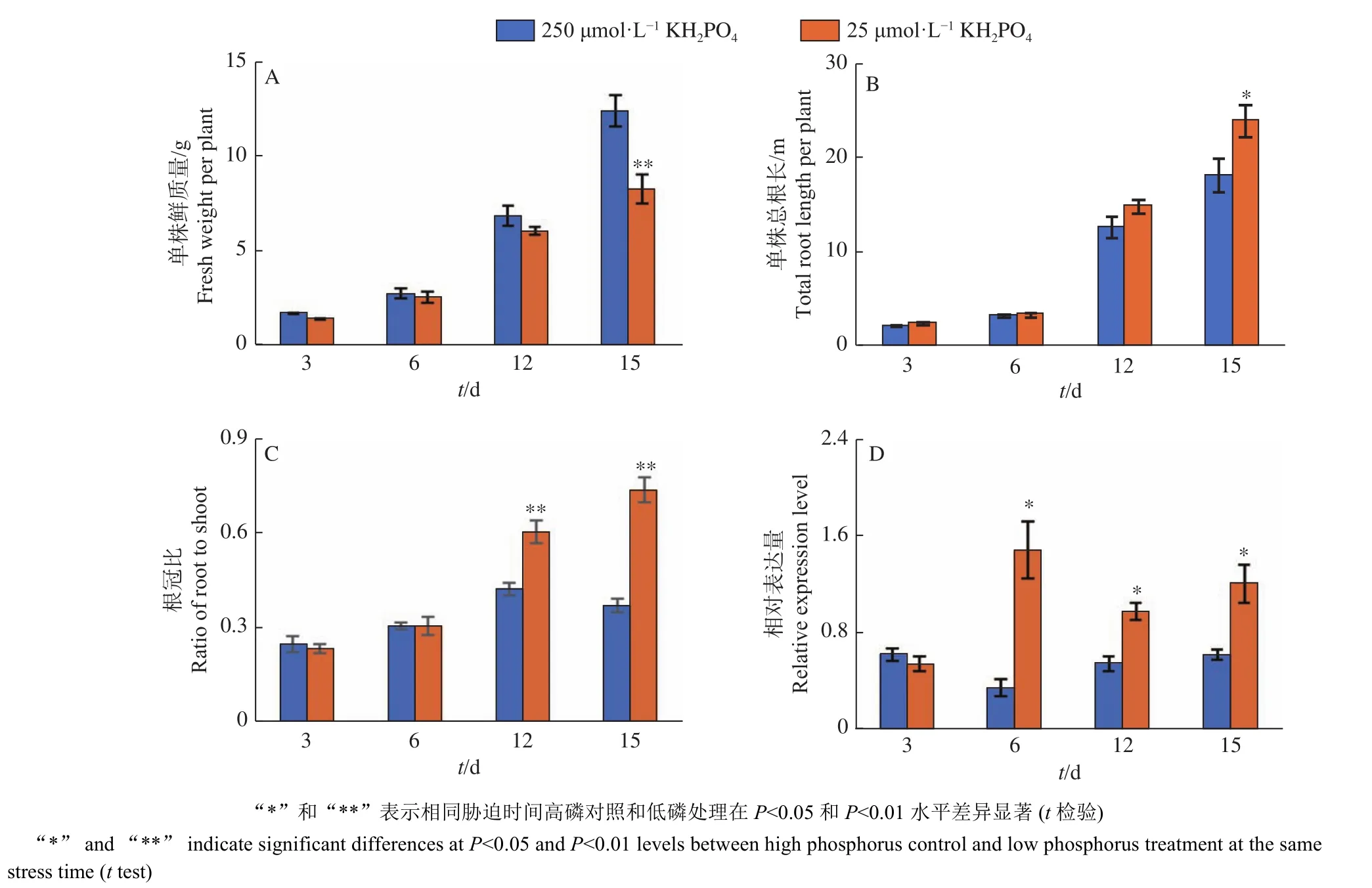
图 4 不同低磷处理时间对大豆生长和GmPIN2b表达水平的影响Fig. 4 Soybean growth and GmPIN2b expression level in response to different periods of low phosphorus treatment
2.4 转基因拟南芥检测
将拟南芥AtPIN2启动子与大豆GmPIN2b的编码区融合,构建了pAtPIN2::GmPIN2b表达载体,转化拟南芥突变体Atpin2,获得了回补表达GmPIN2b的转基因材料。对转基因材料进行了转基因鉴定和GmPIN2b表达水平的分析,结果显示,转基因材料扩增出pAtPIN2启动子融合GmPIN2b基因CDS的片段,表明GmPIN2b回补表达转基因材料为阳性植株(图5)。GmPIN2b在阳性株系RA1和RA2的根系和叶片中均有较高表达水平,与野生型相比呈显著差异(P<0.001)(图6)。

图 5 GmPIN2b阳性转基因植株的检测Fig. 5 Detection of GmPIN2b positive transgenic plants

图 6 拟南芥回补表达株系根系和叶片中GmPIN2b的表达水平Fig. 6 Expression levels of GmPIN2b in the shoots and roots of Arabidopsis complement expression lines
2.5 回补表达GmPIN2b对转基因拟南芥生长的影响
野生型、pAtPIN2::GmPIN2b转基因株系和Atpin2突变体等材料的种子在1/2MS培养基上萌发5 d后,进行不同磷水平的处理,8 d后对其单株鲜质量、主根长度和侧根数等进行分析。与高磷对照相比,低磷胁迫下植株较小,主根生长均受到明显抑制(图7)。结果显示,低磷条件下,无论是野生型还是转基因材料,单株鲜质量和主根长均比高磷对照显著降低(P<0.001)(表1)。无论在高磷还是低磷条件下,AtPIN2基因的突变均显著降低了拟南芥单株的鲜质量和主根长,而回补表达GmPIN2能够部分恢复Atpin2的鲜质量和主根长突变表型(图8A、8B)。其中,回补表达株系RA1和RA2的植株鲜质量在高磷和低磷条件下分别比突变体高27%、28%和18%、16%,其主根长度分别比突变体提高33%、39%和43%、18%。另外,低磷显著减少了拟南芥植株的一级侧根数(P<0.001)(表1)。但在高磷条件下,植株一级侧根数在不同材料之间无显著差别;在低磷条件下,Atpin2突变体的一级侧根数显著低于野生型,而回补表达GmPIN2b后,转基因株系RA1和RA2的一级侧根数均比突变体显著增加,分别为突变体的1.24和1.20倍(图8C)。

图 7 回补表达GmPIN2b对转基因拟南芥生长的影响Fig. 7 Effect of GmPIN2b complement expression on growth of transgenic Arabidopsis

表 1 不同磷处理和转基因回补表达对拟南芥生理指标和根系向重性影响的双因素方差分析Table 1 Two-way ANOVA of the effects of different phosphorus treatments and transgenic complement expression on Arabidopsis physiological indicators and root gravity

图 8 回补表达GmPIN2b对转基因拟南芥生长指标的影响Fig. 8 Effects of GmPIN2b complement expression on growth indexes of transgenic Arabidopsis
2.6 回补表达GmPIN2b对转基因拟南芥根系向重性的影响
将萌发了5 d、生长一致的幼苗转移到新的1/2MS固体培养基中进行不同磷水平处理,将培养皿逆时针旋转90°放置,处理30 h后观察拟南芥主根的弯曲角度。从拟南芥的表型可见,高磷条件下野生型根系的弯曲程度较大,突变体Atpin2较小;而低磷条件下,所有植株的根系生长均明显受阻,但野生型根系的弯曲程度较其他根系明显(图9)。拟南芥根系向重性受磷处理显著影响(P<0.05),在转基因回补表达株系间具有极显著差异(P<0.001)(表1)。无论在高磷还是低磷条件下,RA1、RA2和Atpin2的主根弯曲角度均显著小于野生型(图10)。高磷条件下,RA1和RA2主根弯曲的角度显著高于Atpin2,分别是Atpin2的2.33和2.10倍;而低磷条件下,回补表达株系的主根弯曲角度稍微高于Atpin2,差异不显著 (图 10)。

图 9 回补表达GmPIN2b对转基因拟南芥根系表型的影响Fig. 9 Effect of GmPIN2b complement expression on root phenotype of transgenic Arabidopsis

图 10 回补表达GmPIN2b对转基因拟南芥主根弯曲角度的影响Fig. 10 Effect of GmPIN2b complement expression on curvature angle of transgenic Arabidopsis
3 讨论与结论
生长素作为一种重要的生长调节激素参与植物根系的生长发育[13-14]。植物生长素输出载体PIN基因家族在介导植物生长素不对称分布、调控植株形态建成的过程中起着关键的作用。例如,拟南芥的基因组中存在8个PIN同源基因,这些基因参与拟南芥植株发育的重要调控过程,包括调控胚和花粉的发育以及维管组织的分化[27-28],介导生长素在茎尖分生组织的环流和从地上部到根系的极性运输[27, 29-30],调控细胞内生长素的动态平衡[28, 31],参与根的向重性生长等[19, 32]。本研究对大豆的PIN同源基因进行分析,发现大豆基因组中存在23个GmPIN同源基因,其中大豆GmPIN2b与拟南芥AtPIN2位于同一亚族,具有较高的相似性。AtPIN2参与了根系向地生长的调控[13-14],但是大豆GmPIN调控根系生长和向重性的功能未见报道。因此,本研究选取与AtPIN2较为相似的GmPIN2b作为研究对象,获得了回补表达GmPIN2b的拟南芥Atpin2突变体的转基因材料。该转基因材料能够部分恢复Atpin2突变体根系向重性的表型。该结果与前人的研究结果相似,例如,水稻OsPIN2可以回补突变体Atpin2主根的向重性功能缺陷,且OsPIN2的回补表达可以恢复Atpin2在向重情况下根尖生长素的极性分布[20]。GmPIN2b能够回补Atpin2突变体的根系向重性这一结果进一步说明了植物PIN2在调控植物根系向重性反应的过程中具有一定的功能保守性。
早期研究表明,植物根系形态构型的改变是植物适应低磷胁迫的重要机制[33]。本研究显示,低磷处理12 d后的大豆总根长高于高磷对照,这与前人的研究结果相同[12, 33],说明低磷胁迫条件下,大豆通过促进根系生长、提高植株根冠比,从而提高植株对外界环境磷的吸收和利用。另外,低磷胁迫显著提高了GmPIN2b在大豆根系的表达水平,回补表达GmPIN2b能够部分回补拟南芥Atpin2突变体的向重性。这些结果暗示了GmPIN2b介导的生长素不对称分布可能参与了低磷胁迫调控大豆根系生长的过程;因此,本研究观察了回补表达GmPIN2b的拟南芥Atpin2突变体在不同磷水平条件下根系的生长情况。研究发现无论高磷还是低磷条件下,与Atpin2突变体相比,回补表达GmPIN2b均明显增加了转基因植株的鲜质量和主根长;尤其是低磷条件下回补表达GmPIN2b显著提高了突变体的一级侧根数。最近有研究显示,油菜素甾醇促进PIN2蛋白从根尖到伸长区的积累,导致侧根数增加[19, 34],说明PIN2蛋白也参与了侧根发育的调控;因此,低磷条件下,大豆可能通过提高GmPIN2b的表达水平,改变主根尖生长素的向基运输以及侧根原基中生长素的浓度,从而参与低磷条件下侧根的发育。
综上所述,低磷胁迫提高了大豆根系中GmPIN2b的表达,回补表达该基因能够部分回补Atpin2突变体的生物量、侧根数和根系向重性;因此,GmPIN2b在根系形态建成响应低磷胁迫的过程中可能起着重要的调控作用。本研究结果为进一步揭示大豆根系适应低磷胁迫的分子机制提供了重要的理论依据。

