miR-21通过激活PI3K/Akt信号通路对缺氧诱导的大鼠心肌细胞活性的作用机制*
袁 媛,韩大鹏,朱永新
(1.上海城建职业学院健康与社会关怀学院 201415;2.上海光华中西医结合医院关节外科 200000;3.安徽省池州市人民医院心血管内科 247000)
缺氧缺血性心脏病是血管动脉狭窄或阻塞导致局部心肌组织血氧供应不足而产生心脏功能障碍的临床疾病[1]。研究表示,缺血缺氧性心脏病发病率、病死率逐年升高,机体动脉血流中断,局部损伤的心肌组织细胞出现凋亡,可促进心肌梗死[2]。目前,临床采用支架置入进行扩张血管,增加血氧供应,但是也增加心肌缺血再灌注概率,损伤心肌细胞。磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)信号通路是机体重要信号通路,磷酸化过程中产生转导蛋白,可调节心肌细胞生物活性[3]。以往文献研究表示,PI3K/Akt能够抑制线粒体凋亡,降低Bax活性,从而减少细胞凋亡,改善病情[4]。
近些年随着生物分子靶向技术的发展,已经了解miRNAs与缺氧缺血性心脏病存在关联性,可以根据miRNAs在疾病中表达水平的差异,发现其表达与心肌细胞凋亡及新生血管关系密切。文献证实,在缺血心肌梗死大鼠心肌组织中检测出多种miRNA水平异常,其中miR-214、miR-233表达升高,而miR-21水平降低,说明低表达miR-21对缺血缺氧心肌保护作用降低[5]。miR-21起初被认为具有加快癌细胞增殖扩散的作用,目前已经证实在心脏、肝脾及肠道组织中均有表达。研究证实,miR-21是心脏特异性小分子RNA,在成人心脏中表达较高,具有维持心脏生物功能的作用[6]。以往关于PI3K/Akt信号通路在缺血缺氧心肌细胞中的研究结果无一致性,并与miR-21之间的关系尚少见研究。因此,本文进行体外实验,观察miR-21调节PI3K/Akt对缺氧小鼠心肌细胞活性的作用机制,现将结果报道如下。
1 材料与方法
1.1 材料
1.1.1实验动物
SPF级SD鼠龄1~3 d的雌雄混合的小鼠购自上海弘顺生物,体重200~300 g,许可证号:SCXK(沪)2020-0002,在常温下湿度为55%,模拟黑白交替无菌饮食2周,实验要求符合《实验动物管理条例》规定管理规定,本次实验经复旦大学动物伦理委员会批准。
1.1.2主要试剂及仪器
miR-21拟似物(mimcs)和阴性对照(negative control,NC)、miR-21抑制物(inhibitor)均购自百奥生物技术(南通)有限公司;PI3K、P-PI3K;Akt、p-Akt均购自美国 Cell Signaling Technology公司;Lipofectamine2000购自美国Invitrogen公司;MTT、二甲基亚砜(DMSO)购自上海研谨生物科技公司;电泳仪购自北京由莱普特科学仪器公司;流式细胞仪购自北京德利卡生物技术公司。
1.2 方法
1.2.1小鼠原代心肌细胞培养
15只鼠龄1~3日小鼠,75%乙醇消毒后放入超净台,逐层分离皮肤后分离心脏,放入胎牛血清培养基,最大程度上排除心脏积血,剪去多余的血管组织,更换培养基后采用PBS清洗3次,将心脏剪成1 mm3体积大小放入EP管中,加入1.5 mL消化酶,放入培养箱中消化组织,振荡5 min,提取上清液保留于EP管,上述过程重复8次后,采用200目过滤网分离细胞,制成细胞悬液,取对数心肌细胞进行实验。
1.2.2细胞缺氧模型构建
将正常心肌细胞培养基植入低氧环境中,后通入5%N2+5%CO2混合气体4 h,流速为2 L/min,与低糖培养基重复混合后,加入饱和无血清培养基,后将细胞放入37 ℃无氧环境下继续培养4 h备用。
1.2.3分组及转染方法
正常心肌细胞为A组,在37 ℃、5%二氧化碳环境中正常培养;缺氧心肌细胞分别分为B组(缺氧心肌细胞)、C组(缺氧心肌细胞转染miR-21 mimics)及D组(缺氧心肌细胞转染miR-21 inhibitor)。应用羧基荧光素(FAM)荧光标记miR-21 mimics、miR-21 inhibitor观察转染效果,确定mimics的最佳转染浓度为20 nmol/L,inhibitor的最佳转染浓度为 100 nmol/L。转染方法:将数量为1×104个心肌细胞,在EP管中放入200 μL转染液体和4 μL脂质体,后加入5 μg的miR-21 mimics/inhibitor,充分混合后,转染6 h后备用。
1.2.4RT-PCR 检测miR-21、PI3K、Akt mRNA的表达
将上述组别中的心肌细胞放入EP试管中,提取其RNA,75%乙醇离心,-80 ℃保存。将RNA转化DNA,内参采用GAPDH,PCR循环以95 ℃变性,60 ℃退火后,延伸5 min,循环40次,用2-ΔΔCt的方法计算相对表达水平,参考相关文献合成引物[7],序列见表1。

表1 RT-PCR中各指标引物序列
1.2.5MTT法检测心肌细胞活力
各组细胞取少量胰蛋白酶消化后,每组设置6孔,均加入150 μL细胞悬液,继续培养在加入MTT(5 g/L),每孔20 μL,遮光条件下加入200 μL的二甲基亚砜溶液,轻微摇晃15 min后促使充分溶解后,在波长490 nm检测吸光度(A值),取3次平均值。心肌细胞活力参考文献[7]。
1.2.6Hoechst荧光染色检测
各组心肌细胞,放入5 μg/L的染液,多聚甲醛固定30 min。采用TrintonX-100透明处理,加入Hoechst荧光材料染色,置常温下0.5 h,风干后每张切片选择不重复的5个方位进行观察。细胞凋亡:INS-1细胞核固缩,呈现碎片状,凋亡率=凋亡细胞/细胞总数×100%。
1.2.7流式细胞仪检测
各组心肌细胞加入少量胰蛋白酶,消化4 h后,用冷藏在-20 ℃的乙醇固定,24 h后进行离心,采用PBS冲洗3次,每次3~5 min,后进行避光染色,后采用流式细胞仪分析心肌细胞凋亡率。
1.2.8Western blot检测
常规方法取各组心肌细胞50 μg,洗净烘干电泳槽,制备12%分离胶,制作1 cm的水层。将电泳装置放置聚胶1 h,配制灌注成层胶。每孔分别加入样品悬液50 μg。90 V电泳,溴酚蓝倒入分离胶,等待电压升高至120 V电泳,最后终止电泳。电泳终止,取出凝胶,甲醇放入聚偏二氟乙烯(PVDF)膜放置5~10 s。在15 min内转膜液浸泡滤纸。10 min内移进转膜槽内,加进转膜液,转膜槽进行冰浴,70 V,1.5 h。转膜完成时,从膜槽内把PVDF膜取出,TBST洗2次,每次10 min。PVDF膜置于封闭液,水平摇床密封2 h。然后把PVDF膜装进有一抗PI3K、Akt、GAPDH抗体的自制杂交袋内,4 ℃过夜。待膜取出,将PVDF膜用1×TBST洗3次,每次10 min,冲洗完成后,把膜放入对应的二抗中常温孵育1.5 h,轻轻晃动。待孵育结束,TBST洗3次,每次10 min,将ECL显色液A液和B液混合为工作液,按1∶1比例,加工作液到PVDF膜内,1 min。PVDF膜检测采用自动化学发光成像分析。
1.3 统计学处理
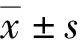
2 结 果
2.1 各组心肌细胞中miR-21表达比较
与A组相比,B组心肌细胞miR-21表达下调,组间比较差异明显(t=11.863,P<0.001),与B组相比,转染miR-21 mimics后C组miR-21表达明显升高(t=15.693,P<0.001),转染miR-21 inhibitor后D组miR-21表达明显降低(t=10.062,P<0.001),见图1。
2.2 各组心肌细胞活力比较
心肌细胞培养24 h后,B组与A组相比活力明显降低(t=16.971,P<0.001),与B组相比,C组心肌细胞活力升高(t=14.310,P<0.001),与B组相比,D组心肌细胞活力下降(t=8.639,P<0.05),见图2。
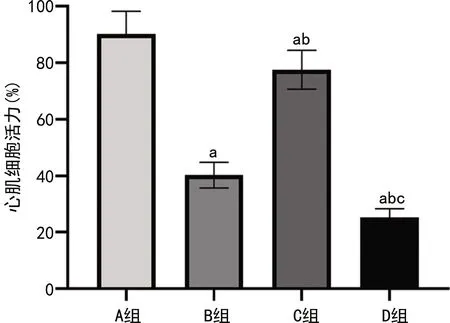
a:P<0.05,与A组相比;b:P<0.05,与B组相比;c:P<0.05,与C组相比。
2.3 Hoechst心肌细胞凋亡的影响
Hoechst荧光结果显示,B组心肌细胞凋亡率较A组相比显著上升(t=14.470,P<0.001),与B组相比,转染miR-21 mimics后C组心肌细胞凋亡率降低(t=10.690,P<0.001),转染miR-21 inhibitor后D组心肌细胞凋亡率升高(t=25.050,P<0.001),见图3。

A:Hoechst荧光检测各组心肌细胞凋亡情况(200×);B:各组心肌细胞凋亡率比较;a:P<0.001,与A组相比;b:P<0.001,与B组相比;c:P<0.001,与C组相比。
2.4 流式细胞仪心肌细胞凋亡的影响
流式细胞仪结果显示:与A组相比,B组心肌细胞凋亡率升高(t=52.45,P<0.001),C组较B组心肌细胞凋亡率有所降低(t=31.480,P<0.001),D组心肌细胞凋亡率相对于B组明显升高(t=32.10,P<0.001),见图4。

A:流式细胞仪检测各组心肌细胞凋亡情况;B:各组心肌细胞凋亡率比较;a:P<0.05,与A组相比;b:P<0.05,与B组相比;c:P<0.05,与C组相比。
2.5 Western blot检测心肌细胞中PI3K/Akt蛋白表达
Western blot条带灰度值计算结果显示:与A组相比,B组心肌细胞中PI3K、p-PI3K、Akt、p-Akt蛋白表达均下降(tPI3K=39.190,tp-PI3K=9.492,tAkt=22.860,tp-Akt=11.900,均P<0.001),与B组相比,C组上述蛋白表达有所升高(tPI3K=11.760,tp-PI3K=5.477,tAkt=10.660,tp-Akt=3.188,均P<0.001),转染miR-21 inhibitor后D组PI3K、p-PI3K、Akt、p-Akt蛋白表达均低于B组(tPI3K=19.130,tp-PI3K=24.000,tAkt=23.940,tp-Akt=14.110,均P<0.001)。见图5、6。

图5 各组心肌细胞PI3K/Akt及其磷酸化表达
2.6 PCR检测心肌细胞中PI3K、Akt mRNA表达
与A组相比,B组心肌细胞中PI3K、Akt mRNA表达下调(tPI3K=11.890,tAkt=9.798,均P<0.001),C组上述表达与B组相比明显升高(tPI3K=6.896,tAkt=7.323,均P<0.001),D组受抑制剂影响PI3K、Akt mRNA表达与B组相比降低明显(tPI3K=8.435,tAkt=10.310,均P<0.001),见图7。

a:P<0.05,与A组相比;b:P<0.05,与B组相比;c:P<0.05,与C组相比。
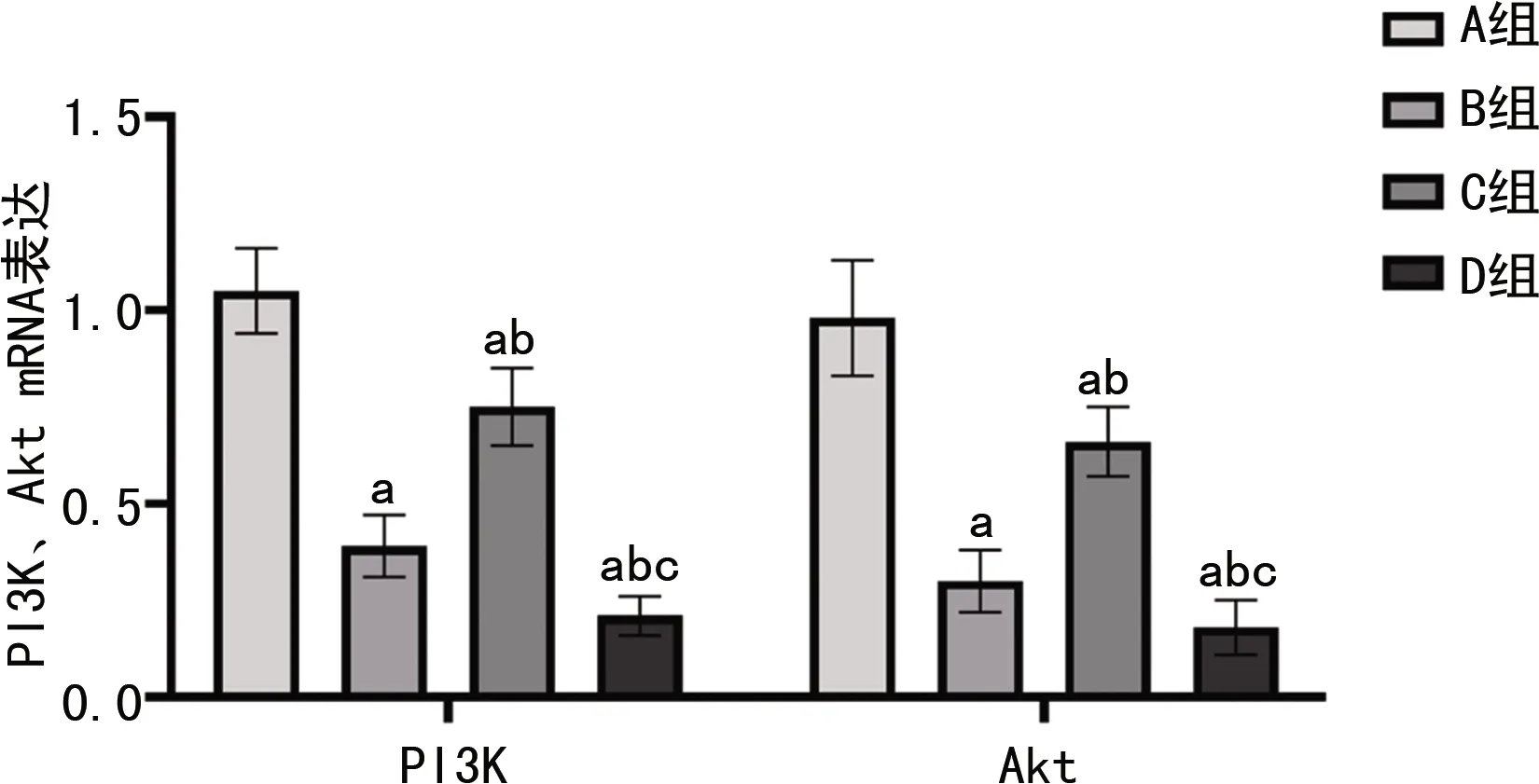
a:P<0.05,与A组相比;b:P<0.05,与B组相比;c:P<0.05,与C组相比。
3 讨 论
心肌细胞活性受多种蛋白质调控,主要通过两种不同的机制发挥作用,分为内外源性及外源性,内源性包含应激、缺氧及基因损伤等诱导细胞凋亡,例如Bax凋亡信号被激活时,能够加速cyto-c释放并快速进入细胞质内促进Caspase-9信号表达,进而触发凋亡信号,损伤心肌细胞[8]。外源性心肌细胞凋亡是通过增加Fas死亡受体而激活Caspase-3信号,从而加快凋亡机制。目前,对于抑制心肌细胞凋亡的研究一直是医学界研究的重点。
miRNAs具有介导DNA产生转录及抑制其表达的小编码RNA,RNA与缺氧心脏疾病之间的关系[9]。miR-21具有高度保守性,在血液及多种器官组织中均有表达,随着该信号通路的深入研究,其在缺氧心肌细胞中呈现低表达,而体外实验转染miR-21能够通过减少凋亡因子PDCD4及下游因子AP-1而减少凋亡[10-11]。吴若霞等[12]通过外源性增加miR-21能够通过降低PTEN表达而抑制心肌细凋亡。梁丽英等[13]研究表明,上调miR-21能够通过降低PDCD4而减少心肌细胞损伤,本文与之研究结果相似。本研究通过给予心肌细胞体外增加miR-21模拟物,转染成功后增加细胞存活率,降低凋亡,说明miR-21过表达对缺氧心脏疾病有保护作用。研究机制可能在于miR-21高表达能够减少缺血心脏疾病发生,可抑制凋亡靶向基因进而减少凋亡,这与SHEN等[14]研究结果相似。
PI3K/Akt在恶性肿瘤中属于原癌基因,能够随着恶性肿瘤变异过程表达逐渐升高,对肿瘤细胞生长具有重要意义。Akt主要在细胞膜中表达,能够通过调节多种生长信号调节细胞生物活性[15]。当PI3K/Akt被激活时,能够整合细胞因子受体,增加细胞激活剂PDKI分子的表达。当细胞膜上的Akt被某些信号磷酸化后,能够增加PI3K相关激酶表达,进而增加细胞活力。PI3K/Akt信号通路是机体重要生存因子,与缺氧心肌细胞活性存在关联。Akt为PI3K的下游分子,能够在THr308点上磷酸化,均属于灌注补救系统,磷酸化后能够通过抗死亡补体而减少心肌细胞凋亡,从而增加存活率[16]。miRNAs能够调节PI3K/Akt活性,例如在神经元细胞中miR-124能够通过增加PI3K/Akt表达而改善神经元凋亡,保护脑组织。而在不同疾病中miR-124作用存在差异,恶性肿瘤鼻咽癌中,PI3K/Akt水平升高发挥促进癌细胞侵袭作用。在缺氧心肌疾病中,miR-21对PI3K/Akt信号通路具有活化作用,主要通过抑制缺氧细胞中FASL活性,增加PI3K/Akt磷酸化表达而减少缺血心脏疾病产生[17-18]。黄伟等[19]研究表示miR-21模拟物抗心肌细胞凋亡的作用机制在于能够激活PI3K/Akt表达,对于恢复心肌梗死大鼠心功能,降低梗死面积具有重要作用。本文研究通过心肌细胞转染miR-21模拟物后发现其上调能够促进PI3K/Akt表达,从而改善心肌细胞凋亡。研究机制可能与PTEN是miR-21靶向因子,miR-21能够抑制PTEN活性,主动调节PI3K/Akt参与心肌细胞生物学行为,降低内源性及外源性凋亡信号通路表达,从而减少心肌细胞凋亡。这与MOOIJ等[20]研究结果相似。
综上所述,在缺氧心肌细胞中通过外源性增加miR-21表达能够提高心肌细胞活性,其作用机制可能与激活PI3K/Akt信号及磷酸化有关。

