槲皮素对H2O2诱导PC12细胞损伤的 保护作用及机制研究
易鹏吉 张哲宇 彭伟军


〔摘要〕 目的 探討槲皮素对H2O2损伤的大鼠嗜铬细胞瘤(PC12)细胞的保护作用及机制。方法 先选取不同浓度H2O2(100、200、300、400、500 μmol/L)干预PC12细胞,确定氧化损伤模型的条件,然后将PC12细胞分为对照组、模型组和槲皮素(6.25、12.5、25 μmol/L)组。通过MTS法、Hoechst染色法检测细胞存活和凋亡;镜下观察细胞形态;免疫荧光检测8-羟脱氧鸟苷(8-OHdG);ELISA法检测丙二醛(MDA)和谷胱甘肽过氧化物酶(GSH);Western blot法检测B淋巴细胞瘤2(Bcl-2)、Bcl-2相关X蛋白(Bax)、蛋白激酶B(Akt)和磷酸化蛋白激酶B(p-Akt)表达水平。结果 与对照组相比,模型组用500 μmol/L H2O2干预6 h后,细胞存活率下降至50%(P<0.01),凋亡率上升为38%(P<0.01);镜下可见细胞萎缩变圆;8-OHdG表达增加(P<0.05);GSH活性降低,MDA含量升高(P<0.05);Bcl-2、Akt、p-Akt表达减少,Bax表达增加(P<0.05)。与模型组相比,槲皮素各浓度组细胞存活率均上升(P<0.05),凋亡率下降(P<0.01);细胞突触再现;8-OHdG表达降低(P<0.05);GSH活性升高,MDA含量下降(P<0.05);Bcl-2、Akt、p-Akt蛋白上调,Bax蛋白下调(P<0.05)。结论 槲皮素能拮抗H2O2诱导的PC12细胞氧化损伤,其作用机制可能与Akt调控的通路以及抗氧化酶的相关作用有关。
〔关键词〕 槲皮素;PC12细胞;氧化应激;凋亡;蛋白激酶B
〔中图分类号〕R277.7 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.06.001
Protective Effect and Mechanism of Quercetin on H2O2-induced PC12 Cell Injury
YI Pengji, ZHANG Zheyu, PENG Weijun*
(Department of Integrated Traditional Chinese and Western Medicine, The Second Xiangya Hospital,
Central South University, Changsha, Hunan 410011, China)
〔Abstract〕 Objective To investigate the protective effect and its mechanisms of quercetin in rat pheochromocytoma (PC12 cell) cell injury stimulated by H2O2. Methods Different concentrations of H2O2 (100, 200, 300, 400, 500 μmol/L) were used to interfere with PC12 cells to construct oxidative stress model, then the experiments were divided into control group, model group and quercetin group (6.25, 12.5, 25 μmol/L). The cell survival and apoptosis were detected by MTS and Hoechst, respectively. Morphology was observed by microscope, and 8-hydroxydeoxyguanosine (8-OHdG) expression was measured by immunofluorescence. Furthermore, the levels of malondialdehyde (MDA) and glutathione (GSH) were assayed by ELISA and the expression levels of B-cell lymphoma-2 (Bcl-2), Bcl-2 associated X protein (Bax), protein kinase B (Akt)and phosphorylated protein kinase B (p-Akt) were evaluated by Western blot. Results After constructed via 500 μmol/L H2O2 for 6 h, compared with the control group, cell survival rate in model group was decreased to 50% (P<0.01), apoptosis rate was increased to 38% (P<0.01); microscopically, the cells became round and atrophic; 8-OHdG expression increased (P<0.05); GSH activity was reduced, and the content of MDA was increased (P<0.05); Bcl-2, Akt and p-Akt expression levels were decreased, and Bax expression was increased (P<0.05). Compared with the model group, the cell survival rate of quercetin groups increased (P<0.05) and apoptosis rate decreased (P<0.01); cell synapse reappeared; the expression of 8-OHdG decreased (P<0.05); the level of GSH increased and the level of MDA decreased (P<0.05); the expression levels of Bcl-2, Akt and p-Akt were up-regulated, and the expression of Bax was down-regulated (P<0.05). Conclusion Quercetin could relieve oxidative damage of PC12 cells induced by H2O2. Its mechanism may be related to Akt regulated pathway and the related effects of antioxidant enzymes.
〔Keywords〕 quercetin; PC12 cell; oxidative stress; apoptosis; Akt
在过去的100年里,人类预期寿命的增加使得与年龄相关的神经退行性疾病发病率也随之增加,给社会和公共健康带来巨大的挑战[1]。研究者们发现,氧化应激是神经病变中的重要参与者[2]。中枢神经细胞耗氧量大,但本身清除自由基能力较弱[3];当体内的氧化系统与抗氧化系统失衡时,过多的活性氧(reactive oxygen species, ROS)以及相关的自由基会直接损伤中枢系统,导致DNA、脂质、蛋白质等的氧化损伤,从而引起细胞功能异常甚至凋亡[4-5]。而天然植物的研究发现三七、姜黄素等中药及复方具有抗氧化作用[6]。因此,寻找天然的抗氧化药物并探索其机制成为神经退行性疾病治疗的研究热点。
槲皮素(quercetin),又名栎精。大量研究[7-8]表明槲皮素可以通过减少氧化应激、干扰肾素-血管紧张素系统、下调活性氧信号通路等方式发挥抗氧化、抗炎、抗肿瘤等药理作用。Ben Salem等[9]发现槲皮素可以保护HCT116细胞免受敌敌畏的氧化损伤;Natsumel等[10]细胞实验证实槲皮素可以减少ROS的产生;李阳等[11]证明槲皮素可以拮抗糖尿病大鼠的氧化损伤。虽然大量研究资料已证实槲皮素的抗氧化作用,但其在神经系统的抗氧化作用有待进一步阐释。因此,本研究拟通过复制H2O2诱导的PC12细胞损伤模型,探索槲皮素的抗氧化作用及其可能机制。
1 材料
PC12细胞株(批号:GDC0006,中国科学院武汉细胞库);30% H2O2试剂(批号:20180611,国药集团有限公司);槲皮素(批号:18112703,成都普菲德生物技术有限公司);胎牛血清(批号:A3160802,美国Gibco公司);MTS试剂[批号:G3580,普洛麦格(北京)生物技术有限公司];凋亡染色试剂(批号:C1022,上海碧云天生物技术公司);丙二醛(MDA)试剂盒(批号:FY8503-13)、谷胱甘肽过氧化物酶(GSH)试剂盒(批号:FY3477-13)均购于江苏菲亚生物技术公司;8-OHdG(批号:ab62623,美国Abcam公司);Bcl-2(批号:2772S)、Bax(批號:15071S)、Akt(批号:2920S)、p-Akt(批号:12694S)均购于美国CST公司。
2 方法
2.1 细胞培养
PC12细胞株置于含完全培养基(90% DMEM培基+10%的胎牛血清+1%双抗)的培养瓶中,于37 ℃、5% CO2环境培养。当培养瓶中的细胞密度达到70%~80%时,传代处理。
2.2 建立H2O2诱导的氧化损伤模型
将密度为5×104 mL的细胞接种于96孔板中培养。实验设置对照组、模型组(100、200、300、400、500 μmol/L的H2O2)。按分组培养6、12、24 h,在设定的时间里,弃去原有的培基,每孔加入100 μL含20% MTS试剂的新鲜培基,在37 ℃孵育30 min后用酶标仪测定490 nm处的吸光值(OD),计算细胞存活率。
2.3 槲皮素对H2O2诱导PC12细胞损伤的影响
实验设置对照组(无任何处理)、模型组(500 μmol/L H2O2)、槲皮素组(H2O2+槲皮素,其中槲皮素浓度分别为6.25、12.5、25、50 μmol/L),共6组。槲皮素组按设置的浓度预处理2 h;然后模型组加入500 μmol/L的H2O2,槲皮素组则加入用500 μmol/L H2O2配置的不同浓度槲皮素继续培养6 h;弃去旧培基,加入MTS试剂孵育后测定OD,计算细胞存活率。
存活率=[(OD实验组-OD空白组)/(OD对照组-OD空白组)]×100%
2.4 细胞形态观察
将生长期的PC12细胞以1×106 mL密度接种于6孔板,每孔2 mL。实验设置对照组(无任何处理)、模型组(500 μmol/L H2O)、槲皮素组(H2O2+槲皮素,其中槲皮素浓度分别为6.25、12.5、25 μmol/L),共5个组。槲皮素组按浓度预处理2 h后,模型组加入500 μmol/L的H2O2,槲皮素组则加入500 μmol/L H2O2配置的不同浓度槲皮素培养6 h,用倒置生物显微镜观察细胞形态并采集图像。
2.5 Hoechst染色检测细胞凋亡
按照“2.4”项方法处理后,使用PBS清洗3遍,加入800 μL的4%多聚甲醛,室温下固定20 min,加入1 mL的Hoechst 33342试剂孵育(37 ℃,避光,20 min),清洗后采集图像。
2.6 ELISA法检测相关的氧化指标
按照“2.4”项方法处理后,用细胞刮刀将细胞刮下,转移至EP管,冷水浴中超声波破碎10 min,随后4 ℃,12 000 r/min,离心10 min(离心半径134 mm),吸取上清备用,按照试剂盒说明书进行GSH活性和MDA含量的测定。
2.7 免疫荧光检测8-OHdG表达
PC12细胞爬片后,设置3个组:对照组(无任何处理)、模型组(500 μmol/L H2O2)、槲皮素组(H2O2+槲皮素,其槲皮素浓度为25 μmol/L);25 μmol/L槲皮素干预2 h后,模型组加入500 μmol/L的H2O2,槲皮素组则加入含500 μmol/L H2O2和25 μmol/L槲皮素培养6 h;弃去旧培基,清洗3次,室温下使用4%多聚甲醛固定;随后清洗3遍进行通透(0.1% Triton X-100);再次清洗,加入5%牛血清白蛋白封闭1 h(恒温箱37 ℃);封闭完成后在一抗(8-OHdG)液中4 ℃孵育过夜;荧光二抗孵育1 h(37 ℃,避光);DAPI染核,最后采集图像。
2.8 Western blot法检测凋亡蛋白
按照“2.4”项方法处理后,预冷PBS清洗2遍,刮下细胞在冰盒上充分裂解,30 min后离心取上清液,取一部分上清液按照BCA法测试蛋白浓度,另一部分则变性后于-20 ℃保存。按照说明书配制10%的聚丙烯酰胺凝胶,电泳90 min、转膜90 min,封闭1 h(5%脱脂奶粉),一抗稀释液4 ℃摇床过夜,TBST液清洗3遍,二抗稀释液室温孵育1 h,TBST液清洗3遍后显影成像。
2.9 统计学分析
采用SPSS 22.0进行统计学分析,计量资料用“x±s”描述,选用单因素方差分析,方差齐者,多重比较采用Bonferroni两两比较,方差不齐者,多重比较采用Dunnetts T3两两比较,P<0.05为差异有统计学意义。
3 结果
3.1 H2O2诱导PC12细胞损伤的适宜浓度和干预时间
干预6 h时,与对照组比较,100 μmol/L的H2O2对PC12细胞损伤不明显,200~500 μmol/L时,细胞受到氧化损伤,存活率下降,差异有统计学意义(P<0.01);在12、24 h时,相较于对照组,所有H2O2浓度组的细胞存活率均下降,差异有统计学意义(P<0.01),考虑药物可能与H2O2反应,故选取500 μmol/L H2O2干预6 h建立损伤模型。见图1。
3.2 槲皮素对H2O2损伤的PC12细胞活力的影响
与对照组比较,仅接受H2O2干预的模型组的细胞存活率降低至50%(P<0.01);相较于模型组,加入槲皮素后细胞的存活率随着槲皮素浓度的增加而逐渐升高,槲皮素25 μmol/L组存活率达到最高,差异有统计学意义(P<0.01),槲皮素50 μmol/L组存活率下降,但差异无统计学意义(P>0.05)。见图2。
3.3 槲皮素对H2O2损伤的PC12细胞的形态影响
对照组细胞贴壁牢固,细胞胞体饱满,以梭形为主,少数呈圆形、三角形,突起光滑粗大;模型组则脱壁细胞增多,胞体萎缩变圆,突触变短、断裂,甚至消失。而在槲皮素各组,细胞形态得到明显的改善,随着药物浓度的增加,脱壁、萎缩变圆的细胞减少,具有完整结构的细胞增多,突触重新长出。见图3。
3.4 槲皮素对H2O2损伤的PC12细胞的凋亡影響
对照组的细胞呈现暗蓝色;模型组呈现蓝白色,细胞核变形,呈现不规则化;槲皮素处理后,随着浓度的增加,细胞的调亡得到不同程度的缓解。模型组细胞的凋亡率是对照组的7倍(P<0.01)。与模型组比较,槲皮素6.25、12.5、25 μmol/L组的细胞凋亡率明显降低,分别为10.76%、9.67%、7.25%(P<0.01)。见图4。
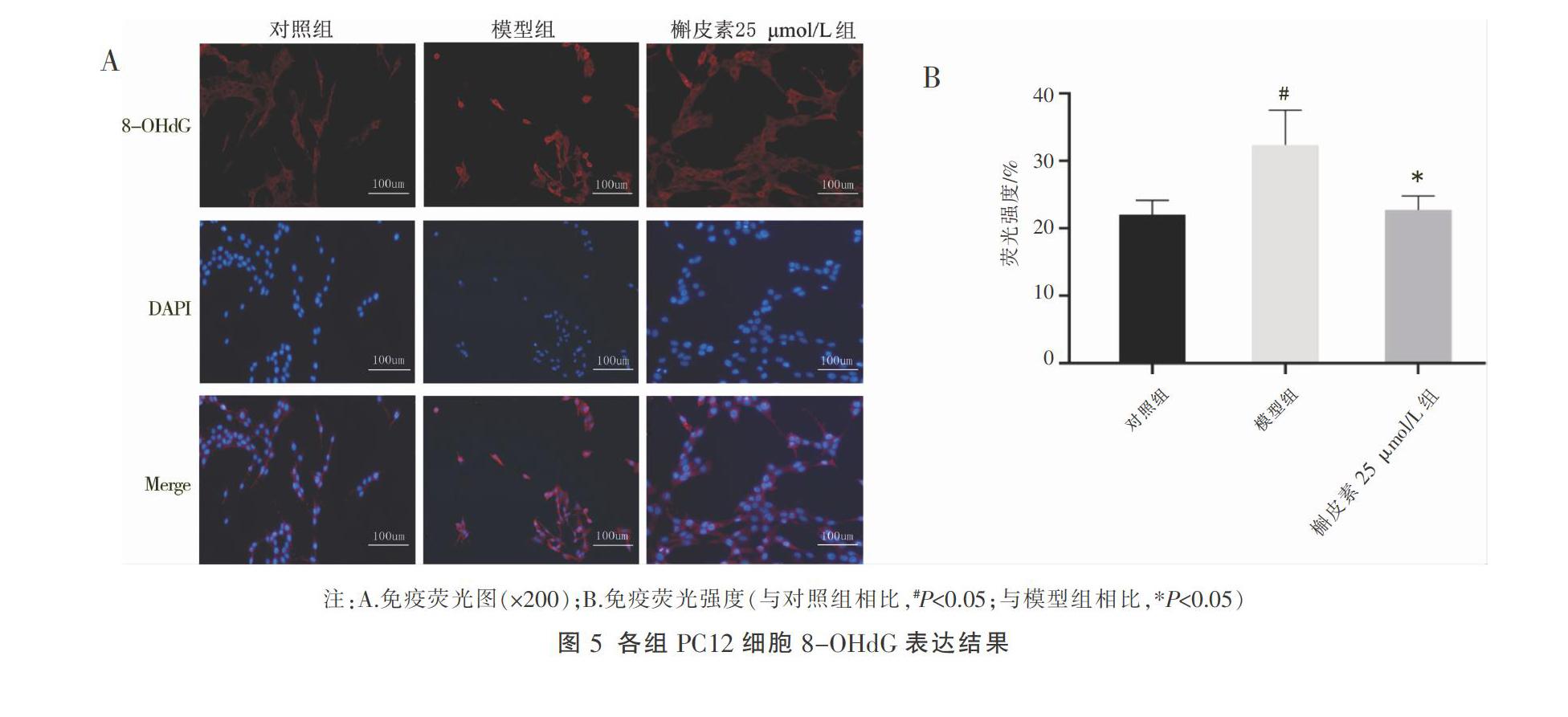
3.5 槲皮素对H2O2损伤的PC12细胞8-OHdG表达的影响
相比对照组,8-OHdG在模型组整体展现出鲜艳的红色荧光信号,有些细胞胞质内具有更强的荧光,量化后为32.39%,差异有统计学意义(P<0.05);槲皮素25 μmol/L组中,胞质内8-OHdG红色荧光信号减弱(22.75%),趋向于对照组(22.04%),与模型组比较,差异有统计学意义(P<0.05)。见图5。
3.6 槲皮素对H2O2损伤的PC12细胞的MDA含量及GSH活性的影响
相比对照组,模型组的GSH活性降低,MDA含量升高,差异均有统计学意义(P<0.05);而在槲皮素组中,不同浓度槲皮素均能改善损伤的PC12细胞中的GSH和 MDA表达,与模型组比较,除槲皮素6.25 μmol/L组的GSH表达差异没有统计学意义外,其余差异均有统计学意义(P<0.05)。见图6。
3.7 槲皮素对H2O2损伤的PC12细胞Bcl-2、Bax的影响
与对照组相比,模型组的抗凋亡蛋白Bcl-2表达水平下降(P<0.05),促凋亡Bax水平上升,差异有统计学意义(P<0.05)。而槲皮素干预后,Bax表达降低,其中槲皮素25 μmol/L组与模型组比较,差异有统计学意义(P<0.05);与模型组比较,Bcl-2表达增加,槲皮素12.5、25 μmol/L组差异有统计学意义(P<0.05)。见图7。
3.8 槲皮素对H2O2损伤的PC12细胞Akt、p-Akt通路蛋白的影响
相比对照组,模型组Akt和p-Akt蛋白表达水平明显下降(P<0.05);与模型组相比,槲皮素各浓度组Akt、p-Akt蛋白表达水平增加,其中槲皮素25 μmol/L组差异有统计学意义(P<0.05)。见图8。
4 讨论
氧化应激诱导的神经损伤是神经退行性疾病发生发展的重要原因之一。PC12细胞在形态、结构、功能与神经细胞高度相似,常被用来进行神经退行性疾病的研究[12]。H2O2容易穿透细胞膜,形成的自由基会造成细胞损伤、凋亡,是常用的氧化损伤试剂[13]。本研究采用不同浓度的H2O2和不同干预时间诱导PC12细胞复制氧化损伤模型,MTS结果显示500 μmol/L H2O2干预6 h时细胞存活率下降至对照组的50%左右,考虑到H2O2可能会与药物存在相互作用,故以此条件开展进一步实验。不同浓度的槲皮素干预后,能够显著提高PC12细胞的存活率,改善PC12细胞损伤的形态,其中25 μmol/L达到最佳的保护效果。为了对槲皮素保护作用进一步评估,本研究还检测了氧化指标(MDA、GSH、8-OHdG)和凋亡相关蛋白。
ROS是描述一类由氧的不完全还原而形成的化学物质的总称,它通过激活线粒体通道释放细胞色素C,引起细胞内蛋白和DNA等生物结构的破坏[14]。氧化应激指标中8-OHdG是内源性的DNA损伤的标记物,MDA、GSH表达水平反应机体氧化的损伤程度[15-17]。本文结果发现,用H2O2诱导PC12细胞后,8-OHdG表达增加(P<0.05),MDA含量显著升高(P<0.05),GSH的活性下降(P<0.05)。槲皮素干预后,降低了MDA含量和8-OhdG表达水平(P<0.05),提高了GSH的活性(P<0.05)。这与槲皮素在氧化损伤的MODE-K细胞、HUVEC细胞结果一致[18-19],推断槲皮素可以降低细胞内ROS表达、提高抗氧化酶的活性,从而发挥保护神经细胞的作用。
ROS引起的损伤最终激活凋亡相关通路,导致细胞死亡。本文结果证实槲皮素预处理后能明显提高PC12的存活率,同時Hoechst染色也进一步验证了其能有效缓解H2O2对PC12细胞的损伤。抗凋亡基因Bcl-2与促凋亡基因Bax形成异二聚体可以阻断凋亡信号的传递,而Bax自身形成的二聚体可以诱导细胞凋亡[20]。Akt是多条调节细胞生长、增殖、凋亡信号的关键环节(例如MAPK、PI3K/Akt、Jak/Stat信号通路),并且激活的Akt可以调控凋亡的级联反应,抑制Bax、Caspase-9表达[21-22]。与涂鄂文等[23]研究结果相符,本文结果表明不同浓度的槲皮素均可增加Akt、p-Akt、Bcl-2蛋白水平(P<0.05),减少Bax蛋白水平(P<0.05),从而抑制H2O2诱导的细胞凋亡。
综上,通过检测氧化指标和凋亡情况,发现槲皮素可以增加细胞存活率、GSH活性、Akt、p-Akt和Bcl-2蛋白表达,减少MDA、8-OHdG和Bax的水平,500 μmol/L H2O2造成细胞的氧化损伤被逆转,而其潜在的作用机制可能与抗氧化酶相关作用以及Akt调控的抑制凋亡通路有关,进一步调控机制有待后续深入探索。
参考文献
[1] BURGOS C, MU[N][`]OZ-MINGARRO D, NAVARRO I, et al. Neuroprotective potential of verbascoside isolated from Acanthus mollis L. leaves through its enzymatic inhibition and free radical scavenging ability[J]. Antioxidants, 2020, 9(12): E1207.
[2] SZELIGA M. Peroxiredoxins in neurodegenerative diseases[J]. Antioxidants, 2020, 9(12): E1203.
[3] JI B S, GAO Y. Protective effect of trihexyphenidyl on hydrogen peroxide-induced oxidative damage in PC12 cells[J]. Neuroscience Letters, 2008, 437(1): 50-54.
[4] KAYAMA Y, RAAZ U, JAGGER A, et al. Diabetic cardiovascular disease induced by oxidative stress[J]. International Journal of Molecular Sciences, 2015, 16(10): 25234-25263.
[5] GIUDETTI A M, SALZET M, CASSANO T. Oxidative stress in aging brain: Nutritional and pharmacological interventions for neurodegenerative disorders[J]. Oxidative Medicine and Cellular Longevity, 2018, 2018: 3416028.
[6] 刘彩霞,邓常清.中药及复方改善血管内皮细胞氧化应激损伤的研究进展[J].湖南中医药大学学报,2021,41(1):151-158.
[7] SHARMA A, KASHYAP D, SAK K, et al. Therapeutic charm of quercetin and its derivatives: A review of research and patents[J]. Pharmaceutical Patent Analyst, 2018, 7(1): 15-32.
[8] 杨 颖,王芸芸,蒋琦辰.槲皮素药理作用的研究进展[J].特种经济动植物,2020,23(5):24-28.
[9] BEN SALEM I, BOUSSABBEH M, GRAIET I, et al. Quercetin protects HCT116 cells from Dichlorvos-induced oxidative stress and apoptosis[J]. Cell Stress & Chaperones, 2016, 21(1): 179-186.
[10] NATSUME Y, ITO S, SATSU H, et al. Protective effect of quercetin on ER stress caused by calcium dynamics dysregulation in intestinal epithelial cells[J]. Toxicology, 2009, 258(2/3): 164-175.
[11] 李 阳,苏艳瑜,李国豪,等.槲皮素通过Nrf2通路对糖尿病大鼠胰腺氧化损伤的拮抗作用机制[J].食品科学,2021,42(5):208-214.
[12] 赵立理,张振昶,苏 刚,等.过氧化氢(H2O2)对PC12细胞的氧化应激损伤的研究[J].临床医药文献电子杂志,2017,4(96):18826-18827,18989.
[13] LI W G, MILLER F J J R, ZHANG H J, et al. H(2)O(2)-induced O(2) production by a non-phagocytic NAD(P)H oxidase causes oxidant injury[J]. The Journal of Biological Chemistry, 2001, 276(31): 29251-29256.
[14] NAVARRO-YEPES J, ZAVALA-FLORES L, ANANDHAN A, et al. Antioxidant gene therapy against neuronal cell death[J]. Pharmacology & Therapeutics, 2014, 142(2): 206-230.
[15] VALAVANIDIS A, VLACHOGIANNI T, FIOTAKIS C. 8-hydroxy-2'-deoxyguanosine (8-OHdG): A critical biomarker of oxidative stress and carcinogenesis[J]. Journal of Environmental Science and Health. Part C, Environmental Carcinogenesis & Ecotoxicology Reviews, 2009, 27(2): 120-139.
[16] 鄒 娟,盖 茂,陶 杨.核桃多肽对过氧化氢及β淀粉样肽25-35诱导PC12细胞氧化损伤的影响[J].中国药师,2019,22(4):619-624.
[17] DAVIES S M, POLJAK A, DUNCAN M W, et al. Measurements of protein carbonyls, ortho-and meta-tyrosine and oxidative phosphorylation complex activity in mitochondria from young and old rats[J]. Free Radical Biology & Medicine, 2001, 31(2): 181-190.
[18] 张哲瑞.基于Nrf2通路探讨槲皮素对甲基苯丙胺致MODE-K细胞氧化损伤的影响[D].昆明:昆明医科大学,2020.
[19] 江 杨.槲皮素调控非编码RNA干预内皮细胞胆固醇损伤的分子机制及其运载体系的构建[D].泰安,山东农业大学,2020.
[20] 张建军,王 东,尚 峰.依托咪酯对过氧化氢诱导的PC12细胞损伤的影响及机制[J].中华实验外科杂志,2019,36(1):100-102.
[21] 闫 斌,王靖博,张 宏,等.槲皮素对高糖培养海马神经元凋亡及Akt、p-Akt、Bcl-2、Bax蛋白表达的影响[J].中国康复理论与实践,2017,23(12):1390-1396.
[22] BALZANO D, FAWAL M A, VEL?ZQUEZ J V, et al. Alternative activation mechanisms of protein kinase B trigger distinct downstream signaling responses[J]. The Journal of Biological Chemistry, 2015, 290(41): 24975-24985.
[23] 涂鄂文,陈 琼,宁 敏,等.槲皮素对脑出血大鼠神经细胞凋亡与Bcl-2、Bax蛋白表达的作用研究[J].湖南中医药大学学报,2020,40(5):555-560.

