妇康栓体外抗菌及对细菌生物膜影响的研究
吕邵娃 邱茜 杨志伟 李庆华 王秋红 匡海学


〔摘要〕 目的 研究婦康栓对妇科疾病致病菌的抑菌活性及对厌氧消化链球菌生物膜的影响。方法 采用滤纸片法测量供试药液作用于菌株的抑菌圈直径;采用倍比稀释法检测菌株的最小抑菌浓度(minimum bacteriostatic concentration, MIC)及最低杀菌浓度(minimum bactericidal concentration, MBC);采用荧光染色法对厌氧消化链球菌生物膜的形成抑制情况进行红绿荧光定量分析。结果 妇康栓对白色念珠菌、新生隐球菌、金黄色葡萄球菌、大肠埃希氏菌、厌氧消化链球菌、乙型溶血性链球菌、红色毛癣菌及阴道加德纳氏菌均有不同程度的抑制作用,尤其是对革兰氏阳性菌的抑制作用强于其他菌株。抑菌结果表明药物对厌氧消化链球菌的抑制作用最强。在荧光显微镜下可清楚观察,与对照组相比,各给药组绿色荧光百分比减少,生物膜总量降低(P<0.05)。结论 妇康栓具有抑菌活性,特别是对厌氧消化链球菌具有较强的抑制作用,并具有破坏生物膜的能力。表明妇康栓对妇科疾病主要致病菌有抑制作用,为进一步临床用药提供理论指导。
〔关键词〕 妇康栓;体外抑菌;妇科炎症;厌氧消化链球菌;生物膜
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.06.004
Study on Antibacterial Activity in Vitro and Effect of Fukang Suppository on Bacterial Biofilm
LV Shaowa1,2, QIU Qian1,2, YANG Zhiwei3, LI Qinghua3, WANG Qiuhong1,4, KUANG Haixue1,2*
(1. Key Laboratory of Basic and Applied Research of Northern Medicine, Ministry of Education, Heilongjiang University of Traditional Chinese Medicine, Harbin, Heilongjiang 150040, China; 2. Key Laboratory of Basic Research on Pharmacodynamic Substances of Traditional Chinese Medicine and Natural Medicine, Heilongjiang University of Traditional Chinese Medicine, Harbin, Heilongjiang 150040, China; 3. Heilongjiang Province Rich East Pharmaceutical Company Limited, Mudanjiang
157000, Heilongjiang, China; 4. College of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou, GuangDong 510000, China)
〔Abstract〕 Objective To study the antibacterial activity of Fukang Suppository on pathogenic bacteria of gynecological diseases and its effect on the biofilm of anaerobic digestion streptococcus. Methods The diameters of inhibition zone of test solution to bacteria was measured by the paper filtering method. The minimum bacteriostatic concentration (MIC) and minimum bactericidal
concentration (MBC) of Fukang Suppository were determined by dilution method. The inhibition of biofilm formation in anaerobic digestion streptococcus was quantitatively analyzed by fluorescence staining. Results Fukang Suppository had different
degree of inhibitory effect on candida albicans, cryptococcus neoforme, staphylococcus aureus, escherichia coli, streptococcus anaerobic digestion, streptococcus hemolytis-β, trichophyton rubrum and Gardnerella vaginalis. The inhibitory effect of the drug on the gram positive bacteria was the strongest. The results of bacteriostasis showed that the drug had the strongest inhibitory effect on anaerobic digestion streptococcus. It can be observed clearly under fluorescence microscope, compared with the control group, the percentage of green fluorescence and the total amount of biofilm in each group were decreased (P<0.05). Conclusion Fukang Suppository had antibacterial activity, especially against the anaerobic digestion streptococcus, and had the ability to destroy the biofilm. It is proved that Fukang Suppository has an inhibitory effect on the main pathogenic bacteria of gynecological diseases, which provides theoretical guidance for further clinical medication.
〔Keywords〕 Fukang Suppository; inhibition in vitro; gynecological inflammation; anaerobic digestion streptococcus; biological membrane
妇康栓是以核桃楸(Juglans mandshurica Maxim.)的成熟种仁采用干馏法得到的馏油为主药,硬脂酸聚烃氧40酯为基质,混合制成黑褐色鸭嘴形栓剂。核桃楸中含有醌、黄酮、糖苷、鞣质和三萜类化合物[1],具有抗肿瘤、抗氧化、杀菌和止痛等多种作用[2-3]。从核桃楸外果皮提取分离出的活性成分对多种病原微生物有抑制作用,然而关于核桃楸成熟种仁的研究报道较少[4]。妇康栓作为阴道外用药用于治疗赤白带下、少腹坠痛、子宫糜烂等多种常见妇科疾病,但其是否通过抑菌起到对宫颈炎、阴道炎及盆腔炎的治疗作用尚不清楚。本文通过研究妇康栓对妇科疾病常见致病菌的体外抗菌活性,旨在为其临床合理应用提供指导。
1 材料
1.1 药品
妇康栓(批号:1804003,黑龙江省富东制药有限公司);盐酸左氧氟沙星氯化钠注射液(批号:20180211,广东彼迪药业有限公司);氟康唑氯化钠注射液(批号:K180805012,四川科伦药业股份有限公司);甲硝唑氯化钠注射液(批号:1812035M,安徽双鹤药业有限责任公司);青霉素V钾片(批号:E190908,浙江亚太药业股份有限公司);硬脂酸聚烃氧40酯(批号:1804003,黑龙江省富东制药有限公司);吖啶橙(批号:A8120,北京索来宝科技有限公司);溴化乙锭(批号:E1021,北京索来宝科技有限公司);氯化三苯四氮唑(批号:M2128-1G,美国Sigma公司)。
1.2 菌株
白色念珠菌标准株(批号:186382)、金黄色葡萄球菌标准株(批号:310011)、新生隐球菌标准株(批号:337347)、大肠埃希氏菌标准株(批号:125988)、阴道加德纳氏菌标准株(批号:337545)、乙型溶血性链球菌标准株(批号:336670)、厌氧消化链球菌标准株(批号:337100)、红色毛癣菌标准株(批号:340195)均购自北纳创联生物技术有限公司。
1.3 培养基
改良马丁(PDA)培养基(批号:20171026)、营养肉汤培养基(批号:20130730)、营养琼脂培养基(批号:20130731)均购自北京奥博星生物技术有限责任公司;YM培养基(批号:HB0297)购自海博生物技术有限公司;哥伦比亚血平板培养基(批号:20191203)購自北纳创联生物技术有限公司。
1.4 仪器
SHINVA型手提式压力蒸汽灭菌器(东新华医疗器械股份有限公司);HH-400型电热恒温培养箱(上海跃进医疗器械厂);JA2003型电子天平(上海天平仪器有限公司);CO2CELL 50L型CO2恒温培养箱(德国MMM公司);HD-650型超净工作台(吴江市伟峰有限公司);KQ-500B型超声波清洗器(昆山市超声仪器有限公司);UTB190型激光共聚焦显微镜(日本Olympus公司)。
2 方法
2.1 试剂的制备
用分析天平称量一定量的妇康栓加热融解后用无菌水配制成含妇康栓质量浓度分别为1.66、0.83、0.41、0.20、0.10、0.05、0.02 g/mL的药液作为供试药液,相当于含核桃楸馏油200.00、100.00、50.00、25.00、12.50、6.25、3.12 mg/mL;配制氟康唑对照品溶液质量浓度为0.20 mg/mL作为白色念珠菌、新生隐球菌的阳性对照药物;配制甲硝唑对照品溶液质量浓度为0.10 mg/mL作为阴道加德纳氏菌、红色毛癣菌的阳性对照药物;配制左氧氟沙星对照品溶液质量浓度为0.04 mg/mL作为金黄色葡萄球菌、大肠埃希氏菌的阳性对照药物;配制青霉素对照品溶液质量浓度为0.02 mg/mL作为厌氧消化链球菌、乙型溶血性链球菌的阳性对照药物。配制1.46 g/mL硬脂酸聚烃氧40酯水溶液作阴性对照药物。
2.2 菌种活化及菌悬液配制
在无菌条件下,将安瓿管表面消毒后在安全柜中打开,用酒精灯灼烧顶部后迅速滴上无菌水使之破裂,随后用镊子将其敲碎。移取0.5 mL无菌水加入冻干管中,充分溶解后直接吸取菌液200 μL到相对应的平板上均匀涂布,并将平板置于各菌种对应培养条件下培养24~48 h。其中金黄色葡萄球菌、大肠埃希氏菌用营养琼脂培养基培养,红色毛癣菌用PDA培养基培养,厌氧消化链球菌、乙型溶血性链球菌、阴道加德纳氏菌用哥伦比亚血平板培养,新生隐球菌、白色念珠菌用YM培养基培养。取过夜培养后平板上的菌种,用无菌生理盐水配制菌液,并与标准的0.5麦氏比浊液进行比浊,制成含1×106~1×107 cfu/mL的菌悬液。
2.3 妇康栓体外抑菌活性的测定
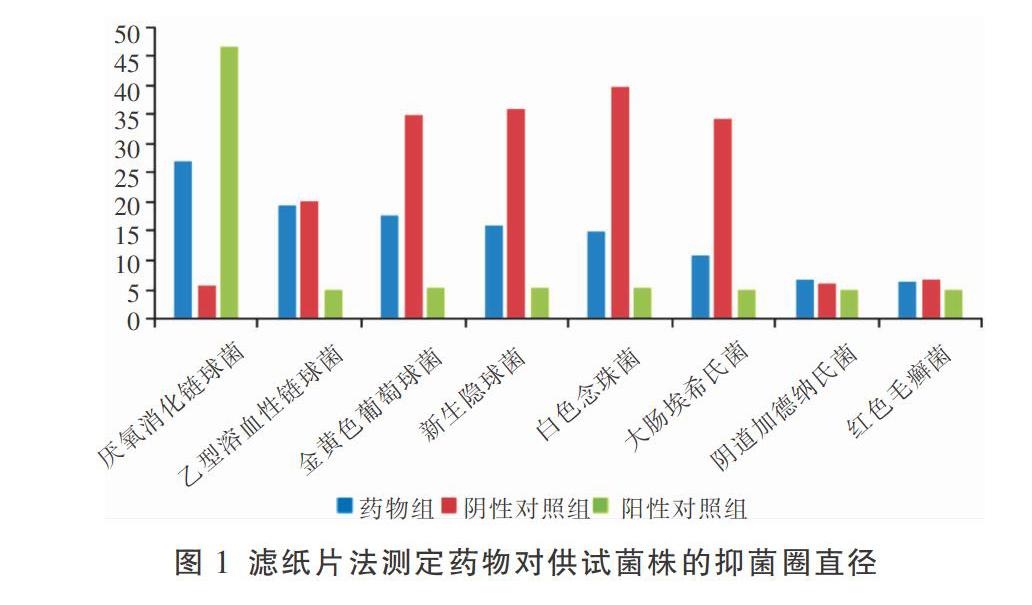
2.3.1 供试菌株的抑菌圈测定 灭菌后,将直径5 mm圆形滤纸片分别放在药液(氟康唑溶液、左氧氟沙星溶液、青霉素溶液、甲硝唑溶液、妇康栓溶液、硬脂酸聚烃氧40酯水溶液)中浸泡2 h,烘干备用。取200 μL上述8种供试菌菌悬液接种于培养基表面,涂布均匀,制成含菌平板。然后用已浸过药液的药敏滤纸片紧贴在含菌培养皿上,各滤纸间距离均等[5]。用游标卡尺测量抑菌圈直径D,并观察抑菌圈的透明程度和边缘整齐程度。重复实验3次,每次3个平行,数据取平均值。
2.3.2 最小抑菌浓度的测定 取96孔聚苯乙烯板,各孔加入100 μL液体培养基、100 μL菌悬液,除空白组加入无菌水溶液以及阳性对照组、阴性对照组加入相对应的阳性药液、硬脂酸聚烃氧40酯水溶液外,其余各组分别加入已配好的不同稀释度供试药液100 μL。每个稀释度对应设置3个复孔。置于各菌种对应培养条件下恒温培养18 h后取出。不同菌种重复以上操作。肉眼借助倒置显微镜观察细菌生长状况,无细菌生长孔的最低药物浓度为MIC[6]。
2.3.3 最杀菌浓度(minimum bacteriostatic concentration, MBC)的测定 将药品有效抑菌浓度的药液和对照组对应的浓度药液100 μL移种至不含药物的营养琼脂平板上,以无菌载玻棒均匀涂布,标记平板,置于菌种适宜的培养条件下恒温倒置培养18 h后取出[7]。观察菌落并计数;以菌落数少于5个(2个复孔的平均值)的药物最低质量浓度为MBC。
2.4 药物对细菌生物膜影响
取厌氧消化链球菌菌悬液100 μL加入肉汤培养基中过夜培养,取1 mL培养基加入带有灭菌盖玻片的6孔板中37 ℃摇床上震荡过夜培养。吸去培养基,PBS溶液冲洗,分别加入浓度为1.66、0.83、0.41、0.20、0.10、0.05、0.02 g/mL的妇康栓药液1 mL,同时设对照组,过夜培养。吸去各孔中的药液,PBS溶液分别冲洗,每次间隔1 min,弃去孔中液体。在暗室吖啶橙(AO)和溴化乙锭(EB)荧光染色液按1∶1混合染液滴加在长有厌氧消化链球菌生物膜的盖玻片表面,暗室恒温孵育15 min,继续分别用 PBS溶液冲洗各孔,每次冲洗时间为1 min,弃去多余荧光染色液。AO荧光染色液可以透过正常菌株胞膜,染活菌株细胞核,使其发出均匀且明亮的绿色荧光。同时,凋亡菌株呈黄绿色荧光或呈黄绿色碎片颗粒。EB荧光染色液可以透过胞膜受损的菌株,嵌入死菌株核DNA,使其产生红色荧光,二者重叠可呈橘黄色荧光,未被染色的空隙显示黑色[8],正常生长的细菌能黏附于物体表面相互聚集、成块而形成生物膜。视野可清楚观察分辨出正常、凋亡或坏死的菌株,绿色荧光面积所占总荧光面积百分比可以表示生物膜中活菌比例,用来判断生物膜形成量[9]。对染色菌株进行红绿荧光定量分析,从而分辨出存活菌株和坏死菌株及药物作用于菌株后对生物膜的破坏程度。
2.5 统计学分析
利用统计学软件SPSS 21.0对实验数据进行分析,各组之间的数据差异比较均采用t检验,P<0.05为差异具有统计学意义。
3 结果
3.1 供试药液对供试菌种抑菌圈的影响
药物组对各菌的抑制能力为厌氧消化链球菌>乙型溶血性链球菌>金黄色葡萄球菌>新生隐球菌>白色念珠菌>大肠埃希氏菌>阴道加德纳氏菌>红色毛癣菌。阴性对照无抑菌作用,表明其对实验结果没有干扰。
3.2 妇康栓对供试菌株的MIC和MBC的影響
药物对厌氧消化链球菌的MIC及MBC均最低,分别为0.05 g/mL和0.10 g/mL。表明药物对厌氧消化链球菌具有显著的抑制效果。金黄色葡萄球菌和乙型溶血性链球菌的MIC和MBC值一致,抑制效果仅次厌氧消化链球菌。含不同浓度梯度的药物液体培养基中有无细菌生长见表1。妇康栓对供试菌株的药物MIC和MBC见表2。实验结果表明妇康栓对以上菌株在体外均有抑制活性、尤其是对革兰氏阳性菌的抑制作用强于其他菌株。综合上述结果,后续实验选择以厌氧消化链球菌为试验菌种。
3.3 妇康栓对细菌的存活状态及其生物膜的影响
与对照组相比,各给药组活菌数量减少,死菌数量增多。与低浓度药物组相比,高浓度药物组活菌数量减少。在妇康栓作用下,生物膜进一步形成量均显著低于对照组,并随着药物浓度增加,生物膜形成量越降低。与对照组比较,0.10、0.20、0.41 g·mL-1药物组生物膜形成量降低,差异有统计学意义(P<0.05),0.83、1.66 g·mL-1药物组生物膜形成量显著降低,差异有统计学意义(P<0.01)。见图2和图3。
4 讨论
宫颈炎、阴道炎及盆腔炎为女性妇科病中的高发疾病,这类疾病主要原因是阴道微生态环境菌群失衡,改变了生殖道内的酸碱度环境,特别是病原菌代替乳酸杆菌等有益菌成为优势菌种快速生长,致病菌大量繁殖,感染女性生殖道引发炎症[10]。女性不仅会有外阴或阴中骚痒,甚者疼痛灼热、溃烂、白带量多或色黄腥臭等不适症状,严重时还会导致不孕、流产、早产、新生儿先天发育畸形等一系列严重后果,危害女性健康和家庭和睦[11-12]。因此,及时地合理治疗妇科疾病尤为重要。Itzhak B[13]总结了女性生殖道感染主要是由消化链球菌属和普雷沃菌属的厌氧菌引起。血液为厌氧菌生长提供了良好环境,使产褥期和月经期的女性加大了细菌性阴道病发生的危险[14]。化学药物治疗细菌性阴道炎,虽然可在短期内对所有厌氧菌起到理想的杀灭或抑制效果,但耐药性和复发率高[15]的问题尚未解决。妇康栓在这方面却有独特的优势,其可以破坏厌氧菌生物膜的进一步形成,避开抗生素的传统作用靶位,防止耐药性的产生[16],在一定程度上能减少用药后复发风险。本研究发现妇康栓对厌氧消化链球菌具有较强的抑制活性,这为临床上使用妇康栓治疗因厌氧消化链球菌感染引发的细菌性阴道炎、盆腔或宫颈病变等常见妇科病提供了科学依据。
妇康栓具有使用方便、直达病灶、起效时间短、降低由于药物作用而带来的肝损害及胃肠道不适的不良反应等优势[17]。虽然妇康栓的有效成分是核桃楸馏油,其水溶性差,较难分散在阴道体液环境中,是药物递送系统的一大挑战。硬脂酸聚烃氧40酯提高了核桃楸馏油在体液中的溶解度,它的熔点是46~51 ℃,使妇康栓在阴道中缓缓溶化释药,延长栓剂的滞留时间,促进了主药的吸收,为促进阴道上皮细胞吸收和提高生物利用度提供了可能[18]。本文对妇康栓的体外抗菌活性进行了初探,从妇科感染常见病原菌的角度研究了其对致病菌的抑菌效果,结果发现其对厌氧消化链球菌抑制效果最强,并且可通过破坏厌氧消化链球菌生物膜达到抑菌和杀菌作用,但其有效成分和抗菌机制还有待进一步深化研究,后续可以从明确化学成分和检测细胞周期、耐药基因水平、细胞膜完整性及菌体蛋白质等方面对其抗菌机制进行深入研究。
参考文献
[1] 常 乐,孟 楠,雷 涛,等.核桃楸皮药理作用的研究概述[J].中国医药导报,2013,10(1):23-24.
[2] 闫勇杰,王丽红.2种青龙衣化学成分及药理作用研究進展[J].安徽农业科学,2017,45(24):123-125,149.
[3] 闻 平,段秀杰,陈 蕾.胡桃楸提取物抗深部感染真菌的活性研究[J].实用全科医学,2006,4(1):94.
[4] 于 雪,胡文忠,金黎明,等.核桃楸不同部位的活性物质及药用价值研究进展[J].食品工业科技,2016,37(21):368-371,376.
[5] 闫绍悦,林树乾,傅 剑,等.五味子提取液抑菌活性研究[J].中国实验方剂学杂志,2014,20(10):142-146.
[6] PANDEY N, GUPTA M K, PAUL P, et al. Necessity to identify candida species accurately with minimum inhibitory concentration determination in each case of bloodstream infections[J]. Journal of Infection and Public Health, 2020, 13(5): 753-758.
[7] 刘玉甜,赵诗雨,杨大宇,等.散结乳癖膏对白色念珠菌的体外抑菌作用研究[J].中药新药与临床药理,2020,31(1):43-47.
[8] 房德芳,王明艳.MTT法及AO/EB荧光染色法分析斑蝥酸钠对HepG2的生长抑制的研究[J].辽宁中医药大学学报,2010,12(2): 41-42.
[9] 游雪娇,李良秋,马连营,等.激光共聚焦扫描显微镜在抗菌机理研究中的应用[J].微生物学通报,2015,42(6):1108-1121.
[10] 钱志祥,陈代杰.益生菌治疗细菌性阴道炎的临床研究及其相关机制[J].中国抗生素杂志,2020,45(10):974-981.
[11] 阮丽君.RVVC证候特点与患者阴道局部IL-4、IL-12、IFN-γ水平的研究[D].广州:广州中医药大学,2012.
[12] 薛凤霞,李小平,李志英,等.女性生殖道感染的诊断与处理[J].现代妇产科进展,2006(1):1-17.
[13] ITZHAK B. Microbiology and management of polymicrobial female genital tract infections in adolescents[J]. Journal of Pediatric and Adolescent Gynecology, 2002, 15(4): 217-226.
[14] 薛鸿林,张云琛,陈锦珊.临床药师参与1例厌氧消化链球菌感染产妇治疗的药学实践[J].药学与临床研究,2016,24(6):503-504.
[15] 吴彩红.维生素C片联合甲硝唑片在治疗妇科细菌性阴道炎的临床应用观察[J].中国农村卫生,2019,11(18):23.
[16] 王央霞,孙婷,马俊芬,等.金诺芬对表皮葡萄球菌及其生物膜的影响[J].中国微生态学杂志,2019,31(2):146-148.
[17] 王瀚声,尤昭玲.阴道炎的中医药治疗进展[J].中医药导报,2005(11):85-87.
[18] 陈秋兰.复方加替沙星妇科栓的制备及质量控制[J].中国医药指南,2008(13):1-3.

