野生小花南芥体内AsA-GSH循环对土壤Cd、Pb胁迫的响应
刘梅,李祖然,张光群,王吉秀,祖艳群*
(1.云南农业大学资源与环境学院,昆明 650201;2.云南农业大学园林园艺学院,昆明 650201)
镉(Cd)、铅(Pb)是植物的非必需微量元素[1-2],Cd、Pb 胁迫会影响植物生长,抑制RNA 的合成及相关酶活性,使植物产生大量活性氧自由基,影响蛋白、脂质及核酸合成,最终导致细胞结构破坏[3]。在一定的重金属浓度范围内,植物可以启动自身的解毒机制,植物细胞通过抗氧化酶和抗氧化物协同作用抵御胁迫,清除逆境胁迫产生的活性氧,提高植物对重金属的耐性[4]。植物体内抗坏血酸-谷胱甘肽(Ascorbate-glutathione,AsA-GSH)循环、GSH 代谢等生理活动存在交互作用,在植物耐受镉胁迫中发挥巨大作用[5]。其主要途径是抗坏血酸(Ascorbic acid,AsA)在抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)的作用下与H2O2反应生成水,从而清除受逆境胁迫所产生的过氧化氢[6-7]。循环过程中单脱氢抗坏血酸(Monodehydroascorbate,MDHA)和单脱氢抗坏血酸还原酶(Monodehydroascorbate reductase,MDHAR)等促进还原反应生成AsA,参与AsA 水平的调节[8]。脱氢抗坏血酸还原酶(Dehydroascorbate reductase,DHAR)利用还原型谷胱甘肽(Reduced glutathione,GSH)作为电子供体可将脱氢抗坏血酸(Dehydro⁃ascorbate,DHA)还原为AsA,而谷胱甘肽还原酶(Glutathione reductase,GR)将氧化型谷胱甘肽催化成GSH,促进AsA 的再生,从而完成清除H2O2等活性氧并再生AsA 和GSH 的过程[9]。GSH 是谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)和谷胱甘肽转硫酶(Glutathione S-transferase,GST)等抗氧化酶底物,GPX 以GSH 为底物催化H2O2、羟基过氧化物和脂过氧化物等还原,GST通过与GSH结合清除内源产生的有毒亲电物质,GPX和GST参与植物对重金属耐受与解毒的过程[10]。目前,关于植物AsA-GSH 循环在不同胁迫逆境中的变化规律已有较多报道,如重金属胁迫下旱柳(Salix matsudanaKoidz)幼苗[10]、金丝草(Pogonatherum crinitum)[1]等植物的AsA-GSH 循环中酶活性的变化,而对于Cd、Pb 污染土壤下,野生小花南芥体内抗坏血酸-谷胱甘肽循环在抵抗Cd、Pb胁迫中发挥的作用及规律的研究鲜见报道。
小花南芥(Arabis alpinaL.var.parvifloraFranch)是云南本土超富集植物,十字花科,南芥属,多年生草本植物[11]。主要发现于云南省会泽县铅锌矿区,因长期开采,矿区及周边土壤中Cd、Pb 污染问题日益凸显[12]。小花南芥对重金属耐受性的研究具有重要的理论和实践价值。本试验以云南省会泽县铅锌矿区Cd、Pb 污染土壤为研究背景,三个不同地区的野生小花南芥为试验材料,研究原生条件下小花南芥根和叶APX、GR、MDHAR、DHAR 的活性和AsA、GSH 的含量变化,明确自然条件下Cd、Pb 胁迫对小花南芥体内AsA-GSH 循环的影响,探索小花南芥适应Cd、Pb 胁迫的抗氧化机制,为小花南芥耐重金属胁迫的机理研究提供一定理论依据。
1 材料与方法
1.1 采样地概况
采样点位于云南省曲靖市会泽县(25°48′~27°04′N,103°34′~103°42′E),平均海拔2 183 m,相对高差389 m,以山地地貌为主,属亚热带季风气候。会泽铅锌矿主要从事采矿、冶炼和化工等生产活动,是中国重要的铅锌产地之一。采样点分布:①驰宏区(CHQ):103.71°E,26.63°N,海拔2 494 m,位于者海矿山镇驰宏矿区;②三多多(SDD):103.62°E,26.47°N,海拔2 254 m,位于者海镇三多多村;③小马坪(XMP):103.71°E,26.63°N,海拔2 471 m,位于者海矿山镇小马坪。三个采样点土壤理化性质见表1。

表1 三个试验区的土壤理化性质及重金属Cd、Pb含量Table 1 Soil physical and chemical properties in the three sampling sites
1.2 样品采集
2019 年10 月,平均气温17~24 ℃,连续天晴的天气下,分别在三个地区设置三个采样点,每个采样点随机连根带土挖取野生小花南芥植株15 株,小花南芥要求分支不超过三支(1~2 年),塑料袋密封根部,保持湿度和鲜活度,带回实验室备用。选用鲜活的野生小花南芥植株,轻轻抖动除去黏附在根表面的土壤,根际土壤晾干,用于土壤重金属的测定,小花南芥洗净,称取地上部和地下部各10 份,每份质量0.1 g,密封,保存于-80 ℃冰箱,用于酶的测定。
1.3 指标测定
1.3.1 土壤基本理化性质
参照鲍士旦《土壤农化分析》(第三版)的测定方法[13],测定pH、有机质、全氮、全磷、全钾、碱解氮、有效磷、速效钾。
1.3.2 植株生长指标
洗净小花南芥,采用Epson Perfection V700 扫描仪进行根系扫描,并利用WinRHIZO-Pro 2013(Re⁃gent Instruments Inc.)分析软件对根系参数进行分析,测得小花南芥的总根长、总根表面积、平均根系直径、根体积和根尖数。随机选取5 株用直尺测定株高。105 ℃杀青30 min,70 ℃烘干至恒质量(地上、地下部),称质量,磨碎,备用。
1.3.3 土壤和植株Cd、Pb含量测定
(1)土壤Cd、Pb 含量:称取1 g 土置于50 mL 三角瓶中,少量水湿润,加浓硝酸3 mL,封口过夜,低温加热至微沸(140~160 ℃),待棕色氮氧化物基本赶完后,取下冷却。沿壁加入高氯酸5 mL,继续加热,样品呈灰白色糊状,取下冷却,加水过滤到50 mL 容量瓶中定容。用火焰原子吸收分光光度法测定。
(2)植株Cd、Pb 含量:称取混匀植株样品0.1 g,置于消解罐,加入3 mL 硝酸(优级纯)和2 mL 双氧水(优级纯),于烘箱中160 ℃加热4 h,取出冷却,用超纯水定容至50 mL。采用火焰原子吸收分光光度计测定。
富集系数=植株Cd、Pb 含量(mg·kg-1)/土壤Cd、Pb含量(mg·kg-1)
转运系数=植株地上部Cd、Pb 含量(mg·kg-1)/植株地下部Cd、Pb含量(mg·kg-1)
1.3.4 AsA-GSH 循环相关酶、抗氧化物质及MDA、H2O2含量测定
称取根或叶0.1 g,用剪刀剪碎放入研钵,加入提取液,冰浴条件下研磨成匀浆。于高速冷冻离心机(HC-3018R高速冷冻离心机,安徽中科中佳科学仪器有限公司)中冷冻离心,取上清液待测。
根据试剂盒(购自苏州格锐思生物科技有限公司)说明书进行测定。还原型抗坏血酸(AsA):在534 nm 波长记录1 h 后吸光值。还原型谷胱甘肽(GSH):在412 nm 测定吸光值。丙二醛(MDA):在532 nm 和600 nm 处读取吸光值。过氧化氢(H2O2):在415 nm 处读取吸光值。抗坏血酸过氧化物酶(APX):在290 nm 比色,记录30 s 和5 min 30 s 吸光值。单脱氢抗坏血酸还原酶(MDHAR):在340 nm 比色,记录10 s 和5 min 10 s 吸光值。脱氢抗坏血酸还原酶(DHAR):在265 nm 比色,记录10 s 和3 min 10 s吸光值。谷胱甘肽还原酶(GR):在412 nm 比色,记录30 s 和10 min 吸光值。谷胱甘肽转硫酶(GST):在340 nm 比色,记录3 s 和10 min 吸光值。谷胱甘肽过氧化物酶(GSX):在412 nm比色,记录1 min吸光值。
1.4 数据统计分析
实验数据采用Microsoft Excel 软件进行编辑和整理,采用SPSS 19.0 软件对数据进行单因素方差分析(One-way ANOVA)和差异显著性检验(α=0.05),Ori⁃gin 软件绘图。图表中的数据用3 个重复的均值±标准差表示。
2 结果与分析
2.1 三个试验区的土壤理化性质及重金属Cd、Pb含量
三个试验区土壤理化性质及重金属Cd、Pb 含量存在明显差异(表1)。其中全磷的含量由多到少依次为小马坪>三多多>驰宏区;全钾的含量依次为三多多>小马坪>驰宏区;全氮的含量依次为驰宏区>小马坪>三多多;有效磷含量依次为三多多>驰宏区>小马坪;速效钾的含量依次为三多多>小马坪>驰宏区;碱解氮的含量依次为小马坪>驰宏区>三多多;有机质的含量依次为三多多>驰宏区>小马坪;pH 值大小依次为三多多>驰宏区>小马坪。驰宏区土壤的Cd、Pb含量显著高于小马坪和三多多。
2.2 三个试验区野生小花南芥株高及根系形态
三个试验区野生小花南芥的株高及根系形态存在差异(表2)。三多多和驰宏区小花南芥的总根长、总根表面积显著高于小马坪(P<0.05)。其中,与小马坪相比,三多多和驰宏区野生小花南芥总根长分别增长107.32%、93.68%,总根表面积分别增长52.11%、45.77%。驰宏区野生小花南芥的根体积显著大于小马坪和三多多,分别增长61.90%和112.50%。三多多野生小花南芥株高显著高于小马坪和驰宏区,相比小马坪和驰宏区株高分别上升77.36%、49.05%。三个试验区的野生小花南芥平均根系直径和根尖数差异不显著(P>0.05,表2)。

表2 三个试验区野生小花南芥的株高及根系形态Table 2 Plant height and root morphology of wild A.alpina in three sampling sites
2.3 三个试验区野生小花南芥植株Cd、Pb 含量及累积特征
三个试验区野生小花南芥地上部和地下部的Cd含量存在显著差异(P<0.05,表3)。野生小花南芥植株地上部和地下部Cd 含量由高到低依次为驰宏区>三多多>小马坪。驰宏区小花南芥地上部Cd 含量分别比三多多和小马坪显著升高46.85%和199.72%,地下部显著升高54.44%和140.63%。驰宏区野生小花南芥植株地上部和地下部Pb含量显著高于小马坪和三多多,相比小马坪和三多多,驰宏区地上部Pb含量增幅为87.83%和291.04%,地下部Pb 含量增幅为360.76%和547.47%。驰宏区、小马坪、三多多三个试验区Cd 富集系数均大于1,Pb 富集系数均小于1。三多多和驰宏区Cd 转移系数大于1,小马坪Pb 转移系数大于1(表3)。

表3 三个试验区野生小花南芥植株Cd、Pb含量及累积特征Table 3 Cd and Pb contents and accumulation characteristics of wild A.alpina in three sampling sites
2.4 三个试验区野生小花南芥植株MDA和H2O2含量
三个试验区野生小花南芥植株根部和叶片的MDA 和H2O2含量存在明显差异(图1)。Cd、Pb 背景值高的驰宏区野生小花南芥叶和根中的MDA 含量显著高于三多多和小马坪,其中,叶中的MDA 含量分别上升74.06%、32.17%,根部的MDA 含量分别上升72.12%、99.73%。三多多和小马坪野生小花南芥叶片和根部的MDA含量差异不显著(P>0.05,图1A)。Cd、Pb背景值低的小马坪野生小花南芥植株的H2O2含量显著低于驰宏区和三多多,小马坪野生小花南芥叶中H2O2含量比驰宏区和三多多分别下降54.73%、66.77%,根的H2O2含量分别下降30.00%、24.32%,三多多和驰宏区野生小花南芥根部和叶片的H2O2含量差异不显著(P>0.05,图1B)。

图1 三个试验区野生小花南芥植株MDA、H2O2含量Figure 1 The contents of MDA and H2O2 in wild A.alpina plants in three sampling sites
2.5 三个试验区野生小花南芥植株AsA-GSH 循环相关抗氧化物质的含量及酶活性
三个试验区野生小花南芥体内AsA 的含量由高到低依次为驰宏区>三多多>小马坪。三多多和小马坪小花南芥叶片的AsA 含量比驰宏区分别显著下降54.55% 和79.43%,根部分别显著下降44.86% 和94.39%(图2A)。Cd、Pb 背景值低的小马坪野生小花南芥叶和根的GSH 含量显著低于驰宏区和小马坪。其中,小马坪野生小花南芥叶的GSH 含量比驰宏区和小马坪分别显著下降28.08%、35.98%,根的GSH 含量分别显著下降66.67%、61.90%,三多多和驰宏区野生小花南芥根部和叶片的GSH 含量差异不显著(P>0.05)。野生小花南芥叶片的GSH 含量均高于根部,说明叶片对Cd、Pb胁迫的抗性更强(图2B)。

图2 三个试验区野生小花南芥植株AsA、GSH含量Figure 2 Contents of AsA and GSH in wild A.alpina plants in three sampling sites
如图3 所示,Cd、Pb 背景值高的驰宏区野生小花南芥叶和根的APX活性显著高于三多多和小马坪(P<0.05)。其中,驰宏区野生小花南芥叶片的APX 活性相比三多多和小马坪分别显著上升135.48%、87.18%;根部APX 活性分别上升77.78%、29.73%(图3A)。三个试验区野生小花南芥地上部GR 活性均高于地下部。其中,根部GR 活性最高的是小马坪,小马坪试验区野生小花南芥植株根部GR 活性相比三多多和驰宏区分别显著上升122.11%和46.53%,说明Cd、Pb 胁迫对小花南芥根部GR 活性具有抑制作用,叶片比根部对Cd、Pb胁迫抗性更强(图3B)。

图3 三个试验区野生小花南芥植株APX、GR活性Figure 3 APX and GR activities of wild A.alpina plants in three sampling sites
三个试验区野生小花南芥植株叶片和根部MD⁃HAR 活性差异显著,野生小花南芥植株叶片MDHAR活性由强到弱依次表现为小马坪>驰宏区>三多多,根部的MDHAR 活性依次表现为三多多>小马坪>驰宏区;小马坪野生小花南芥叶片MDHAR 活性显著高于驰宏区和三多多(P<0.05),分别显著上升97.24%和200%。三多多小花南芥根部MDHAR 活性显著高于小马坪和驰宏区(P<0.05),分别上升32.84%和118.37%(图4A)。而三个试验区野生小花南芥根部的DHAR 活性无显著差异(P>0.05),小马坪试验区野生小花南芥叶片的DHAR活性最强,显著高于驰宏区和三多多(P<0.05),分别上升94.16%、81.42%(图4B)。

图4 三个试验区野生小花南芥植株MDHAR、DHAR活性Figure 4 MDHAR and DHAR activities of wild A.alpina plants in three sampling sites
Cd、Pb 背景值高的驰宏区野生小花南芥叶和根的GST活性显著高于三多多和小马坪(P<0.05),驰宏区野生小花南芥叶片GST 活性相比小马坪和三多多分别上升3.6 倍和2.0 倍,根部显著上升3.5 倍和6.9倍。小马坪和三多多地区野生小花南芥叶片和根部的GST 活性差异不显著(P>0.05,图5A)。而三个试验区野生小花南芥叶片的GPX 活性无显著差异(P>0.05)。小马坪地区野生小花南芥植株根部GPX 活性显著高于驰宏区(P<0.05)。与小马坪相比,三多多和驰宏区野生小花南芥根部GPX 活性分别下降20.47%和35.90%(图5B)。

图5 三个试验区野生小花南芥植株GST、GPX活性Figure 5 GST and GPX activities of wild A.alpina plants in three sampling sites
2.6 相关性分析
由表4可知,野生小花南芥的总根长、根体积与土壤的有机质、pH呈极显著正相关,总根长与土壤Cd含量呈显著负相关;平均根直径与土壤的全磷、全钾、有效磷、速效钾、碱解氮呈显著负相关,与pH、有机质呈显著正相关;总根表面积和根尖数与全磷、全钾、有效磷、速效钾呈显著正相关;株高与土壤Cd含量呈极显著正相关,与土壤Pb含量呈显著正相关。土壤背景值对小花南芥生长有一定的影响,小花南芥在三个试验区均具有适应性。

表4 土壤背景值与野生小花南芥形态的相关性分析Table 4 Correlation analysis of soil physical-chemical properties and morphology of wild A.alpina
野生小花南芥根形态与叶部AsA-GSH 循环的相关性分析(表5)表明,小花南芥的根长、平均根直径、根体积与叶片GSH 呈显著正相关,与MDHAR 呈极显著负相关;小花南芥的总根表面积与叶片AsA、GST呈极显著负相关,与MDA、APX 呈显著负相关;小花南芥根尖数与叶片GSH、H2O2呈极显著负相关,与MDHAR 呈极显著正相关;小花南芥植株株高与叶片MDA、GST 呈极显著正相关。小花南芥的根长、总根表面积、平均根直径、根体积、根尖数和株高与植株叶片GR和GPX无显著相关性。

表5 野生小花南芥形态与叶部AsA-GSH循环的相关性分析Table 5 Correlation analysis between the morphology of wild A.alpina and the ascorbate-glutathione cycle in leaves
野生小花南芥形态与根部AsA-GSH 循环的相关性分析(表6)表明,小花南芥总根长、平均根直径与根系MDA 呈极显著正相关,与GR 呈极显著负相关;小花南芥总根表面积、根尖数与根系GSH 呈显著负相关,平均根直径与根系GSH 呈显著正相关;根系H2O2与总根长呈极显著负相关,与平均根直径和根体积呈显著负相关,与根尖数呈显著正相关;植株株高与根系MDHAR 呈极显著负相关,与GST 呈极显著正相关,植株根系特征和株高与根系DHAR、GPX 无显著相关性。表明植株根系特征受根系AsA-GSH 循环相关抗氧化物质和酶活性的影响。

表6 野生小花南芥形态与根部AsA-GSH循环的相关性分析Table 6 Correlation analysis between morphology of wild A.alpina and ascorbate-glutathione cycle in root
野生小花南芥叶部AsA-GSH 循环与Cd、Pb 含量的相关性分析(表7)表明,野生小花南芥叶的Cd含量与AsA含量和GST活性呈极显著正相关;野生小花南芥叶的Pb 含量与MDA 含量和GST 活性呈极显著正相关,与APX 呈显著正相关;土壤Cd 含量与野生小花南芥叶的APX、GST 活性呈显著正相关;土壤Pb含量与野生小花南芥叶的MDA 含量和GST、GPX 活性呈显著正相关。

表7 野生小花南芥叶的AsA-GSH循环与Cd、Pb含量的相关性分析Table 7 Correlation between AsA-GSH cycle and contents of Cd and Pb in wild A.alpina leaves and soil
野生小花南芥根部AsA-GSH 循环与Cd、Pb 含量的相关性分析(表8)表明,野生小花南芥根的Cd含量与AsA、GSH含量和GST活性呈极显著正相关,与GPX活性呈显著负相关;野生小花南芥根的Pb含量与MD⁃HAR、APX、GST活性呈极显著相关;土壤Cd含量与野生小花南芥根的MDA含量、MDHAR活性呈极显著负相关,与APX、GST活性呈极显著正相关;土壤Pb含量与野生小花南芥根的APX、GST活性呈显著正相关。
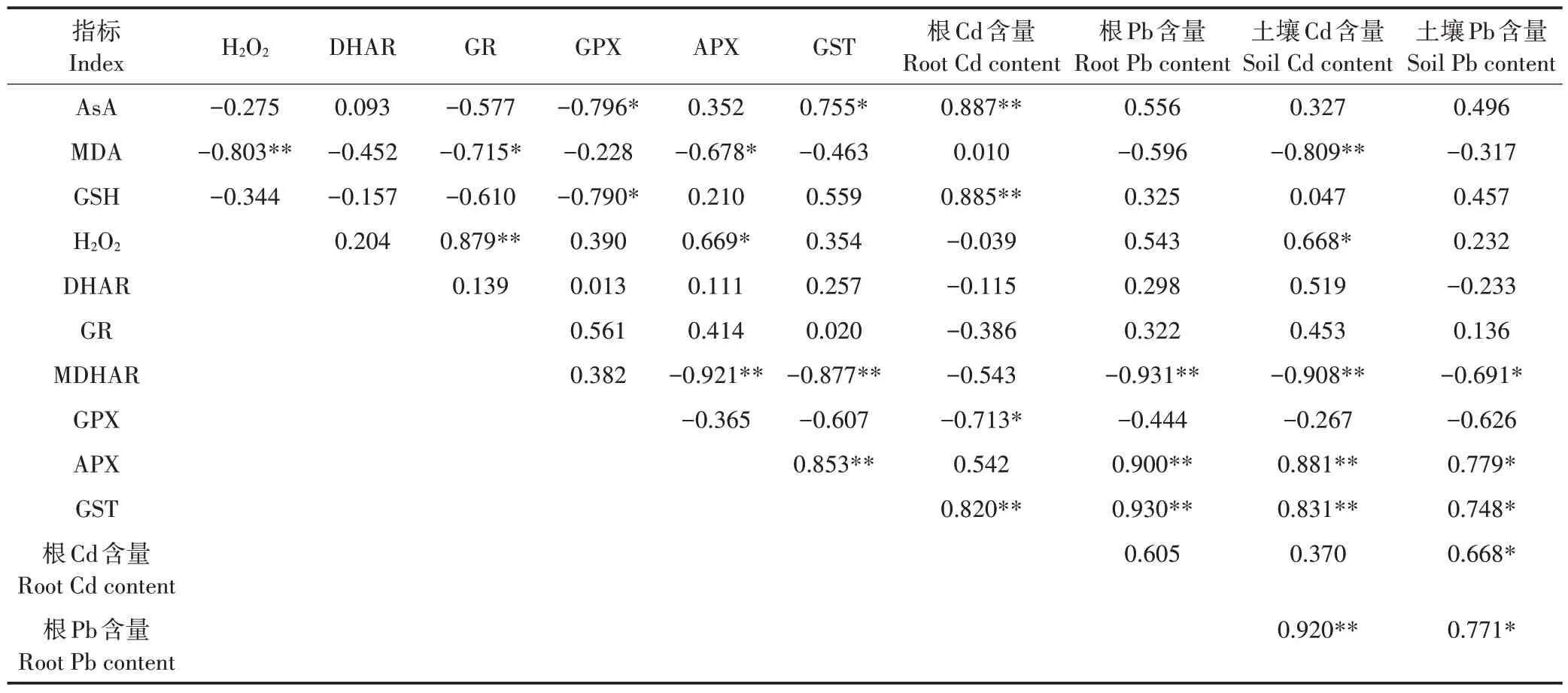
表8 野生小花南芥根的AsA-GSH循环与Cd、Pb含量的相关性分析Table 8 Correlation analysis of relative enzyme activities in AsA-GSH cycle and Cd and Pb contents of wild A.alpina roots
3 讨论
根系是植物和环境介质离子交换的主要界面,是最先感知重金属Cd2+等有毒物质的器官[14],根系形态可以直观反映根系对逆境的适应状况。植物自身可通过改变根长、根表面积、根体积等形态特征以适应胁迫环境。本研究表明,野生小花南芥生长的地区Cd 含量为52.91~106.54 mg·kg-1,Pb 含量为6 218.33~7 512.75 mg·kg-1,其根长、根体积、株高与土壤背景中Cd 含量存在相关性,呈现“低促高抑”的现象,与韩航等[1]、田小霞等[15]研究结果一致。造成此种现象的原因可能是小花南芥通过改变根系形态结构及其分布格局获取生长所需能源物质(水、养分等),从而维持根系生理功能的稳定,进而适应Cd、Pb胁迫,根长、根体积等与土壤中碱解氮、pH、有机质具有显著相关性,这与前人的研究结果相似,氮元素的增加,可以增加植株生物量,增强植物抗氧化防御能力,促进植物对Cd、Pb 等重金属的吸收及转运[16-18];有机质含量高、营养充足的条件利于植物生长,植株对Cd的吸附与固定能力增强[19];pH 与土壤对Cd、Pb 的吸附量存在密切关系[20]。
MDA 是植物受逆境胁迫时膜脂发生过氧化的主要产物,MDA 含量变化可衡量逆境胁迫对植物伤害程度[21],本试验结果表明,野生小花南芥叶的MDA 含量与土壤Cd 含量呈极显著正相关,表明野生小花南芥叶的膜脂受到伤害的程度与土壤Cd 含量有关,驰宏区野生小花南芥MDA 含量最高,说明土壤Cd 含量越高,对小花南芥膜系统伤害程度越大,这与相关研究结果[7,22]一致。
AsA 和GSH 是自由基清除系统的重要非酶促抗氧化物质,有利于维持细胞内氧化还原平衡。Anjum等[23]研究表明,植物细胞内AsA 含量一定程度决定了植物抗逆性。本试验中,AsA 含量与野生小花南芥根与叶中Cd 含量呈极显著正相关,这可能是由于小花南芥体内通过增加AsA 的含量抵抗Cd 胁迫,维持小花南芥正常生长。韩航等[1]也发现,超富集植物金丝草(Pogonatherum crinitum)根系AsA 含量的增加削弱了Pb胁迫毒害、延缓了细胞衰老进程,根系基本功能得以正常运转。油菜(Brassica napusL.)体内AsA 含量的增加提高了其耐Cd 能力[24]。植物体内较高含量的AsA和GSH,可确保较强的植物抗逆境能力。逆境胁迫下植物可增加GSH 和AsA 合成量来抵御逆境带来的伤害[25]。本研究表明,三多多和驰宏区野生小花南芥GSH 含量显著高于小马坪,可能是由于三多多和驰宏区土壤中Cd、Pb含量较高,植物在Cd、Pb胁迫下自身产生大量GSH 以增强抗逆性。这与前人发现逆境下金丝草通过保持体内较高的GSH 含量增强植株的抗氧化能力,且维持DHAR、蛋白活性及膜稳定性的结论相一致[26]。
重金属对植物产生毒害的主要途径之一是产生大量活性氧,造成细胞损伤、功能紊乱等,植物可通过抗氧化系统响应来抵御过氧化毒害[27]。AsA-GSH 循环在清除活性氧方面发挥着重要作用,如金丝草(Pogonatherum crinitum)[1]、旱 柳(Salix matsudana Koidz)[10]、石竹(Dianthus chinensis)[28]等,可通过AsAGSH 循环的响应来抵抗胁迫。AsA-GSH 循环途径如图6 所示,AsA-GSH 循环由GR、GSH、AsA、APX、MD⁃HAR、DHAR 等抗氧化物、抗氧化酶组成。其中APX、MDHAR、DHAR、GR 作为AsA-GSH 循环主要酶类,相互协作清除H2O2,并使AsA和GSH再生[29]。APX是细胞中有效清除H2O2的抗氧化酶之一,催化AsA-GSH循环第一步反应[31]。本研究结果表明,野生小花南芥的APX活性与根部的Pb含量、土壤的Cd含量呈极显著正相关,驰宏区野生小花南芥APX活性显著高于另外两个采样点,表明高浓度Cd、Pb胁迫可以增强小花南芥APX的活性。针对许多植物的研究已发现重金属促使APX活性变化来调控胁迫造成的危害,如Cd胁迫下旱柳幼苗APX活性上升,叶部APX活性高于根部[10]。本研究中,小花南芥地上部APX活性高于地下部,可能是由于小花南芥吸收的Cd运输转移至地上部后,叶APX活性增强,以抵御过氧化损伤及增强自身耐性。

图6 AsA-GSH循环[4,29-30]Figure 6 AsA-GSH cycle[4,29-30]
AsA 通过非酶促或酶促反应氧化为MDHA,MDHAR、DHAR 可以催化AsA 的再生,从而使AsA 在植物组织中保持较高的还原态,其含量与AsA含量有一定的对应关系[23]。本研究结果显示,野生小花南芥DHAR 活性与土壤Cd、Pb 含量无显著相关性,究其原因可能是逆境胁迫下维持循环的平衡过程中DHAR转化加剧,野生小花南芥根部MDHAR 活性与土壤Cd、Pb 含量呈显著负相关,Cd、Pb 胁迫会抑制野生小花南芥的MDHAR活性,从而有效促进MDHA与DHA进一步转化为AsA,维持细胞较充分的AsA 库源,这与杨卫东等[10]研究得到低、中剂量Cd 增加了旱柳幼苗MDHAR活性的结果相一致。
GST、GR 和GPX 这3 种酶在正常GSH 代谢和植株抵抗逆境胁迫中都发挥着特殊作用。GR 是组成AsA-GSH 循环通路的关键酶,以还原型辅酶Ⅱ(Tri⁃phos phopyridine nucleotide,NADPH)为电子供体催化氧化型谷胱甘肽(Oxidized glutathione,GSSG)还原成GSH[32]。本研究结果显示,三个试验区小花南芥叶片GR 活性差异不显著,但叶片GR 活性均高于根部,表明小花南芥在Cd、Pb胁迫下叶部GR活性的优势更利于抵抗胁迫。GR 能有效维持GSH 循环,保持植物细胞中较高GSH 水平,而维持GSH 库不仅需要GR,还需要GSH 底物合成[33]。GSH 是GPX 和GST 等抗氧 化酶底物,GPX和GST参与植物对重金属的耐受与解毒过程[10]。本研究中,野生小花南芥GST 活性与土壤Cd、Pb 含量呈显著正相关,驰宏区野生小花南芥根和叶GST活性显著高于小马坪和三多多,表明GST参与植物对Cd、Pb的耐受与解毒。Li等[34]研究发现,Cd胁迫过程中根和叶GPX 与GST 活性增加。本研究中GPX活性变化与大多报道相反,随着土壤重金属背景值的升高,根部GPX 活性降低,这可能是由于重金属胁迫下GSH 主要参与循环平衡,而较少作为GPX 催化H2O2的底物。本研究结果清楚地显示了植物体抵御氧化胁迫的复杂性,如受金属的含量和植物自身的耐性等影响,但植物体自身通过酶参与解毒过程的程度还很难确定,为更好地了解小花南芥在Cd、Pb胁迫下的防御机制,还应该考虑金属特异性、基因表达等因素。
4 结论
(1)土壤氮、磷、有机质含量对小花南芥的生长具有显著的影响。随土壤Cd、Pb含量的增加,驰宏区、三多多、小马坪试验区野生小花南芥叶和根Cd、Pb含量显著增加,植株根系的总根长、总根表面积、根体积及重金属累积量也增加。
(2)小花南芥通过植物抗坏血酸-谷胱甘肽循环根和叶中AsA、GSH 含量增加,APX、GST 活性升高,根的GR、MDHAR 活性降低,进而使小花南芥对Cd、Pb胁迫的耐性增强。

