堆肥臭味物质
——粪臭素高效降解菌Rp3的分离和鉴定
吴玉洪,张世昌,田茜,马桂珍,郭荣君*,李世东,钟增明
(1.江苏海洋大学,江苏 连云港 222005;2.中国农业科学院植物保护研究所,北京 100193;3.中国检验检疫科学研究院,北京 100176;4.北京启高植物医学和营养研究所有限公司,北京 100193)
氮杂环化合物是一类污染面广、毒性大的难降解有机物。多数氮杂环化合物有恶臭或刺激性气味,其中吲哚类氮杂环有机物是畜牧堆肥中有机污染物的主要成分,造成养殖场及其周边环境恶化,引起一系列环境污染和公共卫生问题[1-2]。
3-甲基吲哚(3MI)俗称粪臭素(SK),是一种可溶于有机溶剂、难溶于水的含氮杂环化合物。它是吲哚的一种衍生物,具有双环结构,是色氨酸的主要代谢物之一[3],其中猪粪和鸡粪中粪臭素含量可高达40~60 mg·kg-1[4-5]。3-甲基吲哚能够调控肠道菌群,抑制产气杆菌、沙门氏菌等多种革兰氏阴性肠道菌的增殖,但对人和动物健康也有不良影响。研究已经发现,其对细胞具有遗传毒性,导致肿瘤的发生,并能够引起多种反刍动物的急性肺水肿和肺气肿[6],严重时导致动物死亡;另外,还可引起人神经内分泌功能和免疫功能的病变,严重时可导致呼吸道细胞发生畸变和癌变[7-8]。
物理化学方法是目前去除吲哚类氮杂环化合物臭味的主要方法,但该方法成本较高,且易造成二次污染,利用微生物降解吲哚类化合物的研究近年受到广泛关注。Yin 等[9]从红树林底泥中分离的铜绿假单胞菌(Pesudomonas aeruginosa)能够降解4 mmol·L-1的粪臭素;Gu 等[10]从海底沉积物中分离出厌氧菌群,在硫还原条件下可降解粪臭素;Kohda 等[11]从禽畜粪便中分离出一株马来提名梭菌(Clostridium malenomina⁃tum),研究发现在粪臭素浓度为100~300 mg·L-1时,丰富的营养供给有利于粪臭素的降解。以往研究报道红球菌对烷烃、芳香烃、原油、有机腈等多种化合物具有转化及降解功能[12],但有关红球菌降解粪臭素等吲哚类化合物的研究未见报道。
本研究从羊粪堆肥下土壤中分离到粪臭素降解菌株Rp3,研究了其对粪臭素的降解率以及在不同粪臭素浓度、pH 及盐度下菌株的生长情况,为该菌株应用于堆肥臭味污染环境的净化提供基础。
1 材料与方法
1.1 试验材料
样品:羊粪堆肥下土壤,采集于山西应县羊养殖场。
无机盐培养基L2:KH2PO40.5 g、K2HPO41.5 g、MgSO40.5 g、(NH4)2SO41.5 g,蒸馏水定容至1 L,pH自然。
LB 液体培养基:胰蛋白胨10 g、NaCl 5 g、酵母提取物5 g,蒸馏水定容至1 L。
富集驯化培养基:在L2 培养基的基础上,梯度(10~100 mg·L-1)增加粪臭素。
趋化培养基:KH2PO40.5 g、K2HPO41.5 g、MgSO40.5 g、(NH4)2SO41.5 g,琼脂2 g,蒸馏水定容至1 L,pH自然。
分离培养基:在富集驯化培养液中加入粪臭素,使其终浓度为50 mg·L-1,琼脂20 g。
BUG+B 培养基:BUG 琼脂培养基57 g,加水至1 000 mL,121 ℃灭菌20 min后加50 g·L-1脱纤维羊血。
Dunham氏蛋白胨水溶液:蛋白胨1 g、NaCl 0.5 g、蒸馏水100 mL。
Ehrlich氏:对二氨基苯甲醛1 g、无水乙醇95 mL、浓盐酸25 mL。
淀粉培养基:蛋白胨10 g、NaCl 5 g、牛肉膏5 g、可溶性淀粉10 g、琼脂15 g、蒸馏水1 000 mL。
1.2 试验方法
1.2.1 样品采集与预处理
从养殖场不同羊粪堆放处取样,每堆多点取样后混合成一个样品,每个样品500 g。低温保存带回实验室,共采集样品10个。
1.2.2 粪臭素母液的制备
将粪臭素0.5 g 溶于100 mL 无水乙醇中,配制成5 g·L-1的粪臭素母液。用0.2 μm 的有机相滤膜过滤除菌,放置于4 ℃冰箱,备用。
1.2.3 微生物菌株的富集驯化培养
将粪臭素母液加到250 mL 三角瓶中,待乙醇挥发后加入60 mL 无机盐培养液L2,振荡混匀,使粪臭素的终浓度为10 mg·L-1。将0.1 g 样品加入培养液中,以不加样品的培养液为对照,每处理3 个重复,28 ℃、180 r·min-1摇床振荡培养7 d,作为第1 个周期富集培养液。取第1 个周期富集驯化后的菌液10 mL,加入到60 mL 新配制的加有更高浓度粪臭素的富集培养液中,28 ℃、180 r·min-1摇床培养7 d,以相同方法连续驯化5 个周期。在第5 个周期,驯化培养液中粪臭素含量达100 mg·L-1。
1.2.4 粪臭素降解菌的分离
取最后一次富集驯化的菌液,稀释涂布于含粪臭素50 mg·L-1的分离培养基上,28 ℃恒温培养3 d。挑取单菌落进行纯化,-20 ℃保存。
1.2.5 降解粪臭素优势菌株的筛选
将纯化后的菌株划线接种于L2 培养基,在菌体表面撒上5 mg的粪臭素,28 ℃恒温培养,感官法判断臭味降解程度,选取臭味降解程度较高的菌株,将该菌株保存于30%的无菌甘油中,备用。
1.2.6 粪臭素降解菌对粪臭素的趋化性
采用点滴平板趋化方法测试降解菌株对粪臭素的趋化反应。吸取1 mL Rp3 菌株的菌悬液(OD600=0.8,109CFU·mL-1)加入到温度为40 ℃的趋化培养基中,混和均匀,倒平板。凝固后,在平板中央放置少量粪臭素,28 ℃静置培养2 d,观察趋化反应圈,并拍照。
1.2.7 菌株Rp3对粪臭素降解的效果
(1)粪臭素标准曲线的绘制
称取粪臭素标准样品10 mg,置于10 mL 容量瓶中,用乙醇配制成1 mg·mL-1标准储备液。依次稀释,得到0、1、5、10、15、20、25 μg·mL-1标准溶液,经0.2 μm 有机滤膜过滤,HPLC 法测定其峰面积,每个浓度重复测定三次。以进样浓度和所得峰面积建立线性回归方程。
色谱条件:色谱柱为Hypersill BDS C18 柱(250 mm×4.6 mm,5 μm);柱温为室温;紫外检测波长254 nm;流动相为甲醇∶水(体积比为90∶10);流速1 mL·min-1;进样量10 μL。
(2)粪臭素在无机盐培养液中的添加回收率
在20 mL L2 培养液中添加粪臭素标准液,使其添加浓度分别为10、20、50、100 mg·L-1,每个添加浓度3 次重复。加入适量甲醇,150 Hz 超声振荡提取10 min,过0.22 μm滤膜,HPLC检测。检测条件同上。
(3)菌株Rp3对粪臭素的降解率
在灭菌的50 mL 三角瓶中加入粪臭素的乙醇溶液,挥发尽溶剂,分别加入灭菌的20 mL 无机盐培养液L2,150 Hz 超声振荡10 min,使三角瓶中粪臭素含量分别为50 mg·L-1和100 mg·L-1。按5%(OD600=0.8)的接种量加入Rp3 菌株的菌悬液,28 ℃、180 r·min-1振荡培养,于0、12、24、36、48 h 取样测定。同时设不接种细菌但含相同浓度粪臭素的无机盐培养液为对照;另设一个培养液中接种菌株Rp3 菌悬液的处理,检测菌悬液细胞提取物对粪臭素的降解效果,每个处理3重复,于0、12、24、36、48 h提取粪臭素。
粪臭素提取:将上述培养液加入等体积甲醇,5 000 r·min-1离心10 min,吸取1 mL 溶液,0.22 μm 有机滤膜过滤,4 ℃保存,待测。如提取液浓度太高,需进行稀释后再进行HPLC检测。检测条件同上。
1.2.8 Rp3菌株生物学特性研究
(1)粪臭素浓度对菌株生长的影响
将菌株接种于粪臭素含量为50、100、150、200、250、300 mg·L-1的无机盐培养液中,28 ℃、180 r·min-1振荡培养48 h,测定OD600值。
(2)pH值对菌株生长的影响
将菌株接种于初始pH 值分别为4、5、6、7、8、9 的LB 培养液中,28 ℃、180 r·min-1振荡培养48 h,测定OD600值。
(3)NaCl含量对菌株生长的影响
将菌株接种于NaCl 含量分别为0、2%、4%、6%、8%、10%、12%、14%的LB 培养液中,28 ℃、180 r·min-1振荡培养48 h,测定OD600值。
1.2.9 菌株Rp3的鉴定
(1)菌落形态观察
将活化好的Rp3 菌株稀释涂布于无机盐固体培养基L2,28 ℃恒温培养,定期观察菌落形态。
(2)菌体特征观察
挑取少量培养24 h 的菌株Rp3 的菌体于载玻片上无菌水中涂抹均匀,自然干燥,2%结晶紫染色,在100倍油镜下观察[13]。
(3)生理生化特征
部分生理生化指标的测定及方法参考文献[14]。
①革兰氏鉴定:取一滴新鲜配制的3%KOH 滴到干净的载玻片上,然后用无菌牙签挑取少许培养20~24 h 的菌株Rp3,与KOH 溶液混和,30 s 内向上拉,观察是否能拉出黏丝。能拉出黏丝为阴性菌,相反则为阳性菌。以已知的G-菌为对照菌株。
②过氧化氢酶鉴定:将培养24 h 的菌株Rp3,用接种环挑取一环于已滴有3%过氧化氢的载玻片上,如有气泡产生则为阳性,无气泡为阴性。
③吲哚试验:将菌株Rp3 接种于Dunham 氏蛋白胨水溶液中,37 ℃培养24~48 h(可延长4~5 d),于培养液中加入二甲苯2 mL,摇匀,静置,沿管壁加入Eh⁃rlich氏2 mL。显红色说明产吲哚。
④淀粉水解试验:将菌株Rp3 点接在平板上,37 ℃恒温培养24 h,滴加少量碘液,菌落周围出现无色水解圈说明能够产生水解酶。
(4)16S rRNA基因序列扩增与分析
用细菌基因组提取试剂盒(天根生化科技有限公司,北京)提取Rp3菌株的总DNA,用细菌16S rRNA基因通用引物进行PCR 扩增[15]。上游引物为27F:5′-AGAGTTTGATCATGGCTCAG-3′;下游引物为1492R:5′-ACGGTTACCTTACCTTGTTACGACTT-3′。
反应体系(50 μL):DNA 模版5 μL,上游引物2 μL,下游引物2 μL,T3 1×SuperMix 41 μL。
PCR 反应条件:94 ℃预变性10 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,循环32 次,最后72 ℃延伸10 min。4 ℃保存样品。
采用3%琼脂糖凝胶电泳对PCR 扩增产物进行检测,PCR 产物送擎科生物公司进行测序。所得16S rRNA 基因序列拼接完整后与NCBI 数据库中的已知序列进行BLAST 比对,采用MEGA 7.0 软件构建Rp3菌株的16S rRNA基因序列系统发育树。
(5)Biolog鉴定[16]
将Rp3 菌株接种至BUG+B 培养基上,28 ℃恒温培养16 h。培养好的菌株转接于IF-A 接种液中,得菌悬液;调节菌悬液浊度为90%~98%之间。
将上述菌悬液用12 道移液器按顺序加入微孔板中,28 ℃恒温培养46 h 后,放入Gen ⅢMicrostation biolog 自动微生物鉴定系统中进行分析。该部分实验在中国检验检疫科学研究院完成。
2 结果与分析
2.1 粪臭素降解菌株的筛选
从羊粪堆肥下土壤中共分离出3 株菌,分别编号为1#、2#、3#,利用感官法及趋化反应筛选降解效果最好的菌株。结果发现L2 培养基上的1#、2#菌株出现酸臭味,而3#菌株未产生酸臭味;在含有粪臭素的L2 培养基上接种3#菌株后臭味消失,说明3#菌自身不产生酸臭味并可以降解粪臭素。三株菌株中只有3#菌株在粪臭素周围形成趋化圈(图1),说明3#菌株对粪臭素降解能力最高,将其命名为菌株Rp3。

图1 菌株对粪臭素的趋化响应Figure 1 Chemotactic response of strains to skatole
2.2 降解率测定
2.2.1 粪臭素色谱图及标准曲线线性范围
粪臭素标准品的出峰时间为4.2 min左右(图2)。配制浓度依次为0、1、5、10、15、20、25 mg·L-1的粪臭素标准溶液,线性方程为y=10 743x-6 327.7,R2为0.996 5,线性良好。

图2 粪臭素标准品高效液相色谱图Figure 2 HPLC chromatography of standard skatole
2.2.2 粪臭素的添加回收精确度及回收率
粪臭素的添加回收率测定结果(表1)表明,不同浓度的粪臭素添加到L2 培养液后的回收率为84.6%~93.7%,在60%~110%范围内,符合要求。粪臭素的提取方法的相对标准偏差为0.09%~4.80%,小于5%,说明提取方法的精确度良好。

表1 粪臭素的添加回收精确度和回收率Table 1 Accuracy and recovery rate of skatole
2.2.3 Rp3菌株对粪臭素的降解率
Rp3 菌株对粪臭素的降解率以及Rp3 菌株的生长情况见图3。从Rp3 菌株生长曲线可知:Rp3 菌株在两种浓度粪臭素处理中的生长趋势基本相同,在0~36 h,处于指数生长期,36~48 h时,生长速率渐缓,进入稳定期;但Rp3菌株在添加100 mg·L-1粪臭素的无机盐培养液中生长量低于其在粪臭素浓度为50 mg·L-1处理中的生长量。从粪臭素的降解曲线可知:在两种浓度下,Rp3菌株对粪臭素的降解趋势相似,均在12~24 h时对粪臭素的降解逐渐增强,但100 mg·L-1浓度处理的降解速率有所减慢。当粪臭素初始浓度为50 mg·L-1,接种Rp3菌株后24 h,粪臭素的降解率达100%;当粪臭素初始浓度提高至100 mg·L-1时,接种Rp3菌株后36 h和48 h,粪臭素的降解率分别为95.5%和98.4%。

图3 Rp3菌株的生长量及其对粪臭素的降解能力Figure 3 The growth of strain Rp3 and its skatole-degrading ability
2.3 Rp3菌株生长特性
2.3.1 不同粪臭素浓度对Rp3菌株生长的影响
Rp3 菌株在无机盐培养液中的生长情况因粪臭素的浓度不同而异(图4)。当粪臭素浓度为50 mg·L-1和100 mg·L-1时,菌株生长较好,两处理间差异不显著;粪臭素浓度增加至150 mg·L-1以上时,Rp3菌株生长受到严重抑制,且与100 mg·L-1以下浓度的菌株生长存在显著差异(P<0.05)。

图4 不同粪臭素浓度下Rp3菌株生长情况Figure 4 Growth of strain Rp3 with different concentrations of skatole
2.3.2 pH值对Rp3菌株生长的影响
培养液的初始pH 值对Rp3菌株生长有一定影响(图5)。pH<6 和pH>8 时,Rp3 菌株生长受到明显抑制(P<0.05);pH 7~8适宜Rp3菌株的生长。

图5 初始pH对Rp3菌株生长的影响Figure 5 Growth of strain Rp3 in LB broth with different initial pH
2.3.3 盐度对Rp3菌株生长的影响
如图6 所示,在培养基中NaCl 浓度为0~10%时,Rp3 菌株能够正常生长,说明Rp3 菌株具有较强的耐盐性;但是当NaCl浓度增加至12%和14%时,Rp3 菌株生长受到严重抑制,与NaCl 浓度为0~10%时差异显著(P<0.05)。

图6 不同盐度下Rp3菌株生长情况Figure 6 Growth of strain Rp3 at different salinity
2.4 菌株鉴定
2.4.1 形态学特征
菌株Rp3 在L2 培养基上培养至7 d 时,菌落呈圆形,粉红色,不透明,表面光滑(图7A-a1、a2);培养至27 d时,菌落变大,菌落呈圆形,菌落边缘至中心颜色由淡粉色至粉红色,不透明,表面光滑,边缘不规则,呈花瓣状(图7A-a3、a4)。培养24 h 时,菌体呈球状、杆状两种不同形态(图7B)。
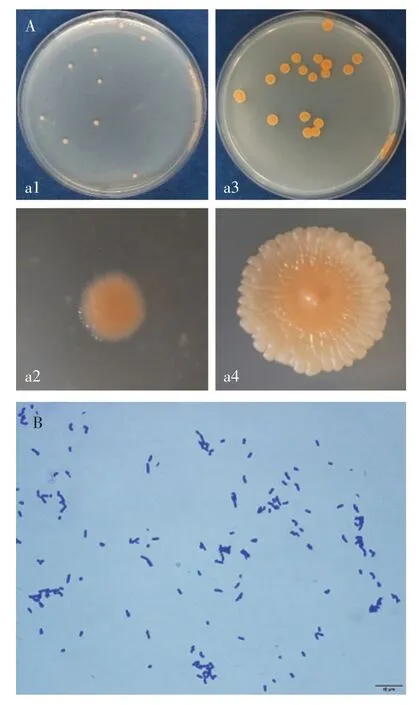
图7 菌株Rp3的菌落形态和菌体形态特征Figure 7 Colony and cell morphological characteristics of strain Rp3
2.4.2 生理生化特征
对菌株Rp3部分生理生化特征的测定结果表明:Rp3 菌为革兰氏阳性菌,能够产生过氧化氢酶,不能产吲哚及解淀粉酶。
2.4.3 16S rRNA基因序列扩增与分析
以Rp3 菌株基因组DNA 为模板,使用16S rRNA基因通用引物(27F 和1492R)进行PCR 扩增,获得一条1 500 bp 左右的DNA 条带,将序列提交到GenBank数据库中,登录号为MT664723。与NCBI数据库中红球菌属多个模式菌株Rhodococcus pyridinivorans(GCA_900105195.1)、R.ruber(GCA_002741725.1)和R.opacus(GCA_003626495.1)以及大肠杆菌Escherichia coli(GCA_000008865.2)比对,Rp3 菌株与多株Rhodococ⁃cus属的序列相似度超过98%。构建菌株Rp3 系统发育树(图8),结果显示,菌株Rp3属于Rhodococcussp.。

图8 基于16S rRNA基因序列构建Rp3菌株的系统发育树Figure 8 Phylogenetic tree of strain Rp3 based on the 16S rRNA gene sequence analyses
2.4.4 Biolog系统鉴定结果
Rp3菌株对Biolog微孔板碳源与化学敏感物质利用情况如表2、表3所示:其可利用碳源为D-果糖、D-山梨醇等16种碳源,对亚碲酸钾等9种化学物质敏感。

表2 Biolog GenⅢ微孔板碳源利用情况Table 2 Utilization of carbon source in Biolog Gen Ⅲmicroplate by strain Rp3

表3 Rp3菌株对化学物质的抗性Table 3 Strain Rp3 resistance to chemicals in Biolog Gen Ⅲmicroplate
经Biolog Gen Ⅲ微孔板培养以及Biolog细菌鉴定系统分析,用可能性(PROB)、相似性(SIM)和距离(DIS)三个参数来判断结果。PROB=0.719、SIM=0.719、DIS=4.000<5,与数据库相应的数据匹配良好,在ID 地址栏显示最佳的匹配名称为Rhodococcus pyri⁃dinivorans。
根据16S rRNA 基因序列分析和Biolog 系统鉴定结果,将Rp3菌株鉴定为Rhodococcus pyridinivorans。
3 讨论
粪臭素是一种环境污染物,前人已经开展了粪臭素降解菌的研究,并获得了一些具有降解能力的菌株。Gu 等[10]发现产甲烷菌群在硫还原条件下能够降解100 μmol·L-1的粪臭素;恶臭假单胞菌LPC24 降解2.0 mmol·L-1的粪臭素需要30 d[17];Meng 等[18]的研究发现乳酸菌以2.5%的接种量接种于培养液后,37 ℃培养120 h 对1 μg·mL-1的粪臭素降解率达65%。上述菌株只能对低浓度的粪臭素进行降解,有的还需要比较特殊的条件。最新研究表明不动杆菌NTA1-2A和NTA1-6A 对粪臭素的降解能力较高。这两株菌在粪臭素浓度为196.75 mg·L-1时,培养6 d 对粪臭素的降解率分别为85%和91%[19]。本研究从羊粪堆肥下土壤中分离出的红球菌Rp3 对50 mg·L-1的粪臭素完全降解的时间为24 h,对100 mg·L-1的粪臭素降解率达到95%以上需要36 h,其降解能力远高于目前已经报道的降解菌株,是一株非常有潜力的粪臭素降解菌株。红球菌是具有工业应用价值的细菌类群,对多种有机化合物有转化或降解作用,利用红球菌生产丙烯酰胺已经实现了工业化,利用红球菌生产生物表面活性剂及生物絮凝剂[20]等已有报道,但红球菌具有专一性,目前未见红球菌应用于粪臭素或堆肥臭味物质降解的报道。Rp3 菌株是红球菌中首次发现能够降解粪臭素的菌株,该菌株的获得为堆肥中粪臭素的降解提供了新的资源。
趋化性是细菌适应外界化学环境而作出的行为反应,是细菌为寻找碳源或能源而进化出的一种选择优势[21]。该方法曾经广泛用于环境污染物降解菌株的筛选[22-25]。在粪臭素降解菌株筛选中,本研究采用了感官法和趋化性测定相结合的方法对降解菌株进行初筛,大大缩短了降解菌株的初筛时间,提高了效率。该方法也可以应用于其他具有类似特性的功能菌株的研究中。Rp3菌株对粪臭素具有趋化响应,说明趋化性可能是该菌株降解性的重要特性之一,可应用于后续研究中,通过趋化性判断菌株降解能力。
红球菌Rp3不仅具有高效降解粪臭素的能力,而且具有较高的耐盐能力和较宽的pH 值适应范围,这可能与其菌株的来源有关。新鲜羊粪的盐分和pH均较高,生存在该环境中的细菌因对环境的适应而具有较强的耐盐能力,有利于将其应用于堆肥环境。有关其对粪臭素的降解机理,以及在堆肥环境中的应用效果还需要进一步研究。
4 结论
(1)从羊粪堆肥下土壤中分离获得能有效降解堆肥臭味物质粪臭素的菌株Rp3。该菌株与浓度为50 mg·L-1的粪臭素共培养24 h 的降解率达100%;与100 mg·L-1的粪臭素共培养48 h的降解率达98.4%。
(2)粪臭素高效降解菌Rp3 为Rhodococcus pyri⁃dinivorans,具有很强的耐盐性,是一株很有潜力的堆肥臭味物质降解菌。

