SIRT1抑制ox-LDL诱导血管平滑肌细胞泡沫化的机制研究
周 毅,王雪笠,康玉莱,张明杰,杨海梅,郭 露,张莉莉
动脉粥样硬化病变中,巨噬细胞和血管平滑肌细胞(VSMC)摄取大量脂质成分,在细胞内合成胆固醇酯,形成泡沫细胞,同时伴细胞因子和趋化因子等炎性介质的增多。尤其是在动脉粥样硬化中晚期,VSMC是泡沫细胞的主要来源[1]。但VSMC转化为泡沫细胞的具体机制目前尚不清楚。沉默信息调节因子1(SIRT1)是Sirtuins家族中的一员,广泛分布于真核细胞中,可使组蛋白和很多下游靶蛋白去乙酰化并调节其活性,进而调控能量、脂质和葡萄糖代谢,并参与细胞分化、代谢、修复和炎症反应等过程[2]。激活SIRT1可以上调肝细胞低密度脂蛋白(LDL)受体的表达从而促进LDL向肝细胞内转运和排出体外,最终降低血浆胆固醇水平[3]。在巨噬细胞中,激活SIRT1能够抑制细胞对氧化型低密度脂蛋白(ox-LDL)的摄取,进而抑制巨噬细胞源性泡沫细胞的形成[4]。泡沫细胞的堆积是动脉粥样斑块形成的基础,而脂质代谢紊乱是泡沫细胞形成的关键,上述研究提示SIRT1能够通过调控脂质转运抑制动脉粥样硬化病变进程。三磷酸腺苷结合盒转运子A1(ABCA1)可将细胞内的胆固醇和磷脂转运至细胞外的载脂蛋白,从而降低细胞内胆固醇含量,是细胞内胆固醇逆转运(RCT)途径的重要分子[5]。研究证实,ABCA1功能障碍导致高密度脂蛋白减少和细胞组织中脂质沉积[6]。同时,ABCA1失活还能增加胆固醇在肠道的吸收,表达主要受肝X受体α(LXRα)转录水平的调控[7]。LXRα是核激素受体蛋白质超家族成员,与维A酸X受体形成异二聚体后,能分别与ABCA1启动子区LXR反应元件(LXRE)结合,从而刺激ABCA1转录[8]。研究表明,SIRT1在巨噬细胞和肝细胞中能够通过去乙酰化和泛素化作用激活LXRα,进而上调细胞中ABCA1的表达[9]。在单核细胞泡沫化过程中,SIRT1可能通过激活LXRα-ABCA1/ABCG1信号通路抑制细胞的泡沫样变[10]。本研究旨在探讨SIRT1是否能够通过LXRα/ABCA1信号通路调控VSMC的脂质代谢,进而抑制ox-LDL诱导的细胞泡沫化。
1 材料与方法
1.1试剂 DMEM培养液、胎牛血清、PBS液购自美国Hyclone公司。SIRT1一抗购自美国Santa Cruz公司。ABCA1一抗、LXRα一抗购自中国碧云天公司。β-actin一抗及所有二抗购自北京中杉金桥生物技术有限公司。α-平滑肌肌动蛋白(α-SMA)一抗购自美国Abcam公司,所用荧光二抗购自江苏碧云天公司。SRT1720购自美国Selleck Chemicals公司,Nicotinamide购自美国Supelco公司。ox-LDL购自广州奕源生物科技有限公司。
1.2细胞培养 组织块贴壁法培养VSMC。取小鼠胸主动脉,用含青、链霉素的无菌PBS液润洗,仔细剥除纤维层和外膜。纵行剖开血管使内膜面向上,用眼科弯剪轻刮2~3遍以去除血管内皮细胞。更换培养皿,将血管中层组织剪切成1 mm3小块,接种于25 ml培养瓶中,组织块间隙大约0.5 cm,瓶内加入含20%胎牛血清的DMEM/高糖培养基,直立于37℃、5% CO2的无菌恒温培养箱中2~4 h,待组织块紧贴瓶底后轻轻翻转培养瓶,使培养基浸没组织块,3 d后第一次更换培养基。待组织块有细胞爬出,且足够传代后进行第一次传代,此后待细胞生长至瓶底面积的80%~90%即可传代培养。传代至第三代时,应用α-SMA对原代培养的VSMC进行鉴定。
1.3细胞分组 取5~10代细胞用于实验,细胞铺板培养,换无血清DMEM饥饿培养24 h。加入80 μg/ml ox-LDL诱导体外培养的C57BL/6J小鼠VSMC泡沫化,VSMC作为空白对照,Western blot法检测SIRT1的表达。应用SIRT1激动剂SRT1720(SRT,1 μmol/L)、抑制剂Nicotinamide(Nic,100 μmol/L),将培养细胞分为对照组(con组)、ox-LDL组、ox-LDL+SRT组、ox-LDL+Nic组,检测各组细胞中SIRT1、ABCA1及LXRα表达及对细胞泡沫化的影响。应用LXRα激动剂GW3965(10 μmol/L)和抑制剂GGPP(10 μmol/L)将细胞分为对照组(con组)、ox-LDL组、ox-LDL+GW3965组、ox-LDL+GGPP组,检测各组细胞ABCA1表达及细胞泡沫化情况。
1.4油红染色 用异丙醇配制0.5%油红O储存液备用。待染色组织或细胞用PBS液洗涤2次,4%多聚甲醛固定30 min。油红O储存液经滤纸过滤后与去离子水按照3︰2比例稀释成工作液,再次经滤纸过滤后静置10 min。PBS液清洗去除多聚甲醛,加入油红O工作液,避光染色30~60 min。去离子水冲洗去除多余染液后镜下观察。
1.5Western blot法分析蛋白表达 采用Western blot法分析细胞中SIRT1、ABCA1及LXRα蛋白表达水平。从小鼠主动脉或培养的VSMC中提取蛋白质样品。蛋白质样品通过10%的聚丙烯酰胺凝胶电泳并转移到聚偏二氟乙烯膜(PVDF)上。PVDF膜与抗SIRT1(1︰600)、抗ABCA1(1︰500)、抗LXRα(1︰2000)及抗β-actin(1︰2000)一抗体在4℃共同孵育过夜。洗涤后,PVDF膜与辣根过氧化物共轭二抗体在室温下孵育2 h。化学发光法曝光,通过Labworks4.6(UVP,Upland,CA,美国)测定蛋白表达。
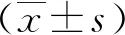
2 结果
2.1ox-LDL诱导VSMC源性泡沫细胞中SIRT1的表达 ox-LDL明显诱导VSMC泡沫化,油红染色可见细胞内大量红色脂滴形成,呈“戒环样”聚集于细胞周边。同时,ox-LDL组细胞中SIRT1的表达与con组相比显著下降(P<0.05)。见图1、图2。
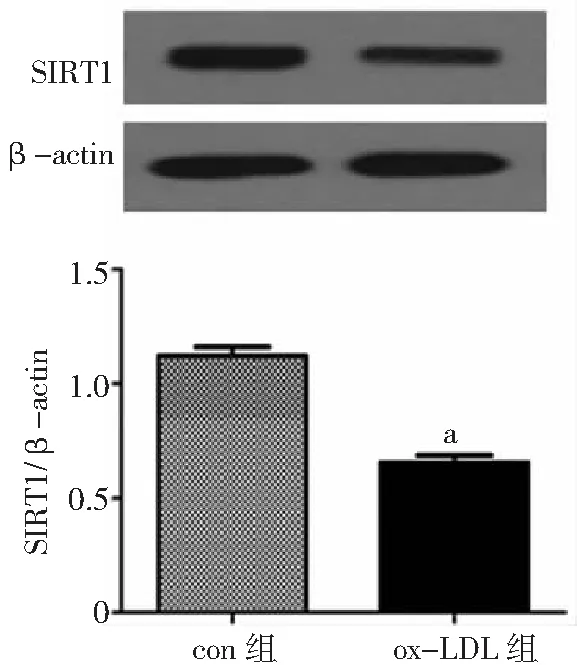
图1 Western blot法检测氧化型低密度脂蛋白诱导血管平滑肌细胞中SIRT1表达情况
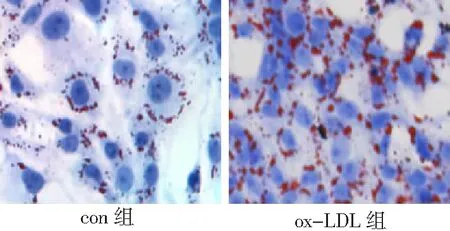
图2 油红染色检测氧化型低密度脂蛋白诱导血管平滑肌细胞泡沫化的程度(×400)
2.2SIRT1对VSMC源性泡沫细胞形成的影响 SRT可使VSMC中SIRT1水平显著升高(P<0.05),同时细胞内红色脂滴明显减少,泡沫化程度被明显抑制;应用Nic后,细胞中SIRT1的表达明显下降(P<0.05),细胞内红色脂滴显著增多。见图3、图4。
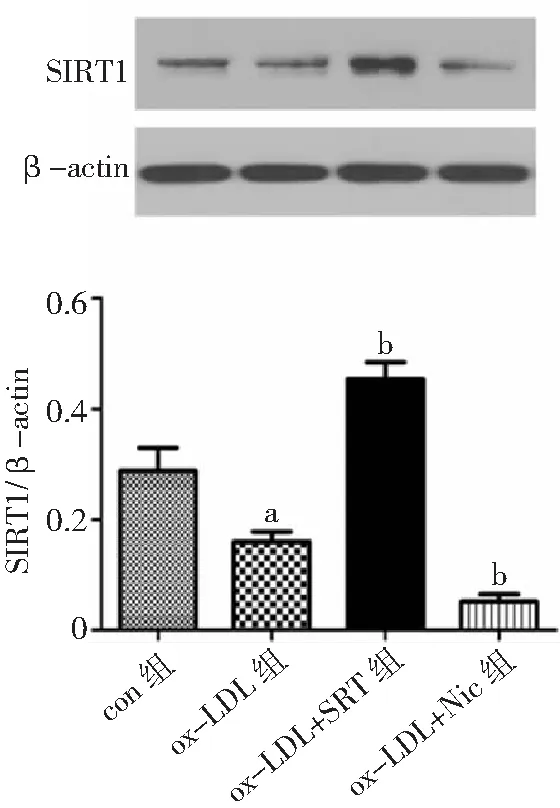
图3 Western blot法检测SIRT1对各组血管平滑肌细胞中SIRT1的表达
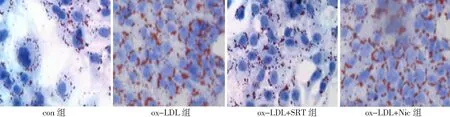
图4 油红染色检测SIRT1对各组血管平滑肌细胞泡沫化的影响(×400)
2.3SIRT1对VSMC源性泡沫细胞中ABCA1表达的影响 ox-LDL刺激培养VSMC 24 h后,细胞中ABCA1表达较con组显著降低(P<0.05)。应用SRT后VSMC中ABCA1表达较ox-LDL组显著升高(P<0.05);应用Nic则使VSMC中ABCA1表达显著降低(P<0.05)。见图5。
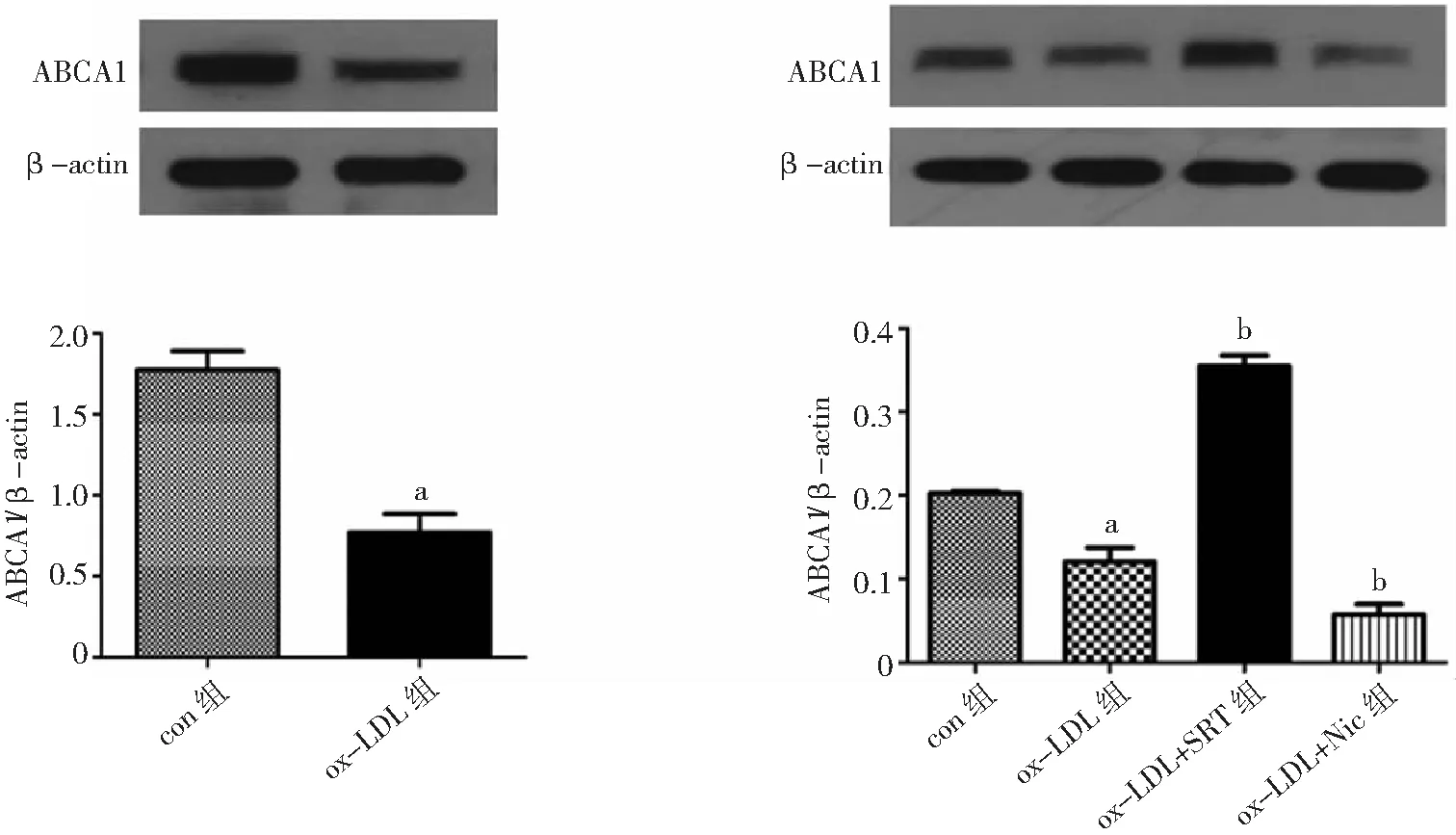
图5 SIRT1对血管平滑肌细胞源性泡沫细胞中ABCA1表达的影响
2.4LXRα介导VSMC中SIRT1对ABCA1表达的促进作用 进一步检测ox-LDL诱导VSMC源性泡沫细胞中LXRα的表达,结果发现ox-LDL组LXRα表达较con组显著降低(P<0.05);SRT可显著上调VSMC中LXRα的表达(P<0.05);应用Nic则使细胞中LXRα的表达进一步降低(P<0.05)。见图6。GW3965可显著上调ABCA1的表达(P<0.05),同时细胞中红色脂滴显著减少;而GGPP则使细胞中ABCA1表达进一步降低(P<0.05),油红染色阳性细胞数显著增多。见图7、图8。
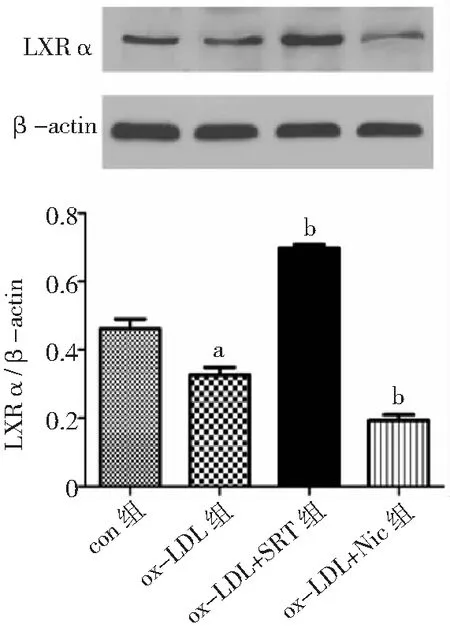
图6 Western blot法检测LXRα介导各组血管平滑肌细胞中LXRα的表达
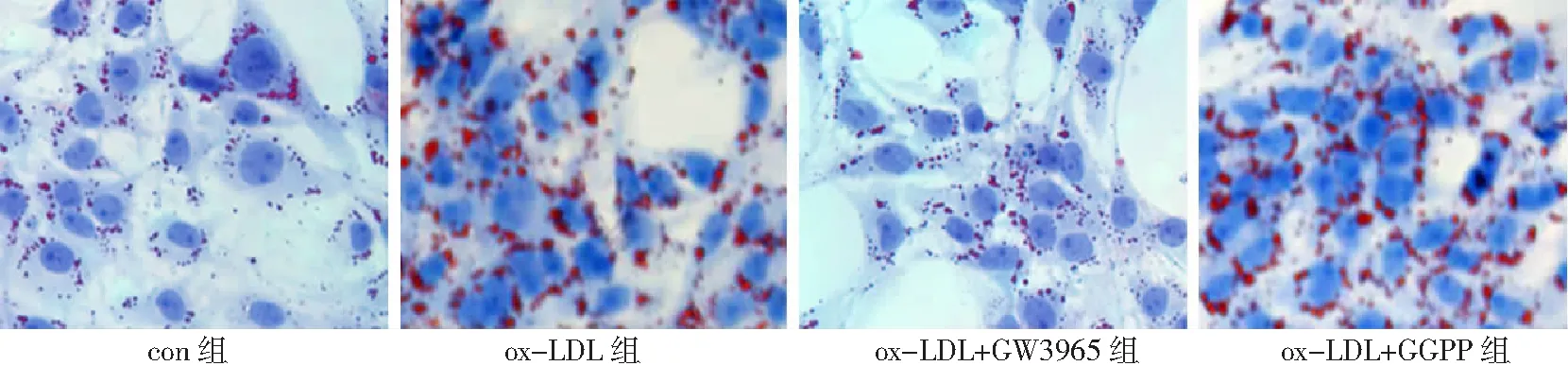
图8 油红染色检测LXRα介导各组血管平滑肌细胞泡沫化的程度(×400)
3 讨论
动脉粥样硬化是发生在动脉壁,以血管内皮下泡沫细胞大量堆积为特征的慢性血管性疾病。泡沫细胞是由巨噬细胞或VSMC摄取脂质成分,在细胞内大量合成胆固醇酯并形成脂质小体。泡沫细胞沉积是动脉粥样硬化的重要标志,也是构成粥样斑块的主要成分,抑制泡沫细胞的形成已成为动脉粥样硬化防治的重要内容。既往认为泡沫细胞主要为巨噬细胞源性,后来研究认为VSMC也具有在细胞内聚积胆固醇酯并泡沫样变的能力。在动脉粥样硬化中晚期,仅有30%的泡沫细胞为巨噬细胞源性,而45%为VSMC源性[11]。因此,深入研究VSMC源性泡沫细胞的形成机制,确定调节这一过程的关键因子,是延缓动脉粥样硬化进程的重要环节。
SIRT1是高度保守的烟酰胺腺嘌呤二核苷酸依赖性组蛋白去乙酰化酶的家族成员之一[12-14]。研究证实,SIRT1通过乙酰化内皮型一氧化氮合酶和增加一氧化氮生物利用度,起到调节内皮依赖性血管舒缩张力的作用[15],SIRT1过表达能够抑制ox-LDL诱导的人脐静脉内皮细胞凋亡[16],表明SIRT1对血管健康发挥有益作用。本研究结果显示,ox-LDL能显著诱导VSMC泡沫化;活化SIRT1能够显著减轻ox-LDL的作用,油红染色阳性细胞明显减少,而应用Nic抑制细胞中SIRT1表达后VSMC中脂质沉积明显增多。提示SIRT1可能为防治动脉粥样硬化的潜在靶点。
VSMC中脂质的聚集涉及细胞对脂质的摄取、胆固醇酯的胞内合成及RCT等过程。RCT是指外周细胞(包括动脉壁细胞)在各级脂质转运体作用下,将细胞中过剩的胆固醇经胆汁酸代谢排出体外。机体通过这一过程清除细胞内过量的胆固醇,抑制泡沫细胞的形成。RCT的关键步骤是由细胞膜上的ABCA1以ATP为能源进行物质转运,可将细胞内的胆固醇、磷脂等脂类物质转运至细胞膜外的载脂蛋白A-I(ApoA-I),从而清除细胞中的多余脂质。ABCA1在泡沫细胞形成和动脉粥样硬化病变发病过程中的重要作用已被各种临床和基础研究证实,血小板衍生生长因子可显著降低VSMC中ABCA1的表达,同时使ApoA-I介导的胆固醇外流显著减少[17]。Choi等[18]研究发现,动脉粥样硬化病变内膜VSMC中的ABCA1表达较中膜明显下降,伴有ApoA-I结合异常、高密度脂蛋白形成障碍及细胞内脂质含量显著增多。因此,ABCA1异常是引起VSMC中RCT障碍和胆固醇聚集的重要原因。为探究ABCA1在VSMC泡沫化中的作用,我们检测激活或抑制细胞中SIRT1时的ABCA1表达情况,结果表明在原代培养的VSMC中激活SIRT1能够上调细胞中ABCA1的表达,应用抑制剂抑制细胞中SIRT1的表达后VSMC中ABCA1的表达也明显下调。提示在VSMC源性泡沫细胞形成过程中,SIRT1是通过上调ABAC1的表达来抑制VSMC的泡沫化。
肝X受体(LXRs)是核受体超家族成员,是受配体激活的核转录因子,包括LXRα和LXRβ[19]。LXRs主要参与脂质和胆固醇代谢的调节[20],近年研究表明,LXRs通过与配体结合还参与炎症[21]和免疫功能[22]的调节。其中,LXRα广泛分布于肝脏、脂肪、肠道等组织,在体内胆固醇代谢中起调节作用[23]。LXRα活化后与上游靶基因LXRE结合,调节包括ABCA1在内的多种基因表达,参与细胞内胆固醇流出,减少细胞内胆固醇蓄积[24]。研究显示,SIRT1可使组蛋白和很多下游靶蛋白去乙酰化并调节其活性,其中包括LXRs。抑制SIRT1的表达能够减弱LXRs在心肌损伤中的保护作用[25]。巨噬细胞源性SIRT1能够在K432位点通过去乙酰化作用激活LXRα,进而上调LXRα靶蛋白ABCA1等的表达,并促进细胞内胆固醇的外流[9]。为探讨LXRα在激活SIRT1时是否减轻ox-LDL诱导VSMC泡沫化的作用,我们分别检测予SRT及Nic时细胞中LXRα的表达情况。结果表明,激活SIRT1后LXRα的表达随之升高,抑制SIRT1后LXRα的表达随之降低。之后,我们在细胞中分别加入LXRα激动剂GW3965及抑制剂GGPP后检测ABCA1的表达情况,结果显示激活LXRα后ABCA1的表达上调,油红染色阳性细胞较ox-LDL组明显减少;抑制LXRα后ABCA1表达明显下降,细胞中脂质沉积情况又明显增强。
综上,激活VSMC中SIRT1能够抑制ox-LDL诱导的细胞泡沫化,这一过程是通过SIRT1激活下游靶蛋白LXRα,进而上调细胞中ABCA1的表达而实现的。本研究为抑制VSMC源性泡沫细胞形成、改善动脉粥样硬化程度提供了新的理论依据。

