麦冬须根正丁醇萃取物化学成分的分离与鉴定
田泽群 王佩 王涛 王昊 梅文莉 于淼 丁立新 戴好富
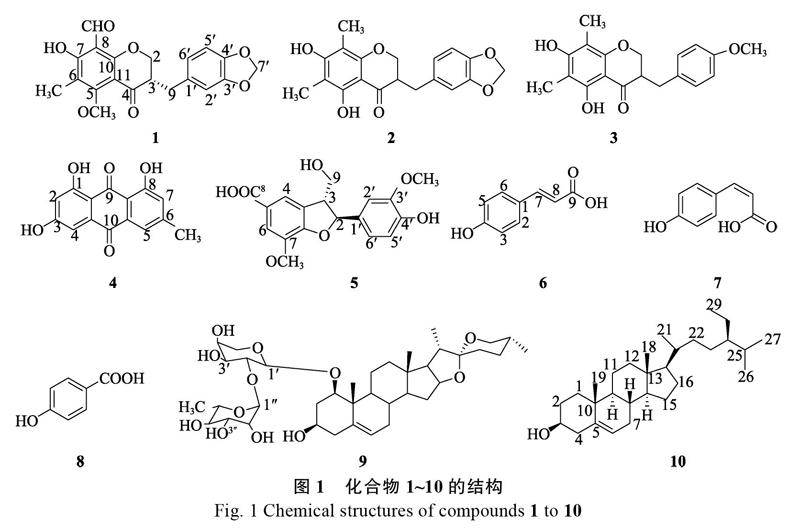
摘 要:为了研究麦冬须根中的化学成分,本研究采用大孔吸附树脂、ODS和Sephadex LH-20多种柱色谱技术对麦冬须根乙醇提取物的正丁醇萃取物进行分离纯化;通过波谱数据与理化性质分析并结合文献进行化合物结构鉴定。从麦冬须根的正丁醇萃取物中分离得到10个化合物,其结构分别鉴定为5-甲氧基-6-甲基-7-羟基-8-醛基-3S-(3?, 4? -亚甲二氧基苯)-4-二氢色原酮(1)、甲基麦冬黄烷酮A(2)、甲基麦冬黄烷酮B(3)、大黄素(4)、肥牛木素(5)、E-对羟基桂皮酸(6)、Z-对羟基桂皮酸(7)、4-羟基苯甲酸(8)、25R-spirost-5-ene-1β, 3β-diol 1-O-[α-L-rhamnopyranosyl-(1→2)-α-L-arabinopyranoside](9)和β-谷甾醇(10)。其中化合物1为新的高异黄酮类化合物,命名为麦冬黄烷酮D?,化合物5和7为首次从百合科植物中分离得到,化合物9为首次从该植物中分离得到。
关键词:麦冬;须根;化学成分;高异黄酮類
Abstract: To study the chemical constituents from the fibrous roots of Ophiopogon japonicus, ten compounds were isolated from the n-butanol extract of the fibrous roots by a combination of various chromatographic techniques, such as macroreticular resin, ODS and Sephadex LH-20 column chromatographies. The chemical structures of the compounds were elucidated as 5-methoxy-6-methyl-7-hydroxy-8-aldehydo-3S-(3?, 4?-methylenedioxybenzyl)chroman-4-one (1), Methylophiopogonanone A (2), Methylophiopogonanone B (3), Emodin (4), Celignan (5), E-p-hydroxycinnamic acid (6), Z-p-hydroxycinnamic acid (7), 4-hydroxybenzoic (8), 25R-spirost-5-ene-1β, 3β-diol 1-O-[α-L-rhamnopyranosyl-(1→2)-α-L-arabinopyranoside] (9), and β-Sitosterol (10) based on spectroscopic analysis, physiochemical properties and literature data. Compound 1, named as asophiopogonanone D?, was isolated and identified as a new compound. Compounds 5 and 7 were isolated from the plants of the family Liliaceae for the first time, while compound 9 was obtained from this plant for the first time.
Keywords: Ophiopogon japonicus; fibrous roots; chemical compositions; homoisoflavones
麦冬[Ophiopogon japonicus (L.f.) Ker-Gawl.]为百合科(Liliaceae)沿阶草属(Ophiopogon)多年生常绿草本植物[1],别名麦门冬或沿阶草,原产于我国,在我国四川和浙江等地均有种植,在日本、越南和印度等地也有分布[2]。麦冬是中国传统中药,始载于《神农本草经》,以块根入药,列为上品[3]。其为养阴生津,润肺清心之药,主治肺燥干咳、喉痹咽痛、内热消渴、心烦失眠和肠燥便秘等[1]。现代药理研究表明,麦冬具有降血糖[4]、抗炎[5]、抗肿瘤[6]、免疫调节[7]和保护心脑血管[8]等多种药理活性,是临床常用药物生脉散和生脉注射液的主要原料之一,用于治疗冠心病、心绞痛等病症。
麦冬以块根入药,研究表明其化学成分包括甾体皂苷类、高异黄酮类、多糖、有机酸、糖苷和环二肽等[9-10]。然而在生产中产生了大量须根,有待利用。据报道,麦冬中主要的活性化学成分高异黄酮类和甾体皂苷类化合物在须根中的含量高于块根[11-12],为进一步研究须根与块根化学成分的异同和麦冬资源的综合利用提供依据,本研究以麦冬须根为研究对象,采用大孔吸附树脂、ODS和Sephadex LH-20等多种柱色谱技术对麦冬须根乙醇提取物的正丁醇萃取物进行分离纯化,并通过波谱数据和理化性质分析对化合物进行结构鉴定。
1 材料与方法
1.1 材料
1.1.1 植物材料 麦冬须根购于中国四川省绵阳市,经中国热带农业科学院热带生物技术研究所王军博士鉴定为百合科沿阶草属植物麦冬[Ophiopogon japonicus (L.f.) Ker-Gawl.]的须根,凭证标本(DAI00022)现存放于中国热带农业科学院热带生物技术研究所。
1.1.2 仪器与试剂 N-1200B立式旋转蒸发仪,上海爱朗仪器有限公司;SUMMIT P680A半制备型高效液相色谱仪, 美国Dionex公司;Bruker AV-500型超导核磁仪,瑞士Bruker公司;HR-ESI-MS质谱仪,瑞士Bruker公司;分析型高效液相色谱仪,美国Agilent Technologies;RP-C18(20~45μm), 日本Fuji Silysa 公司;YMC-packed色谱柱(C18, 250 mm×4.6 mm, ID),日本YMC公司;Sephadex LH-20,德国Merck公司;D101大孔吸附树脂,青岛海洋化工集团公司;薄层层析硅胶板(TLC),青岛海洋化工集团公司;硅胶(60~80目,200~300目),青岛海洋化工集团公司;国产分析纯丙酮和氯仿,广州化工;色谱纯甲醇,天津科密欧。
1.2 方法
新鲜麦冬须根25 kg,干燥、粉碎后经乙醇加热回流提取3次,每次2 h,减压浓缩得到乙醇提取物,将乙醇提取物分散于水中形成悬浊液,依次用等体积的乙酸乙酯和正丁醇萃取3次,减压浓缩,得到乙酸乙酯萃取物和正丁醇萃取物。
正丁醇萃取物(713.3 g)经大孔吸附树脂柱,以甲醇-水(0∶1→1∶0,V/V)为洗脱剂,梯度洗脱,经TLC分析后合并得到5个流份(Fr. A~Fr. E)。Fr. E(910.5 mg)经ODS柱色谱,以甲醇-水(1∶9→1∶0,V/V)为洗脱剂,梯度洗脱,得到11个流份(Fr. E-1~Fr. E-11)。Fr. E-4(80.2 mg)经硅胶柱色谱,以石油醚-乙酸乙酯(50∶1和0∶1,V/V)为洗脱剂,依次洗脱,得到2个流份(Fr. E-4-1和Fr. E-4-2)。Fr. E-4-2(40.0 mg)经Sephadex LH-20凝胶柱色谱,以甲醇为洗脱剂洗脱,得到化合物1(2.0 mg)、2(0.8 mg)、3(0.7 mg)和4(2.1 mg)。Fr. C(74.3 g)经硅胶柱色谱,以氯仿-甲醇-水(4∶1∶0、3∶1∶0和7∶3∶0.5,V/V/V)为洗脱剂,依次洗脱,得到21个流份(Fr. C-1~Fr. C-21)。Fr. C-1(76.2 mg)经硅胶柱色谱,以石油醚-氯仿(1∶0→1∶1,V/V)为洗脱剂,依次洗脱,得到化合物10(7.4 mg)。Fr. C-13(4.85 g)经ODS柱色谱,以甲醇-水(1∶8→1∶0,V/V)为洗脱剂,梯度洗脱,得到10个流份(Fr. C-13-1~Fr. C-13-10),Fr. C-13-7(1.5 g)经硅胶柱色谱,以氯仿-丙酮-甲醇(5∶1∶1→2∶1∶1)为洗脱剂,梯度洗脱,得到化合物9(8.8 mg)。Fr. C-4(1.0 g)经Sephadex LH-20凝胶柱色谱,以甲醇为洗脱剂洗脱,得到9个流份(Fr. C-4-1~Fr. C-4-9)。Fr. C-4-7(84.9 mg)经硅胶柱色谱,以石油醚-乙酸乙酯(5∶1→0∶1,V/V)为洗脱剂,梯度洗脱,得到11个流份(Fr. C-4-7-1~Fr. C-4-7-11)。Fr. C-4-7-10(21.2 mg)经半制备型高效液相色谱,以C-18柱为色谱柱,以40%甲醇水溶液(0.05%三氟乙酸)為洗脱剂,得到化合物5(tR 14.82 min, 11.7 mg)。Fr. C-4-7-7(9.1 mg)经制备薄层色谱(氯仿∶甲醇=4∶1),得到化合物6(3.6 mg)、化合物7(2.4 mg)和化合物8(1.2 mg)。
2 结果与分析
本研究从麦冬须根的正丁醇提取物中分离得到10个单体化合物,其结构分别被鉴定为5-甲氧基-6-甲基-7-羟基-8-醛基-3S-(3?, 4?-亚甲二氧基苯)- 4-二氢色原酮(1)、甲基麦冬黄烷酮A(2)、甲基麦冬黄烷酮B(3)、大黄素(4)、肥牛木素(5)、E-对羟基桂皮酸(6)、Z-对羟基桂皮酸(7)、4-羟基苯甲酸(8)、25R-spirost-5-ene-1β, 3β-diol 1-O-[α-L-rhamnopyranosyl-(1→2)-α-L-arabinopyranoside](9)和β-谷甾醇(10),其中化合物1为新化合物。化合物1~10的结构见图1。
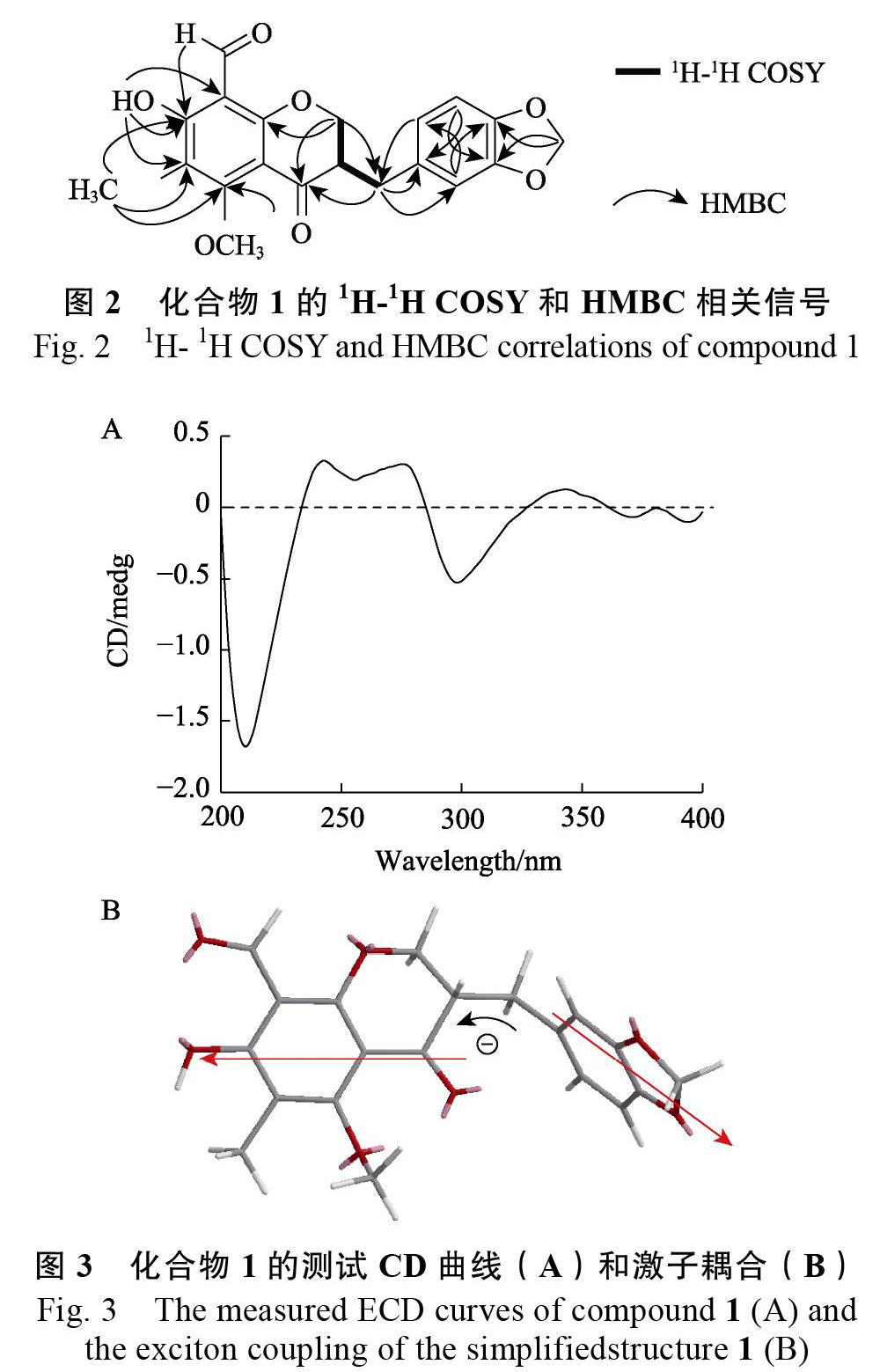
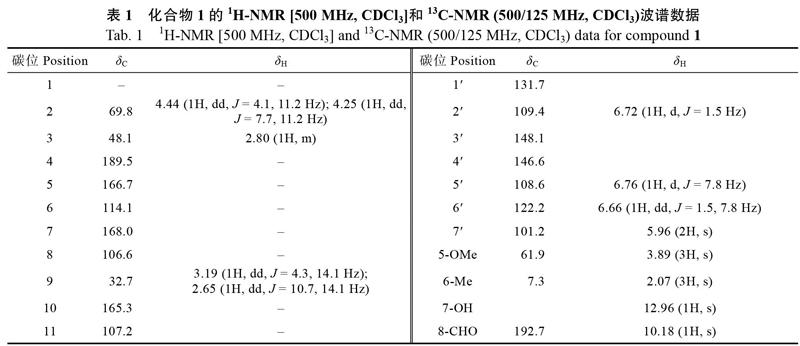
化合物1:黄色粉末。[α]20D=+60.58 (c 0.20, MeOH);高分辨质谱HR-ESI-MS给出分子离子峰m/z: 393.0929 [M+Na]+峰(计算值:393.0945),结合其1H-NMR谱和13C-NMR谱确定其分子式为C20H18O7,不饱和度为12。由表1可见,1H-NMR谱分析提示结构中含有1个ABX耦合系统δH 6.76 (1H, d, J=7.8 Hz),6.72 (1H, d, J=1.5 Hz) 和6.66 (1H, dd, J=1.5, 7.8 Hz);此外,还含有1个单峰的甲基氢信号δH 2.07 (3H, s);1个甲氧基信号δH 3.89 (3H, s);1个亚甲二氧基信号δH 5.96 (2H, s);1个含氧亚甲基上的2个氢信号δH 4.44 (1H, dd, J=4.1, 11.2 Hz) 和4.25 (1H, dd, J=7.7, 11.2 Hz);1个与苯基相连的亚甲基信号δH 3.19 (1H, dd, J=4.3, 14.1 Hz) 和2.65 (1H, dd, J=10.7, 14.1 Hz);1个次甲基信号δH 2.80 (1H, m);1个醛基信号δH 10.18 (1H, s)及1个酚羟基信号δH 12.96 (1H, s)。13C-NMR谱结合DEPT数据分析提示该化合物含有20个碳原子,包括1个甲基 (Me) δC 7.3;1个甲氧基 (OMe) δC 61.9;3个亚甲基 (CH2) δC 101.2,69.8和32.7;3个sp2次甲基 (CH) δC 122.2,109.4,108.6和1个sp3次甲基δC 48.1;10个低场区季碳 (C) δC 189.5,168.0,166.7,165.3,148.1,146.6,131.7,114.1,107.2和106.6;1个醛基碳 (CHO) δC 192.7。以上数据结合图2二维核磁数据,H-2与H-9和H-3之间的1H-1H COSY相关信号,HMBC谱中H-2与C-4,C-9和C-10之间的相关信号,H-9与C-4,C-1?,C-2?和C-6?之间的相关信号,H-5?与C-3?之间的相关信号及H-2?与C-4?之间的相关信号,给出化合物1的高异黄酮骨架[13]。HMBC谱中醛基氢δH 10.18 (1H, s)与C-7之间的相关信号,酚羟基氢δH 12.96 (1H, s)与C-7,C-8和C-6之间的相关信号,甲基δH 2.07 (3H, s)与C-6,C-5和C-7之间的相关信号,甲氧基δH 3.89 (3H, s)与C-5之间的相关信号以及H-7?与C-3?和C-4?之间的相关信号,提示化合物1为5-甲氧基-6-甲基-7-羟基-8-醛基-3?, 4?-亚甲二氧基高异黄酮。以上数据与文献数据[13]比对,与化合物ophiopogonanone D基本一致,因此,化合物1的平面结构与ophiopogonanone D一致,而其旋光值与文献报道ophiopogonanone D{[α]20D=-10.0 (c 0.20, MeOH)}相反,故化合物1应为ophiopogonanone D的对映异构体。化合物1中2个发色团(1个苯环和1个色酮)的激发态的激子耦合产生其CD Cotton效应,用于通过Harada-Nakanishi 非经验规则确定化合物1的绝对构型[14]。图3中,λmax 298 nm处负的长波Cotton效应和λmax 278 nm处正的短波Cotton效应表明处于前侧的发色团相对于后侧的发色团应为逆时针排列,因此,化合物1的绝对构型为3S。以上数据表明化合物1为一个新化合物,因此,化合物1的结构鉴定为5-甲氧基-6-甲基-7-羟基-8-醛基-3S-(3?, 4?-亚甲二氧基苯)-4-二氢色原酮,命名为麦冬黄烷酮D?。
化合物2:黄色粉末状;ESI-MS在m/z: 341.2处给出[M - H]-峰,结合NMR谱数据推断分子式为C19H18O6,不饱和度为11。1H-NMR (500 MHz,CDCl3) δH: 12.36 (1H, s, 5-OH), 6.66~6.87 (3H, m, H-2′, 5′, 6′), 5.95 (2H, s, H-7′), 5.39 (1H, s, 7-OH), 4.29 (1H, dd, J=3.0, 11.5 Hz, Ha-2), 4.12 (1H, dd, J=6.8, 11.5 Hz, Hb-2), 3.18 (1H, d, J=9.3 Hz, Ha-9), 2.81 (1H, m, H-3), 2.66 (1H, dd, J=9.3, 9.4 Hz, Hb-9), 2.06 (3H, s, 8-Me), 2.02 (3H, s, 6-Me). 13C-NMR (125 MHz, CDCl3) δC: 69.0 (C-2), 46.9 (C-3), 198.4 (C-4), 159.7 (C-5), 103.0 (C-6), 160.8 (C-7), 102.4 (C-8), 32.7 (C-9), 157.9 (C-10), 101.1 (C-11), 131.9 (C-1′), 109.5 (C-2′), 148.0 (C-3′), 146.5 (C-4′), 108.5 (C-5′), 122.3 (C-6′), 101.7 (C-7′), 7.5 (6-Me), 7.0 (8-Me)。通过与文献数据对比,以上数据基本与文献[15]一致,故鉴定化合物2为甲基麦冬黄烷酮A。
化合物3:黄色粉末状;ESI-MS在m/z: 327.4处给出[M - H]-峰,结合NMR谱数据推断分子式为C19H20O5;不饱和度为10。1H-NMR (500 MHz, CDCl3) δH: 12.39 (1H, s, 5-OH), 7.15 (2H , d, J=8.5 Hz, H-2′/ H-6′), 6.87 (2H , d, J=8.5 Hz, H-3′/H-5′), 5.38 (1H, s, 7-OH), 4.27 (1H, dd, J=3.0, 11.5 Hz, Ha-2), 4.10 (1H, dd, J=6.8, 11.5 Hz, Hb-2), 3.80 (3H, s, 4′-OMe), 3.15 (1H, d, J=9.3 Hz, Ha-9), 2.81 (1H, m, H-3), 2.66 (1H, dd, J=9.3, 9.4 Hz, Hb-9), 2.06 (3H, s, 8-Me), 2.02 (3H, s, 6-Me). 13C-NMR (125 MHz, CDCl3) δC: 69.1 (C-2), 47.0 (C-3), 198.6 (C-4), 159.7 (C-5), 102.9 (C-6), 160.7 (C-7), 102.4 (C-8), 32.1 (C-9), 158.0 (C-10), 101.7 (C-11), 130.2 (C-1′), 130.3 (C-2′), 114.2 (C-3′), 158.5 (C-4′), 114.2 (C-5′), 130.3 (C-6′), 7.5 (6-Me), 7.0 (8-Me), 55.4 (4′-OMe)。通过与文献数据对比,以上数据基本与文献[15]一致,故鉴定化合物3为甲基麦冬黄烷酮B。
化合物4:橙黄色粉末状;ESI-MS在m/z: 293.4处给出[M+Na]+峰,结合NMR谱数据推断分子式为C15H10O5,不饱和度为11。1H-NMR (500 MHz, DMSO) δH: 12.09 (1H, s, 1-OH), 12.02 (1H, s, 8-OH), 7.49 (1H, br s, H-2), 7.17 (1H , br s, H-4), 7.12 (1H, br s, H-5), 6.60 (1H, br s, H-7), 2.42 (3H, s, 6-Me). 13C-NMR (125 MHz, DMSO) δC: 164.9 (C-1), 113.8 (C-1a), 108.4 (C-2), 148.7(C-3), 109.2 (C-4),133.3 (C-4a), 121.0 (C-5), 135.6 (C-5a), 161.9 (C-6), 124.6 (C-7), 166.0 (C-8), 109.4 (C-8a), 190.2 (C-9), 181.9 (C-10), 22.0 (6-Me)。通过与文献数据对比,以上数据基本与文献[16]一致,故鉴定化合物4为大黄素。
化合物5:白色粉末状;ESI-MS在m/z: 345.1处给出[M-H]-峰,结合NMR谱数据推断分子式为C18H18O7,不饱和度为10;[α]20D= + 42.32 (c 0.20, MeOH)。1H-NMR (500 MHz, CD3OD) δH: 7.63 (1H, br s, H-4), 7.56 (1H, br s, H-6), 6.95 (1H, d, J=1.7 Hz, H-2′), 6.82 (1H, dd, J=1.9, 7.8 Hz, H-6′), 6.77 (1H, d, J=8.0 Hz, H-5′), 5.62 (1H, d, J=6.5 Hz, H-2), 3.90 (3H, s, 7-OMe), 3.84 (2H, m, H-9), 3.82 (3H, s, 3′-OMe). 13C-NMR (125 MHz, CD3OD) δC: 90.2 (C-2), 54.6 (C-3), 130.4 (C-3a), 120.8 (C-4), 125.1 (C-5), 115.3 (C-6), 145.2 (C-7), 153.9 (C-7a), 169.8 (C-8), 64.6 (C-9), 133.9 (C-1′), 110.6 (C-2′), 149.2 (C-3′), 147.8 (C-4′), 116.2 (C-5′), 119.8 (C-6′), 56.7 (7-OMe), 56.4 (3′-OMe)。通過与文献数据对比,以上数据基本与文献[17]一致,故鉴定化合物5为肥牛木素。
化合物6:白色粉末状;ESI-MS在m/z: 163.1处给出[M - H]-峰,结合NMR谱数据推断分子式为C9H8O3,不饱和度为6。1H-NMR (500 MHz,CD3COCD3) δH: 7.61 (1H, d, J = 16.0 Hz, H-7), 7.55 (2H, d, J = 8.5 Hz, H-2, 6), 6.90 (2H, d, J = 8.5 Hz, H-3, 5), 6.33 (1H, d, J = 16.0 Hz, H-8). 13C-NMR (125 MHz, CD3COCD3) δC: 126.5 (C-1), 130.4 (C-2), 116.8 (C-3), 160.0 (C-4), 116.8 (C-5), 130.4 (C-6), 145.0 (C-7), 115.3 (C-8), 167.8 (8- COOH)。通过与文献数据对比,以上数据基本与文献[18-19]一致,故鉴定化合物6为E-对羟基桂皮酸。
化合物7:白色粉末状;ESI-MS在m/z: 163.2处给出[M-H]-峰,结合NMR谱数据推断分子式为C9H8O3,不饱和度为6。1H-NMR (500 MHz, CD3 COCD3) δH: 7.78 (2H, d, J=8.7 Hz, H-2/H-6), 6.85 (1H, d, J=13.0 Hz, H-7), 6.82 (2H, d, J=8.7 Hz, H-3/ H-5), 5.81 (1H, d, J=12.9 Hz, H-8). 13C-NMR (125 MHz, CD3COCD3) δC: 127.6 (C-1), 130.9 (C-2), 117.1 (C-3), 159.6 (C-4), 117.1 (C-5), 130.9 (C-6), 143.8 (C-7), 115.2 (C-8), 167.3 (8-COOH)。通过与文献数据对比,以上数据基本与文献[19-20]一致,故鉴定化合物7为Z-对羟基桂皮酸。
化合物8:无色针晶状;ESI-MS在m/z: 137.1处给出[M-H]-峰,结合NMR谱数据推断分子式为C7H6O3,不饱和度为5。1H-NMR (500 MHz, CD3COCD3) δH: 7.90 (2H, d, J=8.6 Hz, H-2, H-6), 6.80 (2H, d, J=8.6 Hz, H-3, H-5). 13C-NMR (125 MHz, CD3COCD3) δC: 122.7 (C-1), 132.4 (C-2), 115.7 (C-3), 163.1 (C-4), 115.7 (C-5), 132.4 (C-6), 168.2 (7-COOH)。通过与文献数据对比,以上数据基本与文献[21]一致,故鉴定化合物8为4-羟基苯甲酸。
化合物9:无色透明状;ESI-MS在m/z: 706.9处给出[M-H]-峰,结合NMR谱数据推斷分子式为C38H60O12,不饱和度为9;[α]25D= - 61.12 (c 0.8, MeOH)。1H-NMR (500 MHz, CD3OD) δH: 5.55 (1H, br d, J=5.56 Hz, H-6), 5.28 (1H, d, J=1.35 Hz, H-1?), 4.31 (1H, d, J=7.31 Hz, H-1′), 4.06 (1H, m, H-16), 3.68 (2H, m, H-1, 3), 3.44 (2H, m, H-26), 1.24 (3H, d, J=6.03 Hz, H-6?), 1.09 (3H, s, H-21), 0.96 (3H, d, J=6.95 Hz, H-19), 0.80 (3H, s, H-18), 13C-NMR (125 MHz, CD3OD) δC: 84.7 (C-1), 37.2 (C-2), 69.2 (C-3), 43.5 (C-4), 139.6 (C-5), 126.1 (C-6), 32.9 (C-7), 34.2 (C-8), 51.5 (C-9), 43.5 (C-10), 24.7 (C-11), 41.1 (C-12), 41.1 (C-13), 57.8 (C-14), 32.8 (C-15), 82.2 (C-l6), 63.8 (C-17), 17.1 (C-l8), 14.9 (C-l9), 42.9 (C-20), 15.3 (C-21), 110.6 (C-22), 32.4 (C-23), 29.9 (C-24), 31.4 (C-25), 65.4 (C-26), 17.5 (C-27), 100.7 (C-1′), 75.9 (C-2′), 77.5 (C-3′), 72.0 (C-4′), 67.5 (C-5′), 101.6 (C-1?), 74.1 (C-2?), 72.2 (C-3?), 75.0 (C-4?), 69.7 (C-5?), 18.3 (C-6?)。通过与文献数据对比,以上数据基本与文献[22]一致,故鉴定化合物9为25R-spirost-5-ene- 1β,3β-diol 1-O-[α-L-rhamnopyranosyl-(1→2)-α-L- arabinopyranoside]
化合物10:白色粉末状;ESI-MS在m/z: 437.4处给出[M+Na]+峰,结合NMR谱数据推断分子式为C29H50O,不饱和度为5;[α]25D=-23.26 (c 0.40, MeOH)。1H-NMR (500 MHz, CDCl3) δH: 5.35 (1H, m, H-6), 3.43 (1H, m, H-3), 1.01 (3H, s, H-19), 0.92 (3H, d, J=6.79 Hz, H-21), 0.85 (3H, d, J=7.45 Hz, H-26), 0.83 (3H, d, J=7.45 Hz, H-27), 0.81 (3H, d, J=7.45 Hz, H-29), 0.69 (3H, d, J=9.37 Hz, H-18). 13C-NMR (125 MHz, CDCl3) δC: 37.3 (C-1), 31.7 (C-2), 71.8 (C-3), 42.3 (C-4), 140.8 (C-5), 121.7 (C-6), 31.9 (C-7), 31.9 (C-8), 50.2 (C-9), 36.5 (C-10), 21.2 (C-11), 39.8 (C-12), 42.3 (C-13), 56.8 (C-14), 24.4 (C-15), 28.3 (C-l6), 56.1 (C-17), 12.1 (C-l8), 19.0 (C-l9), 36.2 (C-20), 18.8 (C-21), 34.0 (C-22), 26.1 (C-23), 45.9 (C-24), 29.2 (C-25), 19.4 (C-26), 19.8 (C-27), 23.1 (C-28), 11.9 (C-29)。通过与文献数据对比,以上数据基本与文献[23]一致,故鉴定化合物10为β-谷甾醇。
3 讨论
本研究从麦冬须根正丁醇萃取物中分离鉴定了10个单体化合物,包括3个高异黄烷酮类(1~3)、1个蒽醌类(4)、1个木脂素类(5)、3个酚酸类(6~8)、1个甾体皂苷类(9)和1个甾醇类(10)化合物。其中化合物1为新的高异黄酮类化合物,木脂素类化合物5和酚类化合物7为首次从百合科植物中分离得到,甾体皂苷类化合物9为首次从该植物中分离得到。
高异黄酮类化合物作为麦冬的主要活性化学成分之一,具有抗炎、镇咳、抗菌、细胞毒、抗血管生成和抑制黑色素细胞生长的等多种生物活性[9-10]。目前从麦冬中分离得到的高异黄酮类化合物主要分为2大类:高异黄酮类和二氢高异黄酮类。二氢高异黄酮类是一类C环3-位碳为手性碳原子的高异黄酮,但报道的多数该类型化合物未确定其立体构型,已确定构型的少数几个化合物也几乎全部为3R构型[24]。本研究从麦冬须根提取物中分离鉴定了3个该类化合物,其中化合物1是一个新的化合物,其立体构型被确定为3S构型。该化合物与ophiopogonanone D为一对对映异构体,文献中仅确定了ophiopogonanone D的平面结构,而对其立体构型未见确定,本研究确定化合物1的立体构型为3S进而说明ophiopogonanone D的立体构型为3R。化合物的立体构型与其生物活性之间往往密切相关,本研究从麦冬须根中获得了ophiopogonanone D的对映异构体,丰富了麦冬化学成分,对其立体构型的确定进一步确定了ophiopogonanone D的立体构型,为其生物活性的进一步研究奠定了基础。
本研究从麦冬须根所获得的化合物类型与麦冬块根中基本一致[10, 11, 25],而麦冬块根中主要活性成分为高异黄酮类和甾体皂苷类化合物[3, 9-10],后续将重点从麦冬须根提取物中寻找高异黄酮类和甾体皂苷类化合物,寻找结构新颖的活性化合物,为进一步研究麦冬须根是否可以替代麦冬块根作为药材及麦冬资源的综合利用提供依据。
参考文献
国家药典委员会. 中华人民共和国药典: 2015年版 一部[S]. 北京: 中国医药科技出版社, 2015: 155-156.
国家中医药管理局《中华本草》编委会. 中华本草[M]. 上海: 上海科学技术出版社, 1999.
孙晓媛, 于 凡, 肖 伟, 等. 麦冬现代应用的研究進展[J]. 中国现代中药, 2018, 20(11): 1453-1458.
沙建平, 马红英, 陈晓文, 等. 麦冬对糖尿病大鼠胰岛β细胞的保护作用[J]. 成都中医药大学学报, 2014, 37(3): 23-24, 40.
马 丽, 寇俊萍, 黄 跃, 等. 鲁斯可皂苷元对HL-60与ECV304细胞黏附的影响[J]. 中国药理学通报, 2006, 22(6): 706-709.
Sun L, Lin S S, Zhao R P, et al. The saponin monomer of dwarf lilyturf tuber, DT-13, reduces human breast cancer cell adhesion and migration during hypoxia via regulation of tissue factor[J]. Biological and Pharmaceutical Bulletin, 2010, 33(7):1192-1198.
Xiong S L, Hou D B, Ni H, et al. Preparation and biological activity of saponin from Ophiopogon japonicas[J]. J African Journal of Pharmacy and Pharmacology, 2012, 6(26): 1964-1970..
Wang S, Zhang Z, Lin X, et al. A polysaccharide, MDG-1, induces S1P1 and bFGF expression and augments survival and angiogenesis in the ischemic heart[J]. Glycobiology, 2010, 20(4): 473-484.
白 晶. 麦冬甾体皂苷和高异黄酮类成分的研究进展[J]. 北京联合大学学报, 2014, 28(2): 9-12.
彭 婉, 马 骁, 王 建, 等. 麦冬化学成分及药理作用研究进展[J]. 中草药, 2018, 49(2): 477-488.
金 虹, 王化东, 何 礼, 等. 川产麦冬及其须根组织学与麦冬皂苷量的对比研究[J]. 中草药, 2014, 45 (7): 1002-1005.
马军守, 别继明, 金 虹. 川麦冬及其须根中多糖和黄酮类有效成分定量分析[J]. 西南科技大学学报, 2008, 23 (1) : 83-86.
Hung T M, Thu C V, Dat N T, et al. Homoisoflavonoid derivatives from the roots of Ophiopogon japonicus and their in vitro anti-inflammation activity[J]. Bioorganic and Medicinal Chemistry Letters, 2010, 20(8): 2412-2416.
Yang Y, Mei W L, Kong F D, et al. Four new bi-2-(2-phenylethyl)chromone derivatives of agarwood from Aquilaria crassna[J]. Fitoterapia, 2017, 119: 20-25.
Chang J M, Shen C C, Huang Y L, et al. Five new homoisoflavonoids from the tuber of Ophiopogon japonicus[J]. Journal of Natural Products, 2002, 65(11): 1731-1733.
朱 丹, 李淑青, 袁永兵, 等. 粉萆薢脂溶性化学成分研究[J]. 中草药, 2016, 47(3): 379-382.
梅文莉, 戴好富, 吴大刚. 肥牛木中一个新的降新木脂素[J]. 高等学校化学学报, 2006(8): 1480-1481.
柴 玲, 林 霄, 梁柏照, 等. 拟草果化学成分研究[J]. 中草药, 2018, 49(14): 3217-3221.
冯美玲, 王书芳, 张兴贤. 枸杞子的化学成分研究[J]. 中草药, 2013, 44(3): 265-268.
王洪石, 陈文豪, 陈光英, 等. 崖县风车子茎化学成分研究[J]. 化学研究与应用, 2015, 27(5): 700-703.
张艳军, 聂 辉, 周德雄, 等. 桂野桐化學成分的研究[J]. 中草药, 2017, 48(11): 2172-2176.
Lina Eristavia, Darejan Gugunishvilib, Lili Gvazavac. The steroidal glycosides of Allium waldsteini G. Don.[J]. Nature Nanotechnology, 2007, 2(5): 537-540.
Latifa A, Al Shammari, Wafaa H B, et al. Phytochemical and biological studies of Carduus pycnocephalus L. [J]. Journal of Saudi Chemical Society, 2015, 19(4): 410-416.
江洪波, 黄 静, 郭明娟, 等. 天然高异黄酮的研究进展[J]. 药学学报, 2007(2): 118-126.
王艳翠. 麦冬化学和营养成分及其体外活性的研究[D]. 杨凌: 西北农林科技大学, 2016.
责任编辑:崔丽虹

