甾烷和藿烷的国产X型分子筛分离制备实验研究
李二庭,向宝力,李 际,迪丽达尔·肉孜,王汇彤,马万云,刘翠敏,张晓刚
(1.新疆砾岩油藏实验室,新疆 克拉玛依 834000;2.中国石油 新疆油田分公司 实验检测研究院,新疆 克拉玛依 834000;3.中国石油勘探开发研究院,北京 100083)
在油气地球化学领域,稳定碳同位素分析技术已在油源对比、烃源岩的沉积环境、成熟度研究及有机化合物的生物前驱物探讨等方面得到了广泛应用[1-6]。随着分析技术的发展,有机分子单体稳定碳同位素已深入应用于有机地球化学的研究中,生物分子的分布与碳同位素组成特征的联合应用,可以大大增强追踪古环境中有机质来源和恢复古生物化学过程及沉积环境的能力[7-8],在油源精细对比方面的作用也更显著[9-12]。相比于正构烷烃而言,甾烷和藿烷类生物标志化合物的单体同位素分析技术研究较少[13-15],主要是由于这些生物标志物在地质样品中含量极低,单体制备中存在同位素的分馏[16-17],因此,要得到准确的单体同位素数据,必须对其单体分子进行有效的分离富集。
目前国内外分离、富集饱和烃生物标志化合物的方法主要包括Silicalite法[18-20]、分子筛法[21-26]、尿素络合法[27]和硫尿络合法[28],对藿烷和甾烷类化合物的分离富集主要采用前两种方法。如董爱正等[20]采用活化的Silicalite柱子实现了藿烷馏分分离富集;WHITEHEAD等[21]发现,孔径大小接近0.8 nm的NaX和10X分子筛对支链藿烷类化合物具有较强的吸附作用,且对22S构型的藿烷异构体吸附强度大于22R构型的藿烷异构体。KENIG等[23]采用超稳Y型分子筛进行固相填料,在高效液相色谱上实现了甾烷类与藿烷类化合物的分离,证明分子筛分离生物标志化合物的过程中无同位素“分馏”效应,但该类型材料在国内尚无法购买。王汇彤等[25]采用国产的不同种类 Y型分子筛对甾烷和藿烷类化合物进行了吸附和脱附实验,发现NaY分子筛对不同构型的甾烷和藿烷类化合物具有不同的吸附行为,可用于生物标志化合物的分离。
本文通过国产10X和13X型分子筛对甾烷和藿烷类化合物的吸附对比实验,探讨两种分子筛在制备这些化合物过程中的同位素分馏效应,为其单体化合物的分离技术不断改进提供借鉴。
1 实验
1.1 饱和烃制备
称取原油或地质样品氯仿抽提物60~100 mg,加入二氯甲烷溶解后,加少许细粒硅胶吸附,挥发二氯甲烷,取6 g经180 ℃活化4 h后的细粒硅胶(100~200目)在振荡条件下装入层析柱,将吸附样品的细粒硅胶转入柱子中,用正己烷淋洗,当柱子下端溶液流出时,加10 mL正己烷,收集饱和烃馏分。
1.2 异构烷烃和环烷烃制备
采用ZSM-5分子筛吸附的方法分离正构烷烃,从而实现异构烷烃和环烷烃的制备。方法如下:取饱和烃样品加入ZSM-5分子筛充填的层析柱,分子筛质量为饱和烃质量的100倍,用20 mL异辛烷多次淋洗,得到饱和烃中的异构烷烃和环烷烃组分,并进行称量。
1.3 分子筛吸附实验
国产13X型分子筛吸附甾烷及藿烷实验:13X型分子筛用前需经550 ℃活化10 h,取制备好的异构/环烷烃样品20 mg左右,二氯甲烷溶解后,加少许13X型分子筛吸附,挥发二氯甲烷,静置过夜。取300倍左右样品质量的13X型分子筛(60~80目)在振荡条件下装入层析柱中,将吸附样品的13X型分子筛转入柱子中,用冷的正戊烷淋洗,收集从分子筛填充柱淋洗下来的正戊烷淋洗液1 mL六份,20 mL和40 mL的各一份,进行色谱/质谱检测。层析柱中的残留物经异辛烷加热回流10 h,过滤收集滤液,进行色谱/质谱检测。
国产10X型分子筛吸附甾烷及藿烷实验,过程基本同13X分子筛吸附实验:10X型分子筛用前需经550 ℃活化10 h,取制备好的异构/环烷烃样品20 mg左右,二氯甲烷溶解后,加少许10X型分子筛吸附,挥发二氯甲烷,静置过夜。取300倍左右样品质量的10X型分子筛(60~80目)在振荡条件下装入层析柱中,将吸附样品的10X型分子筛转入柱子中,用冷的正戊烷淋洗,每2 mL淋洗液收集一份,共收集八份,进行色谱/质谱检测。层析柱中的残留物经异辛烷加热回流10 h,过滤收集滤液,进行色谱/质谱检测。
1.4 仪器分析
色谱/质谱分析:色谱仪为安捷伦公司生产的6800型号,质谱仪为热电公司生产的DSQ-Ⅱ型。采用HP-5柱(60 m×0.25 mm×0.25 μm),进样口温度300 ℃,载气He;初始温度100 ℃,恒温3 min,以2.6 ℃/min升温至300 ℃,恒温9 min;传输线温度300 ℃,离子源温度250 ℃,离子化方式为70 eV电子轰击,发射电流200 μA,分析采用全扫描和选择离子方式。
单体烃碳同位素分析:采用Thermo公司生产的MAT-253型,单体烃同位素标准样品来自美国Indiana大学。采用DB-1柱(60 m×200 μm×0.25 μm ) ,初始温度70 ℃,恒温5 min,以4 ℃/min升温至240 ℃,再以3 ℃/min升温至320 ℃,恒温30 min;进样口温度为300 ℃,采用分流进样模式,分流比为20∶1,燃烧炉温度900 ℃,离子化能量70 eV。
2 结果与讨论
2.1 国产13X型分子筛吸附行为实验
国产13X型分子筛对甾烷和藿烷类化合物的吸附及脱附实验结果见图1和图2。图1为正戊烷从13X型分子筛淋洗下来各馏分的色谱/质谱图。从图1中可以看出,13X型分子筛对甾烷化合物的5α,14α,17α-20S、5α,14β,17β-20R和5α,14β,17β-20S三种构型吸附相对较弱,优先被淋洗下来;随着淋洗进行,5α,14α,17α-20R构型的甾烷系列含量明显提高,其次是伽马蜡烷、β-胡萝卜烷。在前2个馏分中,除少量伽马蜡烷外,几乎全是甾烷的系列化合物;随着淋洗的继续,5α,14α,17α-20S、5α,14β,17β-20R和5α,14β,17β-20S构型的甾烷系列化合物完全脱附,馏分中开始出现部分构型的藿烷化合物(图1c)。13X型分子筛对S构型的藿烷吸附能力低于R构型的藿烷,馏分5中S构型的藿烷含量远远高于R构型的藿烷(图1c),而馏分7中S构型的藿烷含量与R构型的藿烷基本接近(图1d),说明13X型分子筛对藿烷的吸附也并非完全一致。

图1 国产13X型分子筛柱淋洗下不同馏分总离子流图

图2 异辛烷抽提13X分子筛残留馏分总离子流和m/z 191图
从40 mL正戊烷淋洗馏分8中的化合物组成和色谱/质谱检测强度来看(图1e),30 mL的正戊烷可以从13X型分子筛上淋洗下甾烷的系列化合物,而藿烷系列化合物大部分仍然吸附在13X型分子筛上,这从异辛烷抽提13X型分子筛残留物的结果也可以证实这一点。图2是异辛烷抽提下来的馏分进行色谱/质谱检测,总离子流图谱与m/z191图谱完全一致,说明13X型分子筛可以用柱层析的方法对藿烷类化合物进行富集,可以实现藿烷类化合物的生物标志化合物同位素测定。甾烷也可以通过13X类分子筛分离出,并满足生物标志化合物同位素的测定分离度。
2.2 国产10X型分子筛吸附行为对比实验
国产10X型分子筛对甾烷和藿烷类化合物的吸附实验结果见图3和图4。图3为正戊烷从10X型分子筛淋洗下来各馏分的色谱/质谱图,从前2个馏分的色谱/质谱图可以看出:10X型分子筛对甾烷化合物的5α,14α,17α-20S、5α,14β,17β-20R和5α,14β,17β-20S三种构型吸附最弱,首先被正戊烷淋洗下来(图3a,b);其次是5α,14α,17α-20R构型的甾烷系列(图3c)、β-胡萝卜烷(图3d)和伽马蜡烷(图3e),在馏分1中几乎全是甾烷的系列化合物。随着淋洗的进行,5α,14α,17α-20S、5α,14β,17β-20R和5α,14β,17β-20S构型的甾烷系列化合物完全脱附,5α,14α,17α-20R构型的甾烷系列、β-胡萝卜烷和伽马蜡烷相继脱附。在第4、第5两组馏分中,甾烷主要是5α,14α,17α-20R构型的系列(图3c,d),到了第7、第8组馏分逐渐降低,可以看出在甾烷R构型即将脱附完全的情况下,看到藿烷S构型的少量脱附(图3e,f)。

图3 国产10X型分子筛柱淋洗下不同馏分总离子流图

图4 异辛烷抽提10X分子筛残留馏分色谱/质谱TIC和m/z 191图
通过以上实验结果不难发现:10X型分子筛是分离制备生物标志化合物的良好填料,进一步摸索出更合适的实验条件,可以制备出不同构型的甾烷、伽马蜡烷、β-胡萝卜烷等化合物,使其满足测定单体碳同位素的需要。分子筛中残留物经抽提也可以得到较为纯净的藿烷系列(图4)。
2.3 甾烷和藿烷类化合物分离制备
国产10X型和13X型分子筛都可以分离出甾烷类化合物,但由于10X型分子筛的孔径略小于13X型分子筛的孔径,所以,在正戊烷淋洗不同的分子筛时,不同构型的甾烷化合物从分子筛上脱附的顺序有差异。1 mL的正戊烷淋洗13X型分子筛装填的柱子,可以把四种不同构型的甾烷淋洗下来,而3 mL的正戊烷淋洗10X型分子筛装填的柱子,只淋洗下甾烷化合物的5α,14α,17α-20S、5α,14β,17β-20R和5α,14β,17β-20S三种构型。分子通道孔径相对较小的10X分子筛,放大了不同构型甾烷通过的差异,使得不同构型的甾烷化合物分离度好于13X型分子筛。鉴于10X分子筛对不同构型的甾烷有更好的分离度,这将十分有利于进行生物标志物单体烃同位素测定,因此选用10X型分子筛进行甾烷的分离。根据吸附实验结果,加密3~6 mL之间的馏分收集密度,色谱/质谱定性后,确立了5α,14α,17α-20S、5α,14β,17β-20R和5α,14β,17β-20S的三种构型与5α,14α,17α-20S构型在分子筛上的分离分界点为5 mL左右。收集两份5 mL的馏分,其色谱/质谱检测图谱如图5所示。与前面所有构型的甾烷收集在一个馏分的图比较,馏分1的甾烷化合物是5α,14α,17α-20S、5α,14β,17β-20R和5α,14β,17β-20S的三种构型;馏分2的甾烷化合物是5α,14α,17α-20R构型(图5)。

图5 国产10X型分子筛制备甾烷化合物馏分的总离子流图
同样,国产10X型分子筛和13X型分子筛均可以分离制备出藿烷类化合物,但由于13X型分子筛对于藿烷的吸附能力更强,因此选用13X型分子筛进行藿烷类化合物的分离制备。根据上述对13X分子筛的吸附行为实验,基本可以确定用70 mL左右正戊烷冲洗后,用异辛烷抽提13X分子筛10 h可得到藿烷组分。
根据上述系列实验结果,最终确定甾烷和藿烷类化合物的分离、富集方法如下:(1)称取样品100 mg左右,加入到6 g细粒硅胶填充柱上,采用15 mL正己烷淋洗,分离制备出饱和烃组分,挥发溶剂、称重;(2)取约100倍饱和烃质量的ZMS-5分子筛充填柱子,以20 mL异辛烷淋洗,分离制备出饱和烃的环烷烃和异构烷烃组分,挥发溶剂、称重;(3)取300倍左右环烷烃和异构烷烃质量的13X型分子筛(60~80目)在振荡条件下装入层析柱中,70 mL冷正戊烷淋洗柱子后,浓缩淋洗液,氮气吹干柱子;(4)取300倍左右环烷烃和异构烷烃质量的10X型分子筛(60~80目)在振荡条件下装入层析柱中,将步骤(3)中浓缩的淋洗液加入层析柱上,取两份5 mL的正戊烷淋洗并分别收集,得到不同构型的甾烷组分;(5)异辛烷抽提13X型分子筛残留物10 h,得到藿烷组分;(6)浓缩步骤(4)和步骤(5)所得溶液,进行碳同位素分析。
2.4 分子筛制备甾烷和藿烷过程中的碳同位素分馏分析
根据10X型分子筛吸附实验中分离出不同馏分的甾烷化合物进行单体烃稳定碳同位素的测定结果(表1和表2),可以看出,由于不同构型的甾烷化合物相对集中地出现在某一区间,使得单体在某一馏分内浓度相对较高,不同构型间的相互影响也降低,测定各单体的稳定碳同位素数据就比较令人满意。同一单体化合物在不同馏分中的误差大多数都满足了现行的中华人民共和国石油行业标准规定的误差要求。说明国产10X型分子筛可以用于甾烷化合物单体制备及其稳定碳同位素分析。
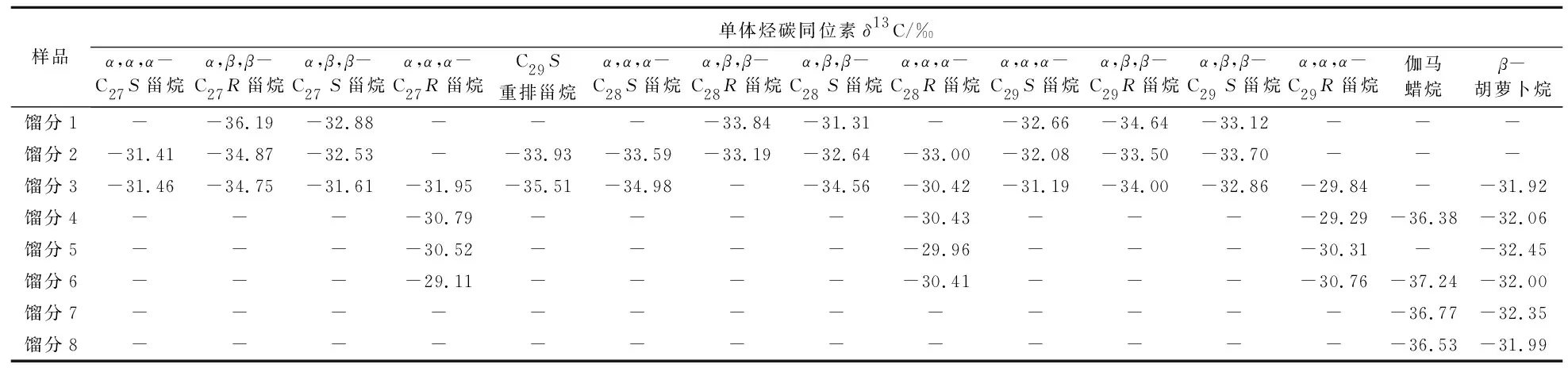
表1 国产10X型分子筛分离出的甾烷化合物单体烃碳同位素测定结果

表2 国产10X型分子筛分离出的甾烷化合物单体烃碳同位素测定结果与平均值的误差
用此方法做平行实验,测得的结果见表3,大部分构型的甾烷两次测定结果的重复性非常好,说明此方法可操作性很高。

表3 国产10X分子筛分离出的甾烷化合物单体烃碳同位素重复性分析
分别用10X型和13X型分子筛富集分离同一个样品,其藿烷单体烃的稳定碳同位素测定结果见表4。富集的藿烷等系列化合物的纯度相对较高,基线平稳,获得的藿烷单体碳同位素测定结果非常吻合,说明10X型分子筛与13X型分子筛一样,都可用柱层析的方法富集分离藿烷类化合物。

表4 国产10X型和13X型分子筛分离出的藿烷化合物单体烃碳同位素测定结果
3 结论
国产10X型和13X型分子筛在分离制备甾烷和藿烷类化合物过程中,对不同类型化合物的吸附能力不同。13X型分子筛对藿烷类吸附能力更强,10X型分子筛对甾烷类吸附能力强,可以将不同构型的甾烷和藿烷分离开,且在分离过程中不存在稳定碳同位素分馏现象。两者结合,可分离制备出高纯度的甾烷和藿烷类化合物。

