基于紫外检测器的壳寡糖色谱分析与比较
周卫强,李 娟,沈雪梅,彭 超,陈 博,晏礼明,赵黎明,李 义,佟 毅
(1.华东理工大学 生物工程学院,上海 200237;2.生物反应器工程国家重点实验室,上海 200237;3.中粮营养健康研究院有限公司,北京 102209;4.中国科学院 微生物研究所,北京 100101;5.中粮生物科技股份有限公司,蚌埠 233010;6.玉米深加工国家工程研究中心,长春 130033)
功能性低聚糖作为新的生理活性物质,在营养保健、畜牧养殖、植物生长调节及抗病害等方面具有极大的开发潜力。低聚壳聚糖,即壳寡糖是一种聚合度(DP)为2~10的氨基葡萄糖低聚化合物,主要来源于海洋虾蟹壳中的甲壳素,相对于壳聚糖,壳寡糖的水溶性更好、生物活性更强、更易于被吸收利用,具有吸湿保湿、增强免疫、降低血糖及血脂和促进营养物质吸收等多种功能[1-2]。壳寡糖产品是具有一定聚合度分布的多组分寡糖混合物,生产过程中通常采用膜分离和色谱分离等方式进行除杂和提纯,以进一步缩小其聚合度分布范围[3]。现有研究表明,壳寡糖的生物功能与其聚合度紧密相关[4-5],壳寡糖聚合度高低与分布水平将直接影响其应用价值及效果。寡糖是典型的极性分子,具有相似的化学组成,存在多种可能的异构体、多种连接方式和分支结构[6],其分离纯化一直是糖生物学研究中的难点之一。
2019年,全国食品发酵标准化中心审议并通过了«壳寡糖»行业标准正式文件[7]。基于氨基柱(250 mm×4.6 mm)或其他同等分析效果的色谱柱,在蒸发光散射检测器(ELSD)或者示差折光检测器(RID)条件下,以高比例乙腈为流动相,可进行壳寡糖含量和聚合度分布的测定。目前主流方法是以Shodex Asahipak NH2P-50 4E 氨基色谱柱(填料为聚乙烯醇微球,修饰多氨基官能团)为固定相,以乙腈-水为流动相进行等度洗脱的高分离度和高灵敏度的高效液相色谱法[8-10]。
此外,日本TOSOH 公司研发的TSK GEL Amide-80酰胺基修饰的硅胶固定相色谱柱也有相关应用报道[11-12],相比于氨基柱,其键合相更稳定,具有更好的亲水性。在脉冲安培检测器(PAD)支持下,使用Dionex 公司生产的CarboPac PA10 低容量阴离子交换色谱柱,亦可分析测定壳寡糖的含量和聚合度分布,并呈现良好的线性关系[13]。其中,1995年以来,已经有多项采用离子色谱-PAD 测定糖类化合物的方法被美国分析化学组织(AOAC)批准为国际标准[14];而ELSD 灵敏度比RID 高,对温度变化不敏感,基线稳定,可用于梯度洗脱,聚合度分析范围可至20以上;RID 主要受温度、流量以及流动相的种类等因素的影响,洗脱系统较难稳定,通常平衡时间较长。上述3种检测器的采购和维护成本较高,一定程度上限制了壳寡糖产品的普遍性分析。
由于常规糖类化合物在紫外光波长范围没有吸收,即没有吸光基团,常规紫外检测器在糖类化合物分析中的应用罕有报道。壳寡糖作为自然界中唯一带正电荷的碱性寡糖,其杂环结构中同时含有羟基和氨基,基于分子轨道理论,紫外照射会引起孤对n电子向单键σ电子发生能级跃迁,可以诱发壳寡糖在波长200 nm 附近产生一定吸收[15]。本工作基于紫外光可诱发壳寡糖电子能级跃迁的原理,在紫外检测器波长200 nm 条件下,分析比较Shodex色谱柱(氨基修饰填料)和TOSOH 色谱柱(酰胺基修饰填料)对壳寡糖混合标准样品的分离效果,并与RID条件进行比较,验证紫外检测器在壳寡糖分析检测中的应用可行性。
1 试验部分
1.1 仪器与试剂
Agilent 1260 infinity 型高效液相色谱仪,配RID、二极管阵列检测器(DAD,本质上也是一种紫外检测器)和常规紫外检测器;Wiggens UA22MFDN 型超声波清洗器;Milli-Q 型超纯水仪;ME 204型分析天平。
氨基葡萄糖标准溶液:5 g·L-1,称取50 mg氨基葡萄糖,用水溶解并定容至10 mL 容量瓶中,配制成5 g·L-1的氨基葡萄糖标准溶液,保存于4 ℃冰箱。
壳寡糖混合标准溶液:30 g·L-1,称取300 mg自制的壳寡糖混合标准样品(DP 2~7),用水溶解并定容至10 mL,配制成30 g·L-1的壳寡糖混合标准溶液,保存于4 ℃冰箱。
氨基葡萄糖,纯度98%;氨水为分析纯;乙腈为色谱纯;试验用水为纯水。
1.2 色谱条件
1)Shodex Asahipak NH2P-50 4E 色谱柱(250 mm×4.6 mm,5μm);柱温30 ℃;进样量10μL;流量1 mL·min-1;流动相为体积比7∶3的乙腈-1%(体积分数)氨水的混合液;DAD 和RID双检测器,紫外检测波长200 nm。
2)TOSOH TSK GEL Amide-80 色谱柱(250 mm×4.6 mm,5μm);柱温80 ℃;进样量10μL;流量1 mL·min-1;流动相为70%(体积分数)乙腈溶液;DAD 和RID 双检测器,紫外检测波长200 nm。
1.3 试验原理
氨基葡萄糖是壳寡糖的单糖结构,与壳寡糖具有相同的官能团,使用氨基葡萄糖作为目标分子对单一聚合度壳寡糖的分析具有普适性[16],因此以氨基葡萄糖为参照。首先观察氨基葡萄糖溶液的全波长扫描吸收情况,即波长190~400 nm 内的吸收光谱,并比较两种色谱柱条件下的分离效果;然后配制氨基葡萄糖的梯度浓度溶液,拟合在紫外检测器(包括常规紫外检测器及DAD,下同)特定波长条件下氨基葡萄糖的标准曲线;参照氨基葡萄糖的检测方法,分析壳寡糖混合标准样品在两种检测器条件下的分离效果与差异,并计算壳寡糖混合标准样品的聚合度分布。
1.4 试验方法
取1 mL氨基葡萄糖标准溶液或壳寡糖混合标准溶液,经0.2μm 水系过滤膜过滤,在色谱条件下进样分析。
2 结果与讨论
2.1 氨基葡萄糖的全波长扫描
移取1 mL氨基葡萄糖标准溶液,分别在两种色谱条件下进样分析,记录在波长190~400 nm 内的吸收光谱,吸收光谱图见图1,色谱分析结果见图2。
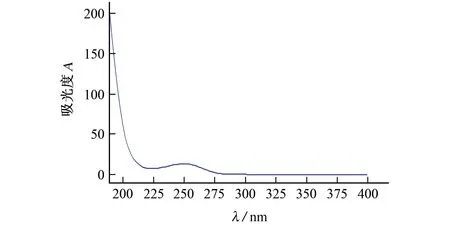
图1 氨基葡萄糖在波长190~400 nm 内的吸收光谱Fig.1 Absorption spectra of glucosamine at the wavelength of 190-400 nm
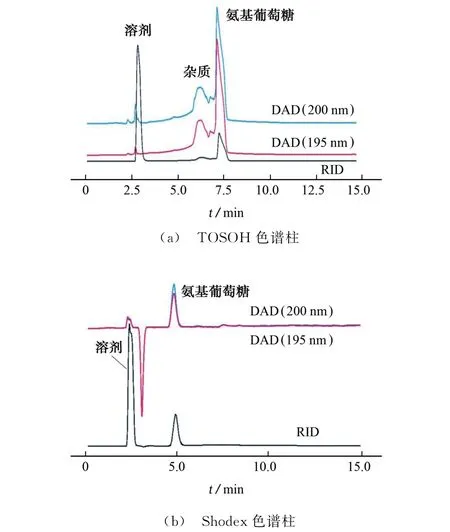
图2 两种色谱条件下氨基葡萄糖的色谱图Fig.2 Chromatograms of glucosamine under two chromatographic conditions
图1为氨基葡萄糖色谱峰的全波长吸收情况,从图1 中可以看出:吸收光谱发生在波长190~210 nm 处,且吸收强度逐渐降低;波长250 nm 处有较弱吸收光谱,推测可能是在氢键作用下,C-N转向C=N,并与羰基共轭产生较弱的π→π∗跃迁吸收[17];波长300 nm 以上无吸收。据此可以判断,紫外检测器的吸收波长可以设定为190~210 nm内的任意波长,考虑到美国药典USP 28方法中氨基葡萄糖的检测波长为195 nm[18],试验又增加了波长200 nm 作为紫外检测器设定波长,即分别以195 nm 和200 nm 作为紫外检测波长,并用DAD代替常规紫外检测器,开展多组分条件下的紫外吸收分析。
图2 为氨基葡萄糖在TOSOH 色谱柱和Shodex色谱柱条件下的色谱图。由图2可见:同一色谱柱条件下,波长195,200 nm的吸收峰峰形无明显差异;采用RID 检测时,氨基葡萄糖在TOSOH 色谱柱和Shodex色谱柱条件下的保留时间分别为7.2,5.0 min,色谱峰占比分别为55.6%和83.5%(扣除负吸收);采用TOSOH 色谱柱时,在6.3 min出现“馒头峰”,该疑似杂质占比31.6%,但是仅从RID 信号分析,因溶剂吸收峰峰高过高,杂质峰易被覆盖或忽略,从而导致氨基葡萄糖样品的检测纯度偏高;采用Shodex色谱柱时,氨基葡萄糖的保留时间较短,即与树脂固定相的作用力弱于其在TOSOH 色谱柱的情况,且DAD 和RID 所得峰形接近,分离度优于TOSOH 色谱柱,对于聚合度10以下的壳寡糖样品,可以在更短时间内完成分析检测。因此试验优选Shodex色谱柱。
对比可知,在波长190~210 nm 内,紫外检测器完全可以用作氨基葡萄糖的定性鉴定,本试验在波长200 nm 处进行研究;而从纯度和定量的角度考虑,Shodex色谱柱条件的纯度检测结果比较接近于现行行业标准方法,定量检测亦可基于标准曲线进行计算。
2.2 氨基葡萄糖的标准曲线测定
将氨基葡萄糖标准溶液逐级稀释,配制成0.5,1,2,4,5 g·L-1的氨基葡萄糖标准溶液系列,在Shodex色谱柱、紫外波长200 nm的色谱条件下进样分析。以氨基葡萄糖的质量浓度为横坐标,其对应的峰面积为纵坐标,拟合标准曲线。拟合得到的线性回归方程为y=753.6x+13.18,线性范围为0.5~5 g·L-1,相关系数为0.998 9,线性拟合结果符合检测要求,可用于氨基葡萄糖的色谱分析的定量计算。
根据GB/T 5009.001-2003«食品卫生检验方法-理化部分总则»对于方法检出限的定义,将3倍空白值的标准偏差(s)相对应的质量或浓度作为检出限,本方法的检出限为仪器基线噪声的3倍信号与标准曲线的斜率的比值,计算结果为0.011 g·L-1。
2.3 壳寡糖混合标准样品的分离效果比较
移取1 mL 壳寡糖混合标准溶液,在Shodex色谱柱条件下进样分析,结果见图3。在波长195,200 nm 处检测单一聚合度壳寡糖的吸收光谱,所得的吸收峰的保留时间和峰面积、壳寡糖的聚合度分布见表1。
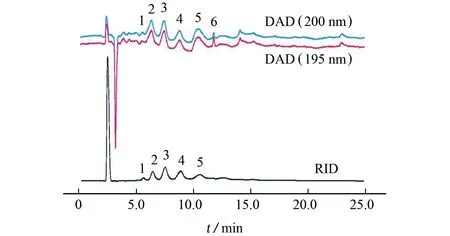
图3 Shodex色谱柱下的壳寡糖混合标准样品的色谱图Fig.3 Chromatogram of chitooligosaccharides mixed standard sample by Shodex chromatographic column
由图3可知:在特定波长条件下,壳寡糖的紫外吸收峰与RID 信号基本一致,但基线有波动,在主要成分前后均检测到较弱的吸收,壳七糖(DP 7)在RID信号中未显示,而DAD条件下出现分离度较高的吸收尖峰,且此后仍有更高聚合度壳寡糖存在的可能。相比之下,RID 信号基线平稳,DP 2~6壳寡糖的相邻组分完全分离。由表1可知:DP 3~6壳寡糖的占比较高,总占比达95.9%。因此,基于氨基葡萄糖的紫外吸收检测同样适用于壳寡糖成分的定性和定量检测。
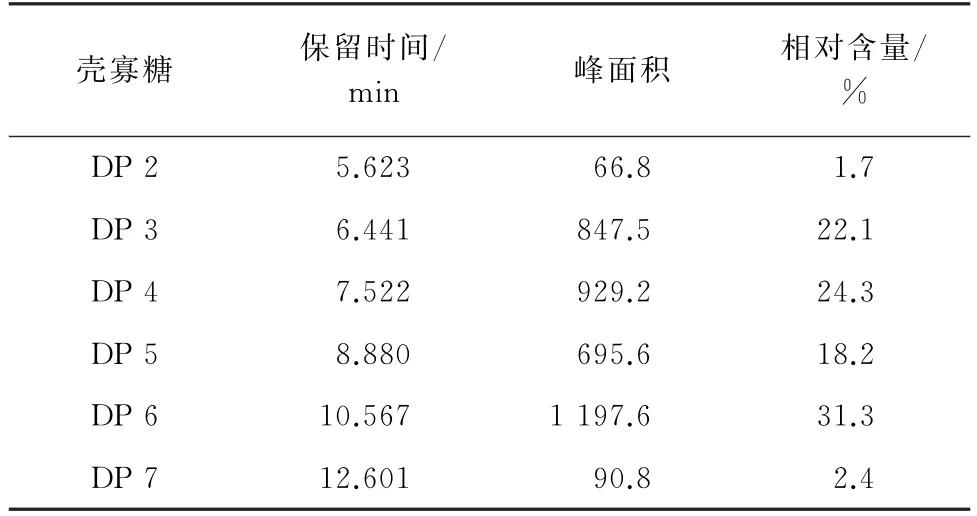
表1 壳寡糖混合标准样品(DP 2~7)的保留时间和聚合度分布Tab.1 Retention time and DP distribution of chitooligosaccharides mixed standard sample(DP 2-7)
本工作基于氨基葡萄糖的电子能级跃迁光谱特性,利用常用的高效液相色谱紫外检测器,在波长190~210 nm 内,实现了氨基葡萄糖和壳寡糖的定性、定量分析检测,并对两种市售色谱柱的氨基葡萄糖分析效果进行了比较。该方法具有操作简单、灵敏度高和普适性强的特点,对于快速测定壳寡糖产品的聚合度分布和单一聚合度成分的含量起到有效补充,从而为科学合理制定壳寡糖产品的地方和国家标准提供理论和数据支撑。

