大肠杆菌谷氨酸脱羧酶A的基因克隆与表达及其酶学性质
于 平,刘 航,朱鹏志,胡淳玉,杨柳贞,贺 敏,马 健
(浙江工商大学食品与生物工程学院 杭州 310018)
γ-氨基丁酸(γ-Aminobutyric acid,GABA)是一种非蛋白质氨基酸[1],最初是在马铃薯块茎组织中发现的[2]。在微生物中,γ-氨基丁酸参与了芽胞杆菌的孢子萌发过程[3-5]。大肠杆菌、乳酸菌、单增李斯特菌和分枝杆菌等部分细菌还可利用γ-氨基丁酸来抵抗酸性环境[6-8]。
目前,γ-氨基丁酸作为一种生物活性因子广泛应用于食品和制药工业中。它可以作为一种功能因子添加到食品中,如奶酪、茶和面包的制作过程中经常添加γ-氨基丁酸[9-11]。在制药工业中,γ-氨基丁酸作为哺乳动物中枢神经系统的主要抑制性神经递质,可改善大脑内血浆和生长激素的浓度以及蛋白质的合成[12]。口服γ-氨基丁酸还能显著降低血压和治疗神系统经障碍[13]。Hagiwara 等[14]的报道称γ-氨基丁酸作为胰岛素的强分泌剂,可有效预防糖尿病。γ-氨基丁酸的摄入也可以调节疼痛和焦虑以及血清和脂质水平[15-16],抑制癌细胞增殖[17],提高记忆力和学习能力[16]。
由于γ-氨基丁酸的诸多有益功能和日益增长的商业需求,越来越多的学者尝试通过化学或生物法制备γ-氨基丁酸[17-19]。由于生物法具有反应过程简单、催化效率高、反应条件温和和环境相容性好等优点,目前已成为制备γ-氨基丁酸的主要方法[20]。γ-氨基丁酸可由谷氨酸脱羧酶(GAD)催化谷氨酸脱羧制备(图1)[1,21],因此研制高校廉价的谷氨酸脱羧酶是生物法制备γ-氨基丁酸的关键。
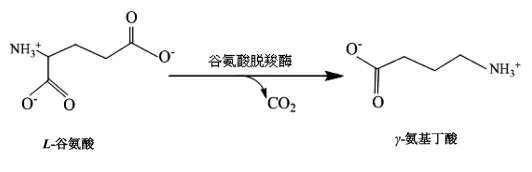
图1 L-谷氨酸脱羧制备γ-氨基丁酸Fig.1 Preparation of γ-aminobutyric acid by L-glutamate decarboxylation
谷氨酸脱羧酶能催化谷氨酸和谷氨酸盐的α-脱羧反应合成γ-氨基丁酸[1]。它是一种磷酸吡哆醛依赖型酶,包括谷氨酸脱羧酶A(GadA)和B(GadB)2 个亚基[3]。据报道,谷氨酸脱羧酶广泛存在于哺乳动物的大脑、植物和微生物中[22]。来源不同的谷氨酸脱羧酶,在酶学性质上存在一定的差异。目前许多学者已经从植物[23]、大肠杆菌[24]、曲霉[25]和乳酸菌[26]中成功分离了谷氨酸脱羧酶,并对其性质进行了研究。例如,Ueno 等[27]从短乳杆菌中分离纯化了谷氨酸脱羧酶,并测定其生化特性。Park 等[28]报道从新分离的短乳杆菌中克隆了编码谷氨酸脱羧酶的基因。Nomura 等[29]对谷氨酸脱羧酶进行了分离鉴定,并克隆了乳酸乳杆菌中含有的一个编码谷氨酸脱羧酶的基因。Kim 等[30]对来源于短乳杆菌BH2 的谷氨酸脱羧酶的酶学性质进行了研究,并发现该酶的一些抑制剂。另外,人们从玉米胚[31]、豆豉[32]和发芽粟谷[33]等植物中分离出谷氨酸脱羧酶,并对其酶学性质进行研究。遗憾的是,天然来源的谷氨酸脱羧酶催化效率低,稳定性差,难以实现大规模工业化应用。
鉴于此,本研究首先从大肠杆菌中克隆编码谷氨酸脱羧酶A 的基因gadA,并构建表达载体pET28a-gadA,然后将该载体转化至大肠杆菌BL21(DE3),成功筛选能高效表达谷氨酸脱羧酶A 的重组大肠杆菌菌株大肠杆菌BL21/pET28agadA。将该菌株诱导表达后,采用Ni2+亲和层析分离纯化谷氨酸脱羧酶A,进一步研究其酶学性质,包括最适温度、最适pH 值、温度稳定性和金属离子对酶活的影响,为深入理解谷氨酸脱羧酶A 的酶学性质及γ-氨基丁酸的制备提供试验基础。
1 材料与方法
1.1 材料与试剂
大肠杆菌DH5α 和BL21 购自美国英杰生物技术有限公司,其中大肠杆菌DH5α 用于构建克隆载体和表达载体,大肠杆菌BL21 用于编码谷氨酸脱羧酶A 的基因gadA 的表达;质粒pET-28a(+)购自美国Novagen 公司,用于构建表达载体;质粒pTrc99a-gadABC 由本实验室构建[34],携带谷氨酸脱羧酶基因gadA,gadB 和谷氨酸/γ-氨基丁酸反向转运蛋白基因C。
PCR 产物纯化试剂盒、DNA 片段纯化试剂盒、质粒提取试剂盒、大肠杆菌DH5α 感受态细胞制备试剂盒、PrimeSTAR HS DNA 聚合酶、核酸胶回收试剂盒、限制性核酸内切酶BamHI 和SacI,日本TaKaRa 生物工程有限公司;DNA 聚合酶、限制性内切酶、DNA Ladder Marker、琼脂糖凝胶电泳缓冲液、T4DNA 连接酶、蛋白质Marker、Ni2+-IDA 琼脂糖纯化树脂,牛血清白蛋白定量检测试剂盒、透析袋,上海生工生物工程有限公司;胰蛋白胨、酵母提取物、氯化钠、琼脂粉、卡那霉素、丹磺酰氯、咪唑、异丙基-β-D-硫代吡喃半乳糖苷(IPTG),杭州汇普生物化学有限公司;蛋白电泳试剂,上海至源叶生物工程有限公司;L-谷氨酸钠,上海国药集团化学试剂有限公司;γ-氨基丁酸标准品,Sigma 公司。
1.2 仪器与设备
2K15 型高速低温离心机,SIGMA 公司;YXQLS-5011 压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;SDS-PAGE 电泳系统,北京市六一仪器厂;Gel Doc XR+凝胶电泳仪,BIO-RAD 公司;STS-2 脱色摇床,北京市六一仪器厂;DHL-B电脑数显定时恒流泵、BZS-100 型自动部分收集器、层析柱,上海沪西分析仪器有限公司;电热恒温水槽,上海精宏实验仪器有限公司;AF-10 制冰机,SCOTSMAN 公司;UV-2550 紫外-可见光分光光度计,SHIMADZU 公司。
1.3 培养基
1)LB 液体培养基 酵母提取物5 g/L,氯化钠10 g/L,胰蛋白胨10 g/L,pH 7.0。
2)LB 固体培养基 向LB 液体培养基中加入15 g/L 的琼脂粉。
3)发酵培养基 向LB 液体培养基中加入不同浓度的L-谷氨酸钠。
4)SOC 培养基 胰蛋白胨20 g/L,酵母粉5 g/L,氯化钠0.5 g/L,氯化钾2.5 mmol/L,氯化镁10 mmol/L,葡萄糖20 mmol/L。
1.4 牛血清白蛋白标准溶液及缓冲液
1)0.1 mg/mL 牛血清白蛋白标准溶液 准确称取1 mg 牛血清白蛋白,充分溶解于0.15 mol/L NaCl 溶液中,定容至10 mL。
2)平衡缓冲液 20 mmol/L Tris-HCl,500 mmol/L 氯化钠,20 mmol/L 咪唑,pH 8.0。
3)结合缓冲液 20 mmol/L Tris-HCl,500 mmol/L 氯化钠,10 mmol/L 咪唑,pH 8.0。
4)洗脱缓冲液 20 mmol/L Tris-HCl,500 mmol/L 氯化钠,250 mmol/L 咪唑,pH 8.0。
1.5 试验方法
1.5.1 质粒pTrc99a-gadABC 的提取 采用质粒提取试剂盒提取质粒pTrc99a-gadABC,具体步骤参照试剂盒使用说明书。
1.5.2 谷氨酸脱羧酶基因A 的克隆 根据Gen-Bank 报道的谷氨酸脱羧酶A 的基因序列,设计引物F1-gadA:5’-TCGCGGATCCATGGACCA GAA GCTGTT-3’ 和R1-gadA:5’-CTTCGAGCTCTTAG GTGTGTTTAAAGCT-3’,进行目的基因的PCR 扩增,其中划线部分分别为限制性内切酶BamHI 和SacI 的酶切位点。PCR 反应体系为:5×HS 缓冲液10 μL,模板DNA 2 μL,引物F1-gadA 1 μL,引物R1-gadA 1 μL,dNTP 混合物4 μL,Prime Star HS DNA 聚合酶0.5 μL,双蒸水补足反应体系至50 μL。PCR 的反应条件为:95 ℃预变性10 min;98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸 (Prime Star HS DNA 聚合酶的延伸速率为1 kb/min,延伸时间根据目的基因长度确定),35 个循环;72 ℃延伸10 min;4 ℃保存。
PCR 扩增产物用1%的琼脂糖凝胶电泳检测。若所需要的目的条带明亮且无杂带,可直接进行PCR 产物回收;若条带不单一,则进行割胶回收。PCR 产物回收的具体步骤参照日本TaKaRa 生物工程有限公司的DNA 纯化试剂盒使用说明书。
1.5.3 重组质粒pET28a-gadA 的构建与转化将回收的PCR 产物和质粒pET-28a(+)用限制性内切酶BamHI 和SacI 双酶切,酶切体系如下:目的基因片段gadA 或质粒pET28a(+)10 μL,酶切缓冲液2 μL,限制性核酸内切酶BamHI 和SacI各1.5 μL,双蒸水5 μL。将上述反应体系放置于37 ℃水浴中酶切3 h 后,用DNA 纯化试剂盒对上述2 种酶切产物进行纯化回收。
将纯化回收后的产物进行连接,连接体系如下:目的基因片段gadA 酶切产物6 μL,质粒pET28a(+)酶切产物2 μL,连接缓冲液1 μL,T4DNA 连接酶1 μL。将连接体系置于16 ℃金属浴中连接12 h,连接产物转化至大肠杆菌DH5α 感受态细胞中[35]。
大肠杆菌DH5α 感受态细胞的制备参照日本TaKaRa 生物工程有限公司的大肠杆菌感受态细胞制备试剂盒说明书。向制备的感受态细胞中加入10 ng 重组质粒DNA,轻轻混匀后于冰上放置30 min 后,取出样品,并置于42 ℃水浴中热激40 s。热激后的样品于冰浴中放置2 min,然后加入1 mL 37 ℃预热的SOC 培养基,37 ℃摇床培养1 h。取适量培养液涂布于筛选平板上,于37 ℃培养箱中培养24 h,获得重组菌株大肠杆菌BL21/pET28a-gadA。
1.5.4 谷氨酸脱羧酶A 的诱导表达 按体积分数2%的接种量接种重组菌株大肠杆菌BL21/pET28a-gadA 至5 mL LB 培养基中 (含100 μg/mL 的氨苄青霉素),37 ℃、220 r/min 摇床培养24 h。再按体积分数2%的接种量转接至装液量为50 mL/250 mL 的LB 液体培养基(含100 μg/mL 的氨苄青霉素)中,37 ℃、200 r/min 培养至OD600nm值为0.6 时,向培养基中加入终浓度为1 mmol/L 的异丙基-β-D-硫代吡喃半乳糖苷,并将摇床温度调至30 ℃,诱导培养8 h 后,收集菌体。
1.5.5 粗酶液的制备和镍柱纯化 将离心收集的菌体用蒸馏水洗2 次,重悬于10 mL 裂解缓冲液中 (50 mmol/L NaH2PO4,300 mmol/L 氯化钠,10 mmol/L 咪唑,1 g/L 溶菌酶,pH 8.0),在冰上放置30 min,期间轻轻旋转2 次;细胞裂解液在4 ℃、15 000 r/min 离心30 min,取上清液;将镍螯合层析柱颠倒混匀树脂,并排除贮存缓冲液,将上清液加入镍柱,弃流出液;用4 mL 漂洗缓冲液(50 mmol/L NaH2PO4,300 mmol/L 氯化钠,20 mmol/L咪唑)洗柱2 次,去除杂蛋白;用1 mL 漂洗缓冲液(50 mmol/L NaH2PO4,300 mmol/L 氯化钠,250 mmol/L 咪唑,pH 8.0)洗柱2 次,收集含谷氨酸脱羧酶A 的洗脱液。
1.5.6 重组谷氨酸脱羧酶A 的酶学性质
1.5.6.1 pH 值对酶活的影响 配置不同pH 值的酶活测定缓冲液:0.2 mol/L Na2HPO4-柠檬酸缓冲液,10 mmol/L 谷氨酸钠,1 mmol/L 磷酸吡哆醛,分别在pH 3.0,3.5,4.0,4.5,5.0,5.5,6.0 下,于37℃水浴中反应10 min 后立即置于沸水浴中终止反应,测定样品中谷氨酸脱羧酶A 的酶活力,以其中最高酶活为100%。
1.5.6.2 反应温度对酶活的影响 取50 μL 适当稀释的纯酶液,加入到预热的1 mL 酶活测定缓冲液中,分别在20,30,37,40,50 ℃和60 ℃水浴中反应10 min,测定样品中谷氨酸脱羧酶A 的酶活力,以其中最高酶活为100%。
1.5.6.3 金属离子对酶活的影响 向反应体系中加入金属离子Cu2+,Ca2+,Mg2+,Ba2+,Co2+和Zn2+,使其终浓度为1 mmol/L。在最适作用pH 值和最适反应温度下,研究金属离子对谷氨酸脱羧酶A 的酶活力的影响,以不加金属离子的相对酶活为100%。
1.5.6.4 酶的热稳定性研究 取1 mL 适当稀释的纯酶液,分别置于40,50,60 ℃和70 ℃条件下保温30,60,90,120 min 和150 min,测定不同时间段的谷氨酸脱羧酶A 的酶活力。重组谷氨酸脱羧酶A 在各自温度下的初始酶活均设定为100%。
1.6 分析方法
1.6.1 蛋白质质量浓度标准曲线的绘制 样品中蛋白质含量的测定采用BCA 法,以牛血清白蛋白为标准品[36]。准确称取100 mg 牛血清白蛋白,充分溶解于磷酸缓冲溶液中,定容至100 mL,即得1 mg/mL 的牛血清白蛋白(BSA)标准溶液。按照表1分别配置不同质量浓度的蛋白标准溶液。取20 μL 相应质量浓度的标准蛋白质溶液加入到酶标板上,立刻加入200 μL 牛血清白蛋白工作液,迅速混匀,在37 ℃水浴中保温30 min,冷却至室温,测定样品在波长562 nm 处的吸光值,0 号管为对照,绘制蛋白质质量浓度标准曲线。
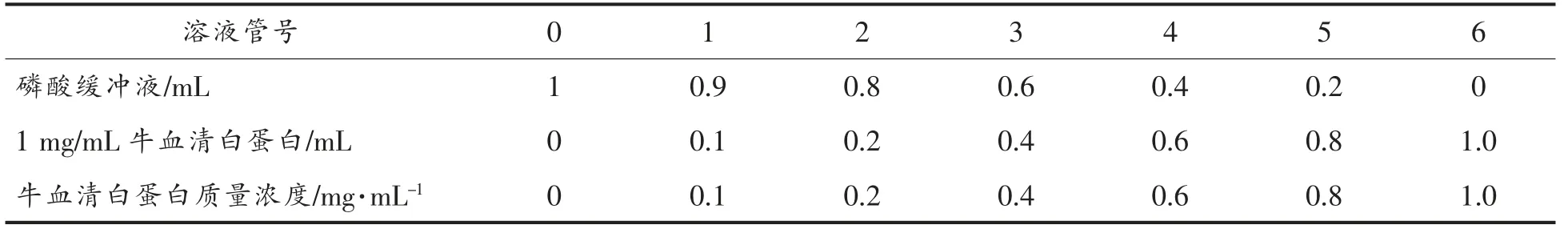
表1 不同质量浓度标准蛋白溶液的配制Table 1 Preparation of different mass concentrations of standard protein solution
1.6.2 样品中蛋白质含量的测定 在酶标板上加入20 μL 样品溶液(蛋白浓度过高可适当稀释),立即加入200 μL 牛血清白蛋白工作液,迅速混匀,在37 ℃水浴中保温30 min,冷却至室温后,在酶标仪上测其在波长562 nm 处的吸光值,对照组加入20 μL 磷酸缓冲液,根据蛋白质质量量浓度标准曲线方程,计算酶液中的蛋白质含量。
1.6.3 琼脂糖凝胶电泳 称取0.2 g 琼脂糖加入到配制好的20 mL 1×TBE 电泳缓冲液中,电炉加热,待琼脂糖完全溶解后,冷却数分钟。将溶液倒入制胶槽,插上梳子,待凝胶完全凝固后放入到电泳槽中,将样品和6×上样缓冲液以2∶1 比例混匀后点样,在80~120 V 电压下电泳,结束后用凝胶成像仪观察条带位置。
1.6.4 蛋白质SDS-PAGE 电泳 取1 mL 细胞破碎后的上清液,加入20 μL 的5×上样缓冲液,并加入80 μL 蒸馏水,震荡离心管将样品混匀。沸水浴煮沸5 min。用微量进样器取15 μL 裂解后的粗酶液上样。电泳时浓缩胶电压为70 V,分离胶电压为110 V。待溴酚蓝指示带跑到胶板底端时结束电泳。用考马斯亮蓝染色液染色30 min,再用脱色液快速脱色40 min,最后将凝胶进行过夜慢脱色处理至蛋白条带清晰可见[37]。最后将凝胶置于凝胶成像仪中,拍照并观察电泳结果。
1.6.5 谷氨酸脱羧酶A 的酶活测定方法 酶活测定缓冲液配方如下:10 mmol/L 谷氨酸钠,1 mmol/L磷酸吡哆醛,0.2 mol/L Na2HPO4-柠檬酸缓冲液,pH 4.5[38]。取50 μL 酶液,加入到1 mL 预热的酶活测定缓冲液中,37 ℃保温10 min,然后置于沸水浴10 min 以终止反应。高效液相色谱测定反应前、后酶活测定缓冲液中生成的γ-氨基丁酸的量。酶活(U)定义:1 min 生成1 μmol γ-氨基丁酸所需的酶量为一个酶活单位。
1.6.6 γ-氨基丁酸和L-谷氨酸钠的测定 采用高效液相色谱法(HPLC)测定样品中γ-氨基丁酸和L-谷氨酸钠的含量,并采用丹磺酰氯衍生化方法[39-40]对样品进行柱前衍生化处理。采用梯度洗脱方法[41-42]对样品中的物质进行分离,梯度洗脱条件如表2所示。液相色谱分离柱为安捷伦公司生产的Zorbax Eclipse Plus C18 柱,紫外检测波长为254 nm,流速为1 mL/min,柱温控制在30 ℃。盐相为四氢呋喃、甲醇和50 mmol/L 醋酸钠缓冲液(pH 6.2)的混合液,体积比为1∶15∶84,有机相为甲醇。
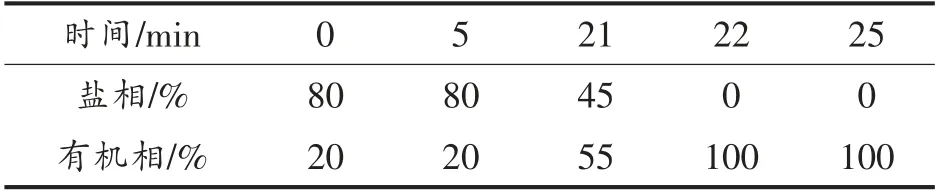
表2 HPLC 梯度洗脱条件Table 2 The condition of HPLC gradient elution
1.7 数据处理和统计分析
试验结果以平均值±标准偏差表示。数据分析采用SPSS 17.0 软件,质粒绘图采用Redasoft Visual Cloning 3.2.3 软件,数据绘图采用Origin 8.5软件。
2 结果与分析
2.1 L-谷氨酸钠、γ-氨基丁酸和蛋白质质量浓度标准曲线
L-谷氨酸钠、γ-氨基丁酸和蛋白质质量浓度标准曲线如图2所示。由该图可知,L-谷氨酸钠标准曲线的线性回归方程为y=2×106x+547820,相关系数R2=0.998,x 为L-谷氨酸钠的质量浓度,y 为信号峰面积(图1a);γ-氨基丁酸标准曲线的线性回归方程为y=5×106x+2×106,相关系数R2=0.9978,x 为γ-氨基丁酸的质量浓度,y 为信号峰面积(图1b);蛋白质质量浓度标准曲线的线性回归方程为y=1.2663x+0.0308,其中y 表示在波长562 nm 下蛋白质的吸光度;x 表示蛋白质质量浓度,相关系数R2为0.9974(图1c)。3 条标准曲线的线性回归方程的相关系数R2均大于0.99,表明自变量与因变量之间的线性关系良好,可用作标准曲线。
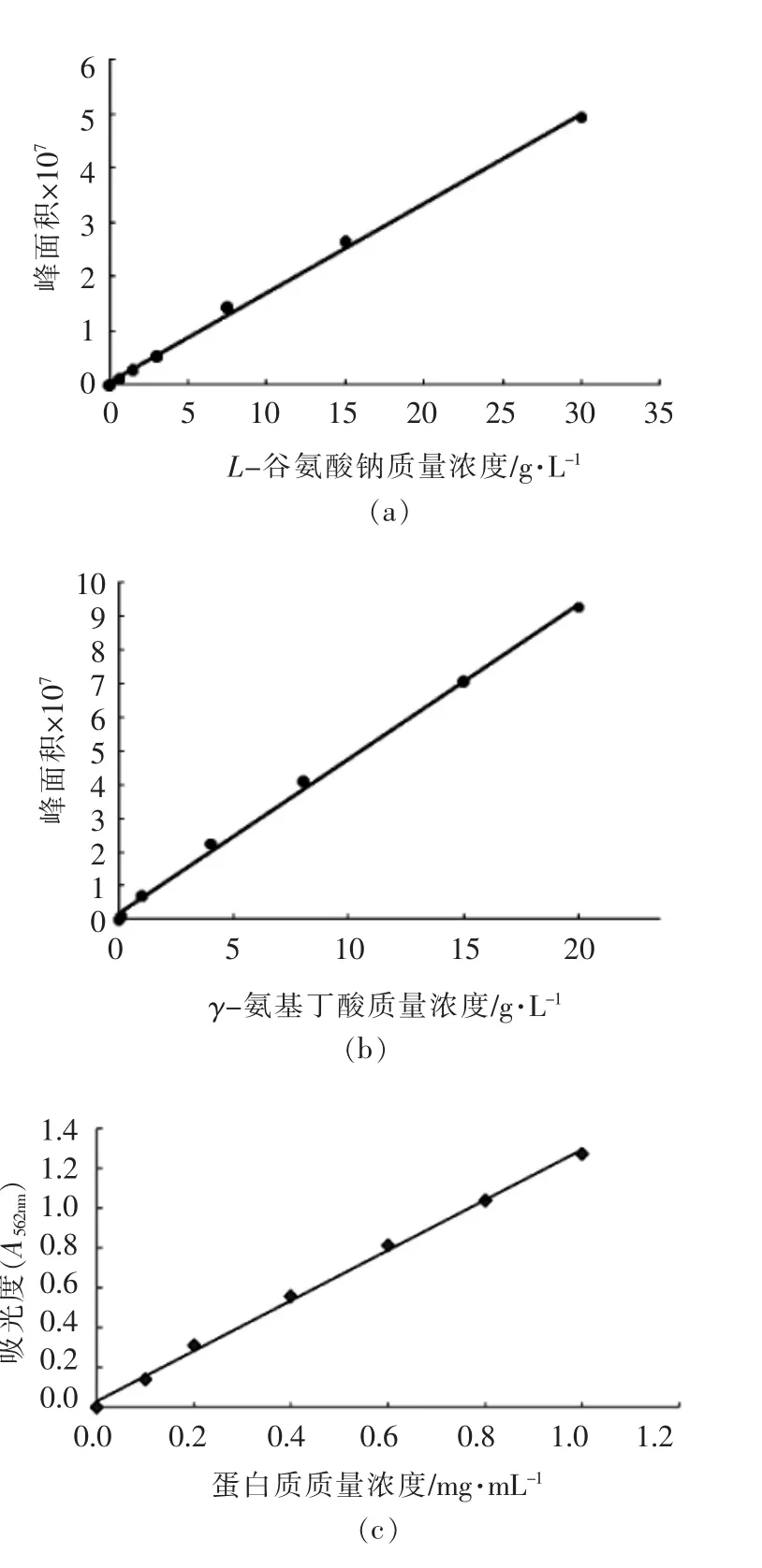
图2 L-谷氨酸钠、γ-氨基丁酸和蛋白质量浓度标准曲线Fig.2 Standard curves of mass concentration of L-monosodium glutamate,γ-aminobutyric acid and protein
2.2 谷氨酸脱羧酶A 基因gadA 的克隆及其表达载体的构建
以质粒pTrc99a-gadABC 为模板,采用PCR技术克隆了编码谷氨酸脱羧酶A 的基因gadA,将gadA 基因用限制性内切酶BamHI 和SacI 双酶切后,连接到用相同限制性内切酶双酶切的质粒pET-28a(+)上,构建重组质粒pET28a-gadA,构建过程如图3所示。
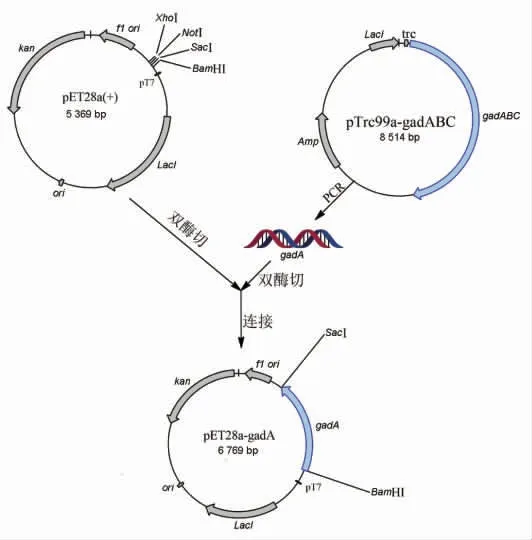
图3 质粒pET28a-gadA 构建过程示意图Fig.3 Schematic map of the construction of the plasmid pET28a-gadA
将重组质粒pET28a-gadA 转化至大肠杆菌BL21,随机挑选4 个转化子进行鉴定,结果如图4所示。
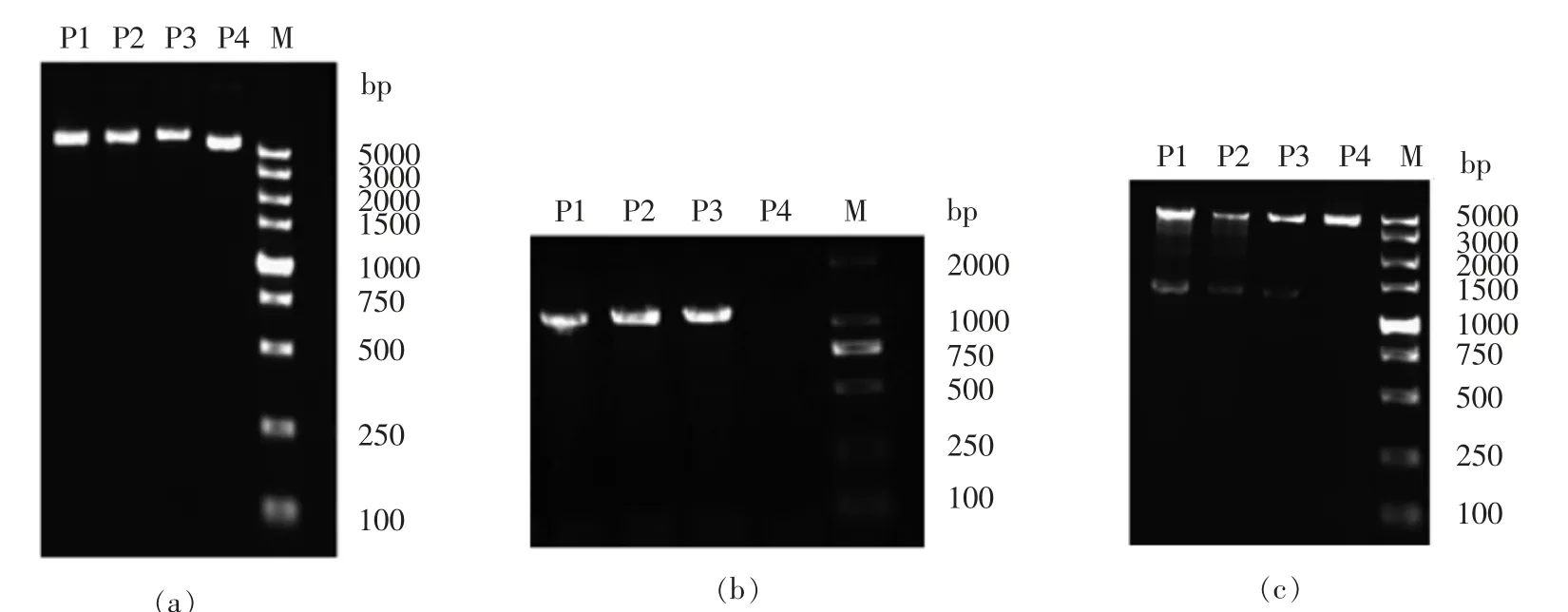
图4 重组质粒P1、P2、P3 和P4 的大小(a)、PCR(b)和双酶切(c)鉴定结果Fig.4 Identification results of size (a),PCR (b)and double enzyme digestion (c)of recombinant plasmids P1,P2,P3 and P4
从抗性平板上随机挑取4 个转化子,分别提取质粒,将质粒命名为P1、P2、P3 和P4。质粒大小鉴定结果如图4a所示,pET28a 质粒大小为5 369 bp,重组质粒pET28a-gadA 大小为6 769 bp,图中P1、P2 和P3 符合预期大小。图3b 为PCR 鉴定结果,gadA 基因为1 400 bp,从图中可看出P1、P2和P3 扩增出的条带符合预期大小。从图3c 可以看出,双酶切后目的基因gadA 大小为1 400 bp,pET28a 质粒载体大小为5 369 bp,图中1、2 和3泳道分别有2 个条带,且符合预期大小。根据上述结果,可以判定质粒P1、P2 和P3 构建成功。
2.3 谷氨酸脱羧酶A 镍柱纯化
将诱导表达的重组菌大肠杆菌BL21/pET28a-gadA 进行超声破碎释放胞内蛋白后,进行镍柱纯化,分别测定其蛋白质含量和谷氨酸脱羧酶A 的酶活力,结果如表3所示。纯化后的重组谷氨酸脱羧酶A 比酶活为19 U/mg,是粗酶液的4.42 倍,得率为12.8%。
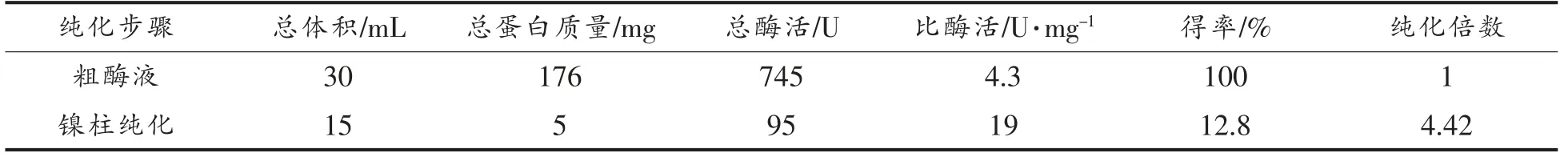
表3 重组谷氨酸脱羧酶A 纯化结果Table 3 Purification results of recombinant glutamate decarboxylase A
2.4 纯化的谷氨酸脱羧酶A 的SDS-PAGE 鉴定
纯化的谷氨酸脱羧酶A 的SDS-PAGE 鉴定结果如图5所示。从该图可以看出,纯化后重组谷氨酸脱羧酶A 为单一的蛋白条带,且其大小与理论分子质量一致,说明其为电泳纯级,可用于酶学性质的测定。

图5 纯化的谷氨酸脱羧酶A 的SDS-PAGE 鉴定结果Fig.5 SDS-PAGE identification results of the purified glutamate decarboxylase A
2.5 pH 值对谷氨酸脱羧酶A 酶活力的影响
pH 值对谷氨酸脱羧酶A 酶活力的影响如图6所示。将适量纯酶液分别在不同pH 值的缓冲体系下反应,测定重组谷氨酸脱羧酶A 的酶活力。从图中可以看出,pH 值为4.5 时,谷氨酸脱羧酶A的酶活力最高,该结果与文献报道的大肠杆菌谷氨酸脱羧酶A 的最适pH 值一致[43-44]。当pH 值在4.0~5.0 之间时,谷氨酸脱羧酶A 的相对酶活在75%以上;当pH 值为5.0~5.5 时,酶活下降较快;当pH 值为6 时,相对酶活仅为10.4%,可见谷氨酸脱羧酶的pH 值活性范围较窄,说明谷氨酸脱羧酶有较强的pH 值依赖性。
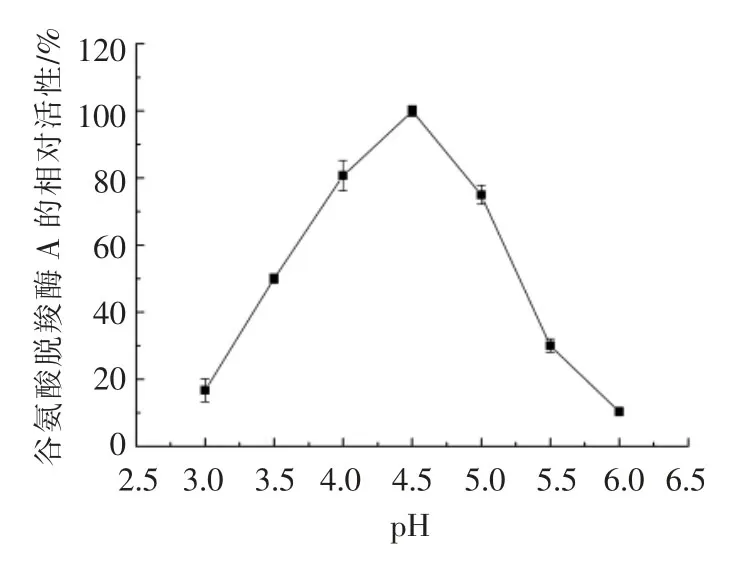
图6 pH 值对谷氨酸脱羧酶A 酶活力的影响Fig.6 Effects of pH value on the activity of glutamate decarboxylase A
2.6 反应温度对谷氨酸脱羧酶A 酶活力的影响
将适当稀释的纯酶液置于pH 4.5 的缓冲液中,在不同温度下反应,研究反应温度对重组谷氨酸脱羧酶A 酶活力的影响,结果如图7所示。从该图可以看出,重组谷氨酸脱羧酶A 的最适温度50℃,在该温度下,重组谷氨酸脱羧酶A 的酶活力比大肠杆菌最适生长温度37 ℃时的酶活力高40%。当反应温度从50 ℃升到60 ℃时,酶活力随着温度的升高逐渐降低,主要是因为酶蛋白的热变性使得部分酶活丧失所致。这与Zhao 等[38]报道的大肠杆菌W3110 的谷氨酸脱羧酶A 的最适温度一致。
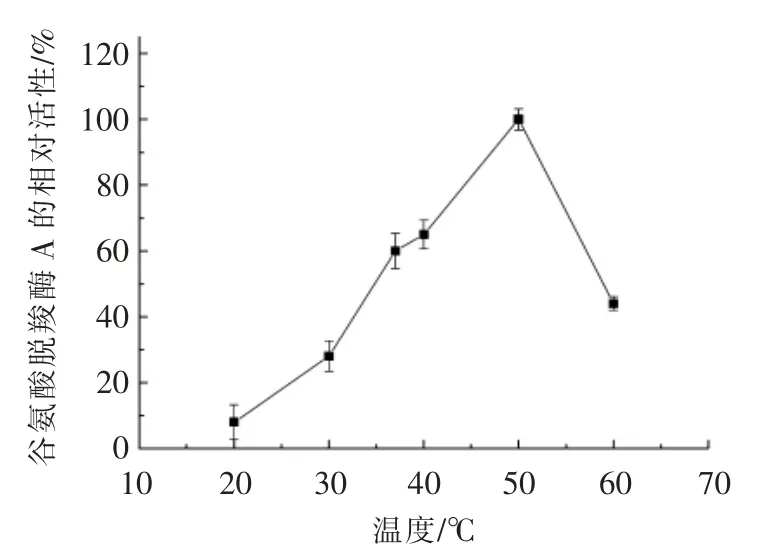
图7 反应温度对谷氨酸脱羧酶A 酶活力的影响Fig.7 Effects of reaction temperature on the activity of glutamate decarboxylase A
2.7 金属离子对谷氨酸脱羧酶A 酶活力的影响
向反应体系中加入金属离子,如Cu2+,Ca2+,Mg2+,Ba2+,Co2+和Zn2+,并使其终浓度为1 mmol/L,测定金属离子对谷氨酸脱羧酶A 酶活力的影响,结果如图8所示。从该图可以看出,Cu2+在低浓度时能明显抑制谷氨酸脱羧酶A 的酶活力,使其下降到80%左右,这可能是Cu2+与谷氨酸脱羧酶A酶分子中某些官能团共价结合,影响了酶分子活性中心结构所致。Mg2+,Ba2+,Co2+在低浓度时对酶活的影响不大;Ca2+能够激活谷氨酸脱羧酶A 的酶活力。Snedden 等[45]研究发现,Ca2+是谷氨酸脱羧酶最通用的激活剂,能够激活大部分来源的谷氨酸脱羧酶的酶活力。还有学者研究发现,多数植物GAD 含有一个钙调蛋白黏合区,钙离子通过此区域来调节谷氨酸脱羧酶的活性[46]。
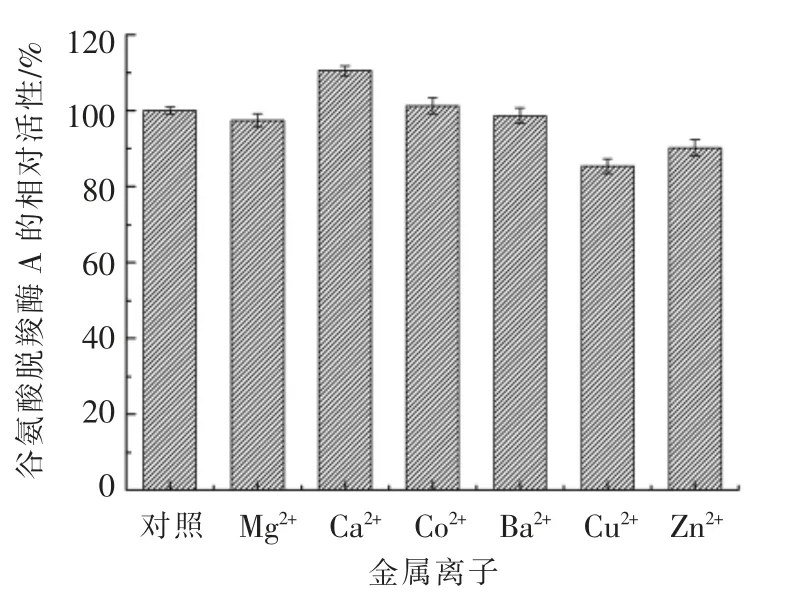
图8 金属离子对谷氨酸脱羧酶A 酶活力的影响Fig.8 Effects of metal ions on the activity of glutamate decarboxylase A
2.8 重组谷氨酸脱羧酶A 的热稳定性
将适当稀释纯酶液分别置于不同的温度下,每隔一定时间测定谷氨酸脱羧酶A 的酶活力,结果如图9所示。从该图可以看出,谷氨酸脱羧酶A在40,50 ℃和60 ℃保温150 min 后,相对酶活均在40%以上。谷氨酸脱羧酶A 的酶活力在40 ℃时,稳定性较好,可以保持63%的活性,然而在70℃时,其活力明显下降,保温150 min 后酶活仅能保持17.9%,这表明重组谷氨酸脱羧酶A 热稳定性不高,易于热失活。
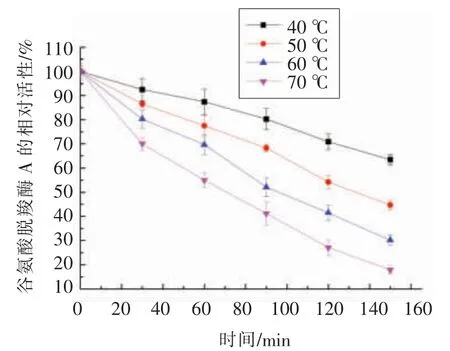
图9 谷氨酸脱羧酶A 的热稳定性Fig.9 Thermal stability of glutamate decarboxylase A
3 结论
本研究首先以质粒pTrc99a-gadABC 为模板,采用PCR 技术克隆了编码谷氨酸脱羧酶A 的基因gadA,然后将该基因与质粒pET-28a(+)连接,构建重组质粒pET28a-gadA,并将该质粒转化至大肠杆菌BL21,成功获得能够表达谷氨酸脱羧酶A 的重组大肠杆菌菌株大肠杆菌BL21/pET28agadA。将该菌株诱导培养后,超声破碎得粗酶液。通过Ni2+柱亲和层析分离纯化出目的蛋白谷氨酸脱羧酶A,并对纯化的谷氨酸脱羧酶A 进行了SDS-PAGE 鉴定。纯化结果表明重组谷氨酸脱羧酶A 的比酶活为19 U/mg,是粗酶液的4.42 倍,得率为12.8%。谷氨酸脱羧酶A 的酶学性质研究表明,该酶的酶活力在pH 值为4.5 时最高,具有较强的pH 值依赖性。该酶的最适温度为50 ℃,在40 ℃时热稳定性最好,70 ℃时稳定性较差,此时酶活力仅为初始酶活的17.9%。Cu2+对谷氨酸脱羧酶A 的酶活力具有较强的抑制作用,Ba2+、Co2+和Mg2+对酶活力影响不大,Ca2+能显著地增加其酶活力。

