丁三醇合成关键酶的筛选、酶学性质及体外催化
李 惑,曹雪飞,储建林,吴 斌
(1. 南京工业大学生物与制药工程学院,江苏南京211800; 2. 南京工业大学药学院,江苏南京211800)
1,2,4-丁三醇(1,2,4-butanetriol,BT)是一种无色、无味、无毒的水溶性C4平台化合物,其为黏稠糖浆状,化学式为C4H10O3,分子量为106.12[1];其2号碳原子为手性碳原子,具有旋光性,在醇类和水中有较高的溶解度,具有一定的吸湿性[2]。
1,2,4-丁三醇在合适的硝化体系中被完全硝化的产物是丁三醇三硝酸酯(BTTN)[3],BTTN是一种含能增塑剂,与硝化甘油(NG)相比,它具有冲击感小、热稳定性高、毒性小、挥发性低及吸湿性低等优点,在炸药、推进剂等领域应用广泛[4-5]。1,2,4-丁三醇也是很多手性化合物的合成前体,以它为原料合成的缓释剂可用来控制药物的释放速度[6-8]。光学纯的1,2,4-丁三醇可以作为抗肿瘤、抗病毒、抗癌药物、血小板活性因子、降胆固醇药物及治疗皮肤病药物等药物制备的关键中间体[9-15],如(S)-1,2,4-丁三醇的环化产物(S)-3-羟基-四氢呋喃是合成治疗艾滋病的药物Agenerase(一种HIV蛋白酶抑制剂)的重要中间体[16]。1,2,4-丁三醇用作烟草降焦油助剂,可以减弱硝基化合物对人体的毒害,从而降低焦油对人体的危害;作为防腐剂的添加剂,能够抑制微生物生长,增强防腐效果;作为彩色显影液的组分,可增加色彩度和黏着力;作为交联剂,可以提高聚合物的强度和硬度[17]。另外,1,2,4-丁三醇还可用作高级服装的表面处理剂、高级墨水防干剂、陶瓷加工助剂以及特殊用途的包装与储运等[18-20]。
迄今为止,在生物法合成1,2,4-丁三醇的途径中,α-酮酸脱羧反应中的关键酶仍然沿用Forst团队的Niu等[21]报道的来源于恶臭假单胞菌的苯甲酰甲酸脱羧酶MDLC。
本研究利用分子模拟技术,从京都基因与基因组百科全书数据库(KEGG)、酶数据库BRENDA等数据库中筛选可能催化3-脱氧-D-甘油-戊酮糖酸脱羧形成3,4-二羟基丁醛的酮酸脱羧酶,将其克隆至pEGX-6p-1后于E.coliDH5α中表达,比较目标酶的酶活力大小,对酶活力最高的脱羧酶进行纯化,并对其酶学性质进行分析及体外催化研究,为提高BT生物合成效率提供优异的新酶源。
1 材料与方法
1.1 材料
菌株E.coliBL21、E.coliDH5α、质粒pGEX-6p-1、质粒pET-22b(+),何冰芳教授实验室保存;E.coliBL21/pET22b-xylD,何冰芳教授实验室构建保存。质粒pUC57-mdlC、pUC57-kivD、pUC57-kdcA、pUC57-aro10和pUC57-pdc5,苏州金唯智生物科技有限公司合成。
各种限制性内切酶、DNA聚合酶、标准DNA、标准蛋白,TaKaRa公司。DNA琼脂糖凝胶回收试剂盒、质粒提取试剂盒,Axygen公司;胰蛋白胨、酵母提取物、琼脂糖,Oxoid公司;木糖酸,珍瑭生物科技有限公司;NaCl、Tris-base,进口或国产分析纯。
LB培养基[22](g/L):蛋白胨10.0、NaCl 10.0、酵母粉5.0;固体培养基另加琼脂20.0。
LB+氨苄青霉素(Amp)培养基:LB培养基灭菌后冷却至60 ℃以下,再加入过滤除菌的Amp,使其终质量浓度分别为100 mg/L。
1.2 大肠杆菌的DNA操作
质粒提取、DNA酶切、连接、电泳、转化等DNA操作参照文献[22]进行。
1.3 3-脱氧-D-甘油-戊酮糖酸-二磷酸硫胺(ThDP)反应中间体的结构构建
利用MOE软件(Chemical Computing Group)构建3-脱氧-D-甘油戊酮糖酸的加H结构(图1(a)),采用MMFF94力场,优化几何三维结构,获得底物的三维结构;按照反应催化机制,将3-脱氧-D-甘油戊酮糖酸接到辅基二磷酸硫胺素(ThDP)上——ThDP结构从酶的晶体结构中提取,构建反应中间体结构(图1(b)),并优化几何三维结构。
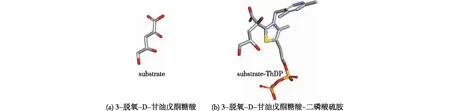
图1 底物3-脱氧-D-甘油戊酮糖酸与中间体3-脱氧-D-甘油-戊酮糖酸-二磷酸硫胺的结构Fig.1 Structures of the substrate (3-deoxy-D-glyceropentanoglycan acid) and the intermediate (3-deoxy-D-glyceropentanoglycan acid-thiamine diphosphate)
1.4 同源建模
来源于Pseudomonasaeruginosa的5-胍基-α-含氧戊酸脱羧酶(ARUI)[23]、来源于Neurosporacrassa的丙酮酸脱羧酶(N-PDC)[24]、来源于Saccharomycescerevisiae的支链-α-含氧酸脱羧酶(S-PDC)[25]和来源于Lactococcuslactis的α-酮异戊酸脱羧酶(KIVD)[26]的晶体结构没有被解析出来,利用同源建模方法构建其三维结构。上述4个脱羧酶的模板结构来自PDB数据库,ID依次分别为6BD3、5EUJ、2VK4和2VBF。利用Discovery studio 2.55软件构建同源模型,并进行全局能量最小化计算。
1.5 分子对接
对接使用MOE软件。分子对接前,所有的蛋白质结构均去除水分子和原有配体;用MOE软件为蛋白质分配电荷和氢原子,并优化结构,力场采用Amber10:EHT。将小分子对接进入脱羧酶的活性中心,配体构象由键旋转生成,分子对接采用Triangle Matcher法,并用LondondG评分函数进行排名,输出100个构象(pose),再用gbvi/wsadg评分功能进一步优化排序,使酶活性口袋中的能量最小化。
1.6 α-酮酸脱羧酶基因的克隆
根据筛选所得序列设计PCR引物及序列(表1)进行基因扩增,上下游引物的5’端分别设计了BamHⅠ、XhoⅠ酶切位点。

表1 PCR引物及序列
PCR的反应体系:模板2 μL,上下游引物各2 μL,2×Priemix 25 μL,加重蒸水至50 μL。
反应条件:95 ℃预变性5 min后,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,进行32个循环,72 ℃延伸10 min。
1.7 表达载体的构建
将质粒与目标酶基因用BamHⅠ、XhoⅠ进行双酶切,得到的线性载体与目标酶基因用T4连接酶16 ℃连接8 h,导入感受态E.coliDH5α/E.coliBL21,得到重组质粒E.coliDH5α/pGEX-6p-1-mdlC、E.coliDH5α/pGEX-6p-1-kivD、E.coliDH5α/pGEX-6p-1-kdcA、E.coliDH5α/pGEX-6p-1-aro10、E.coliDH5α/pGEX-6p-1-pdc5。
1.8 目标酮酸脱羧酶的发酵培养及表达
将重组菌E.coliDH5α/pGEX-6p-1-mdlC、E.coliDH5α/pGEX-6p-1-kivD、E.coliDH5α/pGEX-6p-1-kdcA、E.coliDH5α/pGEX-6p-1-aro10、E.coliDH5α/pGEX-6p-1-pdc5,加入含Amp的LB种子培养基中,在37 ℃、180 r/min摇床中培养12 h。以2%(体积分数)的接种量接入LB发酵培养基中,在37 ℃、180 r/min摇床中培养1.5~2 h,至OD600约为0.6时加入终浓度为1 mmol/L的IPTG,于16 ℃下诱导表达,继续培养36 h后在4 ℃下8 000 r/min离心20 min收集沉淀菌体,破碎后离心,留上清液。
1.9 酶活检测
利用SDS-PAGE分析胞外上清液中的表达产物,并采用脱羧酶酶活检测的方法测定目标α-酮酸脱羧酶的酶活[27]。E.coliDH5α中含有BT合成途径中所需的木糖酸脱水酶和醇脱氢酶,通过醇脱氢酶将3,4-二羟基丁醛转化为BT过程中NADH的消耗来测量其活性。体系中含有50 mmol/L磷酸钾(pH6.5)、10 mmol/L木糖酸、0.15 mmol/L ThDP、0.2 mmol/L NADH、10 U乙醇脱氢酶、20 μL粗酶裂解物。因为醇脱氢酶是测定中最后一种酶,所以需要添加足够量的醇脱氢酶,使得醇脱氢酶的酶活不会对整体酶活产生影响。所测得的活性表示木糖酸转化生成3,4-二羟基丁醛所经历的2步酶反应的总活性。在96孔板中加入酶活测定的组分后混匀,在30 ℃下,340 nm处每隔1 min记录一次吸光值A340。筛选阶段为了简化实验,在酶活检测中所使用的脱羧酶均为粗酶液。酶学性质研究中所使用的均为纯酶液。
反应总酶活定义:一个单位的酶活定义为每分钟消耗1 μmol NADH的量(U)。
1.10 支链-α-酮酸脱羧酶(KDCA)、木糖酸脱水酶(XYLD)的纯化
将经水系滤膜过滤的细胞破碎上清液通过镍亲和层析柱纯化,收集目标酶出峰的洗脱液,于4 ℃透析以除去咪唑和盐。
取适当稀释的酶液,使用Bradfoard法测定蛋白质浓度,以牛血清蛋白(BSA)为标准。
木糖酸脱水酶的酶活定义为每分钟消耗1 μmol木糖酸的量。采用比色法检测木糖酸脱水酶酶活。
1)1,2,4-丁三醇体外催化。50 mmol/L磷酸缓冲液(pH6.5)、0.5 mmol/L 焦磷酸硫胺素(TPP)、10 mmol/L MgCl2、20 mmol/L木糖酸、0.375 mmol/L NADH、0.5 mg/L脱羧酶、0.5 mg/L木糖酸脱水酶、25 U醇脱氢酶。体外催化中所使用的酶均为纯酶。
2)1,2,4-丁三醇体外催化。将上述溶液加入1.5 mL离心管中混匀,在30 ℃、100 r/min控温摇床中避光转化24 h。
3)1,2,4-丁三醇液相检测方法。使用有机酸分析柱Aminex HPX-87H(300 mm×7.8 mm)检测1,2,4-丁三醇,流动相为5 mmol/L H2SO4水溶液,流速0.5 mL/min,进样量20 μL,柱温55 ℃,检测器为折光示差检测器。
2 结果与讨论
2.1 α-酮酸脱羧酶的虚拟筛选
根据底物特点,在KEGG等数据库中检索类似的基团反应。本研究从BRENDA数据库的脱羧酶EC 4.1.1-家族成员中选择了9种具有相似基团反应的不同来源不同种类的脱羧酶:支链-α-酮酸脱羧酶(KDCA)(Lactococcuslactis)[28]、5-胍基-2含氧戊酸脱羧酶(ARUI)(Pseudomonasaeruginosa)[23]、苯丙酮酸脱羧酶(ARO10)(Saccharomycescerevisiae)[29]、丙酮酸脱羧酶(L-PDC)(Lactococcuslactis)[25]、丙酮酸脱羧酶(N-PDC)(Neurosporacrassa)[24]、支链α-含氧酸脱羧酶S-PDC)((Saccharomycescerevisiae)[25]、丙酮酸脱羧酶(PDC1)(Saccharomycescerevisiae)[25]、吲哚丙酮酸脱羧酶(PDC5)(Saccharomycescerevisiae)[25]、α-酮异戊酸脱羧酶(KIVD)(Lactococcuslactis)[26]进行模拟筛选,以原有的苯甲酰甲酸脱羧酶作为对照。酶的氨基酸序列来源于Uniport蛋白质序列数据库(https:∥www.uniprot.org/),索引号见表2。

表2 几种不同来源的α-酮酸脱羧酶的三维结构及序列
其中 KDCA、ARO10、L-PDC、PDC1和PDC5蛋白质晶体结构都已经解析,将从PDB蛋白质结构数据库(https:∥www.rcsb.org)中获得的蛋白质信息列在表2中,另外4个酶的三维结构用同源建模方法构建获得。
利用分子对接软件,将反应中间体与上述蛋白的活性中心逐一对接,并以原有的MDLC做对照,对目标酶进行筛选,获得可能更高效的脱羧酶,最后在实现筛选酶克隆表达和分离纯化的基础上,考察此酶的特性。脱羧酶家族(EC 4.1.1-)含有上百种不同来源、催化不同底物的脱羧酶。本研究根据催化底物特性,在KEGG数据库中搜索相似的基团反应,并对数据库大量的脱羧酶进行比较,选择了9个不同来源催化不同底物的α-酮酸脱羧酶进行筛选。
选取的9种α-酮酸脱羧酶都是ThDP依赖性的非氧化酶,在反应过程中,产生“底物-ThDP”的反应中间体。反应中间体在酶中的稳定与否,往往能够体现催化反应的强弱,因此我们构建了反应中间体,将该中间体与所选的9种α-酮酸脱羧酶进行了分子对接,并将MDLC作为对照,比较其结合自由能,分析其相互作用,从而进一步筛选更有效的催化蛋白质。
表3为不同来源的α-酮酸脱羧酶的对接自由能。由表3可知:反应中间体均能合适地对接到9种α-酮酸脱羧酶活性中心,并有比对照组MDLC更小的对接自由能(负绝对值大),这说明选择的9种α-酮酸脱羧酶都有望替代原有的苯甲酰甲酸脱羧酶。尤其Lactococcuslactis来源的KDCA和Lactococcuslactis来源的KIVD的对接自由能相比对照组有更显著的优势,说明反应中间体与这些酶的亲和性远高于对照组,有望获得更高活性的α-酮酸脱羧酶。
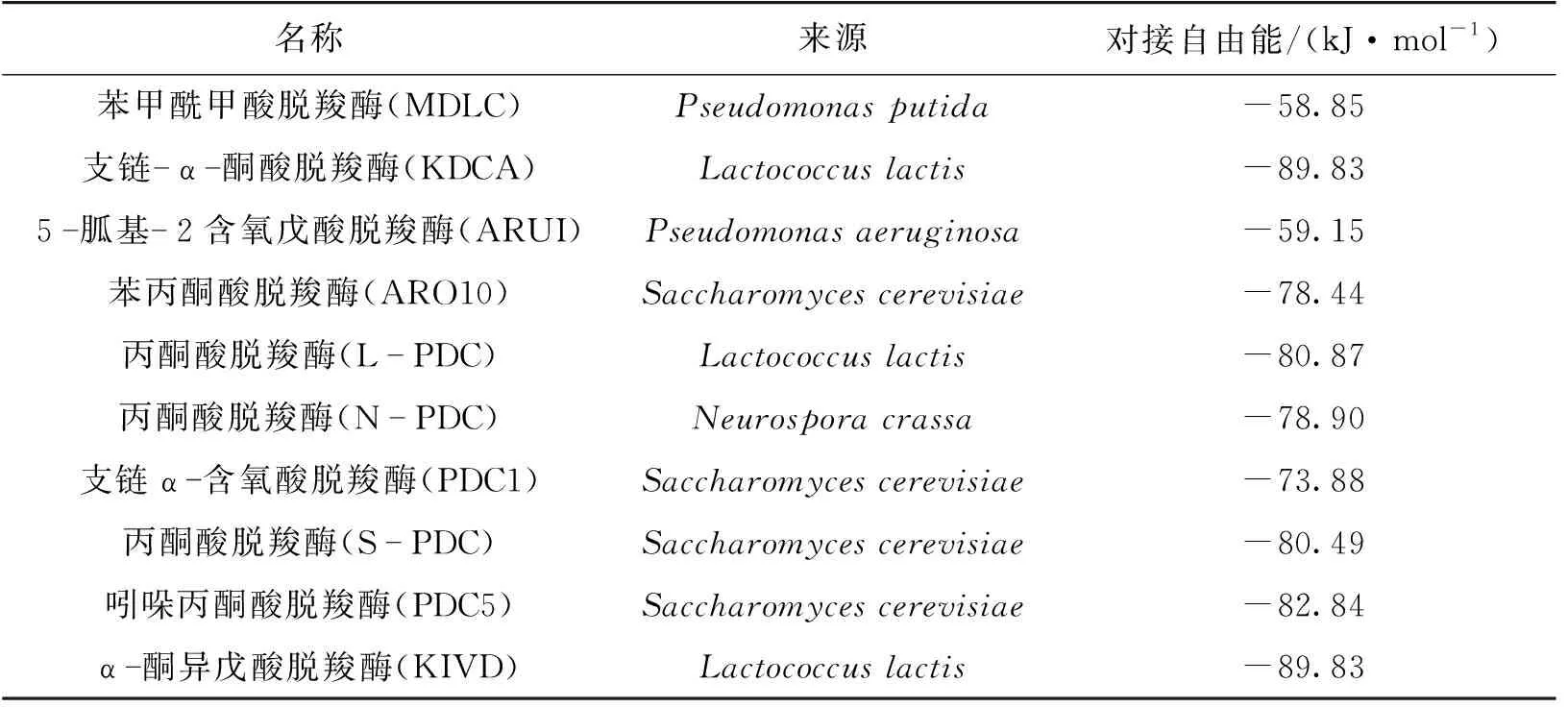
表3 不同来源的α-酮酸脱羧酶的对接自由能
最终选择了Lactococcuslactis来源的KDCA、Saccharomycescerevisiae来源的ARO10、S.cerevisiae来源的PDC5和L.lactis来源的KIVD进行后续实验验证。
2.2 α-酮酸脱羧酶的克隆表达及酶活检测
2.2.1 α-酮酸脱羧酶的克隆表达
通过PCR扩增得到mdlC、kdcA、kivD、pdc5和aro10这5种脱羧酶的基因片段,通过酶切连接转化,经菌落PCR及测序验证,选择正确的菌落进行保存。由于E.coliDH5α自身存在木糖脱水酶以及醇脱氢酶基因,我们将目标脱羧酶基因克隆至E.coliDH5α中表达,可以简化后续酶活检测体系。将发酵破碎上清液进行SDS-PAGE电泳分析,结果见图2。由图2可知:MDLC、KDCA和KIVD在大肠杆菌E.coliDH5α中均可表达,其表观分子量分别为5.6×104、5.6×104和6.1×104。然而酿酒酵母(S.cerevisiae)来源的ARO10和PDC5表达量很低,表达失败。

M—标准蛋白;1—pGEX-6p-1上清液;2—pGEX-6p-1沉淀;3—MDLC上清液;4—MDLC沉淀;5—KDCA上清液;6—KDCA沉淀;7—KIVD上清液;8—KIVD沉淀;9—ARO10上清液;10—ARO10沉淀;11—PDC5上清液;12—PDC5沉淀图2 重组酶的SDS-PAGE分析Fig.2 SDS-PAGE analysis of the combinant recombinase
2.2.2 α-酮酸脱羧酶酶活测定
将发酵破碎离心后的上清液作为粗酶液用于脱羧酶酶活的检测,由于E.coliDH5α中含有木糖脱水酶以及醇脱氢酶的基因,为了简化筛选,选用粗酶液进行酶活检测。用BCA试剂盒检测粗酶液的蛋白含量,再结合蛋白灰度扫描确定酮酸脱羧酶的大致浓度,进行酶活力测定,结果见图3。由图3可知:MDLC、KDCA和KIVD均显示出明显的酶活,且KDCA和KIVD酶活力均高于MDLC,而ARO10和PDC5则无明显比酶活。而孙雷等[30]研究发现,KIVD的催化效率要优于MDLC,但KDCA还没有人对其进行讨论,我们筛选所得的KDCA比KIVD有更高的酶活性,是MDLC的1.93倍,因此KDCA比KIVD在生产BT方面更具有优势。

图3 α-酮酸脱羧酶的相对酶活力Fig.3 Relative enzyme activity of α-keto acid decarboxylase
2.3 KDCA在E.coli BL21中的表达及酶学性质分析
2.3.1 KDCA在E.coliBL21中的表达
由于E.coliDH5α并不是一个专门的蛋白表达宿主,因此,我们将支链-α-酮酸脱羧酶kdcA基因克隆至pET-22b(+),转入蛋白表达宿主E.coliBL21中表达,结果见图4。由图4可知,KDCA成功在大肠杆菌BL21中表达。

图4 KDCA在E.coli BL21中表达Fig.4 Expression of KDCA in E.coli BL21
2.3.2 KDCA酶学性质分析
通过镍柱亲和层析分离获得纯的KDCA。KDCA的理论等电点为4.95,选择pH 7.5的Na2HPO4-KH2PO4缓冲液 A平衡柱子,用缓冲液 B洗脱,收集对应的洗脱峰。木糖酸脱水酶XYLD为本实验室前期构建,为了后续检测,用相同的方法对XYLD进行纯化。
1)温度对重组酶活力及稳定性的影响。考察KDCA的最适催化温度及其热稳定性,结果见图5~6。由图5可知:KDCA的最适温度为30 ℃,与Wei等[28]报道的来源于Lactococcuslactis来源的KDCA的最适温度为45 ℃相比较低。由图6可知:KDCA在30 ℃孵育2 h后仍能保持其初始活性的90 %左右;当温度大于40 ℃孵育时,酶活降低显著;当温度达到60 ℃孵育时,几乎丧失其初始活性的90%以上。

图5 温度对KDCA活力的影响Fig.5 Effect of temperature on KDCA activity

图6 温度对KDCA稳定性的影响Fig.6 Effect of temperature on KDCA stability
2)pH对重组酶活力及稳定性的影响
考察pH对KDCA酶活的影响及其热稳定性,结果见图7~8。由图7可知:KDCA的最适pH为6.5,且pH为6.0~7.0时,具有较好的活性。这与Smit等[31]研究的Lactococcuslactis来源的KDCA的最适pH 6.3相近,与Wei等[28]发现在pH为6.0~7.0时它有广泛活性的结论一致。

图7 pH对KDCA的活力的影响Fig.7 Effect of pH on KDCA activity

图9 脱羧酶体外催化结果的HPLC分析Fig.9 HPLC chromatogram analysis of results of decarboxylase catalysis in vitro
由图8可知:KDCA在0 ℃、pH为6.0~7.0的条件下孵育2 h后,保留了其初始活性的80%以上;在pH大于8的条件下孵育2 h后,KDCA稳定性下降显著。这表明在pH为6.0~7.0时KDCA具有良好的pH稳定性。

图8 pH对KDCA稳定性的影响Fig.8 Effect of pH on KDCA stability
2.4 KDCA、KIVD及MDLC的体外催化性能
发酵制备KDCA、KIVD和MDLC这3种脱羧酶的粗酶液用于1,2,4-丁三醇无细胞催化,在30 ℃、100 r/min条件下避光催化,高效液相色谱(HPLC)检测MDLC、KDCA以及KIVD体外催化生产BT的产物,结果如图9所示。1,2,4-丁三醇标准品出峰时间为17.1 min,底物木糖酸标准品的出峰时间为11.7 min。由图9可知:作为对照的空质粒,无1,2,4-丁三醇产生;MDLC、KDCA以及KIVD均能合成1,2,4-丁三醇。MDLC、KDCA以及KIVD这3个脱羧酶催化生产BT的能力(从小到大)的顺序为MDLC(0.175 g/L)、KIVD(0.216 g/L)、KDCA(0.337 g/L),该结果与酶活检测一致。KDCA体外催化24 h的BT产量为0.337 g/L,是MDLC的1.93倍。
3 结论
利用分子模拟技术,成功筛选出了一个较MDLC酶活力更高的脱羧酶——KDCA,经体外催化研究发现,其24 h的BT产量是MDLC的1.93倍,并对KDCA的酶学性质进行了研究,发现其最适反应温度为30 ℃,最适反应pH 为6.5,为提高BT生物合成效率提供了优异的新酶源。

