克氏原螯虾“五月瘟”致病菌的分离鉴定与药敏试验
李旭东,艾晓辉,刘永涛,童桂香,韦信贤*,杨移斌*
(1.中国水产科学研究院长江水产研究所,湖北 武汉 430223;2.河南省水产技术推广站,河南 郑州 450008;3.广西水产科学研究院,广西水产遗传育种与健康养殖重点实验室,广西 南宁 530021)
克氏原螯虾(Procambarusclarkii),俗称小龙虾,隶属于节肢动物门、甲壳纲、十足目、螯虾科、原螯虾属(Procambarus),原产于北美洲[1]。1930年经日本引进到中国进行养殖,因其食性杂、生长速度快、环境适应能力强,并且肉质鲜美、营养成分丰富等因素,使得克氏原螯虾消费量呈现暴发式增长[2]。
据《中国小龙虾产业发展报告(2019)》[3]显示,2007—2018年,小龙虾产量由26.55万t激增至163.87万t,增长率达517.21%,仅2018年与2017年相比,小龙虾总产量增长45.07%。2018 年中国小龙虾全社会经济总产值3 690亿元,同比增长37.50%。以上数据表明小龙虾正成为养殖户重要经济收入来源。
随着人们对小龙虾消费需求的日益增长,其养殖面积及规模不断扩大,致使小龙虾养殖环境不断恶化小龙虾病害频发。目前国内报道引起小龙虾死亡的病原有很多,包括细菌、病毒和寄生虫等,这些疾病的暴发给快速发展的小龙虾产业蒙上了一层阴影[4-6]。
近年来,在5月份的小龙虾疾病多发,且死亡率高,养殖户称此阶段为小龙虾“五月瘟”。为了解决实际生产问题,本研究深入湖北的多个小龙虾养殖主产区,对养殖户口中的“五月瘟”疾病进行流行病学调查,并取样进行分析,为小龙虾“五月瘟”的防控提供技术支持。
1 材料与方法
1.1 材料
1.1.1 实验动物
患病克氏原螯虾采自湖北荆州、孝感、咸宁、荆门及黄冈等地养殖场。健康克氏原螯虾购自武汉白沙洲水产批发市场,体重(20±2)g,健康无伤病,活力强,暂养7 d无异常后用于试验。
1.1.2 试剂
普通营养琼脂及肉汤、MH琼脂、药敏纸片及细菌生化微量鉴定管均购自杭州微生物试剂有限公司;PCR 所用试剂、特异性引物及细菌基因组DNA 提取试剂盒均购自生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 流行病学调查及临床诊断
对患“五月瘟”的克氏原螯虾主要症状、发病时养殖及周边环境以及危害对象、程度及规模进行调查,了解用药史及采取的防控措施等情况,并进行现场解剖诊断观察。
1.2.2 细菌分离纯化
取每批濒死并具有典型症状的克氏原螯虾10只,体表经75%酒精擦拭后于无菌操作台内解剖,取其肝胰腺,利用无菌接种环取肝胰腺少许组织划线于营养琼脂平板上,置于恒温培养箱中28 ℃培养24 h,挑取形态大小相近、颜色一致的菌落平板进一步纯化培养。将分离纯化得到的菌株与30%甘油混合均匀,保存于-80 ℃备用。
1.2.3 回归感染
根据Koch法则及鉴定结果[7],选择2株(分别编号为:XX01和XX02)细菌进行回归感染试验以检测其致病性。将分离株在28 ℃的液体培养基中培养18 h,在4 ℃下4 000 r/min离心5 min收集菌体,然后用无菌PBS缓冲液重新悬浮,将细菌悬液浓度调整至试验所需浓度4 ℃放置备用。
将600只健康克氏原螯虾随机分为6组,即实验组A、B、C、D和E组,对照组F组,每组100只克氏原螯虾。其中A组和B组,每只克氏原螯虾注射0.1 mL的XX01菌液,每只剂量分别为103、106CFU;C组和D组,每只克氏原螯虾注射0.1 mL的XX02菌液,每只剂量分别为103、106CFU;E组每只克氏原螯虾注射0.1 mL的XX01与XX02 1∶1(V∶V)混合菌液,每只注射混合菌液总剂量为106CFU;对照组F,每只克氏原螯虾注射相同剂量的无菌PBS。
在实验过程中,溶解氧保持在7.5~8.5 mg/mL,水温为24~26 ℃,用完全曝气的自来水进行养殖,感染实验周期为7 d。每天记录临床症状和死亡率。同时对死亡的克氏原螯虾进行解剖,并进行细菌分离纯化及鉴定。
1.2.4 分子鉴定
将分离菌株接种于脑心浸出液,置于摇床恒温28 ℃培养24 h,菌液经高速离心后收集菌体,提取DNA作为PCR扩增模板。细菌16S rRNA序列扩增通用引物为27F:5'-AGAGTTTGATC(C/A)TGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT-3′。参照王小亮等[8]方法进行PCR反应扩增目的基因。扩增产物确定为目的片段后送上海生工进行纯化及序列测定。
将分离株16S rDNA基因序列在NCBI数据库中进行比对,根据比对结果下载同源性较高的序列,采用Clustal X软件进行多序列匹配分析,通过MEGA5.1 软件Neighbor-Joining法构建系统进化树,1 000次Bootstrap检验置信度。
1.2.5 生化鉴定
将分离菌株划线于营养琼脂平板上于28 ℃培养24 h后,挑菌落进行革兰氏染色,参照文献[9]测定,使用微量生化反应管测定分离菌株主要的理化指标。
1.2.6 药敏特性分析
分离株XX01及XX02的药敏特性分析参照NC-CLS抗微生物药物敏感性实验执行标准采用K-B法进行[10]。将分离株XX01及XX02接种于营养肉汤中,28 ℃恒温震荡(200 r/min)培养24 h,用PBS稀释成浓度为107CFU/mL的菌悬液,取100 μL菌液涂布于MH琼脂上,在平板表面贴上选择好的药敏纸片,将平板置于28 ℃恒温培养箱中培养24 h,测量抑菌圈大小。参照杭州微生物公司药敏纸片说明书进行敏感度判定。
1.2.7 治疗研究
根据分离株药敏特性研究结果,选择对二者高度敏感且允许使用的药物进行临床治疗实验。选择自然发病的克氏原螯虾养殖池A、B、C和D,使用所选定的药物进行治疗研究。A池使用选定药物加黄芪多糖(质量比为1∶1,20 mg/kg虾体重)、B池仅使用选定药物(20 mg/kg虾体重)、C池仅使用黄芪多糖(20 mg/kg虾体重)及D组对照组。在实验过程中保证水质指标均符合渔业用水标准(GB 11607— 1989),并将死亡克氏原螯虾及时捞出。每天记录克氏原螯虾临床表现、症状及死亡率。
2 结果
2.1 病原确定
调查发现克氏原螯虾“五月瘟”发病周期较长,一般为每年3~7月,发病高峰期主要集中在5月,发病水温一般为25~30 ℃,发病死亡率高,治疗难度大,而此时也正好是克氏原螯虾大规模上市及二次投苗的时间,给养殖户造成的经济损失很大。发病克氏原螯虾主要症状表现为活力低下、有肌无力症、反应迟钝,解剖后发现肠道及肝胰腺有出血点、鳃部发黑等症状。湖北各地克氏原螯虾主养区均有暴发。
实验共取样137份带回实验室进行病原检测,未发现寄生虫等感染。细菌分离纯化到的菌株2种,编号为XX01及XX02,其中仅检出XX01的样本占25.54%,仅检出XX02占12.42%,二者均检出的占62.04%。
经回归感染试验,结果显示XX01株在106CFU/只克氏原螯虾剂量下,克氏原螯虾全部死亡,而103CFU/只克氏原螯虾剂量下,克氏原螯虾发病率、死亡率均不高;而XX02分离株在106CFU/只克氏原螯虾剂量时7 d内死亡率仅31%,在103CFU/只克氏原螯虾剂量下几乎无死亡;XX01与XX02分离株1∶1混合后以106CFU/只剂量感染克氏原螯虾,引起的死亡率与XX01单独106CFU/只剂量感染克氏原螯虾一致,但死亡速率更快;对照组F组未出现异常。分别从试验组死亡的克氏原螯虾体内分离到与注射菌株形态特征及理化特性一致的菌株。
2.2 细菌鉴定
对分离株的16S rDNA基因序列与NCBI中已有序列比对,显示分离株XX01与气单胞菌属种类同源性最高,而分离株XX02与柠檬酸杆菌属种类同源性最高,构建系统发育树(图2),菌株XX01与嗜水气单胞菌(Aeromonashydrophila)聚为一支,菌株XX02与弗氏柠檬酸杆菌(Citrobacterfreundii)聚为一支。分离株的主要理化特性见表1~2,显示菌株XX01理化特性与嗜水气单胞菌一致,菌株XX02理化特性与弗氏柠檬酸杆菌一致。结合分离株主要理化特性测定结果,综合判定XX01为嗜水气单胞菌,XX02为弗氏柠檬酸杆菌。
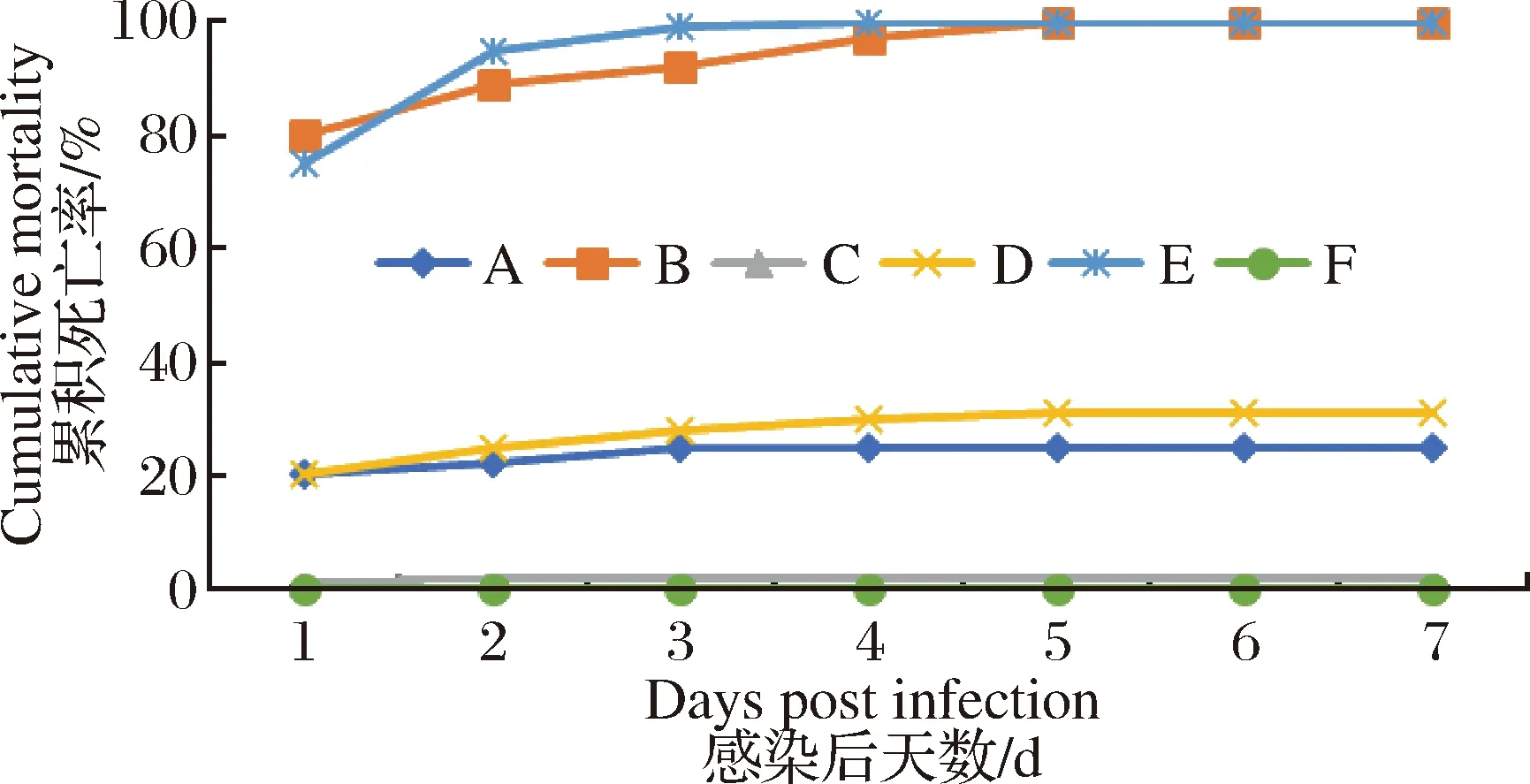
图1 回归感染实验结果Fig.1 Regression infection test results
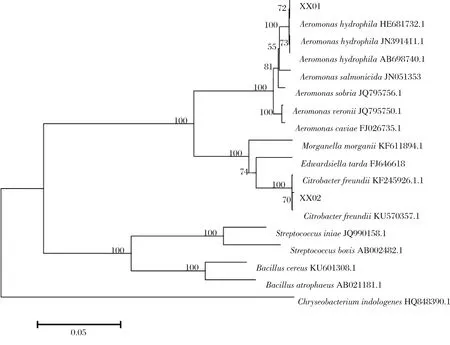
图2 基于16S rRNA构建的关于XX01 和 XX02的进化树Fig.2 Phylogenetic tree for 16S rRNA sequence of XX01 and XX02
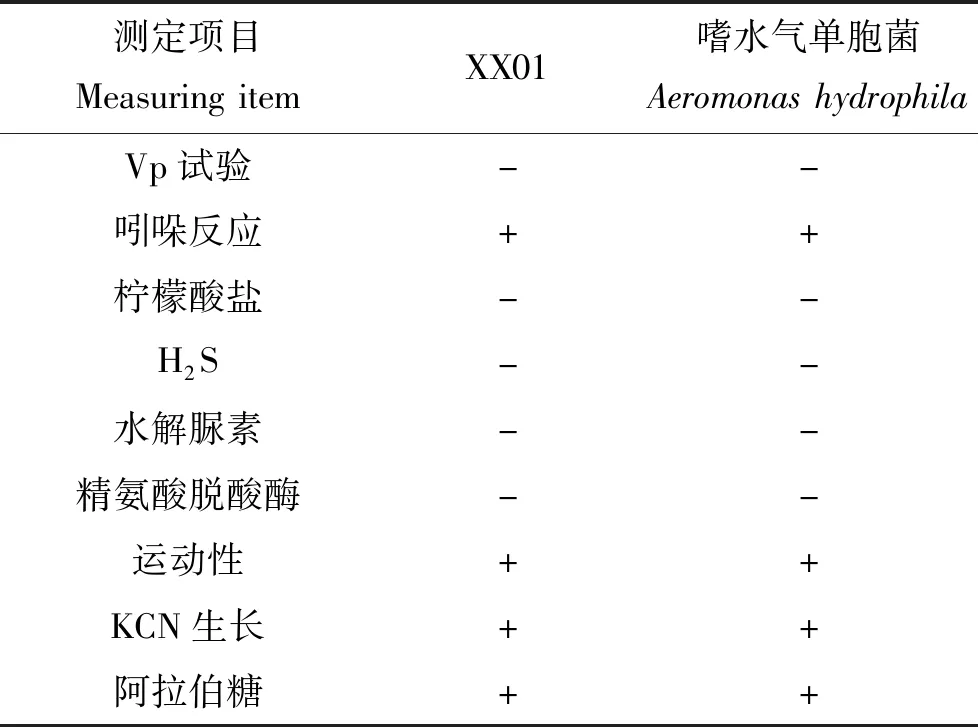
表1 菌株XX01的生化特性Tab.1 Physiologic and biochemical characteristics of XX01 bacterial strain
2.3 药敏特性
研究测定了分离株XX01及XX02对8类19种抗生素的敏感性。结果表明两种分离株对新霉素、阿奇霉素、四环素、强力霉素、依诺沙星、诺氟沙星、氯霉素及氟苯尼考等8种抗生素高度敏感,其中氟苯尼考、强力霉素及新霉素在水产上允许使用,具体见表3。
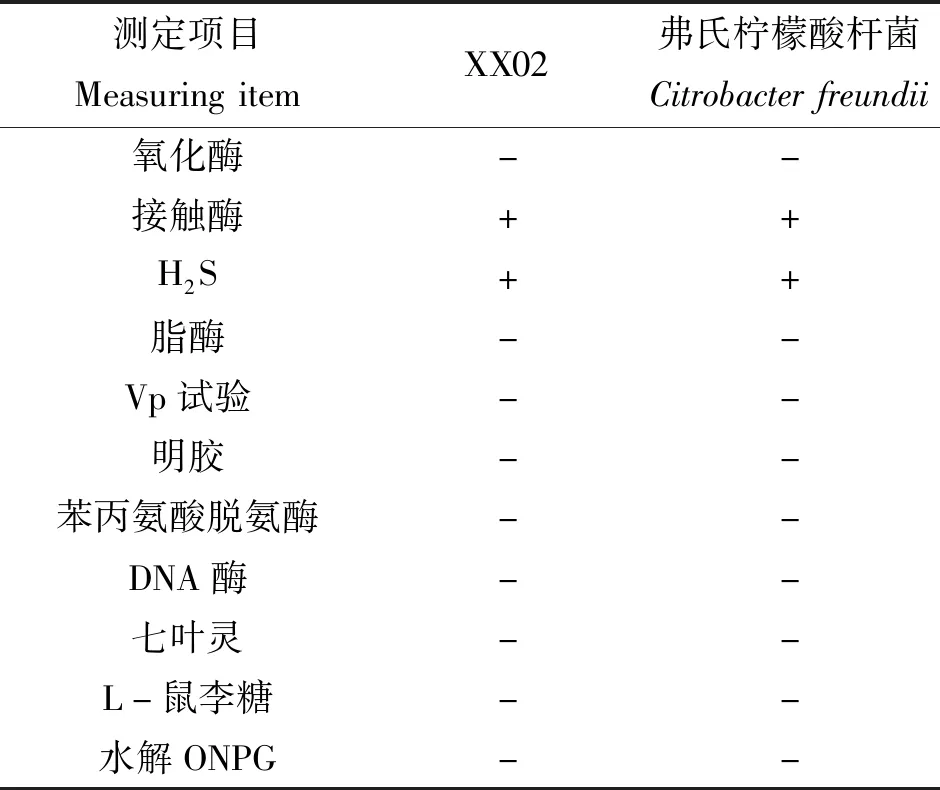
表2 菌株XX02的生化特性Table 2 Physiologic and biochemical characteristics of XX02 bacterial strain
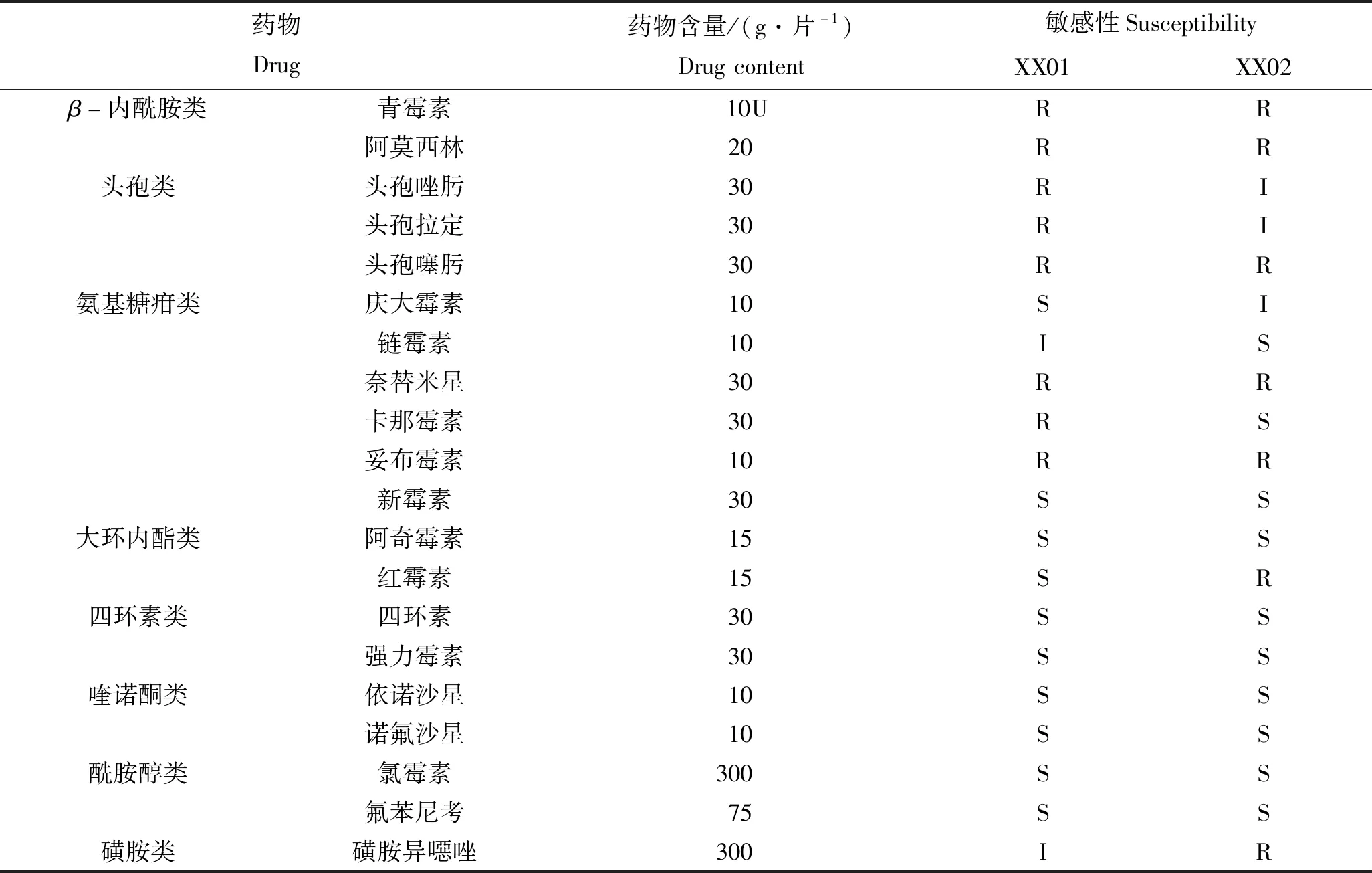
表3 菌株XX01及XX02的药敏特性Table 3 Susceptibility of XX01 and XX02 to antibiotics
根据分离株药敏特性结果,选择氟苯尼考搭配黄芪多糖作为治疗药物。研究发现A组治愈率最高,一个疗程内死亡率明显下降;B组与对照组死亡率接近;C组死亡率首先急剧下降,克氏原螯虾活力增强,第5天左右死亡率出现反弹,治疗效果一般。
3 讨论
本研究经广泛调查取样,基本确定了克氏原螯虾“五月瘟”典型症状。从所取137份样品中分离到2株优势菌,二者混合感染率在62.04%。之所以会出现仅分离到单株优势菌的情况,本研究认为可能是取样划线的误差以及感染菌量等导致的,实际很可能是所有样品中都存在两种菌株感染。经回归感染发现,分离株均可导致克氏原螯虾发病死亡,与以往研究结果一致[11-12],并能从发病死亡个体上再分离到感染菌株。研究结果在一定程度可证实此次分离株对克氏原螯虾存在毒性,是克氏原螯虾“五月瘟”的重要病原,而嗜水气单胞菌是主要致死菌株。本研究也证明了“五月瘟”可能是多病原多重感染导致的,这与唐庆权[13]等研究结果一致。从回归感染结果看,单独的分离株XX02致病能力并不强,而低浓度XX01致病能力也不强,但二者1∶1混合后,毒力明显增强,推测二者之间可能存在协同作用。
目前水产动物疾病防控仍然以化药为主,抗生素是其中重要代表[14]。但是因抗生素大量无序、盲目使用,常导致水产动物病原菌耐药株出现,给水产动物病害治疗带来了极大的麻烦。因此为达到精准用药的目的,必须准确诊断,确定病原病因,并根据病原的药物敏感特性有针对性地选择药物。
本研究结果表明两种分离株均对氟苯尼考、新霉素、阿奇霉素及四环素等8种抗生素高度敏感。因此本研究使用分离株共同敏感的药物氟苯尼考进行治疗研究,配合黄芪多糖共同使用取得了很好的疗效。治疗方案的制定做到了疾病准确诊断,根据病原药敏特性选择相应药物可以达到高效治疗疾病的目的。在研究治疗效果时,配合黄芪多糖使用,则是因为黄芪多糖具有一定的排毒增强免疫的效果[15]。在实际水产动物细菌性疾病治疗过程中,通常会在治疗中后期出现一个死亡高峰,主要原因是水产动物细菌性疾病多为革兰氏阴性菌,其死亡后会释放大量的内毒素,导致病鱼加速死亡,此次治疗研究添加黄芪多糖就是解决此关键问题,这项成果已经得到广大一线鱼病技术人员的认可。细菌的耐药性不同,其可能原因在于养殖环境、地域及用药差异等造成的[16]。为此在水生动物病害防控时,有必要每次都测定其药物敏感特性,选择高度敏感而且允许使用的药物,按照商品药物说明书并在兽医师指导下使用。

