富血小板血浆对兔耳伤口瘢痕增生影响的实验研究
王忠 刘坡 王香梅 邹松云 赵朱云

【摘要】目的 研究富血小板血浆(platelet-rich plasma,PRP)对兔耳增生性瘢痕的影响。方法 选取20只成年新西兰大耳白兔建立兔耳增生性瘢痕动物模型,待伤口上皮化后,将其同体配对对照实验。实验组瘢痕内注射PRP。观察记录术后20天和50天 2组兔耳瘢痕的发生和兔耳瘢痕的大小。结果 对照组兔耳瘢痕的发生率大于实验组兔耳瘢痕的发生率,差异有统计学意义(P<0.05),对照组兔耳瘢痕大于实验组兔耳瘢痕,差异有统计学意义(P<0.05)。结论 表明富血小板血浆具有降低兔耳瘢痕发生的作用;富血小板血浆具有减轻兔耳已发生瘢痕的作用。
【关键词】富血小板血浆;增生性瘢痕;兔耳瘢痕模型
【中图分类号】R644 【文献标识码】A 【文章编号】2026-5328(2021)03-057-04
增生性瘢痕(hyperplastic scar,HS)通常发生在外伤,尤其是烧伤和外科手术之后[1]。HS是一种良性的皮肤纤维化病灶,特征是细胞外基质中胶原蛋白过度沉积和成纤维细胞过度增殖。发生机制是由于细胞凋亡受阻和成纤维细胞生成过多,细胞外基质胶原蛋白合成增加以及各种细胞因子的调节失调而形成的。边界清楚,一般在原创面范围内[2]。由于在生理和心理上不同程度地影响患者,其预防与治疗至今仍然是一个具有挑战性的临床问题。
从20世纪70年代富血小板血浆(platelet-rich plasma,PRP)应用于医学。PRP能够提供自源性生长因子,能够促进组织和细胞再生,为再生医学的发展开辟了一条新途径,在创面修复方面报道较多。近年来的报道PRP在疤痕的预防和治疗中有效,尤其面部瘢痕者,措施多为综合性。PRP對增生性瘢痕直接影响报道较少[3]。
本研究通过检测PRP注射后兔耳创面HS增生情况,研究PRP对HS形成过程中的直接影响。
1 材料与方法
1.1 实验动物 实验选取的新西兰大白兔均通过了深圳龙华区中心医院伦理委员会批准。新西兰大白兔20只,雌性12只,雄性8只,平均体质量(2.4±0.43)kg,兔耳健全,购自贵州医科大学实验动物中心。大白兔喂养于宽敞的笼内,单笼单兔,并给予食物和水,自由摄取。养兔的房间保持通风。
1.2 方法
1.2.1 兔耳瘢痕动物模型的建立:将20只新西兰大白兔用30%戊巴比妥钠做耳缘静脉麻醉。麻醉成功后,在每只兔做两个伤口,一个在左侧,一个在右侧。用消毒后的普通外科手术刀在兔耳中心处无血管的部位,各切一个1 cm×1 cm大小的切口,深至兔耳软骨,切除皮肤、皮下组织、软骨表面软骨膜等,小心搔刮软骨表面,切好后创口用灼烧后的铁片进行止血,手术完成[4]。待伤口上皮化后,每只兔双耳创面随机纳入对照组或实验组,作同体配对对照实验。
1.2.2 PRP准备:用装有复方枸橼酸钠抗凝剂的注射器于大白兔耳中央静脉取新鲜血约4 ml,置入离心管中,使用台式离心机(80-2台式电动离心机,中国上海)进行离心。第一个周期需要10分钟,转速为2500 rpm,血液分为三层。将上部的两层转移到其他一次性无菌管中,以3500 rpm的速度再次离心15分钟。抽出位于底部的PRP,并以1:4的比例添加10%的氯化钙使其活化。
1.2.3 实验组每个创面中心及周缘共6个不同部位给予注射PRP0.2mL,对照组给予0.2mL的生理盐水。每2周进行一次PRP注射,直至8周[5]。本实验严格遵循《实验动物保护条例》。
1.3 观察指标 分别观察20 d时兔耳瘢痕的发生情况和50 d时兔耳瘢痕的大小情况。以已愈合的创面高出正常皮肤2 mm为标准。
1.4 统计学方法 采用软件SPSS16.0进行统计学分析,正态计量资料用用均数±标准差()表示,组间比较采用x2检验,以P<0.05为差异有统计学意义。
2结果
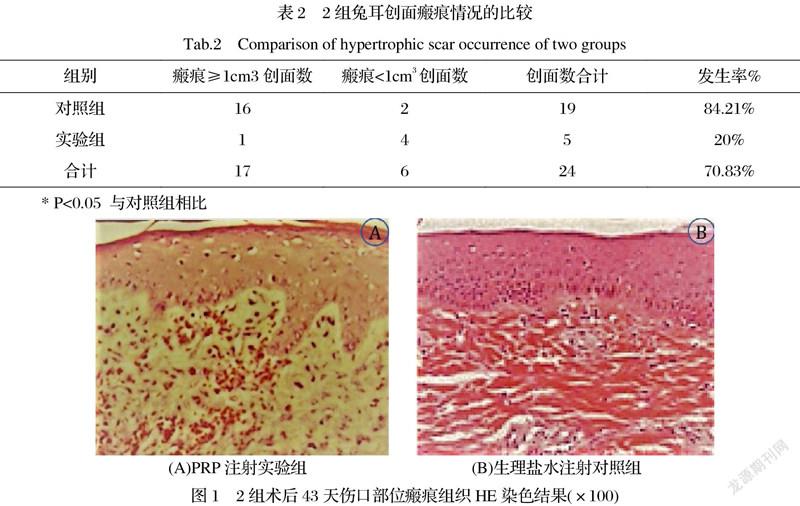
2.1兔耳瘢痕发生情况 对照组与实验组均发生瘢痕增生,见图1。镜下见实验组真皮层增厚,成纤维细胞分散分布,中可见胶原纤维增生;对照组真皮层增厚,胶原纤维增生明显,形成明显纤维束,粗大致密,束间空隙较大。瘢痕发生率对照组大于实验组,差异有统计学意义(P<0.05)。表明PRP瘢痕内注射抑制兔耳瘢痕增生(表1)。
2.2 2组兔耳瘢痕增生情况 对照组兔耳瘢痕增生量超过1cm3创面数大于实验组,差异有统计学意义(P<0.05)。表明PRP瘢痕内注射可有效抑制兔耳瘢痕增生(表2)。
3讨论
实验室制备PRP一般通过双离心方案或几种市售的PRP分离系统。但是,不同实验室、不同方法生产的PRP细胞组成存在很大差异[6-7],相关文献中也常常缺乏对这些生物制剂详细的描述[8]。由于PRP所含成分的复杂,很难判断是单次制备的PRP各种成分实际含量[9]。提高的血小板浓度的一个因素是增加离心时间,另一个因素是离心力增加。但是,过高的力可能会由于血小板的早期活化和破裂而导致上清液血浆中生长因子的损失,意味着PRP的治疗效率会下降[10-12]。选择合理的离心机、离心时间对PRP的制备至关重要。目前比较明确的是PRP中生长因子浓度增加了3至5倍有效,更高的浓度并未显示出有进一步改善的作用[13]。而红细胞及白细胞含量增加对PRP中因子的释放发挥功能有不利影响。由于以上原因,本文采用的制备方案尽可能多地保留血小板,去除红细胞及白细胞,尽可能保护血小板内部颗粒完整性。采用注射的方法则为了尽可能减少PRP意外流失。
传统上,兔耳HS模型用于评估针对疤痕形成的各种治疗方法[14]。标准兔耳HS模型仅反映瘢痕形成的早期阶段组织学及生化变化:密集的肉芽组织血管化,继而细胞渐减少,炎症减退,胶原束排列发生变化,瘢痕逐渐增厚;总蛋白和胶原蛋白由起始时降低到增加,纤维化增加。HS的发病的分子机制尚未阐明。在此过程中,瘢痕组织非常不稳定,反映在胶原蛋白变化上[15]。这也是各种细胞因子、生长因子等调节细胞行为的基础。本文选取兔耳制作标准的瘢痕模型,主要也是针对瘢痕形成早期PRP的作用。
PRP的一個特殊之处是血小板α颗粒内含有血管内皮生长因子,表皮生长因子(EGF),血小板衍生生长因子(PDGF),胰岛素样生长因子和转化生长因子β(TGF-β)等生长因子,以“天然”的生理比例存在,且可以通过不同的途径激活释放。这些细胞因子、生长因子等调节伤口的恢复直至痊愈,如:PDGF对伤口巨噬细胞和成纤维细胞具有强的趋化性,刺激这些细胞表达内源性生长因子;TGF-β直接刺激新的胶原蛋白合成,并在更长的时间内持续增强[16]。PRP对早期瘢痕形成有抑制作用,推测是在瘢痕形成早期,PRP通过生长因子调节成纤维细胞增生及分泌胶原蛋白行为达到减轻瘢痕增生,尚需进一步实验证实。本文对PRP对瘢痕形成过程的影响作了初步探讨,检测各种细胞因子、生长因子的含量与反映胶原蛋白沉积指标如瘢痕指数、酶联免疫检测等及反映细胞增生的指标如增殖细胞核抗原(Proliferating Cell Nuclear Antigen,PCNA)定量关系可以进一步阐明细胞因子生长因子调整细胞行为,从而更好地理解瘢痕形成过程。
4结论
富血小板血浆具有降低兔耳瘢痕发生的作用;富血小板血浆具有减轻兔耳已发生瘢痕的作用。
【参考文献】
[1]Aarabi S,Longaker MT,Gurtner GC. Hypertrophic scar formation following burns and trauma:New approaches to treatment. PLoS Med. 2007;4(e234) doi:10.1371/journal.pmed.0040234.
[2] Gauglitz GG,Korting HC,Pavicic T,Ruzicka T,Jeschke MG. Hypertrophic scarring and keloids:pathomechanisms and current and emerging treatment strategies. Mol Med. 2011 Jan-Feb;17(1-2):113-25. doi:10.2119/molmed.2009.00153.
[3] Wu N,Sun H,Sun Q,Cong L,Liu C,Zheng Y,Ma L,Cong X. A meta-analysis of fractional CO2 laser combined with PRP in the treatment of acne scar. Lasers Med Sci. 2021 Feb;36(1):1-12. doi:10.1007/s10103-020-03105-z.
[4] Nabai,L.,& Ghahary,A. (2017). Hypertrophic Scarring in the Rabbit Ear:A Practical Model for Studying Dermal Fibrosis. Methods in Molecular Biology,81–89.
[5] Elbarbary AH,Hassan HA,Elbendak EA. Autologous platelet-rich plasma injection enhances healing of chronic venous leg ulcer:A prospective randomised study. Int Wound J. 2020 Aug;17(4):992-1001. doi:10.1111/iwj.13361.
[6] Oudelaar BW,Peerbooms JC,Huis In 't Veld R,Vochteloo AJH. Concentrations of Blood Components in Commercial Platelet-Rich Plasma Separation Systems:A Review of the Literature. Am J Sports Med. 2019 Feb;47(2):479-487. doi:10.1177/0363546517746112.
[7] Oh JH,Kim W,Park KU,Roh YH. Comparison of the Cellular Composition and Cytokine-Release Kinetics of Various Platelet-Rich Plasma Preparations. Am J Sports Med. 2015 Dec;43(12):3062-70. doi:10.1177/0363546515608481.
[8] Everts P,Onishi K,Jayaram P,Lana JF,Mautner K. Platelet-Rich Plasma:New Performance Understandings and Therapeutic Considerations in 2020. Int J Mol Sci. 2020 Oct 21;21(20):7794. doi:10.3390/ijms21207794. PMID:33096812;PMCID:PMC7589810.
[9] Everts PA,van Zundert A,Schönberger JP,Devilee RJ,Knape JT. What do we use:platelet-rich plasma or platelet-leukocyte gel? J Biomed Mater Res A. 2008 Jun 15;85(4):1135-6. doi:10.1002/jbm.a.31570.
[10] Dugrillon A,Eichler H,Kern S,Klüter H. Autologous concentrated platelet-rich plasma (cPRP) for local application in bone regeneration. Int J Oral Maxillofac Surg. 2002 Dec;31(6):615-9. doi:10.1054/ijom.2002.0322. PMID:12521317.
[11] Malanga G,Jayaram P. Need for Proper Classification of PRP:Letter to the Editor. Am J Sports Med. 2017 May;45(6):NP23-NP24. doi:10.1177/0363546517693989. PMID:28459636.
[12] Cole BJ,Karas V,Hussey K,Pilz K,Fortier LA. Hyaluronic acid versus platelet-rich plasma:a prospective,double-blind randomized controlled trial comparing clinical outcomes and effects on intra-articular biology for the treatment of knee osteoarthritis. Am J Sports Med. 2017;45(2):339-346.
[13] Foster TE,Puskas BL,Mandelbaum BR,Gerhardt MB,Rodeo SA. Platelet-rich plasma:from basic science to clinical applications. Am J Sports Med. 2009 Nov;37(11):2259-72. doi:10.1177/0363546509349921. PMID:19875361.
[14] Kloeters,O.;Tandara,A.;Mustoe,T.A. Hypertrophic scar model in the rabbit ear:A reproducible model for studying scar tissue behavior with new observations on silicone gel sheeting for scar reduction. Wound Repair Regen. 2007,15,S40–S45.
[15] Fayzullin A,Ignatieva N,Zakharkina O,etc. Modeling of Old Scars:Histopathological,Biochemical and Thermal Analysis of the Scar Tissue Maturation. Biology (Basel). 2021 Feb 9;10(2):136. doi:10.3390/biology10020136. PMID:33572335;
[16] Pierce GF,Mustoe TA,Lingelbach J,Masakowski VR,Griffin GL,Senior RM,Deuel TF. Platelet-derived growth factor and transforming growth factor-beta enhance tissue repair activities by unique mechanisms. J Cell Biol. 1989 Jul;109(1):429-40. doi:10.1083/jcb.109.1.429. PMID:2745556;PMCID:PMC2115493.
基金项目:深圳市龙华区2018年科技創新专项资金(2017年第二批医疗卫生项目)资助,(项目编号:2017136)。
作者简介:王忠,1973.12,男,河北省邢台市人,硕士研究生,副主任医师,研究方向:瘢痕预防与治疗。
深圳市龙华区中心医院烧伤整形科 518110

