小麦TaTDR-Like基因的克隆及表达分析
都晶晶,夏玉,任扬,李燕红,李政,张改生,王军卫,马守才,宋瑜龙,齐倩,牛娜

摘要:【目的】克隆小麥绒毡层退化基因(Tapetum degeneration retardation,TaTDR-Like),研究其组织表达及不同育性材料间花药不同发育时期的时空表达模式,为深入揭示小麦花药异常发育的分子机制打下理论基础。【方法】以普通小麦品种西农1376(MF-XN1376)为材料,通过PCR扩增克隆得到TaTDR-Like基因的3个同源拷贝,利用生物信息学分析TaTDR-Like蛋白特性及TaTDR-Like基因启动子顺式作用元件,利用实时荧光定量PCR检测TaTDR-Like基因的组织表达情况及在可育、不育材料花药不同时期中的时空表达模式,利用酵母双杂交技术进行自激活检测,并构建植物融合表达载体35S-TaTDRLD-EGFP,通过农杆菌介导转入烟草叶片表皮细胞,观察 TaTDRL-D蛋白亚细胞定位情况。【结果】成功克隆小麦TaTDR-Like基因,发现该基因存在3个同源拷贝即TaTDRL-A、TaTDRL-B和TaTDRL-D,分别编码550、553、557个氨基酸,其蛋白分子量分别为58.50、58.90和59.21 kD,等电点(pI)分别为4.77、4.66和4.63。TaTDR-Like蛋白均在C端有1个bHLH保守结构域,其中TaTDRL-A与TaTDRL-B的保守结构域相似度达100%,与TaTDRL-D的保守结构域相似度为96%,TaTDRL-D与OsTDR、AtAMS保守结构域相似度分别为98%和88%;系统发育进化树表明TaTDR-Like蛋白与大麦(KAE8787147.1)、二穗短柄草TDR(XP_014756384)、水稻TDR(Os02g0120500)和拟南芥AMS(AT2G16910.1)的进化关系较密切;启动子分析表明TaTDR-Like基因启动子处含有较多光响应元件、非生物应激反应、激素响应元件等顺式作用元件;组织特异性表达分析显示TaTDRL-D在花药中的表达量最高,而TaTDRL-A和TaTDRL-B在幼穗表达量较高;对花药发育不同时期表达分析显示TaTDRL-D在花药发育单核早期表达量最高,之后逐渐降低,单核晚期到三核期不育材料(CMS-XN1376)表达量均高于可育材料(MF-XN1376);自激活检测结果表明TaTDRL-D具有转录激活活性;亚细胞定位显示TaTDRL-D蛋白定位于细胞核。【结论】TaTDRL-D基因可能参与小麦花药发育,负调控花药育性。
关键词: 小麦;TaTDR-Like基因;克隆;转录因子;表达分析
中图分类号: S512.1 文献标志码: A 文章编号:2095-1191(2021)09-2329-10
Cloning and expression analysis of TaTDR-Like genes in wheat
DU Jing-jing1, XIA Yu1, REN Yang1, LI Yan-hong1, LI Zheng2, ZHANG Gai-sheng1,3,WANG Jun-wei1, MA Shou-cai1, SONG Yu-long1,3, QI Qian1, NIU Na1,3*
(1College of Agronomy, Northwest A & F University/National Yangling Agricultural Biotechnology Breeding Center/Yangling Branch of National Wheat Improvement Center/Engineering Research Center of Wheat Breeding of Ministry of Education, Yangling, Shaanxi 712100, China; 2College of Life Science, Henan University/State Key Laboratory
of Crop Adversity Adaptation and Improvement, Kaifeng, Henan 475001, China; 3Key Laboratory of
Crop Heterosis Research and Utilization in Shaanxi Province,Yangling, Shaanxi 712100, China)
Abstract:【Objective】Wheat tapetum degeneration retardation-like(TaTDR-Like) genes were cloned and their expression patterns were analyzed between different tissues and different developmental stages of anthers in order to gain insight into the molecular mechanisms underlying abnormal wheat pollen development. 【Method】In this study, orthologues of rice (Oryza sativa L.) gene TDR(Os02t0120500) were cloned from the common wheat cultivar, MF-XN1376. Bioinformatics was used to analyze the characteristics of the proteins and cis-acting elements of the gene promoters. Moreover, real-time fluorescence quantitative PCR (qRT-PCR) was used to assess the tissue-specific expression of TaTDR-Like genes in different tissues (anther, leaf, ovary, stem and spike) and expression pattern of TaTDRL-D genes in anthers at different developmental stages. The subcellular localization of TaTDRL-D protein was observed, and yeast two-hybrid technology was used to detect its self-activation. The plant fusion expression vector 35S-TaTDRLD-EGFP was construc-ted and transferred into tobacco leaf epidermal cells through agrobacterium-mediated transfer. 【Result】It was found that there were three homologous copies, namely TaTDRL-A, TaTDRL-B and TaTDRL-D, encoding 550, 553 and 557 amino acids (aa), corresponding to molecular weights of 58.50, 58.90 and 59.21 kD and isoelectric points (pI) of 4.77, 4.66 and 4.63, respectively. TaTDR-Like proteins all have a bHLH conserved domain at the C-terminal. TaTDRL-A and TaTDRL-B had 100% and 96% similarity with TaTDRL-D, respectively, while TaTDRL-D showed 98% and 88% similarity with OsTDR and AtAMS, respectively. A phylogenetic tree analysis showed that TaTDR-Like proteins were closely rela-ted to rice TDR (Os02g0120500), Brachypodium distachyum TDR(XP014756384),barley(KAE8787147.1) and Arabidopsis AMS (AT2G16910.1). Promoter analysis results showed that TaTDRL-A, TaTDRL-B and TaTDRL-D promoters contain many cis-acting elements, such as those involved in the response to light conditions, abiotic stress and phytohormones, which may participate in plant growth, development and the response to abiotic stress. Tissue-specific expression analysis showed that TaTDRL-D had the highest expression level in anthers, followed by young panicles and stems, while TaTDRL-A and TaTDRL-B showed higher expression levels in young panicles. Further studies revealed the expression level of TaTDRL-D to be the highest at the early mononuclear stage of anther development after which it showed a gradual decrease. The expression level in cytosolic male sterility tissues (CMS-XN1376) was higher than that in male fertile tissues (MF-XN1376) from the late mononuclear stage to the tri-nuclear stage. The results showed that TaTDRL-D had transcriptional activation activity. Subcellular localization showed that the TaTDRL-D protein was localized in the nucleus. 【Conclusion】TaTDRL-D gene may be involved in anther development and negatively regulate anther fertility in wheat.
Key words: wheat; TaTDR-Like gene; cloning; transcription factor; expression analysis
Foundation item:Shaanxi Key Research and Development Project(2019NY-003);Key Laboratory Project of Shaanxi (2018SZS-22) ;Postdoctoral Foundation of Shaanxi (2016BSHED113);College Students Innovation and Entrepreneurship Training Project of Northwest A & F University(X202010712224)
0 引言
【研究意义】杂种优势作为自然界的一种普遍现象,已在玉米、水稻、油菜等作物的高产和抗逆育种中取得显著成果(王竹云等,2019;尤诗婷等,2019)。研究表明,小麦(Tritiaum aestivum L.)也具有明显的杂种优势(赵昌平,2010)。小麦雄性不育是杂种优势利用的主要途径,其不育机理是杂种优势利用的理论基础。研究发现绒毡层异常发育会导致雄性不育,在花药中的主要作用包括提供小孢子发育所需的营养物质、参与花粉外壁前体及孢粉素前体合成、分泌并转运胼胝质酶、合成花粉包被等(楼悦,2012),表明小孢子的正常发育与绒毡层细胞是否正常发育密切相关。因此,克隆小麦绒毡层退化基因(Tapetum degeneration retardation,TaTDR-Like)并对其进行序列特征分析及组织表达分析,可为解析TaTDR-Like的功能及阐明小麦花药发育过程中花粉异常的分子机制提供理论基础。【前人研究进展】TDR基因属于bHLH转录因子家族,大量研究表明bHLH转录因子家族主要参与调控植物生长发育(如光信号传递、植物激素信号和器官发育等)(Heisler et al.,2001;Fujimori et al.,2004;Oscar et al.,2004;廉腾飞等,2018)和逆境胁迫(干旱、低温和盐等)(Graciela et al.,2015;徐秀荣等,2019;Liu et al.,2020)。目前相关研究主要集中在拟南芥和水稻上,小麦中尚未见TDR基因的研究报道。在水稻中,TDR基因可通过影响花药脂肪积累、脂质转运和代谢等途径引起绒毡层细胞程序性死亡(PCD),并在花药发育过程中控制花粉壁发育(Li et al.,2006)。此外,TDR的功能缺失还导致236个基因的表达发生变化,其中有154个基因表达上调,82个基因表达下调,表明TDR是花粉發育过程中绒毡层PCD以及其他一些基本生物学过程的主要调控因子(Zhang et al.,2008)。拟南芥AMS基因(Aborted Microspores)(AT2G16910.1)是OsTDR的同源基因,该基因属于bHLH基因MYC亚家族的典型转录因子,在花粉发育早期表达,在花粉减数分裂前后达到最高,是拟南芥孢粉素生物合成、分泌和花粉壁形成的主要调控因子(Anna et al.,2003)。ams突变体表现出小孢子缺陷,缺乏孢粉素沉积,总酚类化合物和角质单体显著减少(Xu et al.,2014)。目前已在多种植物中鉴定到AMS基因并证实其与花药的发育及育性相关,如在瓜类中利用育性分离群体定位到该基因(LOC103498166),同时证实败育小孢子AMS基因在雄性不育系(ms-5)和雄性可育系(HM1-1)2 mm(四分体)及5 mm(第1次花粉有丝分裂)期间的表达量存在显著差异(Sheng et al.,2017);在辣椒(Capsicum annuum L.)中发现并扩增2种亚型:CaAMS1和CaAMS2。研究发现CaAMS在绒毡层强烈表达,CaAMS的下调导致花丝部分缩短、雄蕊皱缩不裂及花粉败育(Guo et al.,2018)。洋葱(Allium cepa L.)AcAMS过表达显示转基因株系表现为部分不育甚至完全不育,部分不育植株的果荚变短,完全不育植株果荚不仅短小而且伴随弯曲生长,转基因株系花的雄蕊比雌蕊更长,花药不饱满且无光泽,有活力的花粉粒明显少于野生型(袁巧玲,2019)。【本研究切入点】至今鲜见有关小麦TDR基因同源拷贝克隆及该基因在花药育性表达模式分析的研究报道。【拟解决的关键问题】从小麦品种西农1376中通过PCR扩增克隆得到TaTDR-Like基因的3个同源拷贝,研究TaTDR-Like基因组织表达及不同育性材料间花药不同发育时期的时空表达模式,对其进行生物信息学分析和启动子顺式作用元件分析,从转录激活活性、亚细胞定位和基因表达的角度初步探讨小麦TaTDR-Like基因的功能,为深入揭示小麦花药异常发育的分子机制打下理论基础。
1 材料与方法
1. 1 试验材料
供试材料为普通小麦品种西农1376(MF-XN1376)和遗传型雄性不育系西农1376(CMS-XN1376),MF-XN1376是CMS-XN1376的保持系,二者具有相同的细胞核背景。试验在西北农林科技大学实验站进行。于2018年10月播种,每个材料各播种10行,行长1 m,行距0.25 m,株距0.67 m。取MF-XN1376植株的花药、茎、叶、子房和幼穗用于组织表达分析,分别取MF-XN1376和CMS-XN1376的单核早期、单核晚期、二核期和三核期的花药用于时空表达分析。取材后所有样品立即冷冻在液氮中,于-80 ℃保存备用。
主要试剂:TRIzol和KOD FX高保真购自东洋纺(上海)生物科技有限公司,反转试剂盒Trans-Script? One-Step gDNA Removal and cDNA Synthesis SuperMix和TransScript? Tip Green qPCR SuperMix购自北京全式金生物有限公司,pClone007 Vector Kit购自北京擎科生物科技有限公司,BM无缝克隆试剂盒购自北京博迈德生物技术有限公司。主要设备仪器:IX83-FV1200激光共聚焦荧光显微镜购自OLYMPUS Corporation。
1. 2 试验方法
1. 2. 1 总RNA提取及cDNA合成 采用TRIzol法提取植物组织总RNA。利用反转试剂盒将RNA反转录为cDNA。
1. 2. 2 小麦TaTDRL基因克隆 从GenBank中获取OsTDR蛋白序列(XP_015625730.1),通过NCBI/blplants/Blast的参考基因组数据库识别TaTDR-Like的氨基酸序列。选择得分最高、E-val最低的预测基因作为目标基因。目的基因的CDS序列从Ensembl Plants數据库获得,并在NCBI数据库中得到证实。使用Primer Premier 5.0根据TaTDR-Like的CDS序列设计扩增TaTDR-Like基因的引物(表1)。以MF-XN1376 cDNA为模板,KOD高保真酶的作用下进行PCR扩增反应。反应体系50 ?L:10×KOD-Plus-Neo PCR Buffer 5 ?L,2 mmol/L dNTPs 5 ?L,25 mmol/L MgSO4 3 ?L,上、下游引物各3 ?L,cDNA模板3 ?L,ddH2O 28 ?L。扩增程序:94 ℃预变性2 min;98 ℃ 10 s,64 ℃ 30 s,68 ℃ 1 min 30 s,进行44个循环;68 ℃延伸7 min。将PCR产物连接pClone007载体,转化至DH5α感受态细胞,在相应抗性LB培养基上筛选出若干个独立的克隆,提取质粒经PCR鉴定后委托北京擎科生物科技有限公司测序。通过DNAMAN软件将测序结果与TaTDRL序列进行比对。
1. 2. 3 生物信息学分析 利用在线网站(FGENESH-HMM-baseg gene structure prediction)将TaTDR-Like翻译为蛋白序列,利用在线工具ExPASy(https://web.expasy.org/protparam/)预测蛋白分子量和等电点。利用在线工具SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测TaTDR-Like蛋白的二级结构;采用SMART(http://smart.embl-heidelberg.de/)网站在线预测TaTDR-Like蛋白的保守结构域;kinasephos在线软件进行磷酸化位点预测(http://kinasephos.mbc.nctu.edu.tw/predict.php);使用ClustalX对TaTDRL、OsTDR和AtAMS进行多重序列比对获得logo图;使用MEGA 6.0进行系统发育进化树分析;使用在线工具ProtScale(http://www.gravy-calculator.de/)预测亲水性平均数(GRAVY);在Plant-mPLoc网站(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)进行TaTDR-Like的亚细胞定位分析。
1. 2. 4 启动子分析 从EnsemblPlants(http://plants.ensembl.org/index.html)数据库中获得上游2000 bp的TaTDRL启动子区域序列。使用PlantCARE(https://www.dna.affrc.go.jp/PLACE/?action=newplace)和NewPLACE(http://bioinformatics.psb.ugent.be/web-tools/plantcare/html/)数据库分析TaTDR-Like启动子区域的调控元件。
1. 2. 5 荧光定量PCR 使用INTEGRATED DNA TECHNOLOGIES网站(https://sg.idtdna.com/Scitools/Applications/RealTimePCR/?tdsourcetag=s_pctim_aiomsg)根据CDS序列设计qRT-PCR引物(表1)。分别以不同组织、不同时期花药cDNA为模板,以小麦TaActin为内参基因,按照全式金荧光定量说明书建立实时荧光定量PCR反应体系及程序,进行3次生物学重复,采用 2-△△Ct法计算基因相对表达量。
1. 2. 6 酵母双杂自激活检测 分别利用TaTDRL-D-BD-F/-R、(1~294)-BD-F/-R、(295~344)-BD-F/-R为引物扩增TaTDRL-D的CDS全长(1~344)以及截取的N端(1~294)、bHLH结构域(295~344),分别连接pGBKT7(酶切位点为EcoRⅠ和SalⅠ)载体,测序正确后,将这些构建体分别转化酵母菌株Y2H。在SD/-Trp培养基挑选单克隆,将菌落稀释100、10-1和10-2接种至SD/-Trp-His-Ade培养基中再培养3 d。
1. 2. 7 亚细胞定位 以TaTDRL-D-EGFP-F/-R为引物扩增TaTDRL-D与EGFP的融合序列。利用无缝克隆Mix(北京博迈德生物技术有限公司)构建35S-TaTDRLD-EGFP融合载体,将构建成功的质粒转至农杆菌GV3101感受态细胞,挑取PCR检测正确的菌株扩大培养,采用注射法将重悬农杆菌侵染入本氏烟叶片中,48 h后将注射孔附近的叶片制作成玻片,用激光共聚焦荧光显微镜观察本氏烟草表皮细胞内的绿色荧光信号,明确融合蛋白的定位情况。
2 结果与分析
2. 1 TaTDRL基因的克隆及序列分析结果
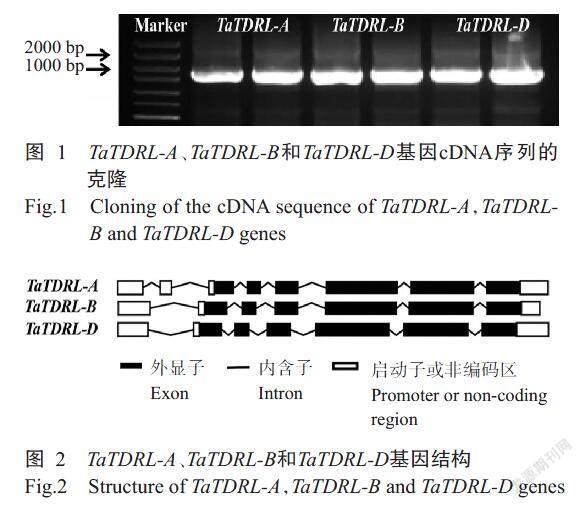
以小麦品种MF-XN1376为材料获得cDNA第一链,并以此为模板进行PCR扩增获得TaTDRL-A(TraesCS6A02G071300.1)、TaTDRL-B(TraesCS6B02 G095600.1)和TaTDRL-D(TraesCS6D02G069300.1)3个同源拷贝基因片段,琼脂糖凝胶电泳显示与目标条带大小一致(图1)。对扩增条带进行测序和分析,结果显示TaTDRL-A、TaTDRL-B和TaTDRL-D其完整的CDS长度分别为1653、1662和1674 bp,分别编码550、553和557个氨基酸。对TaTDR-Like进行数据库比对(图2),发现TaTDRL-A、TaTDRL-B和TaTDRL-D基因全长分别为2153、2059和2150 bp,其中TaTDRL-A的基因结构含有8个外显子和7个内含子,5'和3'未翻译区域(UTRs)分别为301和199 bp;TaTDRL-B的基因结构含有7个外显子和6个内含子,5'和3'未翻译区域(UTRs)分别为130和267 bp;TaTDRL-D的基因结构含有7个外显子和6个内含子,5'和3'未翻译区域(UTRs)分别为251和225 bp。
2. 2 TaTDRL蛋白的生物学分析结果
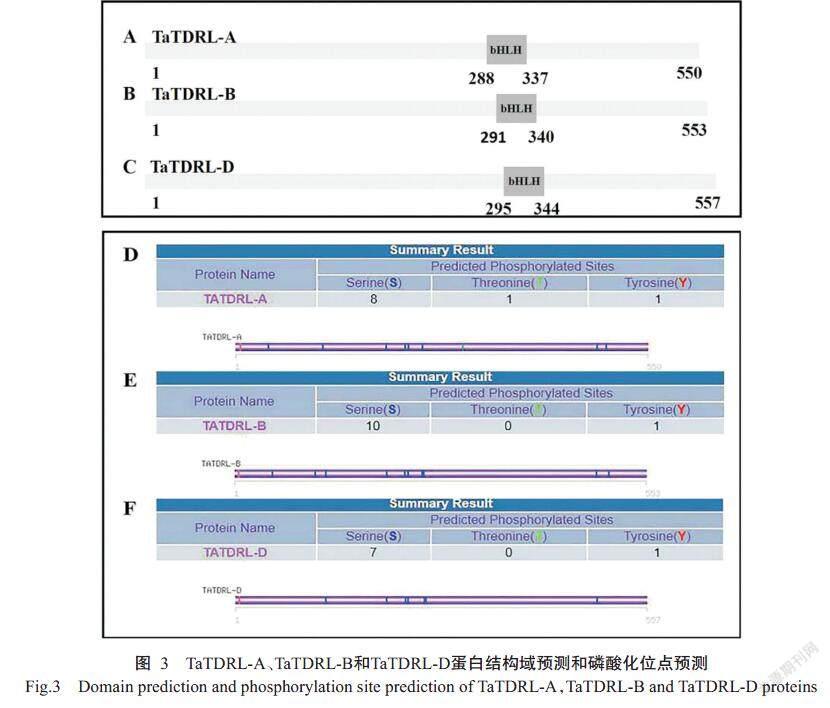
利用在线网站ExPASy预测TaTDRL-A、TaTDRL-B和TaTDRL-D蛋白分子量分别为58.50、58.90和59.21 kD,等电点(pI)分别为4.77、4.66和4.63。SMART在线软件进行保守结构域预测发现TaTDRL-A、TaTDRL-B和TaTDRL-D均在C端含有1个bHLH保守结构域,分别跨越288~337、291~340和295~344 个氨基酸(圖3-A、3-B和3-C)。利用SOPMA对蛋白二级结构进行预测,结果显示TaTDRL-A含有35.82%的α-螺旋、49.64%的随机螺旋、11.09%的延伸链和3.45%的β-转角。TaTDRL-B蛋白含有35.08%的α-螺旋、49.91%的随机螺旋、10.13%的延伸链和4.88%的β-转角。TaTDRL-D蛋白含有36.62%的α-螺旋、50.09%的随机螺旋、9.16%的延伸链和4.13%的β-螺旋。ExPASy和Protscale在线网站预测TaTDRL-A、TaTDRL-B和TaTDRL-D的GRAVY值分别为 -0.472、 -0.513和-0.495,均为亲水蛋白。利用在线软件kina-sephos进行磷酸化分析,结果表明TaTDR-Like蛋白含有较多磷酸化位点,其中TaTDRL-A有3种类型共10个磷酸化位点,包含8个丝氨酸磷酸化位点、1个苏氨酸磷酸化位点和1个酪氨酸磷酸化位点(图3-D);TaTDRL-B有2种类型共11个磷酸化位点,包含10个丝氨酸磷酸化位点和1个酪氨酸磷酸化位点(图3-E);TaTDRL-D有2种共8个磷酸化位点,包含7个丝氨酸磷酸化位点和1个酪氨酸磷酸化位点(图3-F)。
为进一步分析TaTDRL基因功能,对TaTDRL-A、TaTDRL-B和TaTDRL-D蛋白进行在线BLASTp分析(图4),结果表明,TaTDR-Like 3个同源拷贝间蛋白同源性较高,保守结构域基本相同,其中TaTDRL-A与TaTDRL-B的保守结构域相似度达100%,与TaTDRL-D的保守结构域相似度为96%,TaTDRL-D与OsTDR、AtAMS保守结构域相似度分别为98%和88%。与其他植物同源蛋白序列比对,发现TaTDR-Like结构域与转录因子AtAMS及OsTDR相似。在此基础上,构建系统发育进化树(图5),其中AtPIF1(AT2G20180)属于外源基因,是光敏色素作用因子(Qiu et al.,2020),结果表明TaTDR-Like同源基因聚类为同一簇,与AtPIF1亲缘关系较远。TaTDR-Like与大麦TDR(KAE8787147.1)进化亲缘关系最近,与二穗短柄草TDR(XP_014756384)、OsTDR和AtAMS亲缘关系较近。表明TaTDR-Like蛋白序列在进化上具有较高的保守性。
2. 3 TaTDR-Like基因启动子分析结果
对TaTDR-Like基因启动子顺式作用元件进行分析,结果表明在TaTDRL基因启动子上包含若干顺式作用元件,包括参与植物激素响应元件、非生物应激反应和光响应的顺式作用元件。对具有相同或类似功能的不同顺式作用元件进行分类和统计,结果见图6。TaTDR-Like基因启动子序列含有较多的光响应元件,共计11种类型19个,并且不同成员的光反应元件种类和数量各不相同,其中TaTDRL-A、TaTDRL-B和TaTDRL-D的光反应元件数量分别为7、2和10个,说明不同染色体组的TaTDR-Like基因对光的响应程度可能不同。同时,TaTDR-Like基因启动子序列含有许多激素响应元件,包括脱落酸、生长素、赤霉素和茉莉酸甲酯等顺式作用元件,并且不同染色体组均含有脱落酸和茉莉酸甲酯的顺式作用元件,其中TaTDRL-A缺少赤霉素响应元件,TaTDRL-B缺少生长素响应元件。表明TaTDR-Like基因的表达调控可能受多种激素调控,并且不同组成员间可能具有相互补充和促进作用。此外,对TaTDR-Like基因启动子分析发现含有较多不同类型的逆境响应元件,如厌氧诱导ARE、低温响应元件LTR及干旱相关的元件MBS等,说明该基因可能响应了多种逆境胁迫。综合分析发现,小麦TaTDR-Like基因可能在植物生长发育及逆境响应过程中发挥重要作用。
2. 4 TaTDR-Like基因的表达模式分析结果
为分析TaTDR-Like基因在小麦不同组织中的表达模式,以小麦品种MF-XN1376的花药、茎、叶、子房和幼穗cDNA为模板进行实时荧光定量PCR分析,结果(图7)表明,TaTDRL在各组织内均有表达,但表达量存在明显差异,其中,TaTDRL-A在幼穗表达量最高,在花药和叶中表达量较高,在子房中表达最低;TaTDRL-B在幼穗表达量最高,在其他组织中表达量无明显差异;TaTDRL-D在花药中的表达量最高,在其他组织中表达量均较低。说明TaTDRL可能参与花药的发育,而TaTDRL-D在花药中高表达,推测TaTDRL-D在参与花药发育方面起主要作用。
为进一步探究TaTDRL-D是否影响花药育性,分别以可育材料MF-XN137和遗传型不育材料CMS-XN1376花药的单核早期、单核晚期、二核期及三核期的cDNA为模板进行实时荧光定量PCR分析,结果(图8)表明,TaTDRL-D在单核早期中的表达量最高,但MF-XN1376与CMS-XN1376间无明显差异;之后表达量逐渐降低,在可育和不育材料间呈现表达量差异,并且不育材料CMS-XN1376始终高于可育材料MF-XN1376。
2. 5 自激活检测结果
为研究TaTDRL-D是否具有转录激活活性,分别截取TaTDR-Like的CDS以及N端(1~294)、bHLH结构域(295~344)3个区段,并被融合到GAL4的DNA结合结构域(GAL4-BD)上,随后将重组质粒转化至酵母菌株Y2H中,结果显示TaTDRL-BD载体和N端-BD载体转化的酵母细胞中可检测到报告基因HIS3和ADE2的表达,表明TaTDRL-D具有转录激活活性(图9)。
2. 6 亚细胞定位
使用在线软件预测TaTDRL-D定位于细胞核。为进一步验证该结果,利用农杆菌介导法将35S-TaTDRLD-EGFP表达载体转化到烟草叶片表皮细胞中,瞬时表达结果(图10)显示空载信号饱满,细胞膜和细胞核均有表达,而融合蛋白TaTDRLD-EGFP定位在细胞核中,与软件预测结果一致。
3 讨论
绒毡层细胞作为一种营养组织,与发育中的配子体直接接触,减数分裂后PCD促进绒毡层解体被认为是小孢子形成、释放和随后花粉成熟的物质信号,绒毡层提前或推迟降解导致小孢子发育异常,最终引起雄性不育(于世霞,2017)。前人研究表明AMS转录因子属于典型的bHLH基因的MYC亚家族,可直接与花粉外壁发育相关基因的启动子相结合(Anna et al.,2003)。已有研究表明,在拟南芥中AMS基因是孢粉素合成、分泌和花粉壁形成的关键调控因子,ams突变体表现为孢子体隐性雄性不育,纯合突变植株完全没有成熟花粉,败育的主要原因是绒毡层过早降解引起小孢子退化,并伴随着雄蕊花丝变短现象(Alison et al.,2017)。水稻OsTDR基因属于AMS的同源基因,该基因优先在绒毡层表达,促进绒毡层PCD(Li et al.,2006)。AMS同源基因在辣椒、洋葱和瓜类等植物上被证实与绒毡层发育有关(Sheng et al.,2017;Guo et al.,2018;袁巧玲,2019)。综上所见,TDR转录因子在绒毡层的发育中发挥了重要作用,但在小麦上未见相关报道。本研究从西农1376中克隆得到小麦TaTDR-Like基因,发现具有3个同源拷贝,分别命名为TaTDRL-A、TaTDRL-B和TaTDRL-D。蛋白结构预测TaTDR-Like的同源拷贝均含有1个bHLH转录因子的保守结构域。序列分析结果表明TaTDR-Like保守结构域与OsTDR及AtAMS结构域序列高度同源,其中TaTDRL-A与TaTDRL-B的保守结构域相似度达100%,与TaTDRL-D保守结构域的相似度为96%,TaTDRL-D与OsTDR、AtAMS保守结构域相似度分别为98%和88%,推测TaTDR-Like与OsTDR、AtAMS具有相似的生理功能。此外,系统发育进化树结果显示TaTDR-Like蛋白与OsTDR、大麦(AKE8787147)的进化关系较密切,同时TDR与其他物种的同源蛋白聚类为一簇,与AtPIF1(外源基因)聚类远,诸多研究证实TDR与花粉外壁的合成和绒毡层降解有关(Li et al.,2006;Zhang et al.,2008;Xu et al.,2014;Guo et al.,2018;袁巧玲,2019),表明TDR功能十分保守,可能在物种分化之前就具有调控花药发育的相关功能。亚细胞定位显示TaTDRL-D蛋白定位在细胞核内并证明其具有转录激活活性,说明其具有转录因子的基本特性,为后续进一步寻找下游靶基因打下基础。
启动子分析结果表明,TaTDR-Like基因启动子上游有较多激素响应元件、光响应元件和逆境响应元件,推测TaTDR-Like基因在植物生长发育及逆境响应过程中可能发挥重要作用。由于不同的同源拷贝间顺式作用元件的类型和数量各异,推测由于小麦基因组庞大且复杂,不同的同源拷贝间可能存在相互补充或促进作用。在拟南芥上有研究发现CLAVATA3/ESR-RELATED19(CLE19)小肽负调控AMS基因的表达,这种细胞外配体及其受体样蛋白激酶(RLK)介导的信号通路在花药发育调控中发挥着重要作用(Wang et al.,2017)。本研究在TaTDR-Like蛋白上预测到较多的磷酸化位点,推测TaTDR-Like蛋白可能与某种激酶互作并受该激酶磷酸化,从而影响TaTDR-Like的功能。
本研究通过组织表达分析发现TaTDR-Like基因在不同组织中表达量差异明显,TaTDRL-A和TaTDRL-B在花药几乎不表达,而TaTDRL-D在花药表达量最高,说明TaTDRL-D可能参与花药发育过程,并起着重要作用。进一步验证TaTDRL-D在花药各个时期的表达模式,发现TaTDRL-D在可育材料MF-XN1376和遗传型不育CMS-XN1376的单核晚期开始出现表达量的差异,之后逐渐降低,三核期表达量最低,且不育材料CMS-XN1376表达量高于可育材料MF-XN1376。前人研究发现AMS和TDR基因在花药发育早期表达量达到峰值并起作用,之后逐渐减小(Fu et al.,2014;Alison et al.,2017),TaTDRL-D同樣验证了这一趋势。有研究表明遗传性雄性不育CMS-XN1376在单核晚期开始出现败育,三核期败育完全(Wang et al.,2015),败育时期与本研究TaTDRL-D表达量差异相吻合,这些结果均证明TaTDRL-D基因可能影响小孢子的育性,而关于TaTDRL-D在小麦花药发育中的作用有待进一步验证。
4 结论
TaTDRL-D基因可能参与小麦花药发育,负调控花药育性。
参考文献:
廉腾飞,徐永萍,李兰芬,苏晓东. 2018. 植物激素茉莉酸通路中核心转录因子MYC2的结构与功能研究[C]//中国生物化学与分子生物学会第十二届全国会员代表大会暨2018年全国学术会议摘要集. 上海:中国生物化学与分子生物学会:101. [Lian T F,Xu Y P,Li L F,Su X D. 2018. Study on the structure and function of MYC2,a key transcription factor in plant hormone jasmonate pathway[C]//Abstracts of the 12th National congress and 2018 national conference of Chinese Society of Biochemistry and Molecular Biology. Shanghai:Chinese Society of Biochemistry and Molecular Biology:101.]
樓悦. 2012. 拟南芥花药绒毡层发育转录调控通路及关键基因TDF1功能研究[D]. 上海:上海师范大学. [Lou Y. 2012. A genetic pathway for tapetum development of anther in Arabidopsis and function analysis of defective in tapetal development and function1(TDF1)[D]. Shanghai:Shanghai Normal University.]
王竹云,张耀文,赵小光,侯君利,关周博,李殿荣,史文青. 2019. 限制油菜高产水平提高的因素解析及解决途径[J]. 江西农业学报,31(6):45-51. [Wang Z Y,Zhang Y W,Zhao X G,Hou J L,Guan Z B,Li D R,Shi W Q. 2019. Analysis and solution of factors restricting high yield of rapeseed[J]. Acta Agriculturae Jiangxi,31(6):45-51.] doi:10.19386/j.cnki.jxnyxb.2019.06.08.
徐秀荣,杨克彬,王思宁,高志民. 2019. 毛竹bHLH转录因子的鉴定及其在干旱和盐胁迫条件下的表达分析[J]. 植物科学学报,37(5):610-620. [Xu X R,Yang K B,Wang S N,Gao Z M. 2019. Identification of bHLH transcription factors in moso bamboo(Phyllostachys edulis) and their expression analysis under drought and salt stress[J]. Plant Science Journal,37(5):610-620.] doi:10.11913/PSJ. 2095-0837.2019.50610.
尤诗婷,邓策,李会敏,吕蒙,李志敏,刘惠芬. 2019. 玉米株高和穗位高的QTL定位[J]. 河南农业科学,48(6):20-25. [You S T,Deng C,Li H M,Lü M,Li Z M,Liu H F. 2019. QTL mapping of plant height and ear height in maize[J]. Journal of Henan Agricultural Sciences,48(6):20-25.] doi:10.15933/j.cnki.1004-3268.2019.06.004.
于世霞. 2017. 烟草和番茄中活性氧介导的绒毡层程序性细胞死亡影响花粉的发育[D]. 泰安:山东农业大学. [Yu S X. 2017. Reactive oxygen species mediated tapetal programmed cell death affects pollen development in toba-cco and tomato[D]. Taian:Shandong Agricultural University.]
袁巧玲. 2019. 洋葱细胞质雄性不育相关基因AcAMS的克隆及其功能分析[D]. 哈尔滨:东北农业大学. [Yuan Q L. 2019. Cloning and functional analysis of AcAMS gene related to cytoplasmic male sterility in onion (Allium cepa L.)[D]. Harbin:Northeast Agricultural University.]
赵昌平. 2010. 中国杂交小麦研究现状与趋势[J]. 中国农业科技导报,12(2):5-8. [Zhao C P. 2010. Status and trends of hybrid wheat research in China[J]. Journal of Agricultural Science and Technology,12(2):5-8.] doi:10.3969/j.issn.1008-0864.2010.02.02.
Alison C F,Simon P,Leah R B,Yang C Y,Ferjentsikova I,King J,Zheng Y,Zhang D B,Wilson Z A. 2017. Biphasic regulation of the transcription factor ABORTED MICROSPORES(AMS) is essential for tapetum and pollen development in Arabidopsis[J]. New Phytologist,213(2):778-790. doi:10.1111/nph.14200.
Anna M S,Sandra K,Ulrike S U,Peter H,Koen D,Heinz S. 2003. The Arabidopsis ABORTED MICROSPORES(AMS) gene encodes a MYC class transcription factor[J]. The Plant Journal,33(2):413-423. doi:10.1046/j.1365-313X. 2003.01644.x.
Fu Z Z,Yu J,Cheng X W,Zong X,Xu J,Chen M J,Li Z Y,Zhang D B,Liang W Q. 2014. The rice basic helix-loop-helix transcription factor TDR INTERACTING PROTEIN2 is a central switch in early anther development[J]. Plant Cell,26(4):1512. doi:https://doi.org/10.1105/tpc.114.123745.
Fujimori T,yamashino T,Kato T,Mizuno T. 2004. Circadian-controlled basic/helix-loop-helix factor,PIL6,implicated in light-signal transduction in Arabidopsis thaliana[J]. Plant & Cell Physiology,45(8):1078-1086. doi:10.1093/pcp/pch124.
Graciela C,Feranda L,Leila S F,Maria H B Z,Márcia M P. 2015. Possible roles of basic helix-loop-helix transcription factors in adaptation to drought[J]. Plant Science an International Journal of Experimental Plant Biology,223:1-14. doi:10.1016/j.plantsci.2015.03.012.
Guo J J,Liu C,Wang P,Chen Q,Sun L,Yang W C,Shen H L. 2018. The Aborted microspores (AMS)-Like gene is required for anther and microspore development in Pe-pper(Capsicum annuum L.)[J]. International Journal of Molecular Sciences,19(5):1341-1355. doi:10.3390/ijms 19051341.
Heisler M G,Atkinson A,Bylstra Y H,Walsh R,Smyth D R. 2001. SPATULA,a gene that controls development of carpel margin tissues in Arabidopsis,encodes a bHLH protein[J]. Development,128(7):1089-1098. doi:/10.1242/ dev.128.7.1089.
Li N,Zhang D S,Liu H S,Yin C S,Li X X,Liang W Q,Yuan Z,Xu B,Chu H W,Wang J,Wen T Q,Huang H,Luo D,Ma H,Zhang D B. 2006. The rice tapetum degeneration retardation gene is required for tapetum degradation and anther development[J]. Plant Cell,18(11):2999-3014. doi:10.1105/tpc.106.044107.
Liu H,Yang Y,Liu D D,Wang X Y,Zhang L S,2020. Transcription factor TabHLH49 positively regulates dehydrin WZY2 gene expression and enhances drought stress tolerance in wheat[J]. BMC Plant Biology,20(1):259-270. doi:10.1186/s12870-020-02474-5.
Oscar L,Jose M C,Jose J,Sánchez S,Roberto S. 2004. JASMONATE-INSENSITIVE1 encodes a MYC transcription factor essential to discriminate between different jasmonate-regulated defense responses in Arabidopsis[J]. Plant Cell,16(7):1938-1950. doi:10.1105/tpc.022319.
Qiu J R,Xiang X Y,Wang J T,Xu W X,Chen J,Xiao Y,Jiang C Z,Huang Z. 2020. MfPIF1 of resurrection plant myrothamnus flabellifolia plays a positive regulatory role in responding to drought and salinity stresses in Arabidopsis[J]. International Journal of Molecular Sciences,21(8):3011-3030. doi:10.3390/ijms21083011.
Sheng Y Y,Wang Y D,Jiao S Q,Jin Y Z,Ji P,Luan F S. 2017. Mapping and preliminary analysis of ABORTED MICROSPORES(AMS) as the candidate gene underlying the male sterility(MS-5) mutant in melon(Cucumis melo L.)[J]. Frontiers in Plant Science,8:902-916. doi:10. 3389/fpls.2017.00902.
Wang S P,Zhang G S,Zhang Y X,Song Q L,Chen Z,Wang J S,Guo J L,Niu N,Wang J W,Ma S C. 2015. Comparative studies of mitochondrial proteomics reveal an intimate protein network of male sterility in wheat(Triticum aestivum L.)[J]. Journal of Experimental Botany,66(20):6191-6203. doi:10.1093/jxb/erv322.
Wang S S,Lu J J,Song X F,Ren S C,You C J,Xu J,Liu C M,Ma H,Chang F. 2017. Cytological and transcriptomic analyses reveal important roles of CLE19 in pollen exine formation[J]. Plant Physiolog,175(3):1186-1202. doi:https://doi.org/10.1104/pp.17.00439.
Xu J,Ding Z W,Barrena J V,Shi J X,Liang W Q,Yuan Z,Reichhart D W,Schreiber L,Wilson Z A,Zhang D B. 2014. ABORTED MICROSPORES acts as a master regulator of pollen wall formation in Arabidopsis[J]. The Plant Cell Online,26(4):1544-1556. doi:10.1105/tpc.114.122986.
Zhang D S,Liang W Q,Yuan Z,Li N,Shi J,Wang J,Liu Y M,Yu W J,Zhang D B. 2008. Tapetum degeneration retardation is critical for aliphatic metabolism and gene re-gulation during rice pollen development[J]. Molecular Plant,1(4):599-610. doi: 10.1093/mp/ssn028.
(責任编辑 麻小燕)

