云南地区月季灰霉菌致病力及抗药性鉴定
韩洋琳,李思思,袁文斌,刘家讯,贺水莲,吴红芝


摘要:【目的】明确云南地区月季灰霉菌的致病力及对不同杀菌剂的抗药性,为生产上月季灰霉病的有效防控提供指导。【方法】采用单孢分离法从云南15个月季切花主产区灰霉病株上分离月季灰霉菌株,将灰霉菌株孢子悬浮液无创伤接种于月季品种粉红雪山完整花瓣上,通过测量花瓣病斑面积大小鉴定不同灰霉菌株的致病力;将灰霉菌株菌丝块接种于添加有不同杀菌剂的PSA培养基中,通过计算菌丝生长抑制率(抑菌率)鉴定月季灰霉菌对甲基硫菌灵、腐霉利、啶菌恶唑、吡唑醚菌酯、啶酰菌胺、嘧菌环胺和吡噻菌胺7种不同类型杀菌剂的抗药性。【结果】从云南地区15个月季主产区采集的灰霉病株中分离获得141株灰霉菌株,根据月季灰霉病田间症状、菌株形态特征及显微特征判定属于葡萄孢属(Botrytis spp.)真菌。不同灰霉菌株致病力差异明显,病斑面积为3.10~781.50 mm2,未检测到完全不致病的灰霉菌株,弱致病力灰霉菌株较少。来自不同切花产区的灰霉菌株致病力差异不明显。月季灰霉菌株对不同杀菌剂的敏感性为:啶菌恶唑(吡啶恶唑啉类)>吡唑醚菌酯(甲氧基丙烯酸酯类)>嘧菌环胺(苯胺嘧啶类)>啶酰菌胺(烟酰胺类)>腐霉利(二甲酰亚胺类)>吡噻菌胺(酰胺类)>甲基硫菌灵(苯并咪唑类),其中啶菌恶唑、吡唑醚菌酯和嘧菌环胺对灰霉菌的抑制效果最好,抑菌率分别为95.49%、85.78%和77.70%;啶酰菌胺和腐霉利的效果次之,抑菌率为69.73%和64.37%;甲基硫菌灵和吡噻菌胺的效果最差,抑菌率仅为44.36%和56.16%。【结论】云南地区不同月季灰霉菌的致病力差异明显,月季灰霉菌株的致病力与菌株采集地區无关。啶菌恶唑、吡唑醚菌酯和嘧菌环胺可作为目前云南地区月季切花生产中灰霉病防治的主要药剂。
关键词: 月季灰霉病;杀菌剂;抗药性;致病力;云南
中图分类号: S436.81 文献标志码: A 文章编号:2095-1191(2021)09-2489-09
Identification of pathogenicity and fungicide resistance of Botrytis cinerea on rose in Yunnan
HAN Yang-lin, LI Si-si, YUAN Wen-bin, LIU Jia-xun, HE Shui-lian, WU Hong-zhi*
(College of Landscape Architecture and Horticulture, Yunnan Agricultural University, Kunming 650201, China)
Abstract:【Objective】Identified the pathogenicity and fungicide resistance of Botrytis cinerea strains from cut roses in Yunnan, and provided the basis for effective prevention and control of B. cinerea in rose production. 【Method】Strains of B. cinerea were isolated from 15 main rose cut flower producing areas in Yunnan by single spore isolation method. The spore suspension was inoculated on the complete petals of rose cultivar Pink Snow Mountain non-invasively. The pathogenicity of different strains of B. cinerea was identified by measuring the area of petal lesion. The mycelium was inoculated in PSA medium with different fungicides to control B. cinerea. Through the calculation of mycelial growth inhibition rate(antibacterial rate), the resistance of B. cinerea to thiophanate methyl, procymidone, dinitroxazole, pyrazoxystrobin, picrylamide, azoxycycline and pyrthifenamide was identified. 【Result】A total of 141 isolates collected from 15 main rose producing areas in Yunnan were determined to be Botrytis spp. according to the field symptoms, morphological characteris-tics and microcharacteristics of cut rose. There were obvious differences in pathogenicity among different strains of B. cinerea, with the lesion area of 3.10-781.50 mm2. No completely non-pathogenic strains were detected, and a few weak pathogenic strains were detected. There was no obvious difference in the pathogenicity of B.cinerea strains from diffe-rent cut flower producing areas. The sensitivity of B. cinerea to seven main fungicides for controlling B. cinerea were as follows: pyridoxazole(pyridoxazoline)>pyrazoxystrobin (methoxyacrylate)>pyrimethanil (anilinopyrimidine)>pichiani-lamide(nicotinamide)>procymidone(diformylimine)>pyrthiazolamide(amide)>thiophanate methyl(benzimidazole). Inhibition effects of pyridoxazole, pyrazoxystrobin and pyrimethanil were the best, the inhibition rates of mycelium growth were 95.49%,85.78% and 77.70% respectively. Followed by pichianilamide and procymidone, the inhibition rates of mycelium growth were 69.73% and 64.37% respectively. The inhibition effects of pyrthiazolamide and thiophanate methyl were the worst,the inhibition rates of mycelium growth were 44.36% and 56.16% respectively. 【Conclusion】The pathogenic difference B. cinerea strains on cut rose in Yunnan is obvious. The pathogenicity of B. cinerea on cut rose in Yunnan is not related to the place where the strain was collected. Pichiazole, pyrazoxystrobin and pyrimethanil can be used as the main fungicides to control Botrytis cinerea in cut rose production in Yunnan.
Key words: rose gray mold; fungicide; drug resistance; pathogenicity; Yunnan
Foundation item: National Key Research and Development Program of China(2018YFD1000407);Yunnan Key Science and Technology Project(202102AE090001); Academician Expert Workstation Project of Yunnan Science and Technology Department (2018IC098)
0 引言
【研究意义】灰霉病是由葡萄孢属真菌(Botrytis spp.)引起的死体营养型真菌病害(尹大芳,2015),灰霉病菌具有极强的腐生性和较长的潜伏期,其寄主范围广泛,可侵染1400多种寄主植物(Fillinger and Elad,2016),其中包括大量花卉、蔬菜和水果,是世界范围内分布最广、为害最严重、造成经济损失最大的植物病原菌之一,也是引起采后植物病害的重要病原菌,灰霉菌被列为世界第二大植物真菌病害(郑媛萍,2018)。月季是我国十大传统名花之一,月季切花占世界切花总数的30%~32%,被称为“花中皇后”。云南是全球三大鲜切花产区之一,鲜切花种植面积及产量均位居全球第一,国内市场占有率超过70%。月季切花是云南生产量最大的花卉,据云南省农业农村厅统计,2017年云南月季切花种植面积6593 ha,产量49.7亿支,占云南省鲜切花产量的45.1%,出口到亚洲和欧洲等46个国家和地区,在国际贸易中占有重要地位(吕和君,2018)。灰霉病是月季生产中常见且危害严重的一种真菌性病害,被侵染的月季花瓣产生褐色腐烂及灰色霉层,严重影响切花品质(郎立新和蒋兰玲,2006)。灰霉病菌具有低温致病性。月季切花运输过程中需低温高湿环境,低温可抑制大多数病菌扩散,但不能抑制灰霉菌,灰霉病被称为月季切花采后的“癌症”。因此,研究月季灰霉病菌及其防治方法,对月季切花产业发展具有重要意义。【前人研究进展】灰霉菌的致病力分化及对杀菌剂的抗药性研究是生产中防治灰霉病的基础。胡梦琼(2016)、张艳杰等(2017)采用菌丝块创伤接种法分别测定蓝莓和葡萄灰霉菌的致病力,结果表明灰霉菌致病力分化严重且致病力与菌株的形态、采集地的地理位置、寄主的种类、ISSR指纹图谱间无明显相关性,与气候区具有一定的相关性。张双艳等(2019)通过ITS和RPB2基因联合分析对云南地区月季灰霉病病原进行分类和鉴定,表明引起云南地区月季灰霉病的主要病原菌为灰葡萄孢(Botrytis cinerea),且种内变异十分丰富。目前,农业生产中防治灰霉病仍以化学防治为主。防治灰霉病的化学杀菌剂主要有七大类:二甲酰亚胺类、烟酰胺类、苯胺嘧啶类、苯并咪唑类、甲氧基丙烯酸酯类、苯吡咯类和酰胺类。不同类型的杀菌剂作用机理不同,灰霉菌株产生的抗药性程度也不相同。灰霉菌具有繁殖快、种内遗传变异大和适合度高等特点(王克勤,2000),各种杀菌剂使用之初的防效通常在80%以上,但连续使用单一杀菌剂导致灰霉菌产生了抗药性,防治效果下降,已被列为高抗药性风险病原菌。苯并咪唑类杀菌剂(如多菌灵和甲基硫菌灵等)是最早应用于灰霉病防治的化学杀菌剂,灰霉菌株对该类杀菌剂已普遍产生抗药性。张亚等(2016)、赵虎等(2016)通过最小抑制浓度法发现湖南和江苏等地的草莓灰霉病菌已对多菌灵产生了抗药性。二甲酰亚胺类杀菌剂(如腐霉利和异菌脲等)是一类广谱保护性杀菌剂,可引起病原菌菌株甘油过量积累,从而改变其体内渗透压,抑制病原菌;灰霉菌株对该类杀菌剂不同产品间存在正交互抗药性,抗性菌株多为低、中等抗药性,且抗性不稳定(陈乐等,2020)。甲氧基丙烯酸酯类杀菌剂(如嘧菌酯和吡唑醚菌酯等)有很高的抗性风险,多数病原菌使用该类杀菌剂后均会产生抗药性。肖婷等(2018)采用区分剂量法对上海地区草莓灰霉病进行抗药性分析,结果表明供试菌株对吡唑醚菌酯的抗性频率较高。苯胺嘧啶类杀菌剂(如嘧菌环胺和嘧霉胺等)通过抑制甲硫氨酸的合成进而抑制病原菌菌株的菌丝生长和分生孢子芽管伸长。戴启东等(2019)通过菌丝生长速率抑制法对蓝莓灰霉病抗药性测定结果表明,嘧菌环胺及其复配剂对蓝莓灰霉病的抑制效果较好。烟酰胺类杀菌剂(如啶酰菌胺等)与甲氧基丙烯酸酯类杀菌剂作用机制相似,但作用靶点不同,不存在交互抗药性。范飞等(2016)研究发现,湖北10个地级市中仅有2个市发现草莓灰霉菌抗啶酰菌胺菌株,为国内首次发现灰霉菌株对啶酰菌胺抗性的报道。吡啶恶唑啉类杀菌剂(如啶菌恶唑)具有保护与治疗双重作用。啶菌恶唑是一类结构独特的新型杀菌剂,具有广谱和突出的离体杀菌活性,与其他类型的杀菌剂均无交互抗药性,暂时未发现对其有高抗药性的菌株(Zhu et al.,2016)。【本研究切入点】目前,有关月季灰霉病菌致病力和抗藥性的研究尚未见报道。【拟解决的关键问题】采用无创伤接种法和菌丝生长速率抑制法分别对从云南地区主要月季切花产区采集的月季灰霉菌株进行致病力鉴定,并选用目前国内外灰霉病防治的主要七大类杀菌剂中的六类(甲基硫菌灵、腐霉利、吡唑醚菌酯、啶酰菌胺、嘧菌环胺和吡噻菌胺)以及国内市场普遍使用的真菌病害防治药剂啶菌恶唑共7种不同类型杀菌剂进行抗药性测定,明确月季灰霉菌的致病力分化和抗药性情况,为云南地区月季灰霉病的防治提供指导。
1 材料与方法
1. 1 试验材料
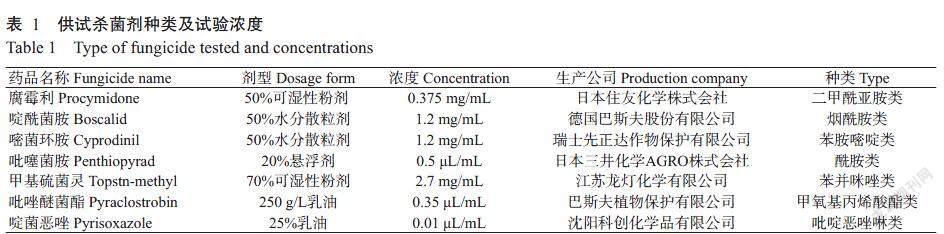
供试灰霉菌株为从云南昆明市、楚雄州、文山州、红河州和玉溪市等15个月季切花主产区的灰霉病株上分离纯化获得。供试月季切花品种为粉红雪山,由云南省弥勒市品元园艺有限公司提供。接种时选择开放至第2阶段(花瓣伸出萼片0.5~1.0 cm)的花朵,要求花瓣无损伤、大小均一。通过查阅文献和常用杀菌剂市场调查结果,选用7种商品化杀菌剂,根据杀菌剂提供的参考浓度选择合适的浓度开展抗药性试验(表1)。
1. 2 试验方法
1. 2. 1 培养基配制 马铃薯蔗糖琼脂固体培养基(PSA培养基):将200 g马铃薯切丝,放入烧开的蒸馏水中煮软,4层纱布过滤,滤液定容至1 L,重新倒入锅中,加入20 g蔗糖和18 g琼脂,煮沸,倒入玻璃瓶中,121 ℃高温高压灭菌。马铃薯蔗糖液体培养基(PB培养基):将200 g马铃薯切丝,放入烧开的蒸馏水中煮软,4层纱布过滤,滤液定容至1 L,重新倒入锅中,加入20 g蔗糖,121 ℃高温高压灭菌。
1. 2. 2 灰霉菌株的获得与保存 采用单孢分离法分离月季灰霉菌株。对于发病初期的病株,分离菌株时将发病部位用无菌水清洗,取3 mm×3 mm病健交界处小块,置于PSA培养基上;对于发病后期的病株,分离菌株时用灭菌后的牙签在发病部位挑取病原物,接入PSA培养基中。接种后的培养基放入25 ℃的培养箱中黑暗培养,待长出菌丝后挑选菌丝相同条件继续培养,重复3~5次后,得到纯净的病原分离物,通过显微观察菌丝和孢子形态确定为灰霉菌株。
用灭菌打孔器打取纯化后培养约5 d的灰霉菌株菌落菌饼,放入装有20%甘油的冻干管中,标明菌株名称、保存时间后,于-80 ℃冰箱保存备用。
1. 2. 3 病原菌致病力鉴定
1. 2. 3. 1 孢子悬浮液制备 纯化得到的灰霉菌株于25 ℃黑暗环境中培养3~4周后产生分生孢子。将配制好的PB培养液浓度稀释为20%,倒入灰霉菌中,用灭菌接种环刮取培养基表面的孢子及菌丝,用超细尼龙网纱(400目)过滤以除去菌丝残留物。孢子悬浮液即配即用。用血球计数板对所制备的孢子悬浮液进行计数,用20% PB将孢子悬浮液的浓度稀释至1×106个/mL。
1. 2. 3. 2 接种 在托盘内倒入无菌水,铺盖1层吸水纸,无菌水不能没过纸面。撕下粉红雪山完整花瓣放在吸水纸上,每个花瓣中间接种5 μL的孢子悬浮液,盖上盖子。接种后72 h测量病斑直径,计算病斑面积,并进行致病力等级分级。
灰霉菌株致病力分级标准(吴红芝等,2011):0级,接种液滴清澈,无侵染迹象;1级,菌株开始侵染,病斑在接种液滴内,0<病斑面积≤20.00 mm2;2级,侵染扩展到液滴外,病斑大小为液滴的2~5倍,20.00<病斑面积≤100.00 mm2;3级,病斑大于液滴5倍,小于接种花瓣1/2面积,100.00<病斑面积≤350.00 mm2;4级,病斑超过接种花瓣面积的1/2,350.00<病斑面积≤700.00 mm2;5级,接种花瓣几乎完全被侵染,病斑面积>700.00 mm2。
1. 2. 4 病原菌的抗药性鉴定 杀菌剂按浓度配制好后与灭菌、冷却至50 ℃的PSA培养基混匀,以不加杀菌剂的培养基为对照,倒入培养皿中,每皿15~20 mL;保存的菌株在PSA培养基上活化培养3 d,用打孔器打取菌饼,接种在培养基上,每皿1个菌饼,每株菌株3个重复,倒置在恒温培养箱中25 ℃黑暗培养。48 h后测量菌落直径,计算菌丝生长抑制率(抑菌率)。
抑菌率(%)=(对照菌落直径-药剂处理的菌落
直径)/对照菌落直径×100
1. 3 统计分析
试验数据运用Excel 2007和SPSS 19进行整理分析并作图。
2 结果与分析
2. 1 月季灰霉病田间症状
如图1所示,月季生长的各个阶段且花朵、叶片和茎均可发生灰霉病,其中花朵最易发病。雨季为灰霉病发病高发期,在温暖潮湿条件下,灰霉孢子长满整个受侵染部位。月季叶片被侵染后,从叶片边缘向内部扩散,病部变黄并长出灰色孢子(图1-A)。花蕾被感染后,花托腐烂变黑,花蕾停止发育并长满灰色孢子,最后腐烂枯死(图1-B)。花朵被感染后,初期花瓣上出现红色或褐色斑点,有的花朵花瓣边缘变褐色(图1-C和图1-D),侵染后期病部腐烂,长出灰色孢子(图1-E)。月季切花在运输过程中需要低温高湿的环境,但此环境并不能抑制灰霉菌的生长。切花在运输前或运输过程被灰霉菌侵染后,在病部会产生大量孢子,并侵染其他切花,造成严重的经济损失(图1-F)。月季切花无论在哪个阶段发病,在高湿条件下被侵染部位长出灰色霉层是灰霉病的重要症状。
2. 2 灰霉菌株分离及致病力分析结果
从云南省昆明市安宁市、富民县、晋宁区、石林县、宜良县、禄劝县和嵩明县;楚雄州楚雄市和禄丰县;玉溪市通海县、红塔区和澄江市;文山州丘北县、红河州弥勒市和丽江市15个月季主产区采集的灰霉病株中分离获得141株灰霉菌株。根据月季灰霉病田间症状、菌株的形态特征、显微特征,判定属于葡萄孢属(Botrytis spp.)真菌。
将分离的141株灰霉菌株接种到月季品种粉红雪山花瓣后,观察花瓣发病情况。接种后72 h观察到清晰的病斑,且不同灰霉菌株间表现出明显差异,能达到鉴定不同致病力菌株的效果。灰霉菌株发病稳定,病斑为近似椭圆形的黄色水渍状,病斑边界清晰,发病率为100%(图2)。
由表2可知,不同灰霉菌株的致病力存在明显差异。分离得到的141株灰霉菌株中,致病力1级的菌株7株,占4.96%;致病力2级的菌株10株,占7.09%;致病力3级的菌株60株,占42.55%;致病力4级的菌株59株,占41.84%;致病力5级的菌株5株,占3.55%。大多数菌株的致病力在3~4级,致病力特别弱和特别强的菌株较少,所测的菌株中无完全不致病的菌株。菌株SLBQ-5、SMDUS-2、SMDUS-1、PZH-4、SMB-4、YXHT-6和SLBQ-8的病斑面积小于20.00 mm2,致病力弱;菌株SLJY-18、SLJY-16、JNSC-1、SMW-2和YZH-5几乎完全侵染整张月季花瓣,致病力强。
采集的菌株中来自昆明市月季主产区灰霉菌株导致的病斑面积均值为327.88 mm2;玉溪市为360.30 mm2;楚雄州为287.12 mm2;红河州为316.87 mm2;文山州为371.19 mm2;丽江市为369.23 mm2。不同地区采集的灰霉菌株病斑面積差异不明显,表明灰霉菌株的致病力与采集地无关。
2. 3 灰霉菌对不同杀菌剂的抗药性分析结果
由表3可看出,不同杀菌剂对灰霉菌株的抑菌率存在明显差异。甲基硫菌灵和吡噻菌胺的抑菌效果最差,其中甲基硫菌灵对灰霉菌的抑菌率为18.9%~65.4%,64.5%的菌株的抑菌率小于50.0%,多数菌株产生了抗药性;吡噻菌胺对供试菌株的抑菌率为28.9%~72.8%,均值为56.16%,其对灰霉菌虽有抑制效果,但抑菌率偏低,有22.7%的菌株的抑菌率小于50.0%。啶酰菌胺和腐霉利的抑菌效果较好,其中腐霉利对供试菌株的抑菌率为45.8%~90.5%,有95.0%的菌株的抑菌率大于50.0%;啶酰菌胺的抑菌率为50.5%~89.1%,有49.6%的菌株的抑菌率大于70.0%。嘧菌环胺、吡唑醚菌酯和啶菌恶唑对灰霉菌的抑制效果最好,3种杀菌剂对灰霉菌株的抑制率分别为57.8%~95.3%、65.8%~98.3%和80.4%~100.0%,其中啶菌恶唑的抑菌率均值高达95.49%,且30.5%的菌株的抑菌率达100.0%,是理想的杀菌剂。
综上所述,月季灰霉菌对杀菌剂的敏感性为:啶菌恶唑>吡唑醚菌酯>嘧菌环胺>啶酰菌胺>腐霉利>吡噻菌胺>甲基硫菌灵。灰霉菌对甲基硫菌灵和吡噻菌胺产生了不同程度的抗性,2种杀菌剂的抑菌效果较差;啶酰菌胺和腐霉利抑制灰霉菌的效果较好;嘧菌环胺、吡唑醚菌和啶菌恶唑防治云南地区月季灰霉病的效果最好。
3 讨论
3. 1 月季灰霉病菌的致病力特征
李娜(2015)、冯晓菲(2018)通过对草莓、黄瓜和番茄灰霉菌株进行致病力分化分析,表明不同灰霉菌致病力差异显著,且灰霉菌株致病力强弱与菌株寄主和地理位置无关。周梓良(2015)对湖北地区草莓灰霉菌致病力分化研究结果表明弱致病力菌株数量极少。本研究显示月季灰霉菌致病力呈现相似的结果,不同月季灰霉菌株致病力差异显著,弱致病力菌株较少,未发现完全不致病的菌株。
3. 2 月季灰霉病菌致病力测定适宜方法
灰霉病菌致病力鉴定方法通常采用菌饼接种叶片(李娜,2015)或孢子接种花瓣圆片(Cao et al.,2019)、孢子喷洒植株。月季的花朵是其主要观赏部位,灰霉病菌的分生孢子、分生孢子梗和菌丝均可侵染花朵,但在田间尤其是月季切花采后运输过程中灰霉病菌的侵染源主要是分生孢子。采用喷洒植株的接种方式需要的孢子量和植株多、成本高、时间长,同时会造成接种不均匀等问题;花瓣圆片失水率较高易萎蔫。本研究接种材料采用完整无损伤的月季花瓣进行月季灰霉菌致病力鉴定省时、省力且花瓣不易失水,使鉴定更加高效、准确。
本研究选择接种的月季切花品种为粉红雪山,该品种对灰霉病菌为中等抗性,能区分出不同致病力的灰霉菌株。抗性太强的月季切花品种不能准确筛选出弱致病力的灰霉菌株,抗性较弱的月季切花品种接种后病斑扩散较快,而强致病力的灰霉菌株易长满整个花瓣,不易测量。此外,粉红雪山花瓣颜色较浅,接种灰霉菌株后发病稳定、病斑边界清晰,易测量病斑面积。
3. 3 云南地区月季灰霉病防治药剂的选择
本研究灰霉菌株对供试杀菌剂的敏感性为:啶菌恶唑>吡唑醚菌酯>嘧菌环胺>啶酰菌胺>腐霉利>吡噻菌胺>甲基硫菌灵。啶菌恶唑、吡唑醚菌酯和嘧菌环胺防治月季灰霉病效果最好,啶酰菌胺和腐霉利效果次之,甲基硫菌灵和吡噻菌胺防效最差。
甲基硫菌灵是最早应用于灰霉病防治的化学杀菌剂,这种20世纪60年代末便投入使用的杀菌剂在1971年就已发现抗性菌株。目前,大多数月季上的灰霉菌株对甲基硫菌灵均产生了抗药性,生产上不推荐使用甲基硫菌灵防治灰霉病。嘧菌环胺和腐霉利这2种杀菌剂先后在辽宁(王猛,2019)、湖北和浙江(卢晓雪等,2018)等地发现有抗性菌株,且抗性频率高达75%(陈乐等,2020);吡唑醚菌酯属于甲氧基丙烯酸酯类杀菌剂,该类杀菌剂具有较高的抗药性风险,肖婷等(2018)研究表明上海地区草莓灰霉菌对吡唑醚菌酯的抗性频率逐年升高。而在本研究中云南地区月季灰霉菌對吡唑醚菌酯、嘧菌环胺和腐霉利的抑菌率分别为为85.78%、77.70%和64.37%,仍较敏感,原因可能是云南地区在防治月季灰霉病中对吡唑醚菌酯、腐霉利和嘧菌环胺的使用年限或使用频率不高,该地区灰霉病病原菌尚未形成高抗变种。啶菌恶唑在本研究中效果最佳,是优秀的杀菌剂,奉代力等(2013)、蔺菊芬(2013)和赵佳振(2019)对番茄灰霉病菌的研究、姜彩鸽等(2017)对葡萄灰霉病菌的研究等也表明啶菌恶唑对灰霉病的防治效果很好。因此,生产中可用啶菌恶唑、吡唑醚菌酯和嘧菌环胺交替使用防治月季灰霉病,同时,下一步应开发新型化学杀菌剂复配剂及生物制剂,以防止灰霉菌株产生较强抗药性,导致防治效果下降。
4 结论
云南地区不同月季灰霉菌的致病力差异明显,月季灰霉菌株的致病力与菌株采集地区无关。云南地区月季灰霉菌株对不同杀菌剂产生了不同程度的抗药性,月季切花生产中可交替使用啶菌恶唑、吡唑醚菌酯和嘧菌环胺作为目前防治灰霉病的主要药剂。
参考文献:
陈乐,苗则彦,孙柏欣,赵杨,段玉玺,白元俊. 2020. 灰霉病菌抗药性研究进展[J]. 中国植保导刊,40(4):21-30. [Chen L,Miao Z Y,Sun B X,Zhao Y,Duan Y X,Bai Y J. 2020. Advance in research on fungicides resistance of Botrytis cinerea[J]. China Plant Protection,40(4):21-30.] doi:10. 3969/j.issn.1672-6820.2020.04.004.
戴启东,李广旭,杨华,张广仁,周朝辉. 2019. 6种杀菌剂对蓝莓采后灰葡萄孢菌的室内毒力测定[J]. 辽宁农业科学,(4):19-22. [Dai Q D,Li G X,Yang H,Zhang G R,Zhou C H. 2019. Toxicity assay of the six fungicides on Botrytis cinerea from post-harvest blueberry fruits[J]. Liaoning Agricultural Sciences,(4):19-22.] doi:10.3969/j.issn.1002-1728.2019.04.005.
范飞,李娜,李国庆,罗朝喜. 2016. 湖北省草莓保护地灰霉病菌的抗药性研究[C]//中国植物病理学会2016年学术年会论文集. 北京:中国植物病理学会:487. [Fan F,Li N,Li G Q,Luo C X. 2016. Study on the resistance of Botrytis cinerea in strawberry protected field in Hubei Province[C]//Proceedings of 2016 Seminar of Chinese Society of Plant Pathology. Beijing:Chinese society of Plant Pathology:487.]
奉代力,王强,郑纪慈,张昌朋,仇厚援. 2013. 几种杀菌剂对番茄灰霉病菌的抑菌效果对比研究[J]. 浙江农业学报,25(1):119-123. [Feng D L,Wang Q,Zheng J C,Zhang C P,Qiu H Y. 2013. Comparative experimental study of several fungicides to Botrytis cinerea[J]. Acta Agriculturae Zhejiangensis,25(1):119-123.] doi:10.3969/j.issn.1004-1524.2013.01.22.
冯晓菲. 2018. 四川草莓灰霉病菌的多样性及防治药剂筛选[D]. 雅安:四川农业大学. [Feng X F. 2018. Diversity and fungicide screening of strawberry Botrytis cinerea in Sichuan Province[D]. Yaan:Sichuan Agricultural University.]
胡梦琼. 2016. 蓝莓叶枯病的鉴定及灰霉病菌ISSR指纹图谱差异研究[D]. 沈阳:沈阳农业大学. [Hu M Q. 2016. Identification of the causal agent of leaf blighet on blueberry and ISSR fingerprinting of Botrytis cinerea isolates[D]. Shenyang:Shenyang Agricultural University.]
姜彩鸽,杨小伟,张怡,王国珍,王广录,方治永. 2017. 12种杀菌剂对葡萄灰霉病菌的室内毒力测定[J]. 宁夏农林科技,58(8):33-35. [Jiang C G,Yang X W,Zhang Y,Wang G Z,Wang G L,Fang Z Y. 2017. Indoor toxicity of 12 fungicides against grape Botrytis cinerea pers[J]. Ningxia Journal of Agriculture and Forestry Science and Techno-logy,58(8):33-35.] doi:10.3969/j.issn.1002-204X.2017. 08.013.
郎立新,蒋兰玲. 2006. 切花月季温室灰霉病[J]. 中国花卉园艺,(20):41. [Lang L X,Jiang L L. 2006. Gray mold of cut rose in greenhouse[J]. China Flowers & Horticulture,(20):41.]
李娜. 2015. 湖北省保护地番茄/草莓灰霉病菌多样性研究[D]. 武汉:华中农业大学. [Li N. 2015. Studies on diversity of Botrytis cinerea isolated from tomato and strawberry[D]. Wuhan:Huazhong Agricultural University.]
藺菊芬. 2013. 25%啶菌恶唑EC防治日光温室番茄灰霉病药效试验[J]. 农业科技与信息,(1):39-40. [Lin J F. 2013. Experimental study on the efficacy of 25% oxazolec against grey mould of tomato in solar greenhouse[J]. Agricultural Science-Technology and Information,(1):39-40.] doi:10.15979/j.cnki.cn62-1057/s.2013.01.018.
卢晓雪,聂国嫒,孙海燕,张金凤,陈怀谷,魏利辉. 2018. 长三角地区果蔬灰霉病病菌对5种杀菌剂的抗药性检测[J]. 江苏农业科学,46(24):97-100. [Lu X X,Nie G Y,Sun H Y,Zhang J F,Chen H G,Wei L H. 2018. Detection of resistance of Botrytis cinerea to five fungicides from fruit and vegetable crops in the Yangtze River Delta[J]. Jiangsu Agricultural Sciences,46(24):97-100.] doi:10. 15889/j.issn.1002-1302.2018.24.025.
吕和君. 2018. 云南切花月季产业持续发展新主张[J]. 中国花卉园艺,(12):18-20. [Lü H J. 2018. The new idea of cut Chinese rose industry sustainable development in Yunnan[J]. China Flowers & Horticulture,(12):18-20.] doi:10.3969/j.issn.1009-8496.2018.12.008.
王克勤. 2000. 灰霉病菌抗药性研究进展及防治对策[J]. 黑龙江农业科学,(5):40-42. [Wang K Q. 2000. Research progress and control strategy of resistance of Botrytis cinerea[J]. Heilongjiang Agricultural Sciences,(5):40-42.] doi:10.3969/j.issn.1002-2767.2000.05.015.
王猛. 2019. 莘县地区灰霉病菌对腐霉利的抗药性研究[J]. 农药科学与管理,40(10):38-42. [Wang M. 2019. Study on resistance of Botrytis cinerea to procymidone in Shenxian[J]. Pesticide Science and Administration,40(10):38-42.] doi:10.3969/j.issn.1002-5480.2019.10.009.
吴红芝,和凤美,张敬丽,吴景芝. 2011. 非洲菊灰霉病抗性鉴定技术的研究[J]. 云南农业大学学报(自然科学版), 26(3):334-339. [Wu H Z,He F M,Zhang J L,Wu J Z. 2011. Identification on gerbera resistance to Botrytis cinerea[J]. Journal of Yunnan Agricultural University(Natural Science),26(3):334-339.] doi:10.3969/j.issn.1004-390X(n).2011.03.009.
肖婷,成瑋,颜伟中,王建华,许媛,吉沐祥,杨敬辉. 2018. 上海地区草莓灰霉病病菌种群抗药性研究[J]. 江苏农业科学,46(20):117-120. [Xiao T,Cheng W,Yan W Z,Wang J H,Xu Y,Ji M X,Yang J H. 2018. Fungicide resistance of Botrytis cinerea isolated from strawberry in Shanghai area[J]. Jiangsu Agricultural Sciences,46(20):117-120.] doi:10.15889/j.issn.1002-1302.2018.20.030.
尹大芳. 2015. 浙江省草莓灰霉病菌抗药性检测及抗性机制的研究[D]. 杭州:浙江大学. [Yin D F. 2015. The detection on fungicide resistance and the research on resistance mechanism of Botrytis cinerea from strawberry in Zhejiang Province[D]. Hangzhou:Zhejiang University.]
张双艳,孟静,韩洋琳,吴红芝. 2019. 云南地区月季灰霉病病原菌的分离鉴定[J]. 浙江大学学报(农业与生命科学版),45(6):692-698. [Zhang S Y,Meng J,Han Y L,Wu H Z. 2019. Isolation and identification of gray mold pathogens on rose in Yunnan[J]. Journal of Zhejiang University(Agriculture and Life Sciences),45(6):692-698.] doi:10.3785/j.issn.1008-9209.2019.03.061.
张亚,王翀,刘双清,廖晓兰,马文月. 2016. 湖南省草莓灰霉病菌对4种杀菌剂的抗药性检测[J]. 植物保护,42(5):181-187. [Zhang Y,Wang C,Liu S Q,Liao X L,Ma W Y. 2016. Detection of the resistance of Botrytis cinerea on strawberry in Hunan Province to four fungicides[J]. Plant Protection,42(5):181-187.] doi:10.3969/j.issn.0529- 1542.2016.05.032.
张艳杰,许换平,沈凤英,李兴红,李亚宁,刘大群. 2017. 我国葡萄灰霉病菌形态型和致病力分化[J]. 农业生物技术学报, 25(11):1740-1755. [Zhang Y J,Xu H P,Shen F Y,Li X H,Li Y N,Liu D Q. 2017. Phenotypes and virulence variability among grape gray mold isolates from grapes(Vitis vinifera) in China[J]. Journal of Agricultural Biotechnology,25(11):1740-1755.] doi:10.3969/j.issn. 1674-7968.2017.11.002.
赵虎,王松群,余新燕,强承魁,陈长军. 2016. 南京、镇江地区草莓灰霉病菌对6种杀菌剂的抗药性及生物学性状分析[J]. 基因组学与应用生物学,35(7):1828-1834. [Zhao H,Wang S Q,Yu X Y,Qiang C K,Chen C J. 2016. Resistance and biological characteristics of Botrytis cinerea to six fungicides in Nanjing and Zhenjiang[J]. Genomics and Applied Biology,35(7):1828-1834.] doi:10.13417/j.gab.035.001828.
赵佳振. 2019. 关中地区温室番茄灰霉病化学防治药剂的筛选[D]. 杨陵:西北农林科技大学. [Zhao J Z. 2019. Scree-ning of chemical control agents for Botrytis cinerea in greenhouse in Guanzhong region[D]. Yanglin:Northwest A & F University.]
郑媛萍. 2018. 我国葡萄灰霉病菌对主要杀菌剂的抗药性检测[D]. 北京:中国农业科学院. [Zheng Y P. 2018. The detection on the main fungicides resistance of Botrytis cinerea from grape in China[D]. Beijing:Chinese Academy of Agricultural Sciences.]
周梓良. 2015. 湖北省灰霉病菌致病力分化及菌株HBstr-470中真菌病毒的研究[D]. 武汉:华中农业大学. [Zhou Z L. 2015. Pathogenicity differentiation of Botrytis cinerea in Hubei Province and the mycoviruses present in strain Hbstr-470[D]. Wuhan: Huazhong Agricultural University.]
Cao X Q,Yan H J,Liu X T,Li D D,Sui M J,Wu J,Yu H Q,Zhang Z. 2019. A detached petal disc assay and virus-induced gene silencing facilitate the study of Botrytis cinerea resistance in rose flowers[J]. Horticulture Research,6(1):136. doi:10.1038/s41438-019-0219-2.
Fillinger S,Elad Y. 2016. Botrytis–the fungus,the pathogen and its management in agricultural systems[M]. Springer International Publishing.
Zhu H,Huang C T,Ji M S. 2016. Baseline sensitivity and control efficacy of pyrisoxazole against Botrytis cinerea[J]. European Journal of Plant Pathology,146(2):315-323. doi:10.1007/s10658-016-0917-7.
(責任编辑 麻小燕)

