春兰根状茎缓慢生长保存和包埋保存
付双彬 杨燕萍 应震 周庄
摘 要:以春兰根状茎为材料,研究培养基中不同MS盐含量、蔗糖浓度、甘露醇浓度及矮壮素(chlormequat chloride, CCC)浓度对根状茎缓慢生长保存的影响;研究不同浓度海藻酸钠(sodium alginate, SA)和氯化钙(calcium chloride, CC)对于根状茎包埋珠合格率和萌发率的影响,并以此为基础研究春兰根状茎的包埋保存。结果表明:根状茎在MS+10.0 g/L蔗糖+10.0 g/L甘露醇+7.5 g/L琼脂+1.0 g/L活性炭和MS+20.0 g/L蔗糖+7.5 g/L琼脂+1.0 g/L活性炭的培养基上保存,12个月后存活率达84.00%。利用3.5%(W/V)的SA,75.0 mmol/L CC制成的根状茎包埋珠合格率和萌发率达97.60%和92.00%。合格的包埋珠在4 ℃下保存180 d,萌发率和再生率最高,分别为68.00%和64.00%。本研究的结果可为春兰等国蘭的种质资源保存和种苗生产提供理论和技术指导。
关键词:春兰;根状茎;缓慢生长保存;包埋保存
Abstract: Rhizomes of Cymbidium goeringii were used as the materials, the effects of different MS salt content, and the concentration of sucrose, mannitol and chlormequat chloride added in the medium were studied. The effects of different concentration of sodium alginate and calcium chloride on the qualification rate and germination rate of encapsulated rhizomes were studied. The results showed that the survival rates of rhizomes stored on MS medium containing 10.0 g/L sucrose + 10.0 g/L mannitol + 7.5 g/L agar + 1.0 g/L activated charcoal and MS medium containing 20.0 g/L sucrose + 7.5 g/L agar + 1.0 g/L activated charcoal was 84.00% after 12 months. The qualification rate and germination rate of rhizome capsules produced by using 3.5% (W/V) sodium alginate, 75.00 mmol/L calcium chloride was 97.60% and 92.00%, respectively. The qualified capsules were stored at 4 ℃ for 180 d, the germination and conversion rate were the highest, 68.00% and 64.00%, respectively. The results could provide a theoretical and technical guidance for the conservation of germplasm resources and seedlings production of Cymbidium goeringii and other Chinese orchids.
Keywords: Cymbidium goeringii; rhizomes; slow growth storage; encapsulation storage
春兰(Cymbidium goeringii)为兰科(Orchidaceae)兰属(Cymbidium)地生兰,是国兰家族中的主要类群之一,由于其俊美的外形和幽雅的香气深得亚洲人民的喜爱[1]。近年来,由于兰花的商业价值不断升高,导致野生资源盗采盗挖不断猖獗,重要的资源不断流失;加之兰科植物资源庞大,实地保护存在困难等,寻找有效的离体保存方法便变得十分迫切[2]。然而,参考其他兰科植物的离体保存,春兰的离体保存面临2个问题:(1)与其他兰科植物如洋兰等相比,春兰原球茎较小,并在培养基中很快发育成特定的器官,称为根状茎,并会在此阶段保持数年[3],这就使得国兰的离体保存不能单纯地参考应用现今大多数兰利用原球茎保存的方法;(2)对于种质资源的离体保存,超低温保存是目前最优的选择,但该方法开发有一定难度,距离广泛使用还存在一定差距[4]。因此,需要另行寻找合适的方法。
近年来,蝴蝶兰[5]、大花蕙兰[6]等兰科植物利用原球茎或试管苗进行了缓慢生长保存研究并取得成功;而包埋保存的方法在万珠兰和万代兰杂交种[7]、石斛兰[8]等中已得到有效应用。虽然缓慢生长保存和包埋保存在保存时间上较超低温保存要短,但由于操作简便,材料易恢复生长等仍有应用空间[4, 7]。因此,本试验以春兰根状茎为材料,通过调整MS培养基无机盐含量、调整蔗糖含量、添加甘露醇、添加生长抑制物矮壮素的方法对其缓慢生长保存进行研究;通过调整海藻酸钠浓度和氯化钙浓度对其进行根状茎包埋研究及后续的保存研究,以期通过研究这2种方法为春兰等国兰的种质保存提供借鉴。
1 材料与方法
1.1 材料
选用春兰种子无菌播种产生的根状茎作为材料,实验室现存,已增殖继代3年。
1.2 方法
1.2.1 調整添加培养基不同组分对春兰根状茎缓慢生长保存的影响 选用MS[9]为基本培养基,添加20.0 g/L蔗糖、7.5 g/L琼脂和1.0 g/L活性炭,而不添加植物激素,并选用此组合作为对照。在此培养基基础上调整蔗糖含量为0、10.0、40.0、60.0、80.0 g/L;调整MS盐为1/2、1/4、1/6、1/8、1/10、0 MS;以逐步替换蔗糖的方式添加甘露醇,为蔗糖/甘露醇15.0/5.0、10.0/10.0、5.0/15.0、0.0/20.0 g/L;添加10.0、20.0、30.0、40.0、50.0 mg/L CCC。调整单个成分时其他组分不变,4组做单因素试验。各培养基在调pH至5.8后灭菌。接种时取大小、状态一致的根状茎,每段切成约1.0 cm,每处理接种10瓶,每瓶5段,共50段接入培养基内,重复5次。在温度25 ℃,光照时间12 h/d条件下培养,保存12个月,每3个月观察根状茎存活状况,统计根状茎存活率。
保存12个月恢复生长时转入MS+4.0 mg/L NAA+20.0 g/L蔗糖+7.5 g/L琼脂+1.0 g/L活性炭的恢复培养基中,再生培养基为MS+3.0 mg/L 6-BA+1.0 mg/L NAA+30.0 g/L蔗糖+7.5 g/L琼脂+ 10.0%(V/V)椰汁。
存活率=存活的根状茎数/根状茎接种数× 100%
再生率=能分化再生根状茎数/根状茎接种数× 100%
1.2.2 春兰根状茎包埋及保存 制备3.0、3.5或4.0 %(W/V)的SA,用添加20.0 g/L蔗糖的液体MS(不含CaCl2·2H2O)培养基溶解,制备50.0、75.0、100.0 mmol/L CC(用CaCl2·2H2O试剂配制)溶液,SA浓度、CC浓度二者做3×3的完全随机试验设计。上述溶液配制好后,调pH至5.8后灭菌。包埋时先将春兰根状茎切成0.3 cm左右,而后混合在SA溶液中并使用镊子将混合物轻轻滴入CC溶液中来完成包埋,每个包埋珠内含有一个根状茎,反应20 min后,将含根状茎的包埋珠在无菌蒸馏水中冲洗2~3次,以去除多余的CC,然后放在无菌滤纸上干燥,之后随机取出50粒,统计合格率,试验重复5次。而后取各处理合格包埋珠50粒(每瓶10粒)转入上述恢复培养基中培养,试验重复5次,1个月后统计萌发率。
对于包埋后保存,设置以下4组试验:(1)未包埋的根状茎放入1.8 mL冷冻管,室温25 ℃条件下黑暗保存;(2)包埋的根状茎放入冷冻管,室温25 ℃条件下黑暗保存;(3)未包埋的根状茎放入冷冻管,放入4 ℃冰箱内黑暗保存;(4)包埋的根状茎放入冷冻管,4 ℃下黑暗保存。每个冷冻管中各放置5个供试材料,在30、60、90、120、150、180 d时每处理取出冷冻管2管,将供试材料取出转入上述恢复培养基中进行恢复生长并统计萌发率和萌发所需时间,试验重复5次。待萌发率统计过后,将萌发出的根状茎切下转入上述再生培养基中进行再生培养,并统计再生率。
合格率=合格的包埋珠数/总的50粒包埋珠×100%(合格与否主要取决于根状茎是否被覆盖,包埋珠是否坚固,透明,等径)
萌发率=包埋珠萌发数/总的50粒(合格)包埋珠×100%(萌发指未包埋根状茎长出新根状茎或包埋珠内根状茎伸出包埋珠约1.0 cm)
1.3 数据处理
试验数据用Origin Pro 2020b(Learning Edition, Origin Lab, USA)软件绘图,数据用平均值加标准差表示,用SPSS 22.0软件进行方差分析和Duncuns法作多重比较。
2 结果与分析
2.1 调整培养基不同组分对春兰根状茎缓慢生长保存的影响
如图1A所示,0~3月,在含0、80 g/L蔗糖的培养基中保存的根状茎存活率下降趋势较明显,而在6~9月,则以在含10、20 g/L蔗糖的培养基中下降明显,在其他许多处理中也有同样的现象(图1C、图1D);9个月后,所有处理根状茎存活率开始保持较稳定的水平,12个月后存活率最高的为对照组,为84.00%,但与其他5组差异不显著。从图1B可以看出,在含1/2、1/4、1/6、1/8 MS的培养基中保存的根状茎存活率下降趋势较平稳,而在1/10、0 MS中下降较为迅速,12个月后,0 MS培养基中根状茎存活率已下降到12.40%,而存活率最高为1/8 MS,为82.40%,与1/2、1/4、1/6 MS差异不显著。从图1C可以看出,在蔗糖/甘露醇0/20 g/L培养基中保存的根状茎呈现独立的下降趋势,而其他处理呈现相同下降趋势,12个月后,以在蔗糖/甘露醇10/10 g/L培养基中保存的根状茎存活率最高,为84.00%,与蔗糖/甘露醇15/5、5/15 g/L差异不显著。从图1D可以看出,5组处理均呈相同下降趋势,最终以含CCC10、20 mg/L的培养基中存活率最高,为83.60%,但5个处理间差异不显著。综合来看,多数处理在6个月后有较大幅度下降,此后趋于稳定,保存12个月后,以在对照组、蔗糖/甘露醇10/10 g/L培养基中保存的根状茎存活率均值最大,为84.00%,并且存活的根状茎均能再生(图1A)。
2.2 春兰根状茎包埋
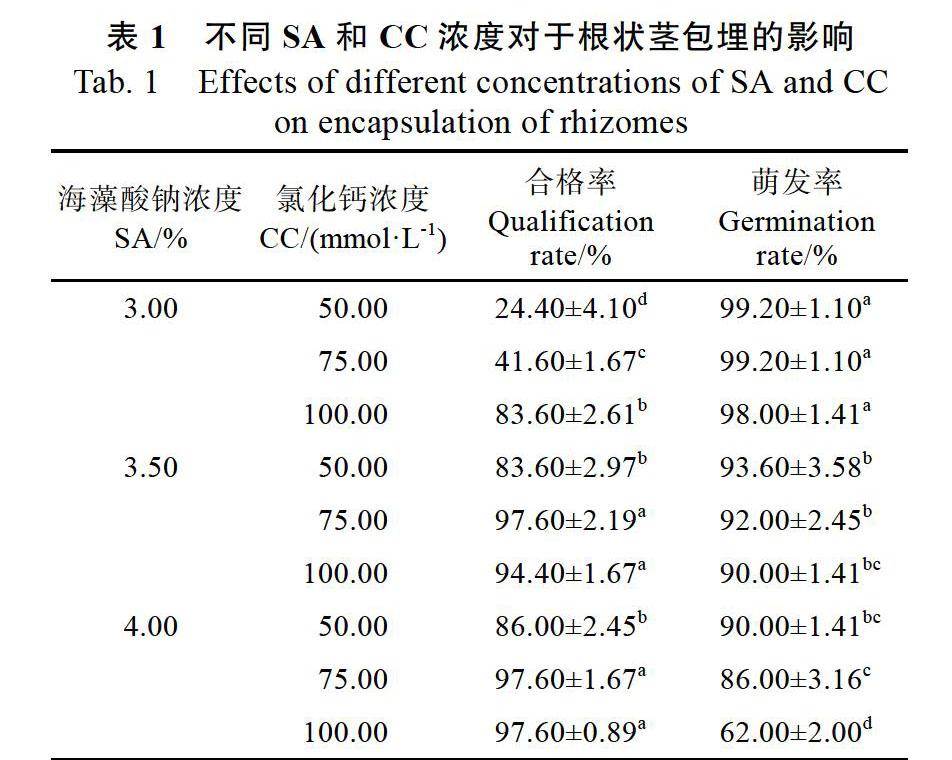
如表1中所示,随着SA浓度和CC浓度的增加,合格率呈逐渐增加的态势,其中3.5~4.0%的SA和50.0~100.0 mmol/L的CC均可产生大量合格包埋珠(图2B),而3.0%的SA和50.0~ 75.0 mmol/L的CC反应,大多数包埋珠形成不规则的形状(图2C、D、E、F)。其中以3.5%的SA和75.0 mmol/L CC、4.0%的SA和75.0~100.0 mmol/L CC组合的合格率最高,为97.60%,而与3.5%的SA和100.0 mmol/L CC的组合差异不显著。相比于合格率,萌发率则成相反的趋势,SA浓度和CC浓度高,萌发率则偏低。SA(4.0%)和CC(75.00~100.00 mmol/L)浓度过高,大多数包埋珠变的过于坚硬,导致萌发率下降到90%以下。
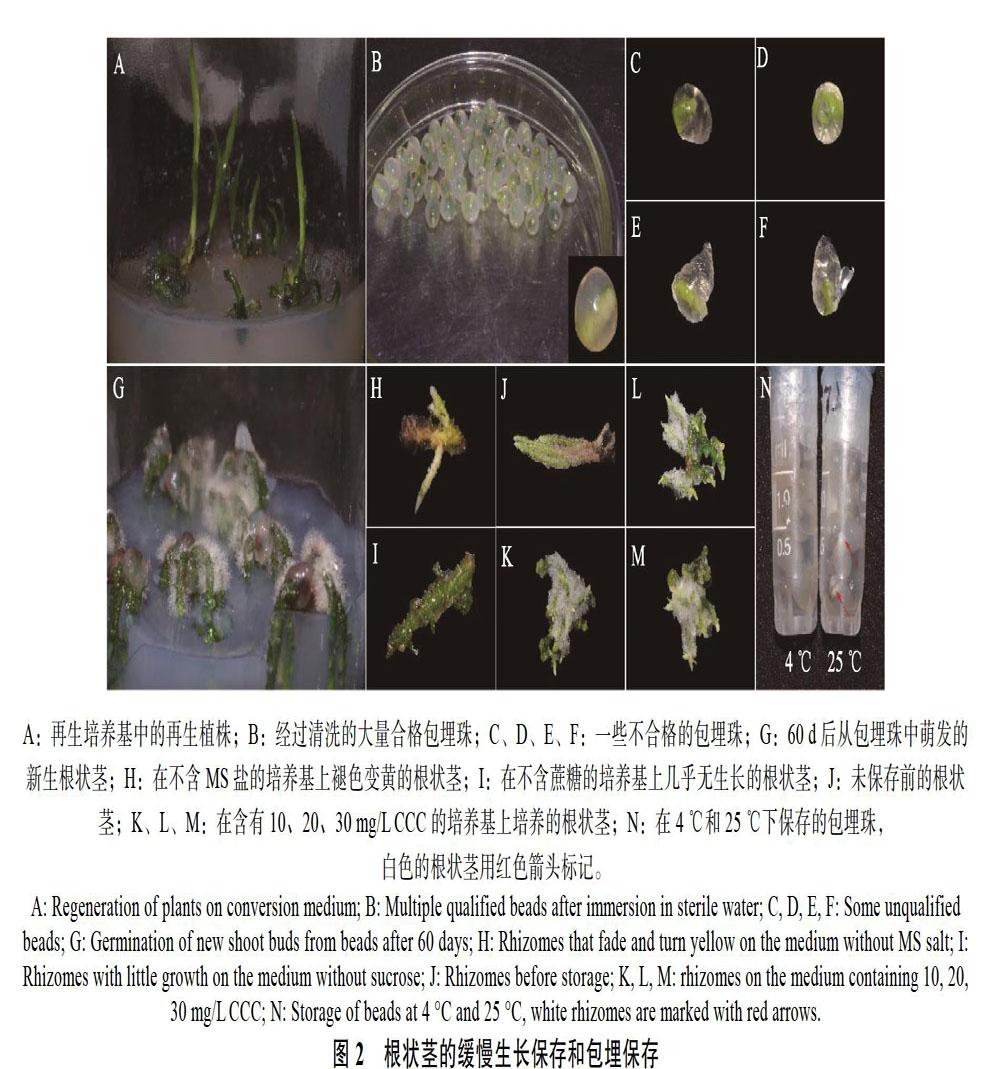
A:再生培养基中的再生植株;B:经過清洗的大量合格包埋珠;C、D、E、F:一些不合格的包埋珠;G:60 d后从包埋珠中萌发的新生根状茎;H:在不含MS盐的培养基上褪色变黄的根状茎;I:在不含蔗糖的培养基上几乎无生长的根状茎;J:未保存前的根状茎;K、L、M:在含有10、20、30 mg/L CCC的培养基上培养的根状茎;N:在4 ℃和25 ℃下保存的包埋珠,白色的根状茎用红色箭头标记。
以合格率优先,综合萌发率来看,以3.5%的SA和75.0 mmol/L CC的组合春兰根状茎包埋珠合格率和萌发率均值最大,分别为97.60%和92.00%(图2G),与3.5%的SA和100.0 mmol/L CC的组合差异不显著。
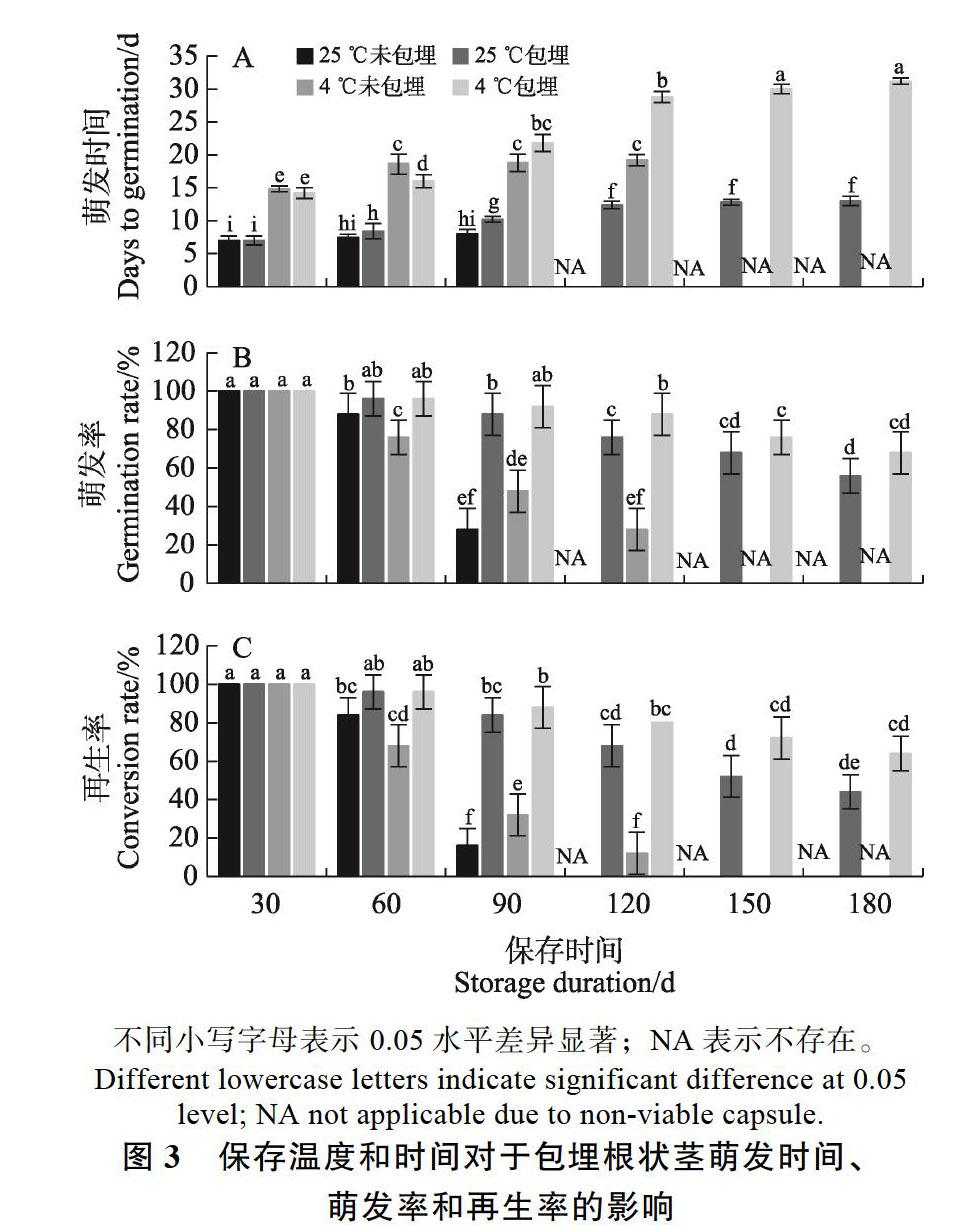
2.3 春兰根状茎包埋后保存
在180 d的保存时间里,随着保存时间的增加,所有处理萌发天数也随之延长,萌发率和再生率则逐渐下降,但4组之间的差异显著(图3)。25 ℃未包埋根状茎随着保存时间的延长,一些根状茎逐渐死亡,导致萌发率和再生率逐渐降低,直到120 d全部死亡(图3B)。而包埋根状茎在25 ℃保存,180 d后仍有存活,最终萌发率为56.00%,再生率稍有下降,为44.00%(图3B、C)。根状茎直接暴露于4 ℃,根状茎在低温下比在室温下可以保存稍长的时间,但150 d后仍全部死亡(图3B)。包埋根状茎在4 ℃下保存,180 d后仍有存活,但萌发时间也最长。然而,在此温度下保存的包埋根状茎180 d后萌发率和再生率最高,分别为68.00%和64.00%。
3 讨论
离体保存的植物材料在保存过程中生长、存活所需的营养主要依赖于培养基的供给,因此,通过降低培养基内的养分和水平,可以抑制组织的生长,从而达到中长期保存植物材料的效果[4]。如菠萝试管苗在MS、1/4 MS、无菌水3种培养基中保存1 a后,以1/4 MS培养基中保存效果最好,所用材料均能存活和再生[10];香青兰试管苗在1/4 MS培养基中前期存活率较低,但保存时间却延长了4个月以上[11]。春兰根状茎在1/2~1/8 MS盐的培养基中保存都能保持较稳定的存活率,但不同小写字母表示0.05水平差异显著;NA表示不存在。
在不含MS盐的培养基上,根状茎绿色逐渐褪去,呈枯黄色状态(图2H),存活率和再生率也有显著的下降,这表明MS盐对于其存活是必须的。文心兰试管苗保存时,向培养中添加30.0 g/L甘露醇能够有效延长文心兰试管苗继代间隔时间,保存12个月的存活率达80.00%[12]。红根草试管苗在无糖的培养基上植株形态和色泽差较差,但保存时间更长,继代后恢复正常[13]。前者主要是由于添加甘露醇或高浓度蔗糖增加了细胞的渗透势,使水分和养分吸收受阻,减少了营养消耗,从而提高了存活率[14];而后者是除去蔗糖这一重要的碳源,达到降低营养供给的效果。将春兰根状茎接种在不含蔗糖的培养基中,根状茎生长受到明显抑制,新生根状茎少且短(图2I),但存活率和再生率与其他处理无显著差异,是可行的方法。采用添加甘露醇的方法,当培养基中的蔗糖全部替换为甘露醇时,与其他三者相比存活率和再生率有显著下降,这表明此时的渗透压已对根状茎生长和存活造成不利影响,对比不含蔗糖培养基中根状茎的生长状况,在不添加蔗糖的同时减少甘露醇的含量或许能起到更好的效果。
在配制的缓慢生长保存培养基中,除1/10~ 0 MS和添加20 g/L甘露醇的培养基外,其他培养基都能起到很好的保存效果,这其中也包括对照培养基,这与培养基中不添加植物激素,减少其生长有一定的关系,同理,向培养基中添加生长抑制物,利用激素来延缓和抑制生长。CCC是一种广谱高效低毒的植物生长延缓剂,可抑制作物细胞伸长,但不抑制细胞分裂,能使植株变矮,杆茎变粗,抗逆性增强,被作为延缓剂广泛应用于种质保存中[12, 15]。如马铃薯离体试管苗的保存时,相较于脱落酸(ABA)和丁酰肼(B9)等,CCC抑制作用最明显,且合理浓度的矮壮素兼具增加马铃薯试管苗的叶片数,加粗茎段以及增多根系的作用[16]。根状茎在添加有CCC的培养基中,一个显著的特点是根毛的增多(图2J、K、L、M),这也一定程度上印证了CCC的作用特点。
在许多研究中发现,3.0%的SA溶液最适合包埋珠的制作以及后续供试材料的萌发,而高于此浓度的SA往往使得包埋珠过于坚硬,导致萌发率的显著下降[17-18]。然而,在本研究中,较高浓度的SA(3.5%)是可行的,除了能保证萌发率外,较高浓度的SA也有助于包埋珠的制作,这是因为大多数包埋珠的制作过程通常是通过将外植体混合到SA溶液中,然后用移液管等仪器将混合物滴入CC溶液来实现[19-22],而高浓度的SA使得溶液具有更高粘性,根状茎很容易被覆盖,从而使用镊子就可完成包埋过程,简化了步骤。
与SA一样,CC浓度对于合格包埋珠的形成和萌发也十分重要(经方差分析,二者对于春兰根状茎包埋珠合格率和萌发率影响均显著,数据未列出)。然而,不同于3%浓度的SA被广泛使用,CC的浓度(多为50.0~100.0 mmol/L)与不同的外植体类型相关[23]。如在石斛兰中,3.0%的SA和75.0 mmol/L的CC制成的类原球茎包埋珠萌发率为100%[8],在万珠兰和万代兰杂种类原球茎包埋中同样以此浓度为最优[7];但在印度娃儿藤中,其体胚的包埋则以50.0 mmol/L的CC为最优[24]。
与保存在4 ℃的包埋珠相比,保存在25 ℃的包埋珠大多存在根状茎自然萌发的现象,露出的根状茎在1~2个月后褪色(图2N),导致其完整性受损。而在低温下,外植体代谢活动受到抑制,以一种近乎静止的状态进行,可能更适合于外植体的保存[4, 25]。在贝母兰中,在4 ℃下保存60 d,包埋的类原球茎没有显示出萌发率的快速下降,25 ℃室温下稍差;而未包埋的类原球茎15 d即全部死亡,在室温下也同样如此[25]。然而,并非所有包埋保存的材料都适宜在4 ℃下保存,包埋保存的温度主要取决于物种,如万珠兰和万代兰杂种类原球茎包埋珠、罗勒茎尖包埋珠等则在25 ℃室温下保存更好[7, 26]。
4 结论
本研究以春兰根状茎为材料,利用缓慢生长保存和包埋保存的方法,对其进行了保存研究。结果表明,春兰根状茎在MS+10.0 g/L蔗糖+10.0 g/L甘露醇+7.5 g/L琼脂+1.0 g/L活性炭和MS+20.0 g/L蔗糖+7.5 g/L琼脂+1.0 g/L活性炭的培养基上保存12个月后,根状茎存活率最高,达84.00%,并且存活的根状茎均能再生。从经济层面考虑,在实际生产中建议将原培养基减少或去除激素,以达到减少继代次数降低成本的目的。利用3.5%(w/v)的SA,75.0 mmol/L CC制成的根状茎包埋珠合格率和萌发率达97.60%和92.00%。合格的包埋珠在4 ℃下保存180 d,萌发率和再生率最高,分别为68.00%和64.00%。此方法不需要过多复杂的操作、添置昂贵的设备及材料,并且便于处理和运输,在所述2种方法中可作为春兰根状茎保存的首选方法。
由于随保存时间延长瓶内培养基干涸的问题,缓慢生长保存中根状茎存活情况并未统计更长的时间,这个问题可能需要更多数量的处理和重复试验来解决。此外,保存后的遗传稳定性也需要分子试验来进一步验证。
参考文献
Park H Y, Kang K W, Kim D H, et al. In vitro propagation of Cymbidium goeringii Reichenbach fil. through direct adventitious shoot regeneration[J]. Physiology and Molecular Biology of Plants, 2018, 24(2): 307-313.
欧阳英. 几种兰科花卉的离体保存技术研究[D]. 北京: 北京林业大学, 2010.
Popova E, Kim H H. Cryobiotechnology of Korean orchid biodiversity: A case study using Cymbidium kanran[M]// Khasim S M, Hegde S N, González-Arnao M T. Orchid biology: Recent trends & challenges. Singapore: Springer Nature Singapore Pte Ltd, 2020: 119-135.
蘭 伟, 陈发棣. 植物种质资源缓慢生长法保存研究进展[J]. 阜阳师范学院学报(自然科学版), 2010, 27(2): 68-72.
叶秀仙, 黄敏玲, 樊荣辉, 等. 蝴蝶兰离体保存及其遗传稳定性研究[J]. 福建农业学报, 2014, 29(10): 976-981.
刘佩佩. 大花蕙兰‘幻影组培再生体系建立及离体保存技术研究[D]. 北京: 北京林业大学, 2008.
Gantait S, Bustam S, Sinniah U R. Alginate-encapsulation, short-term storage and plant regeneration from proto corm-like bodies of Aranda Wan Chark Kuan ‘Blue × Vanda coerulea Grifft. ex. Lindl. (Orchidaceae)[J]. Plant Growth Regulation, 2012, 68(2): 303-311.
Saiprasad G V S, Polisetty R. Propagation of three orchid genera using encapsulated protocorm-like bodies[J]. In Vitro Cellular & Developmental Biology-Plant, 2003, 39(1): 42-48.
Murashige T, Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue cultures[J]. Physiologia Plantarum, 1962(15): 473-494.
Zee F T, Munekata M. In vitro storage of Pineapple (Ananas spp.) germplasm[J]. Hortscience A Publication of the American Society for Horticultural Science, 1992, 27(1): 57-58.
兰 伟, 徐培培, 许树成. 香青兰的离体保存研究[J]. 热带作物学报, 2013, 34(4): 675-680.
叶秀仙, 黄敏玲, 吴建设, 等. 甘露醇和生长抑制剂对文心兰离体保存的影响[J]. 福建农业学报, 2011, 26(1): 76-82.
付传明, 赵志国, 黄宁珍, 等. 药用植物红根草种质资源的离体保存[J]. 广西植物, 2007(4): 653-657.
余 乐. 流苏、金钗、报春石斛种子非共生萌发以及流苏石斛离体保存的研究[D]. 重庆: 西南大学, 2009.
蒋泽平, 王福银, 徐招娣, 等. 火焰南天竹离体保存技术研究初报[J]. 江苏林业科技, 2010, 37(3): 6-8.
马海兰. 矮壮素、脱落酸、山梨醇、丁酰肼植物生长抑制剂对马铃薯种质离体保存的影响分析[J]. 南方农机, 2018, 49(5): 54.
Verma S K, Rai M K, Asthana P, et al. In vitro plantlets from alginate-encapsulated shoot tips of Solanum nigrum L.[J]. Scientia Horticulturae, 2010, 124(4): 517-521.
Rai M K, Jaiswal V S, Jaiswal U. Encapsulation of shoot tips of guava (Psidium guajava L.) for short-term storage and germplasm exchange[J]. Scientia Horticulturae, 2008, 118(1): 33-38.
Bhattacharyya P, Kumar V, Van Staden J. In vitro encapsulation based short term storage and assessment of genetic homogeneity in regenerated Ansellia africana (Leopard or chid) using gene targeted molecular markers[J]. Plant Cell, Tissue and Organ Culture, 2018, 133(2): 299-310.
Mishra J, Singh M, Palni L M S, et al. Assessment of genetic fidelity of encapsulated microshoots of Picrorhiza kurrooa[J]. Plant Cell, Tissue and Organ Culture, 2011, 104(2): 181-186.
Martin K P. Clonal propagation, encapsulation and reintroduction of Ipsea malabarica (Reichb. f.) J. D. Hook., an endangered orchid[J]. In Vitro Cellular & Developmental Biology-Plant, 2003, 39(3): 322-326.
Danso K E, Ford-Lloyd B V. Encapsulation of nodal cuttings and shoot tips for storage and exchange of cassava germplasm[J]. Plant Cell Reports, 2003, 21(8):718-725.
Gantait S, Vijayan J, Majee A. Artificial seed production of Tylophora indica for interim storing and swapping of germplasm[J]. Horticultural Plant Journal, 2017(3): 41-46.
Devendra B N, Srinivas N, Naik G R. Direct somatic embryogenesis and synthetic seed production from Tylophora indica (Burm. f.) Merrill an endangered, medicinally important plant[J]. International Journal of Botany, 2011, 7(3): 216-222.
Mohanraj R, Ananthan R, Bai V N. Production and storage synthetic seeds in coelogyne breviscapa Lindl[J]. Asian journal of biotechnology, 2009, 1(3): 124-128.
Saha S, Sengupta C, Ghosh P. Molecular and phytochemical analyses to assess genetic stability in alginate-encapsulated microshoots of Ocimum gratissimum L. following in vitro storage[J]. The Nucleus, 2014, 57(1): 33-43.
責任编辑:白 净

