高效液相色谱-串联质谱法测定蛋和奶中氨基糖苷类药物残留
栾枫婷 龚兰 朱磊 陈明 唐敏敏 邵雪梅 魏瑞成 王冉

摘要: 建立了高效液相色谱-串联质谱法测定蛋和奶中氨基糖苷类药物(双氢链霉素、卡那霉素A、庆大霉素、链霉素、妥布霉素、潮霉素B、大观霉素、阿米卡星、新霉素B和安普霉素)残留。用5%三氯乙酸水溶液提取目标物,经HLB固相萃取柱净化,高效液相色谱柱分离,梯度洗脱,外标法定量。结果表明,10种药物在各自范围内线性关系良好,R2>0.99,方法的检出限为10.0~50.0 μg/kg,定量限为30.0~100.0 μg/kg,平均回收率为62.3%~110.4%,相对标准偏差为1.0%~13.6%。该方法简便、准确、灵敏,且扩大了检测范围,适用于蛋和奶中氨基糖苷类药物的定量测定。
关键词: 高效液相色谱-串联质谱;固相萃取;氨基糖苷类药物;残留;禽蛋;奶
中图分类号: S859.84 文献标识码: A 文章编号: 1000-4440(2021)04-1033-10
Determination of aminoglycoside residues in eggs and milk by high-performance liquid chromatography-tandem mass spectrometry
LUAN Feng-ting1,2, GONG Lan1,2, ZHU Lei1,2, CHEN Ming1,2, TANG Min-min1,2, SHAO Xue-mei1,2,WEI Rui-cheng1,2, WANG Ran1,2
(1.Key Lab of Food Quality and Safety of Jiangsu Province-State Key Laboratory Breeding Base, Nanjing 210014, China;2.Institute of Food Safety and Nutrition, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract: The high-performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) was developed for the simultaneous determination of ten aminoglycosides (dihydrostreptomycin, kanamycin A, gentamycin, streptomycin, spectinomycin, tobramycin, hygromycin B, amikacin, neomycin B and apramycin) in milk and eggs. The samples were extracted with 5% trichloroacetic acid solution, followed by Oasis HLB solid phase extraction for further purification. The analytes were separated on a high performance liquid chromatography column, then analyzed by MS/MS with electrospray ionization in positive mode, and quantified by external standard method. Results showed that there were good linear relationships for 10 target analytes, and the linear correlation coefficients were greater than 0.99. The limits of detection and the limits of quantitation were in the ranges of 10.0-50.0 μg/kg and 30.0-100.0 μg/kg, respectively. The average recoveries for ten aminoglycosides ranged from 62.3% to 110.4% with relative standard deviations of 1.0%-13.6%. The developed method is simple, rapid, accurate, sensitive and has wide detection range, so it is suitable for the determination of ten aminoglycosides in eggs and milk.
Key words: high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS);solid phase extraction (SPE);aminoglycosides (AGs);residues;eggs;milk
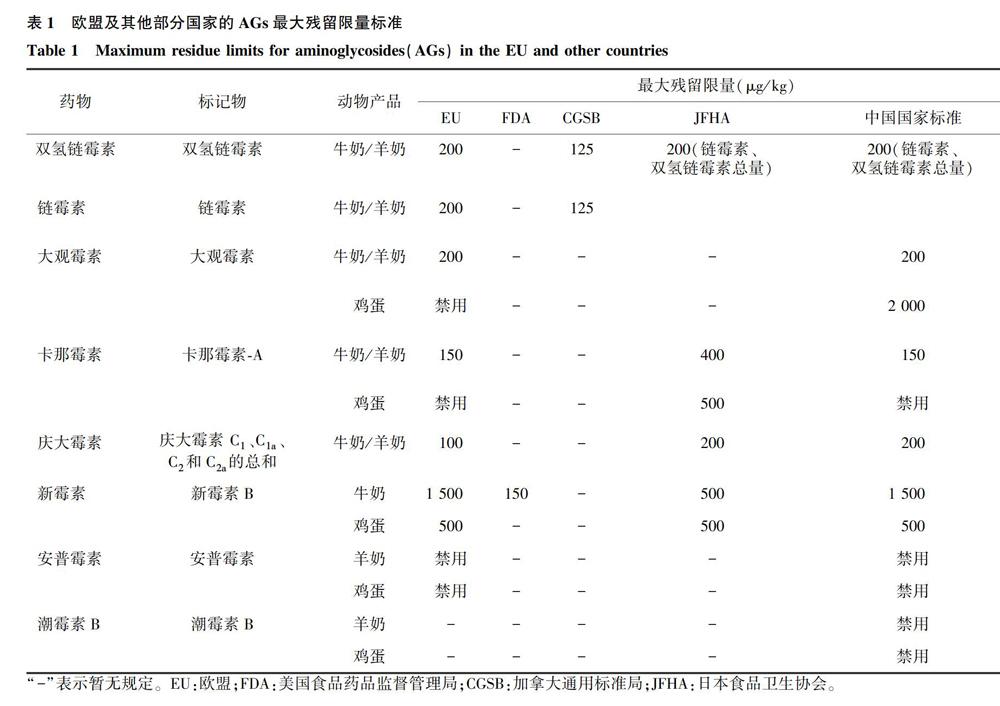
氨基糖苷類药物(Aminoglycosides,AGs)是通过氨基糖和氨基环醇以苷键结合而构成,主要作用是阻碍细菌的蛋白质合成,使细菌细胞壁的通透性发生变化,从而发挥抗菌作用。AGs因其价格低廉且具有广谱抗菌性,被广泛用于治疗和预防禽霍乱、奶牛乳腺炎及奶牛结核病等,还作为促生长剂提高饲料报酬率[1]。但该类药物长期食用后易蓄积于动物细胞、组织和器官中,食用这些动物产品后会损害人体健康。近年来,有文献报道AGs对人体具有显著的耳毒性、肾毒性且会损害前庭神经功能,严重时会导致休克,甚至死亡[2]。由农业农村部、国家卫生健康委员会和国家市场监督管理总局联合发布的食品安全国家标准《食品中兽药最大残留限量》(标准号:GB 31650-2019)中对蛋中5种药物及奶中7种药物的残留限量做出了相关规定,且欧盟(European Union, EU)在2010年发布的《动物源性食品中药物活性物质及其最大残留限量》中除潮霉素B外对其他9种药物的残留限量均有规定。除此之外,美国食品药品监督管理局(Food and Drug Administration, FDA)、加拿大通用标准局(Canadian General Standards Board, CGSB)和日本食品卫生协会(Japan Food Hygiene Association, JFHA)对AGs的最高残留限量(MRL)也有相关规定[2-3](表1)。
关于动物源食品中AGs残留的检测方法有微生物法、分光光度法、发光分析法、免疫分析法、色谱分析法、电化学分析法等,其中微生物法和分光光度法易受条件限制,且操作繁琐,灵敏度低,重现性差[4]。随着生物技术的快速发展,基于抗体的免疫分析法通过特异性生物识别元件,能够提高检测灵敏度,且缩短检测时间,但获取高灵敏度的抗体难度高[2]。虽然液相色谱的紫外检测器和荧光检测器具有高灵敏度、宽线性范围以及定量准确等优势,但不能测定某些无荧光基团或弱紫外吸收的AGs(如庆大霉素、卡那霉素A和链霉素等)[1]。近年来,由于高效液相色谱-串联质谱检测方法能定量准确、灵敏度高、抗背景干扰能力强以及无需衍生等特点而得到广泛应用[5],但多数研究中使用离子对试剂及高浓度盐,且操作繁复,损伤仪器和色谱柱性能,不利于批量化检测和实际操作[6-10]。除此之外,国内已制定的由中华人民共和国国家质量监督检验检疫总局和中国国家标准化管理委员会联合发布的《奶粉和牛奶中链霉素、双氢链霉素和卡那霉素残留量的测定 液相色谱-串联质谱法》(标准号:GB/T 22969-2008)中蛋和奶的品种及待测药物种类覆盖不全,无法同时测定10种AGs。因此,为保障农产品质量安全和人类健康,亟待建立蛋和奶中AGs残留量检测的标准方法。
本研究考察了蛋和奶的前处理方法,且优化了目标物的色谱分离条件及质谱测定条件,确立了测定蛋和奶中10种AGs的液相色谱-串联质谱法。该方法覆盖畜禽养殖行业中常用的10种AGs,无需使用离子对试剂及高浓度盐检测蛋和奶中目标化合物的含量,结果准确、可靠、杂质干扰小,为相关部门的监管提供技术支撑。
1 材料与方法
1.1 试验材料
Arium Pro超纯水系统,德国Sartorius公司产品;ME104E万分之一电子分析天平,瑞士Mettller-Toledo集团产品;VORTEX 3涡旋混匀器,德国IKA公司产品;5810R高速冷冻离心机,美国Epppedorf公司产品;KQ-500E型超声波清洗机,昆山超声波仪器有限公司产品;N-EVAP-24型氮吹仪,美国Organomation公司产品;Oasis HLB固相萃取小柱(填料质量为200 mg,柱体积为6 ml),美国Waters公司产品;滤膜(孔径为0.22 μm)购自南京大沪科技仪器有限公司;Acquity UPLC BEH Amide 色谱柱(粒径为1.7 μm,柱长×内径为100.0 mm×2.1 mm),美国Waters公司产品;高效液相色谱-三重四极杆-串联质谱联用仪(SCIEX Triple QuadTM 6500+),美国SCIEX公司产品。
本试验所用标准物质(表2)均购于德国Dr.Ehrenstorfer公司,10种AGs含量均≥89.0%。
色谱级异丙醇,德国Merck公司产品;色谱级乙腈和甲醇,美国Honeywell公司产品;色谱级甲酸和乙酸铵,意大利阿拉丁科技有限公司产品;分析纯氨水、三氯乙酸和甲醇,国药集团化学试剂有限公司产品。
试验所用鸡蛋、鸭蛋、鹌鹑蛋、牛奶、羊奶均购于市场。
1.2 标准溶液配制
标准储备液(0.5 mg/ml)的配制:准确称取适量标准品于50 ml聚丙烯容量瓶中,用水溶解后定容,配制成标准储备溶液。储备液置于圆形广口聚丙烯瓶中,2~8 ℃保存,有效期为30 d。
混合标准中间液(50 μg/ml)配制:分别移取5.0 ml标准储备液置于50 ml聚丙烯容量瓶中,用甲酸∶异丙醇∶0.002 mol/L乙酸铵水溶液(10∶5∶85,体积比,pH=0.80)定容至50.0 ml,有效期为7 d。
混合标准工作液配制:移取0.01~2.00 ml混合标准中间液,置于50 ml聚丙烯容量瓶中,用甲酸∶异丙醇∶0.002 mol/L乙酸铵水溶液(10∶5∶85,体积比,pH=0.80)稀释成10~2 000 ng/ml混合标准工作液,有效期为7 d。
1.3 样品前处理
准确称取2.00 g样品于50 ml离心管内,加入20 ml 5%三氯乙酸提取,涡旋混匀,振荡15 min,10 000 r/min离心5 min,转移上清液,用氨水调节上清液pH至7.5±0.2,作为备用液。
HLB固相萃取柱预先用5 ml甲醇、水活化,取备用液全部过柱,用水和5%甲醇水溶液各3 ml依次淋洗,抽干。准确加入2.0 ml甲酸∶异丙醇∶0.002 mol/L乙酸铵水溶液(10∶5∶85,体积比,pH=0.80)洗脱并收集,涡旋混匀后,经0.22 μm滤膜过滤后,供高效液相色谱-串联质谱仪测定。
1.4 仪器条件
色谱条件:色谱柱为ACQUITY UPLC BEH Amide (粒径为1.7 μm,柱长×内径为100.0 mm×2.1 mm ),柱温为40 ℃,流速为0.3 ml/min;进样量为5.0 μl。流动相A为1%(体积分数)甲酸(混有0.002 mol/L乙酸铵),流动相B为1%(体积分数)甲酸乙腈(混有0.002 mol/L乙酸铵)。梯度洗脱程序为0~2.5 min,20%流动相A;2.6~4.0 min,20%~65%流动相A;4.1~5.5 min,65%~90%流动相A;5.6~6.7 min,90%流动相A;6.8~7.5 min,90%~20%流动相A;7.6~12.0 min,20%流动相A。
质谱条件:电喷雾电离(Electron Spray Ionization, ESI),正离子模式,气帘气为30 V,碰撞气为8 V,离子源电压为5 500 V,离子源温度为550 ℃,雾化气压力为448.2 kPa,辅助加热气压力为413.7 kPa。扫描方式:多反应监测模式,母离子、子離子、去簇电压(Declustering Potential, DP)和碰撞能量(Collision Energy, CE)见表2。
2 结果与分析
2.1 质谱条件优化
在正离子模式下,取质量浓度为200 ng/ml的AGs混合标准溶液,在质荷比为300~650的条件下用一级质谱扫描目标物,依次选取10种AGs的母离子,并通过优化传输电压确定目标物的最优离子源去簇电压。在最优去簇电压下,采取不同的碰撞能量,用二级质谱扫描10种AGs的母离子,在主要离子碎片中选取高离子丰度、干扰小的离子碎片作为目标化合物的定量离子以及定性离子,最佳质谱条件见表2。结果表明,庆大霉素(GTC)为多组分抗生素,由C1、C1a、C2 3种抗菌活性基本相同的同分异构体组成,本方法采用GTC C1作为定量标记物。
2.2 色谱条件优化
2.2.1 色谱柱的选择 AGs含有羟基、氨基等极性基团,徐丽佳等[6]、Frederique等[9]、龔强等[11]分别在流动相中添加了20 mmol/L、3 μmol/L、2 mmol/L七氟丁酸,离子对试剂与极性基团形成稳定的疏水性离子可增强目标物的保留,但离子对试剂与色谱柱的固定相结合产生不可逆吸附,影响填料活性位点,缩短色谱柱寿命。除此之外,为增强目标物在色谱柱上的保留时间及改善峰型和拖尾现象,戴辉等[7]、Feng等[12]在流动相中分别加入250 mmol/L、200 mmol/L甲酸铵,但其中高浓度盐的使用对液相系统使用后的冲洗要求高,易增加液相系统泵中活塞杆堵塞磨损的风险。因此,本研究在无离子对试剂和低盐浓度流动相的试验条件下,考察了OSAKA SODA SILICA、SiELC Obelisc R、BEH C18、HSS T3、BEH HILIC和BEH Amide 6种分析色谱柱对目标物与杂质的分离效果和灵敏度[8,13-14]。试验结果表明BEH Amide色谱柱内填料为酰胺基键合亚乙基桥杂化颗粒,随1%(体积分数)甲酸(混有0.002 mol/L乙酸铵)比例的增加,目标物被分离洗脱,峰型良好,出峰时间均晚于4 min,且对流动相系统无特殊的试剂要求,使用便捷。使用SiELC Obelisc R色谱柱时,微量醇类试剂会造成目标物峰形拖尾,对仪器管路系统要求高。此外,BEH C18、HSS T3、OSAKA SODA SILICA、BEH HILIC色谱柱对部分目标物无保留,出峰时间均小于2 min,杂质干扰大。因此,本试验选择BEH Amide分析色谱柱。
2.2.2 流动相体系的优化 研究设定当有机相为甲醇或乙腈,水相为乙酸铵缓冲溶液、甲酸水溶液和乙酸水溶液时,对比峰形、灵敏度以及分辨率的改变情况。结果表明,以0.002 mol/L乙酸铵水溶液作为水相,乙腈较甲醇洗脱目标物能力强,且在流动相体系中加入1%的甲酸有助于增强离子化程度并改善峰形,提高检测灵敏度,而当在有机相中加入0.002 mol/L乙酸铵时,稳定的酸性环境增强了对目标物的吸附洗脱能力,减少了拖尾现象,提高了仪器的响应值。但随着乙酸铵浓度逐渐增大,乙酸铵与目标物竞争电荷,影响目标化合物的电离,导致目标物响应值降低[15]。试验结果表明,当有机相为1%甲酸0.002 mol/L乙酸铵乙腈溶液时,目标物呈现良好峰形。
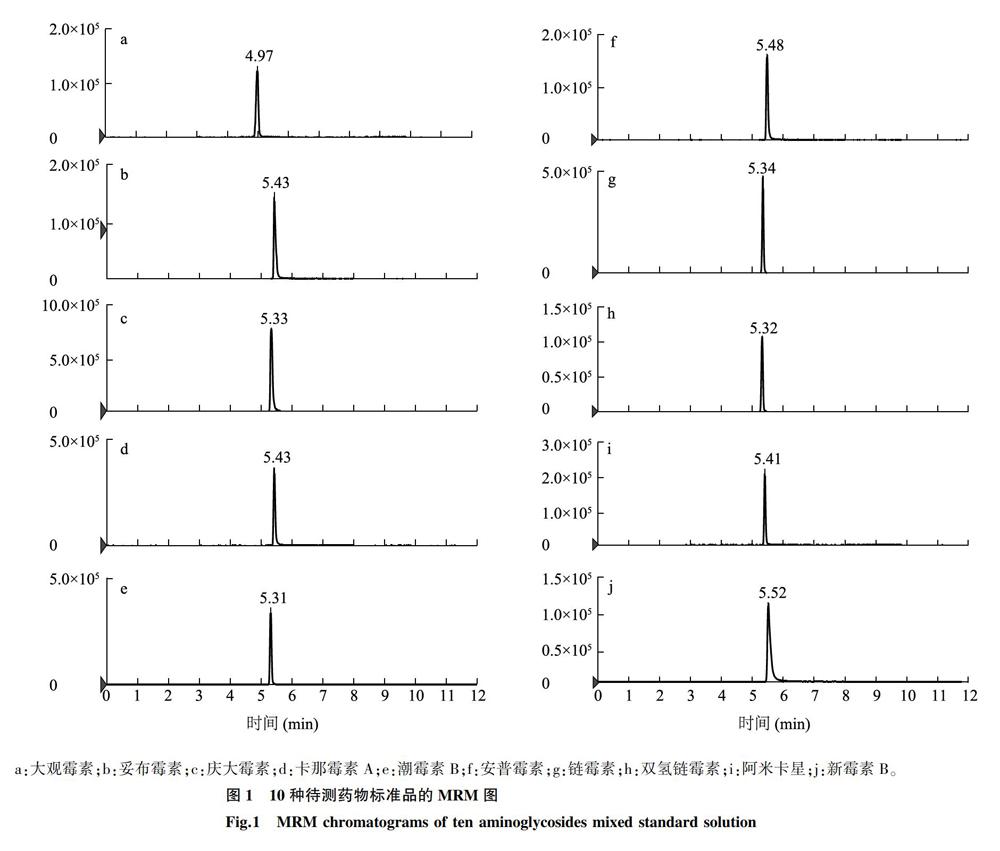
因此,本试验以1%甲酸0.002 mol/L乙酸铵水溶液和1%甲酸0.002 mol/L乙酸铵乙腈溶液作为流动相,梯度洗脱。由图1可以看出,质量浓度为200 μg/L的10种氨基糖苷类抗生素色谱具有较好的峰形,与徐丽佳等[6]、龚强等[11]的研究结果相比,本研究在无离子对试剂的试验条件下,优化流动相体系,保证了灵敏度高,不受杂峰的干扰。避免了质谱在负离子模式下,目标物与溶液中阳离子形成紧密的中性离子对,不能被检出且易累积,造成污染。
2.3 提取溶剂的选择
本试验选取磷酸盐缓冲溶液、乙二胺四乙酸二钠盐溶液和5%三氯乙酸等酸性溶液作为提取液,考察其对AGs的回收率。结果表明,经10 mmol/L磷酸盐缓冲溶液、0.4 mmol/L乙二胺四乙酸二钠盐溶液提取后的溶液浑浊且杂质较多,不利于后续净化,影响回收率。而5%三氯乙酸作为提取液,易于沉降样品中蛋白质,溶液澄清,10种目标物回收率为70.2%~80.5%。因此,选择5%三氯乙酸作为样品提取剂。
2.4 固相萃取条件的优化
2.4.1 不同固相萃取柱的选择 由于10种AGs属于碱性化合物,在标准号为GB/T 22969-2008的国家标准及万译文等[10]的方法中均在提取液中加入庚烷磺酸钠,并将其作为备用液通过固相萃取柱(Solid Phase Extraction, SPE)净化。除此之外,国家标准中使用2种固相萃取柱,净化步骤复杂。本研究为简化净化步骤,在避免使用离子对试剂的条件下,设计对比了WCX、PRiME HLB和HLB 3种不同类型SPE的回收率。结果表明,WCX对目标药物保留较少,经PRiME HLB净化浓缩,GTC、DSM、SPM、HGC、AKH的回收率均低于40%,且添加回收重现性低,而HLB对目标药物的含量保留稳定,回收率在65.1%~87.9%。因此,本研究选择HLB柱作为净化浓缩的SPE。
2.4.2 pH值对固相萃取效率的影响 通过固相萃取柱时,备用液的pH值会影响目标物的离子化程度及填料对目标物的吸附率。试验结果表明,pH≤5和pH≥9时,目标物均无法在HLB柱上保留,所以本试验考察了pH值在5.5、6.5、7.5、8.0、8.5条件下,5%三氯乙酸溶液为提取液时,HLB柱对10种目标物的回收率。图2和图3表明,当鸡蛋和牛奶基质的备用液pH为7.5时,目标药物在HLB柱上保留,回收率提高至68.1%~96.7%。因此,选择pH为7.5作为SPE上样溶液的pH值。
2.4.3 洗脱溶液的选择 AGs属于强极性化合物,为提高目标物在HLB的洗脱效率,本试验考察了纯水(A)、10%甲酸水溶液(B)、5%异丙醇水溶液(C)和甲酸∶异丙醇∶水(10∶5∶85,体积比)(D)4种洗脱液的效果。结果表明,异丙醇极性较强,在酸性水溶液中加入异丙醇提高了目标物在HLB柱上的洗脱效率,所以选取甲酸∶异丙醇∶水(10∶5∶85,体积比)洗脱目标物,鸡蛋和牛奶中10种AGs的回收率在60.9%~89.4%(图4),明显高于其他洗脱液。
由于洗脱液中水分含量高,为提高检测分析效率,本试验设计以洗脱液作为氨基糖苷类药物的上机溶液。结果表明,洗脱液的pH值对目标物的峰型有显著的影响。设计对比了2种洗脱液[甲酸∶异丙醇∶水(10∶5∶85,体积比)(D)和甲酸∶异丙醇∶2 mmol/ml乙酸铵水溶液(10∶5∶85,体积比,pH=0.80)(E)]的回收率,分别是60.6%~98.9%和73.6%~101.0%。洗脱液E对目标物回收率略有提高,且作为上机测定液时,APC和TBC的半峰宽更窄,上机响应值更高。因此,本研究选择甲酸∶异丙醇∶0.002 mol/L乙酸铵水溶液(10∶5∶85,体积比,pH=0.80)作为洗脱液及其洗脱后溶液作为上机测定液。
2.5 前处理方法的基质效应评估
ESI离子源易受到基质中蛋白质、脂肪、磷脂等物质干扰,产生基质效应。因此,为了准确定量目标物的含量,本研究设计评估前处理方法的基质效应。
本研究按照方法1.2的方法制备基质标准溶液,参照由原中华人民共和国卫生部发布的标准号为WS/T 356-2011的《基质效应与互通性評估指南》,根据空白基质中标准物质的峰面积(A)和溶剂标准物质的峰面积(B)的比值评估基质效应(ME),ME=A/B,若ME为0.8~1.2,则表明基质效应不明显。表3表明,在最佳前处理条件下,10种目标物中新霉素B(NMC)和潮霉素B(HGC)在禽蛋中基质效应不明显,其余8种药物在鸡蛋、鸭蛋、鹌鹑蛋中存在基质抑制或增强效应。在羊奶、牛奶中卡那霉素(KNM)、庆大霉素(GTC)、NMC、妥布霉素(TBC)、阿米卡星(AKH)和安普霉素(APC)的基质效应不明显,其余4种药物在牛奶、羊奶中存在基质抑制或增强效应。为了消除基质效应带来的定量偏差,本研究采用基质混合标准工作液进行定量。
2.6 蛋和奶中10种AGs的定量检测
选取未检出AGs的蛋和奶样品为空白基质,按方法1.3的方法配制10种AGs的基质系列标准溶液,通过10种AGs定量离子的峰面积和相应的质量浓度求出线性方程,分别选取3倍和10倍信噪比为检出限和定量限。结果(表4)表明,10种药物在各自的范围内线性关系较好,相关系数(R2>0.99),方法的检出限和定量限分别为10.0~50.0 μg/kg和30.0~100.0 μg/kg,满足标准号为GB 31650-2019的《食品中兽药最大残留限量》中对AGs的限量要求。
2.7 添加回收率和批内批间相对标准偏差
设计添加1倍、2倍、10倍定量限这3种质量浓度目标物于禽蛋和奶阴性样品中,考察添加目标物的回收率,且每种添加水平作6次重复,平均回收率及相对标准偏差见表5。结果(表5)表明,10种AGs的平均回收率均在62.3%~110.4%,批间和批内的相对标准偏差均在1.0%~13.6%。与叶磊海等[8]的研究结果相比,本方法更稳定且批间相对标准偏差均小于15%。除此之外,戴辉等[7]的研究中仅新霉素和潮霉素B的回收率满足要求,而本研究中10种AGs均可满足要求。
2.8 实际样品检测
为了进一步验证方法的可行性,应用所建立的方法对市售不同类型的20份蛋(鸡蛋、鸭蛋、鹌鹑蛋)和奶(牛奶、羊奶)进行检测,其中检测出1份鸡蛋中SPM的残留质量浓度为88.4 μg/kg,其余19份蛋和奶中均未检出。
3 结论
本试验中蛋和奶样品通过5%三氯乙酸溶液提取,经HLB柱净化,采用高效液相色谱-串联质谱检测10种AGs。该方法的检出限为10.0~50.0 μg/kg,定量限为30.0~100.0 μg/kg,回收率为62.3%~110.4%,批内和批间标准偏差为1.0%~13.6%。方法准确、灵敏、快速,扩展了相关国家标准中的检测对象和参数范围,同时避免使用离子对试剂,适用于实际操作,为行业监管提供了强有力的技术支持。
参考文献:
[1] 张 元,周 昱,周伟娥,等.食品中氨基糖苷类残留前处理及分析方法研究进展[J].食品工业,2016,37(4):223-227.
[2] 邵 杰,韦达理,曾 昆,等.食品中氨基糖苷类抗生素快速分析方法研究进展[J].江苏农业科学,2019,47(8):18-24.
[3] FATEN F, HASSAN M A, WILFRIED M N. Challenges in the determination of aminoglycoside antibiotics, a review[J]. Analytica Chimica Acta, 2015, 890: 21-43.
[4] 胡小莉,刘绍璞,罗红群,等.氨基糖苷类抗生素分析方法的研究进展[J].分析科学学报,2005,21(3):316-321.
[5] 李佩佩,龙 举,方 益,等.液相色谱法检测动物源食品中AGs残留的研究进展[J].理化检验(化学分册),2019,55(11):1356-1364.
[6] 徐丽佳,刘 笑,张秀芹,等.超高效液相色谱串联质谱法检测鸡蛋中残留的AGs[J].药物分析杂志,2016,36(2):301-305.
[7] 戴 辉,孟 晶,祖立青,等.基于HPLC-MS检测食品中新霉素和潮霉素B的残留量[J].山西农经,2016(18):97-98.
[8] 叶磊海,钟世欢,叶佳明,等.LC-MS-MS法同时测定动物肌肉组织和牛奶中10种AGs的方法优化研究[J].化工设计通讯,2016,42(12):107-108.
[9] FREDERIQUE L H, MARTIEN L E, PATRICK J M, et al. A generic method for the quantitative analysis of aminoglycosides (and spectinomycin) in animal tissue using methylated internal standards and liquid chromatography tandem mass spectrometry[J]. Analytica Chimica Acta, 2009, 637(1) :135-143.
[10]万译文,黄向荣,伍远安,等.固相萃取净化-高效液相色谱串联质谱法测定鱼肉制品中链霉素、双氢链霉素、卡那霉素的含量[J].现代食品科技,2018,34(8):255-259.
[11]龚 强,丁 利,朱绍华,等.高效液相色谱-串联质谱法检测乳制品中10种氨基糖苷类抗生素残留[J].色谱,2012,30(11):1143-1147.
[12]FENG J, SHE X, HE X, et al. Synthesis of magnetic graphene/mesoporous silica composites with boronic acid-functionalized pore-walls for selective and efficient residue analysis of aminoglycosides in milk[J]. Food Chemistry, 2018, 239: 612-621.
[13]钟名琴,黄 婷,吴雯娟,等.超高效液相色谱-串联质谱法同时测定动物肌肉组织中6种AGs残留[J].饲料博览,2019(5):1-6.
[14]陶大利,白 鹤,李 琴.SPE净化-液质联用测定AGs残留[J].中国乳品工业,2019,47(2):51-53.
[15]王钦钦.饲料中氨基糖苷类抗生素和地昔尼尔的测定[D].烟台:烟台大学,2019.
(责任编辑:陈海霞)
收稿日期:2020-01-15
作者简介:栾枫婷(1993-),女,江苏南京人,学士,研究实习员,主要从事畜禽产品质量安全研究。(Tel)025-84391617;(E-mail)245886650@qq.com
通讯作者:魏瑞成,(E-mail)rcwei79@jaas.ac.cn;王 冉,(E-mail)ranwang@jaas.ac.cn

