光激化学发光免疫分析系统检测传染病四项的性能评价
劳少杏 荣成智

摘要: 目的 验证和评价LiCA500光激化学发光免疫分析系统在HBsAg、Anti-HIV、Anti-HCV、Anti-TP检测中的性能,并评估其使用价值。方法 通过设计实验对LiCA500光激化学发光免疫分析系统进行精密度、线性范围、检出限/分析灵敏度及符合率等进行评价;并与安图A2000plus、雅培ARCHITECT-i2000SR进行符合度比较。结果 HBsAg、Anti-HIV、Anti-HCV、Anti-TP等的精密度、检测限、分析灵敏度均符合相关文件标准和厂家要求;定量项目HBsAg的回归方程为y = 1.0064x - 9.9246(r2=0.9955;a=1.0064);且LiCA500和安图、雅培的比较有较好的一致性,符合率>95%。结论 LiCA500初步评价各项性能良好,同时其分析样本需求少,携带污染低,适用于本实验室日常标本检测。
关键词: 光激化学发光;传染病四项;性能评价;方法学比对
【中图分类号】R51 【文献标识码】A 【文章编号】2107-2306(2021)06-025-02
传染四项病筛查检验技术从ELISA发展到现在各类化学发光免疫分析技术,检测的灵敏度和特异度均得到了很大的提升。科美诊断LiCA500免疫分析仪是基于光激化学发光(Light Initiated Chemilnescent Assay, LiCA)免疫分析技术的全自动免疫分析系统,可定量或定性检测血清、血浆中各类抗原或者抗体的成分。该技术来源于LOCI(Luminescent oxygen changneling immunoassay )技术,LOCI最初由Ullman等[1]在1994年报道,后由西门子生产出了免疫诊断试剂,国产光激化学发光免疫检测系统,是由上海博阳公司建立,也是LiCA500全自动免疫分析仪使用的配套试剂。为了评估该设备是否符合实验室的使用要求,需要在仪器的投入使用之前对该仪器进行必要的验证和评价。
1 材料与方法
1.1 标本来源:收集本院门诊和住院患者血清,包括阳性和阴性标本,阳性数值覆盖有低值与高值。
1.2 仪器与试剂:
1.2.1 仪器:科美LiCA500全自动光激化学发光免疫分析仪;安图A2000plus全自动磁微粒化学发光免疫分析仪;雅培ARCHITECT-i2000SR化学发光免疫分析仪
1.2.2 试剂及标准品:
LiCA500使用博阳生物科技(上海)有限公司生产试剂及配套校准品和质控品:HbsAg,批号1901;Anti-HIV,批号1902;Anti-HCV,批号1902 ; Anti-TP,批号1903。A2000plus 使用安图生物配套试剂:HbsAg,批号20190617;Anti-HIV ,批号20190702;Anti-HCV,批号20190516; Anti-TP,批号20190507。
ARCHITECT-i2000SR 使用雅培配套试剂:HbsAg,批号04383FN00;Anti-HIV,批号05527BE01;Anti-HCV,批号04539BE01;Anti- TP,批号05031BE01。北京康彻思坦生物有限公司校准物:Anti-HIV(2NCU/ml)批号201808003;Anti-HCV(0.5NCU/ml) 批号201902001;Anti- TP(0.5NCU/ml)批号201901001。
1.3 评价方法及标准
1.3.1 精密度評价 参考美国临床实验室标准化(CLSI)EP12-A[2]及EP15-A2[3]文件。按试剂说明书操作,检测博阳生物试剂配套高、低两个浓度水平的质控品,收集20次实验数据,计算均值、标准差和CV值。
1.3.2 检出限评价 参考WS/T 494-2017《临床定性免疫检验重要常规项目分析质量要求》[4]文件,将康彻思坦生物有限公司校准物Anti-HIV(2NCU/ml),Anti-HCV(0.5NCU/ml),Anti- TP(0.5NCU/ml)梯度稀释至厂商声明的检出限浓度(Anti-HIV 1 NCU/ml、Anti-HCV 0.16 NCU/ml和Anti- TP 0.25 NCU/ml),配置5份样本,重复检测,每个检测项目收集20份数据。
1.3.3 分析灵敏度评价 参考CLSI的EP17-A[5]文件。对博阳公司“零浓度”水平的校准品,在1次运行中重复测定10次, 计算检测结果的光信号均值(X)和SD。分析灵敏度采用空白光信号X±2SD对应的浓度值。
1.3.4 线性范围评价 参考CLSI 的EP6-A[6]文件,选择HbsAg对应的低浓度(L)和高浓度 (H) 标准品各一支,按要求稀释成5个浓度水平,每份样本平均检测4次,计算均值。以x为预期值,y为检测均值做线性回归,计算相关系数(r2)和斜率(a)。
1.3.5 不同方法学比较 参考CLSI的EP9-A2[7]文件。分别检测已知阴阳性的标本(阳性22例和阴性20例),其中阳性标本浓度涵盖弱阳性至高值阳性值。样本随机分成4组,分上下午检测,共两天完成。根据结果计算灵敏度、特异度、符合率等指标。
1.4 结果统计分析 检测数据使用Excel2019软件处理;仪器符合度分析使用软件SPSS25.0进行Kappa一致性检验,Kappa≥0.75,代表两比较者有较好的一致性。
2 结果
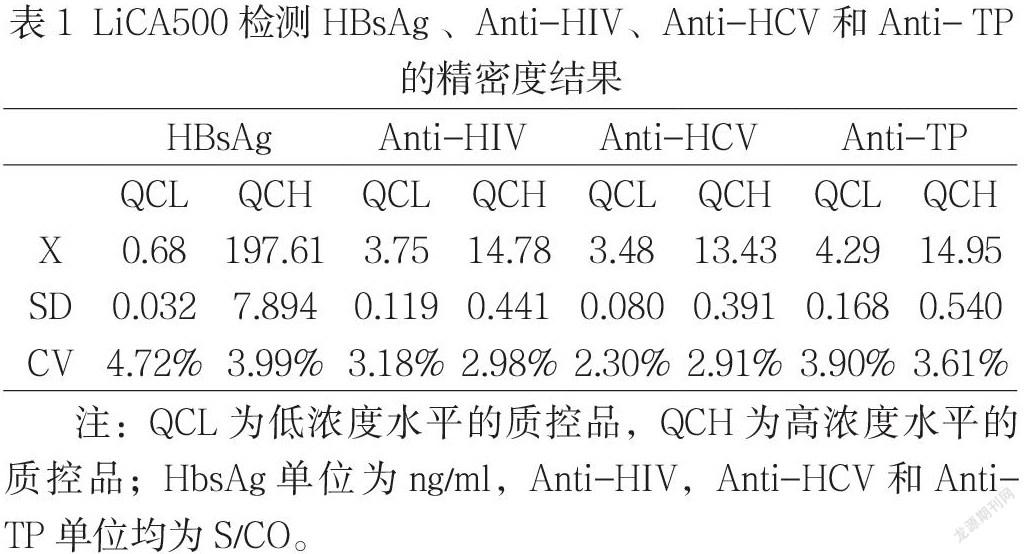
2.1 精密度评价 LiCA500检测HBsAg、Anti-HIV、Anti-HCV、Anti-TP精密度如表1所示。
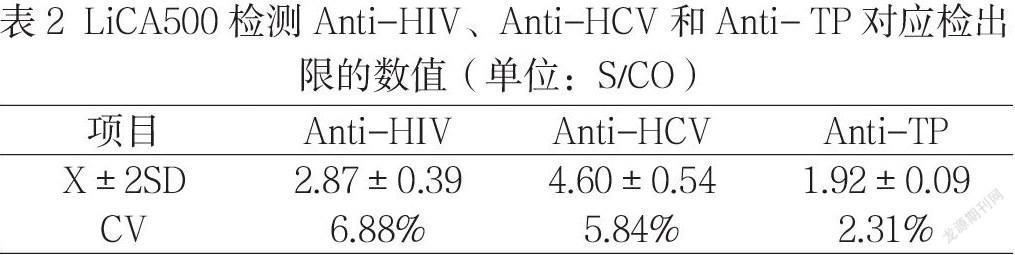
2.2 检出限评价 检测稀释后的康彻思坦生物有限公司校准物Anti-HIV,Anti-HCV和Anti-TP的结果均值分别为2.87S/CO、4.60S/CO和1.92S/CO,且所有样本均检测出阳性,见表2。
2.3 分析灵敏度评价 定量检测项目HBsAg检测结果的光信号X=313和SD=17.11;X+2SD=347.22,其对应的浓度为0.04ng/ml。因此HBsAg分析灵敏度为0.04ng/ml。
2.4 线性范围评价 HBsAg线性检测数值见表3,经计算,相关系数r2=0.9955;斜率a=1.0064,在0.95-1.05之间。检测回归方程为y = 1.0064x - 9.9246。
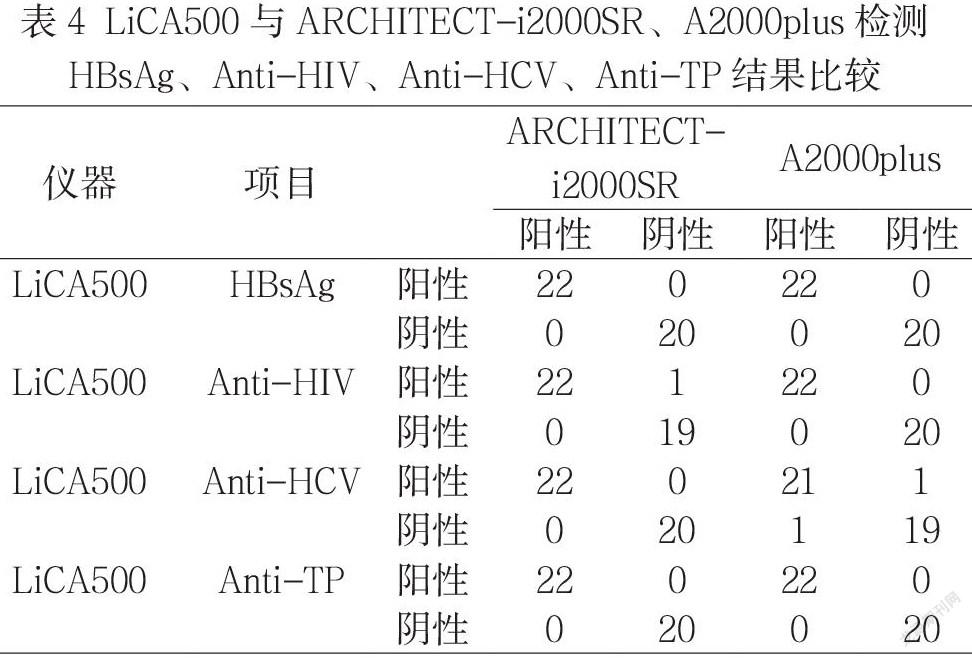
2.5 不同检测方法符合度分析 三台仪器分别检测HBsAg、Anti-HIV、Anti-HCV和Anti-TP的结果见表4。在HbsAg分析中,LiCA500、ARCHITECT-i2000SR和A2000plus的灵敏度和特异度均为100%;在Anti-HIV分析中,三台仪器的灵敏度均为100%,特异度 LiCA500和A2000PLUS为95%,ARCHITECT-i2000SR为100%;在Anti-HCV分析中,LiCA500和ARCHITECT-i2000SR的灵敏度和特异度为100%,而A2000plus的灵敏度为95.46%,特异度为95.00%;在Anti-TP分析中,三台仪器的灵敏度和特异度均为100%。LiCA500和ARCHITECT-i2000SR检测HbsAg的总符合率为100%,K=1;检测Anti-HIV的总符合率为97.62%,K=0.952;检测Anti-HCV的总符合率为100%,K=1;检测Anti-TP的总符合率为100%,K=1。LiCA500和A2000plus检测HbsAg的总符合率为100%,K=1;检测Anti-HIV的总符合率为100%,K=1;检测Anti-HCV的总符合率为95.24%,K=0.905;检测Anti-TP的总符合率为100%,K=1。
3 讨论
传染病原体乙型肝炎(HBV)病毒、艾滋(HIV)病毒、丙型肝炎(HCV)病毒、梅毒(TP)螺旋体的传播是威胁人们健康的公共卫生难题。大量资料表明上述疾病均可通过胎盘进行垂直传播,常规开展孕产妇传染病检测是做好孕产妇保健及早期胎儿疾病预防的必要前提[8]。在不同地区不同人群,HBV、HIV、HCV和TP的感染风险和阳性率是不一样的,其中孕产妇的HBV感染率可达9.83%,而由母婴传播的乙肝可高达30%~50%[9,10]。检验环节是孕产妇筛查及应对治疗措施的关键点,因此,要求HBV、HIV、HCV和TP的检测方法學具有高灵敏度及高特异度,以满足临床检测的需求。
在对LiCA500精密度评价中可知HBsAg、Anti-HIV、Anti-HCV和Anti-TP的总CV值均小于厂家规定的变异系数CV≤15%的要求,而且本次的CV5%,检测结果相对稳定。在徐少华等[11],荣杨等[12] 对LiCA免疫技术检测HbsAg、AFP和CEA的精密度评价中,其结果与本次结论相同,可见LiCA免疫技术精密度是符合临床样本检测要求。
根据仪器项目检测方式的不同,HbsAg为定量分析,Anti-HIV、Anti-HCV和Anti-TP为定性分析,因此本次HBsAg进行分析灵敏度分析,Anti-HIV、Anti-HCV、Anti-TP进行检测限分析。结果可知HBsAg分析灵敏度为0.04 ng/ml,检测结果与张阳根等[13]结果一致,均符合厂家规定的≤0.05ng/ml要求。在检测限分析中,博阳生物科技有限公司规定其Anti-HIV、Anti-HCV、Anti-TP的检测限分析分别为≤ 1NCU/ml,≤ 0.2NCU/m l和≤ 0.5NCU/ml,本次检测在规定的要求下均能有阳性反应。
在仪器的线性分析上,本次检测的线性范围r2=0.9955;斜率a=1.0064,a在0.95-1.05之间,仪器线性良好,能有效的确保了检测范围内结果的准确性。初步评价,检测结果均符合厂家的要求,检测结果总体满意,与同类检测系统有相近的检测水平[14]。
在LiCA500符合度分析上,本次用LiCA500、雅培ARCHITECT-i2000SR和安图A2000plus共同检测42例标本,三台仪器在HBsAg、Anti-HIV、Anti-HCV和Anti-TP符合率分析中均有较好的一致性,Kappa>0.75。
但是在Anti-HIV检测中发现LiCA500和A2000plus均出现了1例假阳性,且两者的S/CO均小于5,考虑为三台仪器间不同方法学差异造成。首先从原理上来看,雅培ARCHITECT-i2000SR和安图A2000plus均采用磁微粒化学发光技术,但是在免疫标记物上又有区分,雅培ARCHITECT-i2000SR为直接化学发光,A2000plus为酶促化学发光;而LiCA500的光激化学发光技术是通过将两种微粒表面包被的抗原或抗体,在液相中形成免疫复合物而将两种微粒拉近,在激光的激发下,使微粒之间的离子氧转移,进而产生高能级的红光,通过单光子计数器和数学拟合将光子数换算为靶分子浓度。其次根据相关研究对HIV化学发光检测结果的S/CO阳性率验证发现,S/CO>15才是HIV诊断的最佳临界点,而S/CO值越小假阳性率也会越高[15]。所以三台检测敏感性存在差异是可以接受的。就本次比对而言LiCA500相对雅培ARCHITECT-i2000SR的检测灵敏度高,假阳性率也相对增大,但作为日常临床标本初筛是适用的,能减少可疑标本的漏检。
LiCA500与科室在用的安图A2000plu比较,存在以下优势:其一,LiCA500单个检测项目需要样本量少(LiCA500最多为25ul,A2000plus最多为165ul),更加适用于标本较少的新生儿标本检测,从临床角度来看则能减少患者的抽血量,减轻患者痛苦。其二,由于仪器检测使用一次性TIP枪头,全程无清洗,也无磁珠微粒反应性步骤,并且具有避免HOOK效应的专利,因此携带污染的因素相对较少,仪器使用及保养也相对简单。毕竟,妇幼医院检测标本以新生儿和孕产妇的为主,两者血清中容易存在干扰性物质,如高水平胆红素、高甘油三酯等,检测过程中减少干扰是科室比较看重的。
综上所述,虽然有研究[16-17]表示LiCA免疫分析技术在某一些项目的检测上优于目前市面上使用的酶联免疫技术、电化学发光技术和化学发光技术,具有极为广阔的临床、科研应用前景。但是每种分析技术的使用,又受到了試剂和检测仪器研发的限制,每个方法都有其独特的方面。目前在临床标本的检测上,推荐多种方法学的联合检测,才能有效的弥补各方法学、各仪器间的不足,以提高项目检测的灵敏度和特异度[18]。本研究对LiCA500初步评价,光激化学发光免疫分析技术具有高通量,操作简单,背景干扰少,样本消耗少,灵敏度和特异度高等特点,各项结果均符合产家的要求,同时与目前在用的国内外仪器比对,总体符合率良好,可以用于临床标本检测。
参考文献:
[1] Ullman E F, Kirakossian H, Singh S, et al. Luminescent oxygen channeling immunoassay: measurement of particle binding kinetics by chemiluminescence[J]. Proc Natl Acad Sci U S A, 1994, 91(12):5426-30.
[2] CLSI. User Protocol for Evaluation of Qualitative Test Performance; Approved Guideline:EP12-A [S]. Wayne, Pennsylvania CLSI, 2002.
[3] CLSI. User demonstration of performance for precision and accuacy approved guideline-sacond edition:EP15-A2 [S]. Wayne, PA: CLSI, 2004.
[4]中华人民共和国国家卫生和计划生育委员会.临床定性免疫检验重要常规项目分析质量要求[C].中华人民共和国卫生行业标准,WS/T 494-2017.
[5]CLSI. Protocols for determination of limits of detection and limits of quantitation; approved guideline-second edition [S]. EP17-A, CLSI, 2004.
[6]CLSL.Evaluation of the linearity of quantitative measurement procedures; a statistical approach; approved guideline[S]. EP6-A, CLSI, 2004.
[7]CLSI. Method comparison and bias estimation using patient samples, approved guideline-sacond edition:EP9-A2 [S]. Wayne, PA,USA: CLSI, 2010.
[8]李庆. 孕妇产前四项传染病指标检测结果的分析[J]. 中华实验和临床感染病杂志(电子版), 2014, 8(02):98-100.
[9]祁慧, 徐志明. 5477例孕产妇四种血源性传染病检测结果分析[J]. 医学检验与临床, 2018, 29(6):43-45.
[10] 覃清华, 谢小花, 张华, 等. 2011-2016年广西孕产妇艾滋病、梅毒和乙肝血清学监测分析 [J].中国健康教育, 2018, 34(1):10-13.
[11] 涂少华, 朱敏, 沈江帆. 光激化学发光法检测乙型肝炎病毒感染血清学标志的性能评价[J]. 检验医学, 2011, 26(07):452-456.
[12] 荣扬, 赵强元, 刘敏, 等. 光激化学发光法定量测定AFP和CEA的性能评价[J]. 检验医学, 2013, 28(02):146-149.
[13] 张阳根, 胡桂华, 黄林江. Lica光激化学发光免疫分析系统检测乙肝两对半的性能评价[C]. 第五次全国免疫诊断暨疫苗学术研讨会, 2011:4.
[14] 刘立民, 李钰, 蒙雨明, 等. 化学发光微粒免疫分析技术检测输血四项的性能评估[J]. 现代检验医学杂志, 2015, (2):107-110.
[15] 罗娜, 张劲丰, 苏荣, 等. 雅培化学发光法检测HIV的S/CO比值与确证试验的相关性分析 [J]. 中国卫生检验杂志, 2017, 27(19):2794-2796.
[16] 贺安. 癌胚抗原和神经元特异性烯醇化酶光激化学发光免疫分析试剂的研制[D]. 南方医科大学, 2011.
[17] 颜露, 赵晓航, 许杨. 均相光激化学发光免疫分析技术研究进展[J]. 生命科学, 2016, 28(09):1083-1088.
[18] 邓飞, 韩惠云, 来祝檩. 不同ELISA试剂检测传染病四项弱反应性结果的比较[J]. 中国卫生产业, 2018, 15(24):162-163.

