老年2型糖尿病患者合并肌少症的情况及影响因素分析▲
戚艳艳 郑 欣 毕丽娜 胡 苏 赵 丹 佟艳铭
(中国康复研究中心北京博爱医院内分泌科,北京市 100068,电子邮箱:qyy123@126.com)
肌少症是与增龄相关的,以肌量减少、肌肉强度下降或功能减退为特征的综合征,是老年衰弱的主要表现之一,严重影响老年人的生活质量[1]。随着我国人口老龄化的加速,肌少症及其相关并发症是我国老年人群面临的重要健康问题。研究显示,糖尿病患者发生肌少症的风险是正常人群的3倍,糖尿病合并肌少症可增加残疾发生率和死亡风险,严重威胁老年糖尿病患者的健康[2]。在老年糖尿病患者中,改善肌少症被认为是长期康复需求的初级阶段,适当的评估和干预,对于维持患者的日常生活能力非常重要[3]。本研究旨在了解老年2型糖尿病(type 2 diabetes mellitus,T2DM)患者合并肌少症的情况,分析相关影响因素,从而为防控老年糖尿病患者的肌少症提供依据。
1 资料与方法
1.1 临床资料 选取2018年7月至2019年10月中国康复研究中心内分泌科收治的老年T2DM患者共287例作为研究对象。纳入标准:患者符合1999年世界卫生组织定义的T2DM诊断标准[4]。排除标准:1型糖尿病、糖尿病急性并发症、急慢性感染、严重心肺肝肾功能不全、甲状腺疾病、肿瘤、精神疾病、激素及维生素补剂服用者及长期卧床患者。287例患者年龄60~89(69.53±7.50)岁,男性133例,女性154例。本研究通过医院医学伦理委员会审核批准(No.2014CZ-27),研究对象均签署知情同意书。
1.2 方法 以下指标的检测及资料收集均在治疗前进行。
1.2.1 收集一般资料:收集受试者的性别、年龄、糖尿病病程、身高、体重、腰围,计算体质指数,体质指数=身高/体重2(kg/m2)。
1.2.2 生化指标检测:禁食过夜至少8 h后采集肘静脉血8 mL,应用全自动生化分析仪(中国迈瑞公司,型号:BS-2000M)检测空腹血糖、总胆固醇、HDL、LDL、三酰甘油、游离脂肪酸(free fatty acid,FFA)、血尿酸,应用糖化血红蛋白分析仪(日本TOSOH公司,型号:HLC-723G8),采用离子交换高效液相色谱法检测糖化血红蛋白(hemoglobin A1c,HbA1c),应用化学发光检测器(美国Abbott公司,型号:I2000SR)检测空腹C肽,应用电化学发光免疫分析仪(瑞士Roche公司,型号:Cobas e401)检测25-羟基维生素D[25-hydroxyvitamin D,25-(OH)D]。
1.2.2 身体成分测定:应用双能X线吸收检测仪(美国Hologic公司,型号:Discovery Wi),采用双能X线吸收法测量四肢骨骼肌含量(appendicular skeletal muscle mass,ASM)、骨矿含量、脂肪组织含量、体脂百分比(Fat%)。四肢骨骼肌质量指数(appendicular skeletal muscle mass index,ASMI)=ASM/身高2(kg/m2)。
1.2.3 肌肉力量和功能测定:应用握力计(中国CAMRY公司,型号:EH101),采用握力法测量优势手肌肉力量,重复测量3次取最大值,计量单位为千克(kg)。肌肉功能以4 m常规步速为测量指标,重复测量2次取平均值。
1.2.4 肌少症诊断标准[5]:采用亚洲肌少症工作组制订的肌少症诊断标准。(1)肌肉质量减少(通过双能X线吸收法测量,男性ASMI<7.0 kg/m2,女性ASMI<5.4 kg/m2);(2)肌肉力量下降(根据握力评估,男性<26 kg,女性<18 kg);(3)肌肉功能下降(步速<0.8 m/s)。符合条件(1)和条件(2)或(3)即可诊断为肌少症。
1.2.5 体力活动水平调查:采用国际体力活动问卷(International Physical Activity Questionnaire,IPAQ)[6]评估受试者1周内体力活动水平。依据评分结果,将患者体力活动水平分为高、中和低3个级别。
1.3 统计学分析 采用SPSS 25.0软件进行统计学分析。符合正态分布的计量资料以(x±s)表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料以[M(Q)]表示,比较采用Mann-Whitneyu检验;计数资料以例数(百分比)表示,比较采用χ2检验;采用Logistic回归分析影响T2DM患者合并肌少症的因素。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同性别老年T2DM患者合并肌少症的情况 287例老年T2DM患者合并肌少症的发生率为21.25%(61/287),其中女性为24.03%(37/154),男性为18.05%(24/133),不同性别T2DM患者合并肌少症的发生率差异无统计学意义(χ2=1.525,P=0.217)。
2.2 不同性别的老年T2DM患者合并肌少症与不合并肌少症肌肉力量及身体成分的比较 男性、女性合并肌少症患者的ASMI、握力均低于不合并肌症少患者(均P<0.05),女性肌少症患者的步速低于不合并肌少症患者(P<0.05),见表1。

表1 合并肌少症与不合并肌少症老年T2DM患者肌肉力量及身体成分的比较(x±s)
2.3 合并肌少症与不合并肌少症的老年T2DM患者临床资料及体力活动水平的比较 男性合并肌少症的老年T2DM患者年龄、空腹血糖高于不合并肌少症的老年T2DM患者,糖尿病病程长于不合并肌少症的老年T2DM患者,体质指数、腰围、骨矿含量低于不合并肌少症的老年T2DM患者;女性合并肌少症的老年T2DM患者年龄、HbA1c高于不合并肌少症老年T2DM患者,糖尿病病程长于不合并肌少症老年T2DM患者,体质指数、Fat%、骨矿含量、25-(OH)D、空腹C肽水平低于不合并肌少症老年T2DM患者(P<0.05),见表2、3。男性、女性合并肌少症患者体力活动水平低于不合并肌少症老年T2DM患者(u=2.735,P=0.003;u=5.093,P<0.001),见表4。
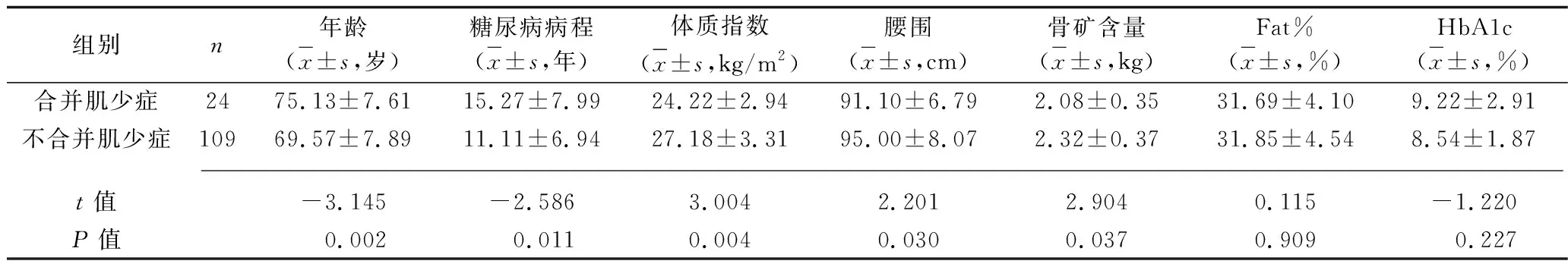
表2 合并肌少症与不合并肌少症的男性老年T2DM患者临床资料的比较
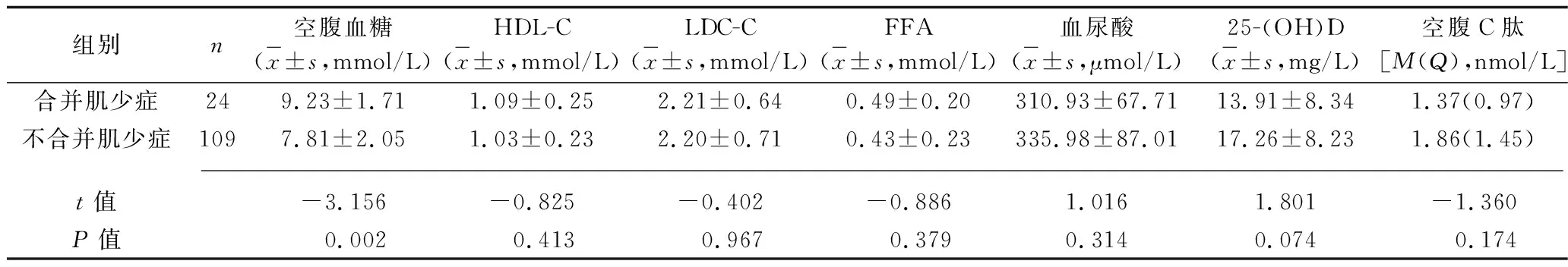
组别n空腹血糖(x±s,mmol/L)HDL-C(x±s,mmol/L)LDC-C(x±s,mmol/L)FFA(x±s,mmol/L)血尿酸(x±s,μmol/L)25-(OH)D(x±s,mg/L)空腹C肽[M(Q),nmol/L]合并肌少症249.23±1.711.09±0.252.21±0.640.49±0.20310.93±67.7113.91±8.341.37(0.97)不合并肌少症1097.81±2.051.03±0.232.20±0.710.43±0.23335.98±87.0117.26±8.231.86(1.45) t值-3.156-0.825-0.402-0.8861.0161.801-1.360P值 0.002 0.413 0.967 0.3790.3140.074 0.174
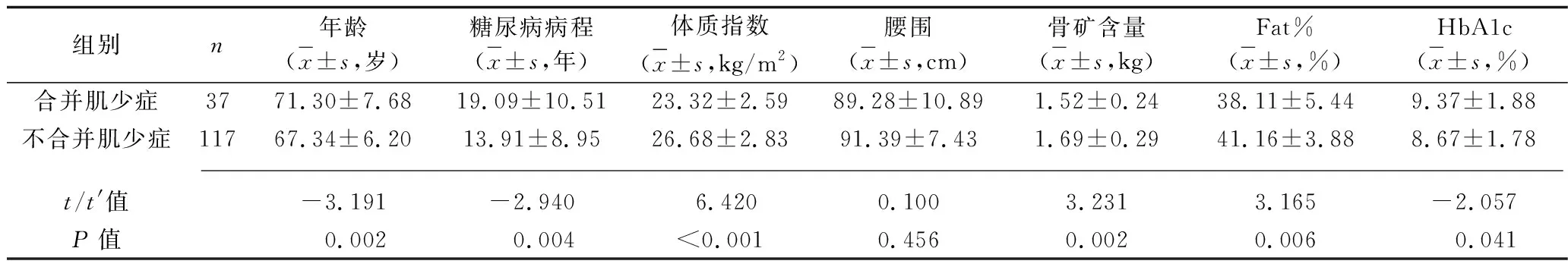
表3 合并肌少症与不合并肌少症的女性老年T2DM患者临床资料的比较
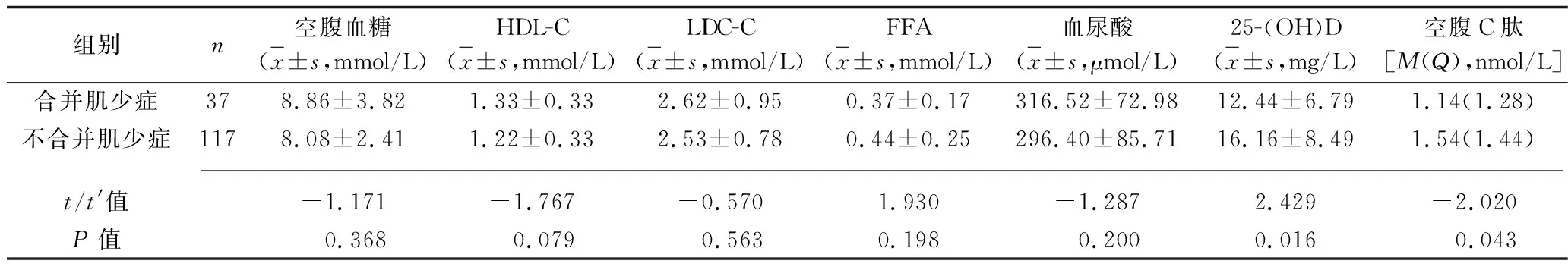
组别n空腹血糖(x±s,mmol/L)HDL-C(x±s,mmol/L)LDC-C(x±s,mmol/L)FFA(x±s,mmol/L)血尿酸(x±s,μmol/L)25-(OH)D(x±s,mg/L)空腹C肽[M(Q),nmol/L]合并肌少症378.86±3.821.33±0.332.62±0.950.37±0.17316.52±72.9812.44±6.791.14(1.28)不合并肌少症1178.08±2.411.22±0.332.53±0.780.44±0.25296.40±85.7116.16±8.491.54(1.44) t/t'值-1.171-1.767-0.5701.930-1.2872.429-2.020P值 0.368 0.079 0.5630.198 0.2000.016 0.043

表4 合并肌少症与不合并肌少症的老年T2DM患者体力活动水平的比较(n)
2.4 影响不同性别的老年T2DM患者合并肌少症的多因素Logistic回归分析 以是否合并肌少症为因变量(是=1,否=0),以单因素分析差异有统计学意义的因素为自变量(均以连续变量纳入),采用多因素Logistic回归分析法分别对不同性别的T2DM患者合并肌少症的影响因素进行分析。结果显示,年龄、体质指数、糖尿病病程、骨矿含量是老年男性T2DM患者合并肌少症的影响因素,糖尿病病程、体质指数、骨矿含量是老年女性T2DM患者合并肌少症的影响因素(均P<0.05)。见表5。
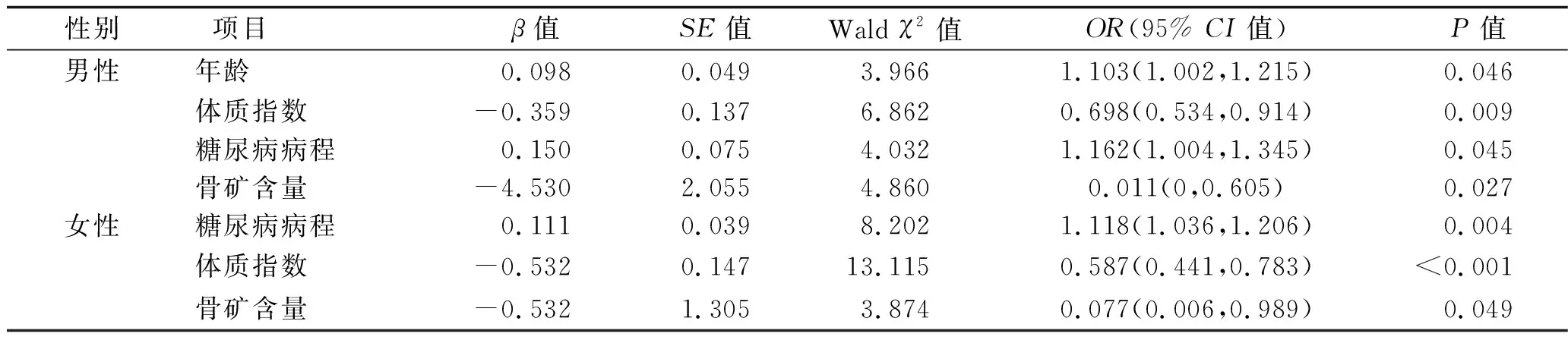
表5 影响不同性别的老年T2DM患者合并肌少症的多因素Logistic回归分析
3 讨 论
肌少症与活动障碍、代谢紊乱和低骨量密切相关,是老年人生理功能减退的重要原因,而老年糖尿病患者肌少症的患病率明显升高。Wang等[7]对1 090例60岁以上的中国社区居民进行调查,发现老年T2DM患者肌少症患病率为14.8%,高于非糖尿病者,而另一项研究发现,中国T2DM患者肌少症的发生率为24.2%,但男性发生率高于女性[8]。Kim等[2]的研究显示,韩国60岁以上男女T2DM患者肌少症的患病率分别为19%和27%,高于健康人群。本研究结果显示,60~89岁老年T2DM患者肌少症的发生率为21.25%,男女发生率分别为18.05%和24.03%,不同性别老年T2DM患者肌少症发生率差异无统计学意义(P>0.05),与上述研究结果不一致,原因可能与本研究入选的患者人群、样本数量及身体成分检测方法不同有关。糖尿病患者发生肌少症的机制尚未完全明确,主要机制包括胰岛素抵抗、糖基化终末产物及炎性因子的作用和氧化应激等,导致微血管和大血管并发症,干扰正常的细胞代谢功能,引起骨骼肌质量、强度和功能的下降,进而诱发肌少症的发生[9-10]。
肌肉减少是一个与增龄相关的持续性过程,老年T2DM肌少症患病率随年龄增长而逐渐升高,80岁以上患病率高达40%~50%[10-11]。本研究结果显示,在男性或女性老年T2DM患者中,合并肌少症者年龄均大于不合并肌少症者(P<0.05),且多因素Logistic回归分析显示,高龄是老年男性T2DM患者合并肌少症的危险因素(P<0.05),与上述研究结果相似。本研究结果还显示,男性或女性患者中,合并肌少症者的糖尿病病程长于不合并肌少症者(P<0.05),多因素Logistic回归分析显示,糖尿病病程长是老年T2DM患者合并肌少症的危险因素(P<0.05),与Murata等[10]的研究结果相似。提示T2DM病程越长,肌肉减少越明显[12],原因可能与随着糖尿病病程延长,胰岛素抵抗效应增加,老化的肌细胞接收胰岛素作用后,肌肉蛋白的合成进一步降低有关[13]。
近年研究发现,低体质指数的糖尿病患者肌少症的发病风险增加[3]。本研究结果显示,在男性或女性患者中,老年T2DM患者合并肌少症者的体质指数明显低于不合并肌少症者,且低体质指数是老年T2DM患者合并肌少症的危险因素(P<0.05)。其原因可能与老年糖尿病患者的蛋白质营养摄入不足、躯体和四肢的肌肉含量减少有关。在临床上为患者制定体重控制方案时应结合患者临床情况,将体质指数控制在一个合理范围,避免不适当的减重导致肌肉加速损失,增加患者发生肌少症的风险。本研究还发现,男性、女性老年T2DM患者中合并肌少症者骨矿含量低于不合并肌少症者,且低骨矿含量是老年T2DM患者合并肌少症的危险因素(P<0.05)。不良的肌肉质量和功能与T2DM患者突发性骨折和死亡率相关,肌少症患者的骨矿含量更低,跌倒和骨折的发生率更高[14],肌少症患者的骨矿含量低和肌肉功能差可能在跌倒和骨折的机制中发挥协同作用。因此,应重视测量肌少症患者的骨密度,动态了解骨矿含量,做好骨量的管理,以防止骨折引起的活动性降低。
有研究表明,不良生活方式包括久坐、缺乏活动是肌少症发生的危险因素,低体力活动的老年人发生肌少症的风险更高[15]。一项荟萃研究显示,增加体力活动可减少肌少症的发生风险[16],有氧运动和抗阻训练均能增加肌肉力量和促进肌肉功能的恢复,并减少衰老过程中活动障碍和跌倒的发生[17]。本研究结果显示,肌少症患者体力活动水平较非肌少症患者差,且老年女性T2DM合并肌少症患者血清25-(OH)D水平明显低于不合并肌少症组(P<0.05)。25-(OH)D可以维持肌肉质量,低水平25-(OH)D不仅会导致肌肉质量下降及跌倒风险增加,且与糖尿病患者运动反应能力密切相关[18]。在同等量体力活动下,25-(OH)D水平高的老年人较水平低者更能有效地改善身体成分[19],充足的25-(OH)D更能让老年人从增强运动锻炼中改善体能[20]。因此,对于T2DM患者,除了控制血糖,还需要通过改善生活方式,包括进行适当强度的体力活动、必要时增加维生素D的摄入来延缓肌肉质量的丢失,增加肌肉强度,提高日常活动能力。
综上所述,老年T2DM患者合并肌少症的发生率较高,早期筛查及防治至关重要。对于老龄、病程长、低体质指数的糖尿病患者应及时进行肌少症的早期筛查,建议同时进行骨密度检测,尽早采取预防措施和干预治疗,以延缓肌少症的发生发展,防止代谢紊乱、跌倒和骨折,提高老年糖尿病患者的生活质量。

