不同叶色茶树品种春季新梢生理生化特性研究
穆兵 艾仄宜 唐君 梅菊芬 杨亦扬

摘要:为探明不同葉色茶树品种新梢在春季不同采摘期的生理生化变化,为特异叶色茶树资源的综合利用提供理论参考,选取5种具代表性的茶树品种:福鼎大白、白叶1号、黄金芽、龙井43和紫鹃,分别在2020年春季茶叶开采初期(T1)、开采中期(T2)、开采末期(T3)3个时间点比较新梢中过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)和多酚氧化酶(PPO)等酶活变化,并对含水率、茶多酚总量、氨基酸总量、没食子酸含量、咖啡碱含量、儿茶素组分含量、氨基酸组分含量等品质成分进行了测定。结果表明,紫鹃春季新梢中CAT活性和SOD活性均处于偏低水平,推测可能和紫鹃品种选自云南大叶群体种有关。品质成分的测定结果表明,5个代表性品种中黄金芽氨基酸总量最高,且已测定的21种氨基酸组分中的16种都具有更高含量,此外,黄金芽中的EGCG、GCG等组分含量及儿茶素总量在5个品种中最低,具有高氨基酸低酚的特点;虽然福鼎大白的EGCG含量最高,但紫鹃品种的儿茶素总量及咖啡碱含量最高,同时较EGCG具有更低苦味、涩味阈值的ECG和苦味贡献较大的CG等儿茶素组分含量叶在紫鹃叶中最高,这与感官审评中黄金芽更鲜爽、紫鹃偏苦涩的品质特征结果相符。综合酶活和品质成分分析结果,表明福鼎大白后期更适合制作红茶,且同样作为白化变异品种,黄金芽比白叶1号更适合制作红茶。
关键词:茶树;品种;生理生化;酶活性;品质成分
中图分类号: S571.101 文献标志码: A
文章编号:1002-1302(2021)18-0143-07
收稿日期:2021-01-26
基金项目:江苏省农业科技自主创新资金[编号:CX(19)2011];江苏省科技计划重点项目(编号:BE2019379);江苏省现代农业产业技术体系(编号:JATS[2019]263);农业重大技术协同推广计划试点项目(编号:2020-SJ-047-02-1)。
作者简介:穆 兵(1992—),男,安徽寿县人,硕士,研究实习员,主要从事茶树资源与创新利用研究。E-mail:mubing@jaas.ac.cn。
通信作者:杨亦扬,博士,副研究员,主要从事茶树生理与营养研究。E-mail:yiyangyang@jaas.ac.cn。
茶树[Camellia sinensis (L.) O. Kuntze]起源于我国云贵高原,我国作为世界上最早发现并利用茶树的国家,逐步经历了由药用至饮用,从利用野生茶树到人工栽培茶树,从无意识的种植到选择性地栽培优良植株的过程。长期以来,通过自然进化和人工选择等方式不断发现和培育出丰富的茶树资源,我国也成为世界上茶树种质资源最丰富的国家,目前,茶树已经在世界范围内得到了广泛种植[1-2]。
近些年来,茶树育种和栽培技术迅速发展,越来越多具有不同叶色的特异茶树品种被发掘和培育出来,有的品种在新梢发育过程中具有较高含量的花青素,呈现出紫色叶片,如紫鹃、紫嫣等[3-4]。还有一类茶树品种由于在特定条件下,新梢发育过程中因为缺少叶绿素而呈现白化现象,又因色素含量水平的差异而形成包括全白色、乳白色、浅黄色、金黄色以及黄白相间等不同的叶色表现型,统称新梢白化茶树[5-6],如幼嫩新梢呈现黄色的品种黄金芽[7-8],幼嫩新梢呈现白色的品种安吉白茶[9-10]。茶树为多年生常绿木本经济作物,紫叶、白叶等彩色叶片茶树的成功种植,极大地丰富了茶树的种质资源。由于茶树品种资源的特异性,彩叶茶树不仅在叶色表现型上与普通绿色叶片品种有差异,在茶树生长发育过程中的品质成分含量、生理生化特性、物质合成代谢等方面也具有较大差异[11-12]。因此,本研究拟通过以常规绿色茶树品种为对照,选取不同叶色具代表性的茶树品种,通过科学的方法对不同叶色茶树品种的相关酶活和品质成分等进行测定和分析,旨在进一步揭示不同叶色茶树品种的特异性生理生化特征[13-14],为不同叶色茶树品种的资源开发、适制分析、产品利用以及更深层次的研究提供理论基础和科学依据。
1 材料与方法
1.1 试验材料
本试验所用茶树品种为白叶1号(BY 1)、福鼎大白(FDDB)、黄金芽(HJY)、龙井43(LJ 43)和紫鹃(ZJ),5个品种均生长于江苏省无锡市玉山基地,生长状况良好。分别在2020年春季茶叶开采初期T1(3月30日)、开采中期T2(4月18日)、开采末期T3(4月30日)3个时间点取样,3次取样均在同一地点的茶树上进行,采摘标准为1芽1叶,每个品种取3个平行样,每个平行样取样量为3~5 g,取样后立即用液氮保存。
1.2 试验测定指标及方法
超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、多酚氧化酶(PPO)活性,测定方法参照各试剂盒说明书进行。茶多酚含量和儿茶素类含量、游离氨基酸总量、咖啡碱含量、含水率、没食子酸含量等品质测定方法参考相关国家标准。
超高效液相色谱工作条件,色谱柱:Waters T3 色谱柱;A相:0.1%甲酸;B相:乙腈(包含0.1%甲酸);柱温40 ℃;进样量1 μL;流速0.3 mL/min。梯度如下:0~3 min 1% B;3~6 min 1%~4% B;6~7.5 min 4%~90% B;7.5~9.3 min 90% B;9.3~9.4 min 90% B~1% B;9.4~12 min 1% B。
质谱检测条件:离子化模式ESI+,检测方式为质谱多反应检测(MRM),Curtain Gas:35;IonSpray Voltage:5 500;Temperature:450 ℃;Ion Source Gas1:40 ℃;Ion Source Gas2:40 ℃。
1.3 数据处理
利用Excel 2016進行数据处理和绘图,利用SPSS 18.0软件进行数据分析,采用 ANOVA进行Duncans多重差异分析,显著性水平为P<0.05。
2 结果与分析
2.1 不同叶色茶树品种春季新梢酶活性变化比较
茶鲜叶中的酶类复杂多样。超氧化物歧化酶(SOD)和过氧化氢酶(CAT)是植物体内抗氧化系统中的主要酶类,其活性水平可以反应植物体受外界逆境影响的情况[15-17]。过氧化物酶(POD)和多酚氧化酶(PPO)是茶叶中2种重要的氧化酶,它们在茶树的生理代谢、茶叶制造化学过程中对多酚类物质的氧化、茶叶品质的形成均起到重要作用[18-20]。
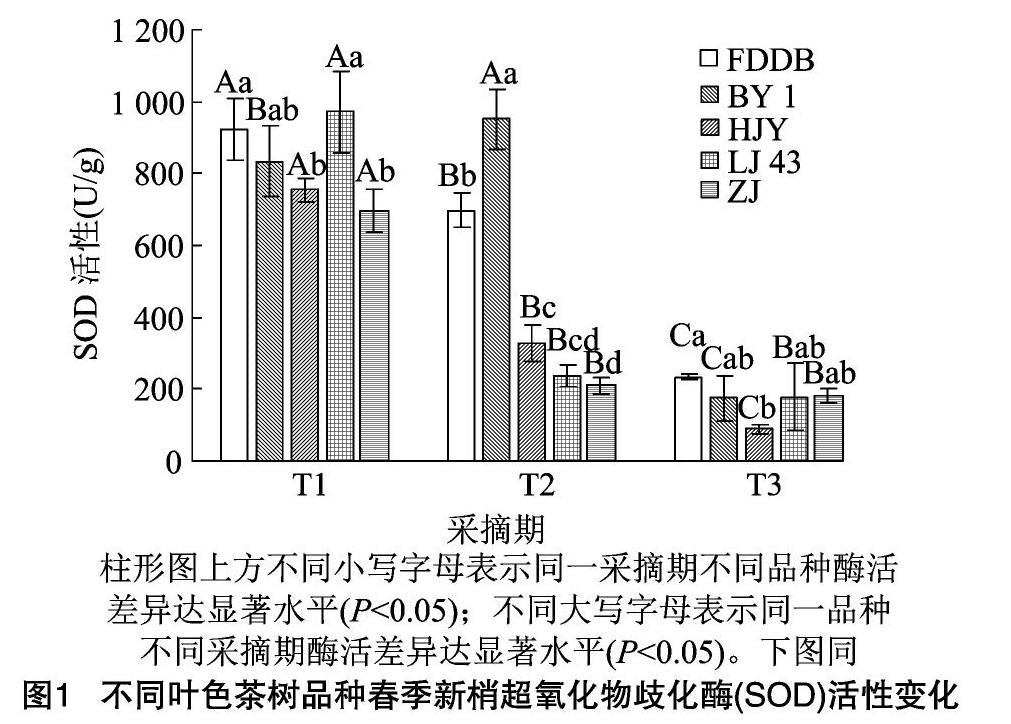
2.1.1 不同叶色茶树品种春季新梢超氧化物歧化酶(SOD)活性变化 由图1可见,不同叶色茶树品种整个春季采摘期(T1、T2、T3阶段)新梢SOD活性整体呈现下降趋势。T1时虽然5个品种之间SOD活性具有显著差异,但是整体活性均处于较高水平;T2时白叶1号新梢SOD活性显著高于其他品种(P<0.05),相对于T1时期除白叶1号SOD活性增加外,福鼎大白、黄金芽、龙井43和紫鹃均显著降低(P<0.05),降幅分别达到24.6%、56.6%、75.6%、69.8%;至T3时期,5个品种SOD活性均呈现下降趋势,处于较低水平,其中福鼎大白、白叶1号、黄金芽呈显著下降趋势(P<0.05),降幅均超过50%,分别为66.4%、81.5%、72.6%,而龙井43和紫鹃SOD活性虽然下降但不显著。就整个春季采摘期(T1、T2、T3阶段)而言,白叶1号新梢SOD活性始终高于黄金芽,结合表1中不同叶色茶树品种春季新梢CAT活性的测定结果,推测同样作为白化变异品种的白叶1号和黄金芽,前者的抗逆能力在理论上要优于后者。
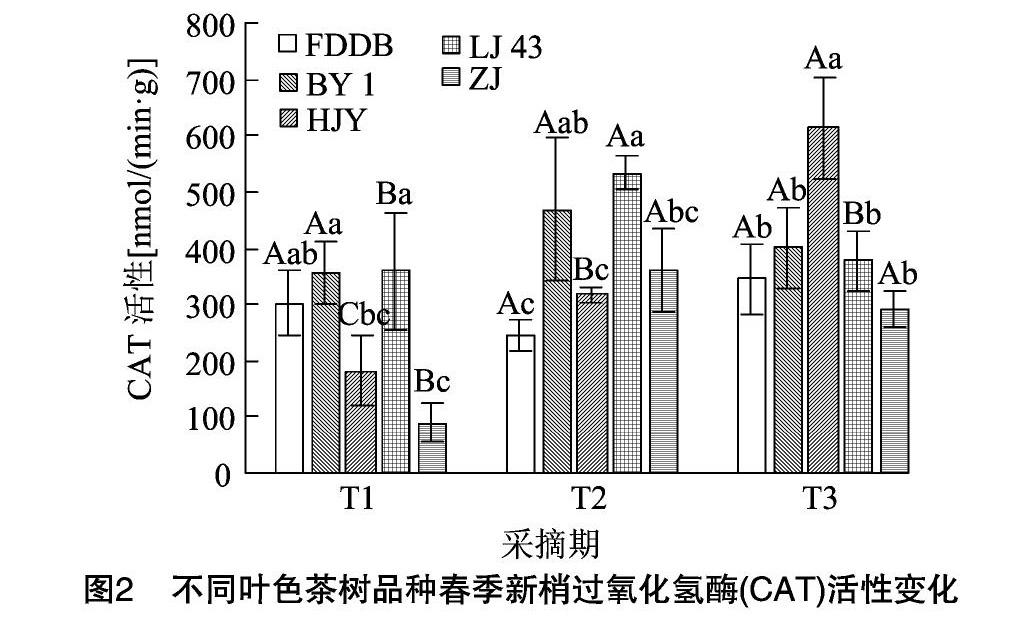
2.1.2 不同叶色茶树品种春季新梢过氧化氢酶(CAT)活性变化 由图2可见,不同叶色茶树品种整个春季采摘期(T1、T2、T3阶段)新梢CAT活性呈现上升趋势,在T1时5个品种CAT活性均不相同,其中福鼎大白、白叶1号和龙井43 CAT活性相对较高,黄金芽次之,而紫鹃新梢中CAT活性最低,仅为龙井43活性的24.8%。在T2时龙井43和白叶1号新梢中CAT活性较高,福鼎大白和黄金芽活性较低,相对于T1来说,紫鹃品种新梢中CAT活性增幅最大,达303.2%。T3时黄金芽新梢中CAT活性最高,显著高于另外4个品种(P<0.05),相对于T2而言,黄金芽和福鼎大白新梢中CAT活性增幅较大,分别为92.9%、41.2%。不同叶色茶树品种春季新梢CAT活性变化趋势表明,福鼎大白呈先降后升的趋势,白叶1号、龙井43和紫鹃3个品种中呈先升后降的趋势,只有黄金芽新梢CAT活性始终上升;就T1、T2、T3变化幅度而言,黄金芽和紫鹃变化幅度较大,福鼎大白、白叶1号和龙井43变化幅度较小。推测福鼎大白、龙井43等绿叶品种和白叶1号作为温度敏感型白化品种,新梢CAT活性在生长过程中对环境因素变化具有较为稳定的表达,而温度、光照敏感型白化品种(叶色一般为黄色)黄金芽[21-22]、叶片为紫色的紫鹃等彩叶茶树品种,可能由于对环境的变化更为敏感,因此在环境因子变化的响应上表现出更高的活性。
2.1.3 不同叶色茶树品种春季新梢过氧化物酶(POD)活性变化 图3为不同叶色茶树品种春季新梢POD活性的测定结果,T1时黄金芽和龙井43新梢POD活性具有较高水平,福鼎大白和紫鹃的新梢POD活性较低;T2与T1相比,福鼎大白、白叶1号、紫鹃的新梢POD活性升高,其中紫鹃显著增加,增幅达100.8%,福鼎大白和白叶1号增幅分别为3.3%、47.0%,黄金芽和龙井43新梢POD活性显著降低,降幅分别为36.7%、55.2%。T3时福鼎大白新梢POD活性显著高于其他品种(P<0.05),T3与T2相比,福鼎大白和龙井43新梢POD活性显著升高,增幅分别达627.6%、131.6%,黄金芽和紫鹃的新梢POD活性虽有降低但不显著,而白叶1号新梢POD活性显著降低,降幅为41.4%。就整个春季采摘期(T1、T2、T3阶段)而言,福鼎大白新梢POD活性由T1时处于较低水平至T3时大幅上升,远高于其他4个品种;而紫鹃新梢POD活性始终处于较低水平。
2.1.4 不同叶色茶树品种春季新梢多酚氧化酶
(PPO)活性变化 图4为不同叶色茶树品种春季新梢PPO活性的测定结果,整个春季采摘期(T1、T2、T3阶段)5个品种新梢PPO活性整体呈现上升趋势。T1时黄金芽、龙井43和紫鹃新梢PPO活性较高,T2时5个品种新梢PPO活性虽有差异但不显著,T3时白叶1号新梢PPO活性最低。T2与T1相比,白叶1号、福鼎大白PPO活性显著上升(P<0.05),增幅分别为53.9%、40.5%,紫鹃PPO活性也呈上升趋势但不显著,增幅为29.9%,而黄金芽和龙井43均呈下降趋势,降幅分别为4.6%、8.8%,均不显著。T3与T2相比,只有白叶1号PPO活性下降但不显著,降幅为16.1%,福鼎大白、黄金芽、龙井43、紫鹃等4个品种PPO活性均呈现显著上升趋势(P<0.05),增幅分别为29.1%、44.7%、63.3%、23.9%。结果表明,就T1、T2、T3阶段而言,福鼎大白均显著上升,表明福鼎大白后期可能更适合制作红茶;T1、T3时白叶1号新梢PPO活性偏低,黄金芽、紫鹃和龙井43变化趋势接近,推测黄金芽较白叶1号更适合制作红茶。
2.2 不同叶色茶树品种春季新梢品质成分变化比较
对不同叶色茶树品种的品质成分,包括含水率、茶多酚总量、氨基酸总量、没食子酸含量、咖啡碱含量、儿茶素组分含量、氨基酸组分含量等进行测定。测定结果如表2所示,福鼎大白、白叶1号、黄金芽、龙井43、紫鹃等5个品种的含水率差异较小,分别为6.72%、7.74%、6.90%、7.11%、6.41%。茶多酚总量测定结果显示,福鼎大白和龙井43这2个品种的茶多酚总量相近,分别为18.43、 18.10 mg/g,紫鹃的含量最高,为21.57 mg/g,白叶1号和黄金芽的含量均较低,分别为15.32、15.00 mg/g。氨基酸的测定结果显示,福鼎大白、紫鹃、龙井43、白叶1号等4个品种氨基酸含量依次升高,分别为44.55、48.33、49.93、53.86、53.86 mg/g,黄金芽具有最高含量,达77.84 mg/g。没食子酸含量的测定结果显示,5个品种中福鼎大白和紫鹃的含量接近,分别为0.69、0.68 mg/g,白叶1号具有最高含量,为1.18 mg/g,龙井43的没食子酸含量最低,仅为0.24 mg/g。
影响咖啡碱含量的主要因素包括茶树的品种、茶树部位、季节时间以及栽培方式等因素[23-25],本研究中样品以同一采摘标准、取自相同时间及相同生长环境,因而其含量差异主要取决于品种因素,从结果可以看出,紫鹃作为云南大叶茶树品种,其咖啡碱含量最高,为32.56 mg/g。福鼎大白和龙井43咖啡碱含量处于中间水平,分别为29.73、27.13 mg/g。有趣的是,同样属于特异叶色品种、以鲜爽滋味为主的白叶1号和黄金芽2个白化品种[26-27],咖啡碱含量却有较大差异,白叶1号的咖啡碱含量为25.13 mg/g,为5个品种中最低的,而黄金芽的咖啡碱含量为31.34 mg/g,高出白叶1号24.7%,仅次于大叶茶树品种紫鹃。
由表3可以看出,不同叶色茶树品种春季新梢中儿茶素组分含量具有较大差异。研究中主要对表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、表儿茶素没食子酸酯(epicatechin gallate,ECG)、没食子儿茶素没食子酸酯(gallocatechin gallate,GCG)、儿茶素没食子酸酯(catechin gallate,CG)、表没食子儿茶素(epigallocatechin,EGC)、表儿茶素(epicatechin,EC)、没食子儿茶素(gallocatechin,GC)、儿茶素(catechin,C)共8种儿茶素含量进行测定,结果显示,在5个品种中福鼎大白的EGCG含量最高,紫鹃的ECG、CG、EGC、EC和C含量最高,儿茶素总量从高到低分别为紫鹃、福鼎大白、龙井43、白叶1号、黄金芽,这与上述茶多酚总量变化趋势相同。
此外,对茶氨酸(theanine)、谷氨酸(glutamic acid,Glu)、 γ-氨基丁酸(γ-aminobutyric acid, GABA)、天冬氨酸(aspartic acid,Asp)、酪氨酸(tyrosine,Tyr)、异亮氨酸(isoleucine,Ile)、亮氨酸(leucine,Leu)、缬氨酸(valine,Val)、精氨酸(arginine,Arg)、瓜氨酸(citrulline,Cit)、谷氨酰胺(glutarnine,Gln)、赖氨酸(lysine,Lys)、鸟氨酸(ornithine,Orn)、脯氨酸(proline,Pro)、丙氨酸(alanine,Ala)、组氨酸(histidine,His)、苯丙氨酸(phenylalanine,Phe)、丝氨酸(serine,Ser)、苏氨酸(threonine,Thr)、色氨酸(tryptophan,Trp)、天冬酰胺(asparagine,Asn)共21种氨基酸组分含量进行测定。测定结果如表4所示,黄金芽的茶氨酸(theanine)、γ-氨基丁酸(γ-aminobutyric acid,GABA)、谷氨酸(glutamic acid,Glu)、精氨酸(arginine,Arg)等16种氨基酸组分在5个品种中都具有最高含量,白叶1号的苏氨酸(threonine,Thr)具有最高含量,紫鹃中天冬氨酸(aspartic acid,Asp)具有最高含量,福鼎大白的色氨酸(tryptophan,Trp)具有最高含量,龙井43的鸟氨酸(ornithine,Orn)具有最高含量。
3 讨论
不同叶色茶树品种除萌发新梢颜色有别于一般绿色芽叶的茶树品种外, 其新梢生理生化特性也具有各自特点[28]。如以CAT、SOD为代表的抗氧化酶类主要是通过协同作用共同维持茶树体内自由基等含量保持在动态稳定的水平,防止自由基过量引起茶树生理生化特征发生改变[29-31],以PPO、POD为代表的氧化酶类在茶树生理代谢及茶叶加工过程中等都具有重要的作用[32],但是它们在不同叶色茶树品种中的活性等都不尽相同。而在内含物的分布差异上,不同叶色茶树品种也具有特殊性,有研究表明不同叶色的茶树品种中,紫芽品种富含花青素,但儿茶素含量较低;白化茶树品种的氨基酸含量较高、多酚含量较低[33-35]。
本研究以福鼎大白为对照,分别选取叶色为白色、黄色、绿色和紫色代表性品種白叶1号、黄金芽、龙井43和紫鹃作为研究对象,并对其相关酶类活性进行了分析。CAT和SOD作为抗氧化酶类可在茶树体内清除活性氧及在逆境生理上表现出积极作用,主要包括病害胁迫、干旱胁迫、高盐离子胁迫、冷热胁迫等[36]。5个代表性叶色茶树品种中,紫鹃春季新梢中CAT活性和SOD活性均处于偏低水平,推测可能和紫鹃品种选自云南大叶群体种有关,但紫鹃品种特性显示该品种具有较强的抗寒、抗旱和抗病虫能力,因此具体原因还需结合其他原因进一步分析。黄金芽品种CAT活性在整个春茶采摘期间始终呈上升趋势,但是白叶1号新梢SOD活性在整个春茶采摘期间始终高于黄金芽,推测同样作为白化品种,黄金芽相较于白叶1号对于环境的变化敏感程度和响应度更高,从理论上来说,白叶1号的抗逆性优于黄金芽。POD和PPO两者均为氧化酶类,除茶树正常生理代谢外,在茶叶加工过程中也起着重要作用,是红茶发酵中重要的酶类。福鼎大白新梢PPO活性随着T1、T2、T3时间变化显著上升,POD活性在T3时期大幅上升,推测福鼎大白后期更适合制作红茶,而就黄金芽品种POD和PPO在春季采摘期的活性变化,可以推测同样作为白化品种,黄金芽比白叶1号更适合制作红茶。
不同叶色茶树品种新梢生理生化的特异性,也体现在品质成分的分布差异上[37-38]。5种代表性叶色茶树品种中儿茶素组分含量差异表明,福鼎大白品种中的EGCG含量均最高,但紫鹃品种的儿茶素总量及咖啡碱含量最高,同时较EGCG具有更低苦味、涩味阈值的ECG和苦味贡献较大的CG[39-40]等儿茶素组分含量在紫鹃叶中也最高,此外,黄金芽品种的儿茶素总量和EGCG含量最低,白叶1号ECG含量最低,这为感官审评中紫鹃滋味偏苦涩、黄金芽和白叶1号滋味偏鲜爽的品质特征提供了理论依据。5种代表性叶色茶树品种中氨基酸含量测定结果显示,黄金芽品种的氨基酸总量最高,且已测定的21种氨基酸组分中,茶氨酸、γ-氨基丁酸等15种在黄金芽中都具有最高含量,其中包括对茶汤鲜爽味贡献较大的谷氨酸、天冬氨酸、苏氨酸等[40-41]。此外,黄金芽中的EGCG、GCG等组分及儿茶素总量在5个品种中含量最低,具有高氨低酚的特点,这与王丽鸳、Feng等的研究结果[33,42]及感官审评中黄金芽滋味鲜醇的品质特征结果一致。
俞露婷等发现在红茶发酵过程中不同儿茶素组分配比对茶黄素形成产生影响,其中EC ∶EGC=3 ∶7、EC ∶EGCG=5 ∶5、ECG ∶EGC=3 ∶7、ECG ∶EGCG=3 ∶7时有助于茶黄素的形成,且聚合度优先级依次降低[43]。本研究通过对5种代表性叶色茶树品种中儿茶素组分含量差异比较后发现,福鼎大白对应儿茶素组分含量最接近上述比例,其次为龙井43、白叶1号、黄金芽、紫鹃,结合不同叶色茶树品种新梢PPO、POD等酶类活性,表明福鼎大白后期更适合制作红茶,同样作为白化变异品种,黄金芽比白叶1号更适合制作红茶。
茶树品种既是遗传改良重要的种质资源,也是茶叶优质、高产以及高效生产的基础,是茶叶生产中最重要的生产资料[44]。近些年来不同茶树品种,尤其是以白叶1号、黄金芽、紫鹃等不同叶色为代表的茶树品种资源的选育和推广,为推动我国茶产业发展做出了重要贡献。以不同叶色茶树为代表的特异性茶树品种资源的挖掘和利用,也已经成为目前茶叶研究领域的重要方向之一[45-46]。虽然本研究通过对具代表性的不同叶色茶树品种春季新梢的生理生化特性进行了系统分析,但是对于酶活变化过程中代谢通路的调控、品质成分等分布规律和形成差异等仍然需要进一步深入探究。这不仅有助于揭示茶树的品种特性(抗逆性、适制性等)的内在机制,更可应用于茶叶的加工制作、生产指导、功能产品开发等,进一步推动茶产业健康、稳定的发展。
参考文献:
[1]杨亚军,梁月荣. 中国无性系茶树品种志[M]. 上海:上海科学技术出版社,2014.
[2]陈杰丹,马春雷,陈 亮. 我国茶树种质资源研究40年[J]. 中国茶叶,2019,41(6):1-5,46.
[3]杨兴荣,田易萍,黄 玫,等. 国家植物保护品种紫娟茶树的选育与应用[J]. 湖南农业科学,2013(11):1-3.
[4]杨纯婧,谭礼强,杨昌银,等. 高花青素紫芽茶树新品种紫嫣[J]. 中国茶叶,2020,42(9):8-11,14.
[5]李娜娜. 新梢白化茶树生理生化特征及白化分子机理研究[D]. 杭州:浙江大学,2015.
[6]杜颖颖. 新梢白化茶树品种白化机理研究[D]. 杭州:浙江大学,2009.
[7]王开荣,李 明,梁月荣,等. 茶树新品种黄金芽选育研究[J]. 中国茶叶,2008,30(4):21-23.
[8]Li N A,Yang Y P,Ye J H,et al. Effects of sunlight on gene expression and chemical composition of light-sensitive albino tea plant[J]. Plant Growth Regulation,2016,78(2):253-262.
[9]刘丁丁,梅菊芬,王君雅,等. 茶树白化突变研究进展[J]. 中国茶叶,2020,42(4):24-35.
[10]Li Q,Huang J A,Liu S Q,et al. Proteomic analysis of young leaves at three developmental stages in an albino tea cultivar[J]. Proteome Science,2011,9(1):44.
[11]罗 意,董丽娟,段继华,等. 福鼎大白茶等20个茶树品种实生苗抗寒性鉴定与评价[J]. 茶叶通讯,2013,40(2):3-5.
[12]Mu B,Zhu Y,Lv H P,et al. The enantiomeric distributions of volatile constituents in different tea cultivars[J]. Food Chemistry,2018,265:329-336.
[13]李远华,顾 玮,倪德江,等. 茶树叶绿素酶活性的变化研究[J]. 茶叶科学,2011,31(1):27-32.
[14]黄海涛,余继忠,王贤波,等. 不同抗寒性茶树品种秋季新梢的生理特性研究[J]. 浙江农业学报,2014,26(4):925-928.
[15]夏民旋,王 维,袁 瑞,等. 超氧化物歧化酶与植物抗逆性[J]. 分子植物育种,2015,13(11):2633-2646.
[16]张宇婷,高建民,张琼琳,等. 植物超氧化物歧化酶的研究进展[J]. 畜牧与饲料科学,2016,37(9):28-31.
[17]马旭俊,朱大海. 植物超氧化物歧化酶(SOD)的研究进展[J]. 遺传,2003,25(2):225-231.
[18]黄 晨. 茶树多酚氧化酶基因的克隆及其对胁迫的响应[D]. 南京:南京农业大学,2018.
[19]杨 节,龚淑英,唐德松. 茶树中过氧化氢酶活力变化规律[J]. 浙江大学学报(农业与生命科学版),2014,40(6):647-652.
[20]杨 节. 茶树中过氧化氢酶的初步研究[D]. 杭州:浙江大学,2014.
[21]田月月. 黄金芽茶树叶色响应光质的生理特性及机制研究[D]. 泰安:山东农业大学,2020.
[22]Wang K R,Li N,Du Y Y,et al. Effect of sunlight shielding on leaf structure and amino acids concentration of light sensitive albino tea plant[J]. African Journal of Biotechnology,2013,12:5535-5539.
[23]宛晓春. 茶叶生物化学[M]. 3版.北京:中国农业出版社,2003:76-78.
[24]赵 卉,杜 晓. 低咖啡碱茶的研究进展[J]. 华中农业大学学报,2008,27(4):564-568.
[25]姚永宏,柴友荣,李中林,等. 降低茶叶咖啡碱的研究进展[J]. 西南农业学报,2009,22(6):1799-1802.
[26]王强兵,张丽群,孙道伦,等. 白化茶树品种特异性状理化本质探讨[J]. 中国茶叶,2018,40(8):10-13,17.
[27]陈亚明,翁行良,程学文,等. 黄金芽与安吉白茶引种对比试验[J]. 农业装备技术,2017,43(2):40-41.
[28]Li Y C,Chen C S,Li Y S,et al. The identification and evaluation of two different color variations of tea[J]. Journal of the Science of Food and Agriculture,2016,96(15):4951-4961.
[29]沈思言,徐艳霞,马春雷,等. 干旱处理对不同品种茶树生理特性影响及抗旱性综合评价[J]. 茶叶科学,2019,39(2):171-180.
[30]安晶晶. 富硒SOD绿茶抗氧化效应的动物实验研究[D]. 重庆:第三军医大学,2009.
[31]苏金为,王湘平. 茶树新梢生长及萎凋过程中SOD活性与脂质过氧化作用[J]. 福建农学院学报,1991,20(3):310-314.
[32]黄惠华,陈兴琰,陈国本,等. 茶树秋梢芽、叶间几种同工酶的比较研究[J]. 茶叶科学,1986,6(1):49-54.
[33]王丽鸳,赵容波,成 浩,等. 叶色特异茶树品种选育现状[J]. 中国茶叶,2020,42(1):15-19.
[34]Cheng S H,Fu X M,Liao Y Y,et al. Differential accumulation of specialized metabolite l-theanine in green and albino-induced yellow tea (Camellia sinensis) leaves[J]. Food Chemistry,2019,276:93-100.
[35]Du Y Y,Zhong H,Wu W L,et al. Effect of temperature on accumulation of chlorophylls and leaf ultrastructure of low temperature induced albino tea plant[J]. African Journal of Biotechnology,2008,7(12):1881-1885.
[36]娄 娜. 川西茶区4个主栽茶树品种生理生化特性的研究[D]. 雅安:四川农业大学,2011.
[37]Du Y Y,Liang Y R,Wang H,et al. A study on the chemical composition of albino tea cultivars[J]. The Journal of Horticultural Science and Biotechnology,2006,81(5):809-812.
[38]Shen Z G,He Y,Li Y Y,et al. Insights into the profiling changes of amino acid content in an albino mutant (Camellia sinensis cv. Huangshanbaicha) during the albinostic stage[J]. Scientia Horticulture,2020,260:108732.
[39]张英娜. 绿茶茶汤主要儿茶素呈味特性研究[D]. 北京:中国农业科学院,2016.
[40]Zhang L,Cao Q Q,Granato D,et al. Association between chemistry and taste of tea:a review[J]. Trends in Food Science & Technology,2020,101:139-149.
[41]王凯凯,孙 朦,宋佳敏,等. γ-氨基丁酸(GABA)形成机理及富集方法的研究進展[J]. 食品工业科技,2018,39(14):323-329.
[42]Feng L,Gao M J,Hou R Y,et al. Determination of quality constituents in the young leaves of albino tea cultivars[J]. Food Chemistry,2014,155:98-104.
[43]俞露婷.红茶模拟发酵工序茶黄素形成调控基础研究[D]. 北京:中国农业科学院,2016.
[44]王治会,岳翠男,李 琛,等. 江西省茶树种质化学特性多样性分析与鉴定评价[J]. 江苏农业学报,2020,36(1):172-179.
[45]刘健伟,方寒寒,马立峰,等. 不同氮肥水平下春季茶树新梢代谢组学变化[J]. 浙江农业科学,2019,60(2):189-192.
[46]刘昆言,禹双双,彭长城,等. 我国茶树新品种保护发展现状及建议[J]. 湖南农业科学,2020(8):101-104.

