界面组成对乳状液稳定性及其缓释消化的影响
张婧嫣,朱玲,吴港城,齐希光,张晖
(江南大学 食品学院,江苏 无锡,214122)
肥胖不仅会带来形体问题,更能引发心脑血管疾病、高血脂等慢性疾病风险[1]。引起肥胖的重要原因就是能量摄入过多,虽然通过减少食物中的油脂含量或是使用脂肪酶抑制剂降低油脂的可消化性均可减少能量摄入,但这些举措也丧失了食用油脂带来的积极作用,且大量未消化的油脂进入结肠不利于人体健康,需要权衡考量[2]。
近年来,一种利用饱腹感的饮食干预策略逐渐为大众所接纳[3]。“回肠刹车”机制被认为是一个可有效控制进食量的举措,它是指当未吸收的消化产物(如三酰甘油水解释放的游离脂肪酸)暴露的位置越靠近小肠的末端,它们诱导产生的饱腹感效应也就越强[4]。因脂肪酶水解油脂的作用位点只能在油滴表面,所以可通过在油滴界面结构上进行优化来延缓其在胃肠道中的消化速率[5]。
已知油脂在食品中多以乳状液形式存在,而乳状液的结构在油脂消化方面扮演重要角色[6],如乳状液在胃环境中的酸稳定性对于饱腹感激素的释放有重要影响[7]。因此需要从界面设计入手来构建一种既能使油滴在胃环境中保持均匀分散和稳定、又能在小肠环境中缓慢消化的乳液体系。基于逐层静电沉积技术构建的多层乳液可以通过改变其界面结构来干扰消化酶与油脂相互作用的能力。已有学者研究了果胶(pectin,PC)的性质与其抑制脂解之间的联系[8],且有国外学者发现,添加4%(质量分数)果胶的乳化脂肪相对于对照组,甘油三酯的体外消化降解程度减少了20%[9];覃定奎[10]在初级乳液的基础上添加多糖,发现当壳聚糖(chitosan,CS)和海藻酸钠(sodium alginate,ALG)的质量分数增加至0.4%时可显著抑制油脂消化;SILVA等[11]则利用动态体外模拟实验评估了用壳聚糖和海藻酸钠构建的多层乳液的油脂消化程度,发现这些聚电解质层的添加显著降低了总游离脂肪酸的释放量。然而,大多数研究中未对这些乳状液的胃部酸稳定性进行鉴定分析,且体外消化模型不一,难以科学地对各结果进行对比。本研究选择PC、ALG、CS作为多层乳液构建的界面材料,探讨不同界面组成对乳状液油滴在胃肠道中的消化特性的影响。这将有助于发展以多层乳液为核心的界面工程技术,有望为开发具有延缓油脂消化、提高饱腹感效果的功能性食品提供依据。
1 材料与方法
1.1 材料与试剂
乳清分离蛋白(whey protein isolate,WPI),美国希尔玛公司;壳聚糖,海藻酸钠,上海百灵威化学技术有限公司;亚麻籽油,中粮集团有限公司;胃蛋白酶,美国Sigma公司;果胶、胰脂肪酶、磷酸二氢钠、磷酸氢二钠、盐酸、氢氧化钠、冰乙酸和用于体外模拟胃肠道消化的其他化学试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
M133/1 281-0高速剪切机,瑞士Biospec Products公司;M110L微射流均质机,美国Microfluidics公司;Zetasizer nano ZS纳米粒度及Zeta电位仪,英国Malvern公司;Nano Brook Omni多角度粒度与高灵敏度Zeta电位分析仪,美国Brookhaven Instruments公司;ZQTY-50振荡培养箱,上海知楚仪器有限公司。
1.3 实验方法
1.3.1 初级乳液的制备
将WPI溶于5 mmol/L磷酸盐缓冲液(pH 7.0)和5 mmol/L醋酸缓冲液(pH 3.5)中制备具有不同pH值的WPI溶液。将PC和ALG分散到5 mmol/L磷酸盐缓冲液(pH 7.0)中制备PC和ALG溶液,将CS分散到100 mmol/L醋酸缓冲液(pH 3.5)中制备CS溶液。
将亚麻籽油与2种WPI溶液混合,经10 000 r/min高速剪切5次,再用70 MPa高压微射流均质机均质循环3次,得到2种初级乳液(W),最终组成为质量分数分别为10%的亚麻籽油和1%的WPI(pH 7.0和pH 3.5)。
1.3.2 多层乳液的制备
在pH 7.0时,将初级乳液分别添加到PC和ALG溶液中,再调pH值至3.5,形成WPI-PC/ALG的亚麻籽油二级乳液(W-P/A),最终组成为5%的亚麻籽油、0.5%的WPI和0.2%的PC或0.3%的ALG(均为质量分数)。在pH 3.5时,将初级乳液添加到CS溶液中,再调pH值至5.5,形成WPI-CS的亚麻籽油二级乳液(W-C),最终组成为质量分数分别为5%的亚麻籽油、0.5%的WPI和0.15%的CS。在pH 3.5时,将W-P二级乳液添加到CS溶液中,产生的絮状物用超声破坏,形成WPI-PC-CS的亚麻籽油三级乳液(W-P-C),最终组成为质量分数分别为2.5%的亚麻籽油、0.25%的WPI、0.1%的PC和0.2%的CS。各聚合物浓度均是通过优化试验确定,即通过测定粒径和Zeta电位,得出乳液被聚电解质完全包覆,且溶液中聚电解质没有显著过量的最佳浓度水平。
1.3.3 乳液的粒径及其分布
用多角度粒度与高灵敏度Zeta电位分析仪测定乳状液的平均粒径、多分散指数(polydispersity index,PDI)与粒径分布。在室温下,将每种乳状液摇匀后,用5 mmol/L适当pH值的缓冲液稀释至相同的最终油浓度(质量分数为0.025%),避免多重散射效应。
1.3.4 乳液的Zeta 电位
用纳米粒度与Zeta电位仪测定乳状液的Zeta电位。在室温下,每种乳状液均用5 mmol/L适当pH值的缓冲液稀释至相同的最终油浓度(质量分数为0.025%),避免多重散射效应。
1.3.5 乳液的pH稳定性
在37 ℃下,每种乳状液均用0.1 mol/L NaOH和0.1 mol/L HCl溶液调节至不同pH值(3.0~8.0),搅拌30 min,测定平均粒径和Zeta电位值。
1.3.6 静态体外消化模型
参考前人方法制备口腔(simulated salivary fluid,SSF)、胃(simulated gastric fluid,SGF)、小肠(simulated intestinal fluid,SIF)3部分的体外模拟消化液[12]。
口腔阶段:将5 mL样品(含20 g/L的油)与 4 mL SSF(pH=7.0)混合,添加25 μL 0.3 mol/L的CaCl2·2H2O溶液并加足去离子水,以获得总体积为10 mL的溶液。在37 ℃恒温培养箱中100 r/min振荡2 min。
胃阶段:将口腔消化产物与8 mL SGF(含终体系酶活为2 000 U/mL的胃蛋白酶)混合,添加5 μL 0.3 mol/L的CaCl2·2H2O。调节pH值至3.0,并加足去离子水以获得总体积为20 mL的溶液。在37 ℃恒温培养箱中100 r/min振荡2 h。
小肠阶段:将胃消化产物转移至双层酶反应器中,与10 mL SIF(pH=7.0)混合,依次添加3.5 mL胆盐溶液(53.57 mg/mL溶于SIF),1.33 mL 0.3 mol/L的CaCl2·2H2O溶液和2.5 mL胰脂肪酶溶液(24 mg/mL溶于SIF)。调节pH值至7.0,并加足去离子水以获得总体积为40 mL的溶液。在37 ℃下反应4 h,期间用0.1 mol/L NaOH滴定以维持体系pH值在7.0,并记录NaOH消耗量。
1.3.7 游离脂肪酸释放率的测定
利用滴定法监测小肠消化阶段的游离脂肪酸(free fat acid,FFA)释放量。根据1个三酰甘油分子可在酶解作用下释放2个FFA的最大释放量来计算乳液释放的FFA百分比,如公式(1)所示:
(1)
式中:VNaOH,滴定消耗的NaOH的体积,L;mNaOH,摩尔浓度,0.1 mol/L;Mlipid,亚麻籽油的平均分子质量,873 g/mol;wlipid,小肠消化阶段脂质的质量,0.1 g。
1.4 数据处理
每个实验3次平行,所有数据均表示为平均值±标准差。使用SPSS Statistics(Version 17.0)软件进行统计分析。
2 结果与分析
2.1 乳液的pH稳定性
有研究表明[7],与酸性不稳定乳状液相比,在胃环境中具有更高酸稳定性的乳状液可以诱导产生更强的饱腹感。而在小肠的中性环境中,利用絮凝或聚集效应降低液滴的比表面积,有助于延缓脂质消化,也可达到增强饱腹感的目的[13]。因此,我们研究了不同pH值对乳液稳定性的影响(图1)。相对于W,W-P和W-A在pH 4~5下的平均粒径均降低,可能因为PC和ALG的界面吸附增加了乳状液的界面层厚度,产生的空间位阻效应增强了乳液体系的稳定性[14]。而在pH 3的条件下,相对于W-P,W-A的平均粒径偏高,可能因为W-A界面上的大量ALG分子在该pH值下形成了海藻酸凝胶,溶解度大幅度下降,丧失了对液滴的稳定作用,导致粒径增加。反之,W-C则具有较好的酸稳定性,但在中性或碱性条件下,CS的溶解度变低,促使液滴絮凝,粒径变大。
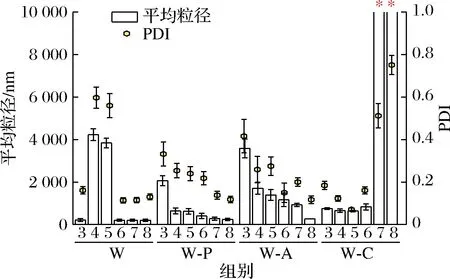
图1 初级乳液和各二级乳液在不同pH下的平均粒径Fig.1 Particle size of primary and secondary emulsions under different pH values注:“*”表示该pH条件下乳状液的粒径数值大于10 000 nm(下同)
之后,我们在W-P的基础上进一步吸附CS以构建W-P-C三级乳液。图2中的粒径结果表明,该三级乳液在pH 3和pH 4时有较高的稳定性,而随着pH升高至中性,粒径显著增大,说明该乳液体系满足了在酸性胃环境中稳定,而在中性肠环境中失稳的预期需求。
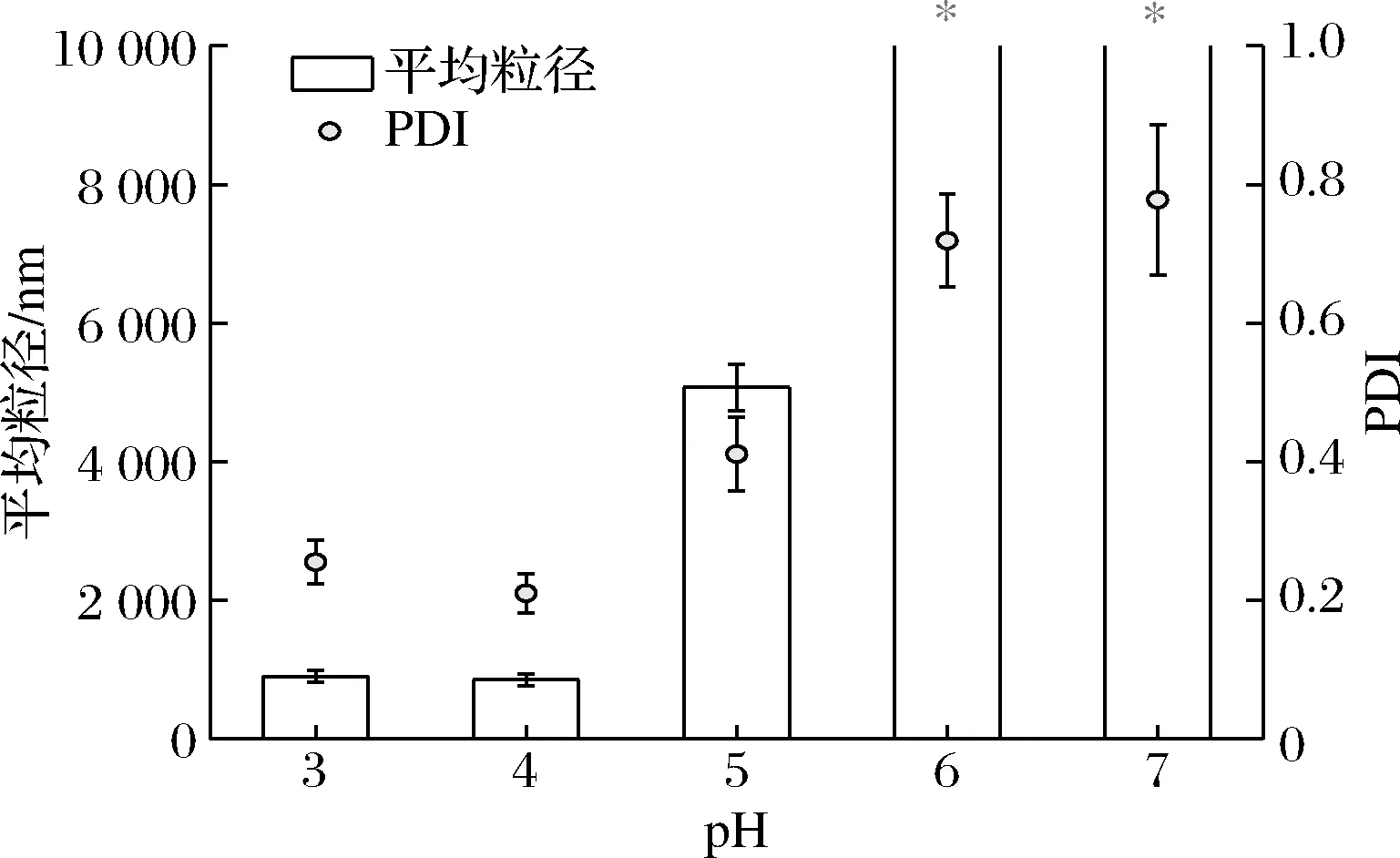
图2 三级乳液在不同pH下的平均粒径Fig.2 Particle size of tertiary emulsions under different pH values
不同pH条件下,初级乳液、各二级乳液和三级乳液的Zeta电位如图3所示。其中,W-P-C的Zeta电位由正值转为负值,且绝对值先变小后变大。据此推测,在低pH下,由于WPI、PC、CS分别带有适量的正负电荷,三级乳液的层与层间发生较强的静电吸附作用而使体系相对稳定。当pH继续升高至偏中性时,由于CS溶解度的下降,最外层结构开始崩解,WPI带电性逐渐转为阴性,而PC也为阴性,这2层间的相互作用逐渐减小,所以该三级乳液在pH 6~7时产生了明显的不稳定现象[15]。
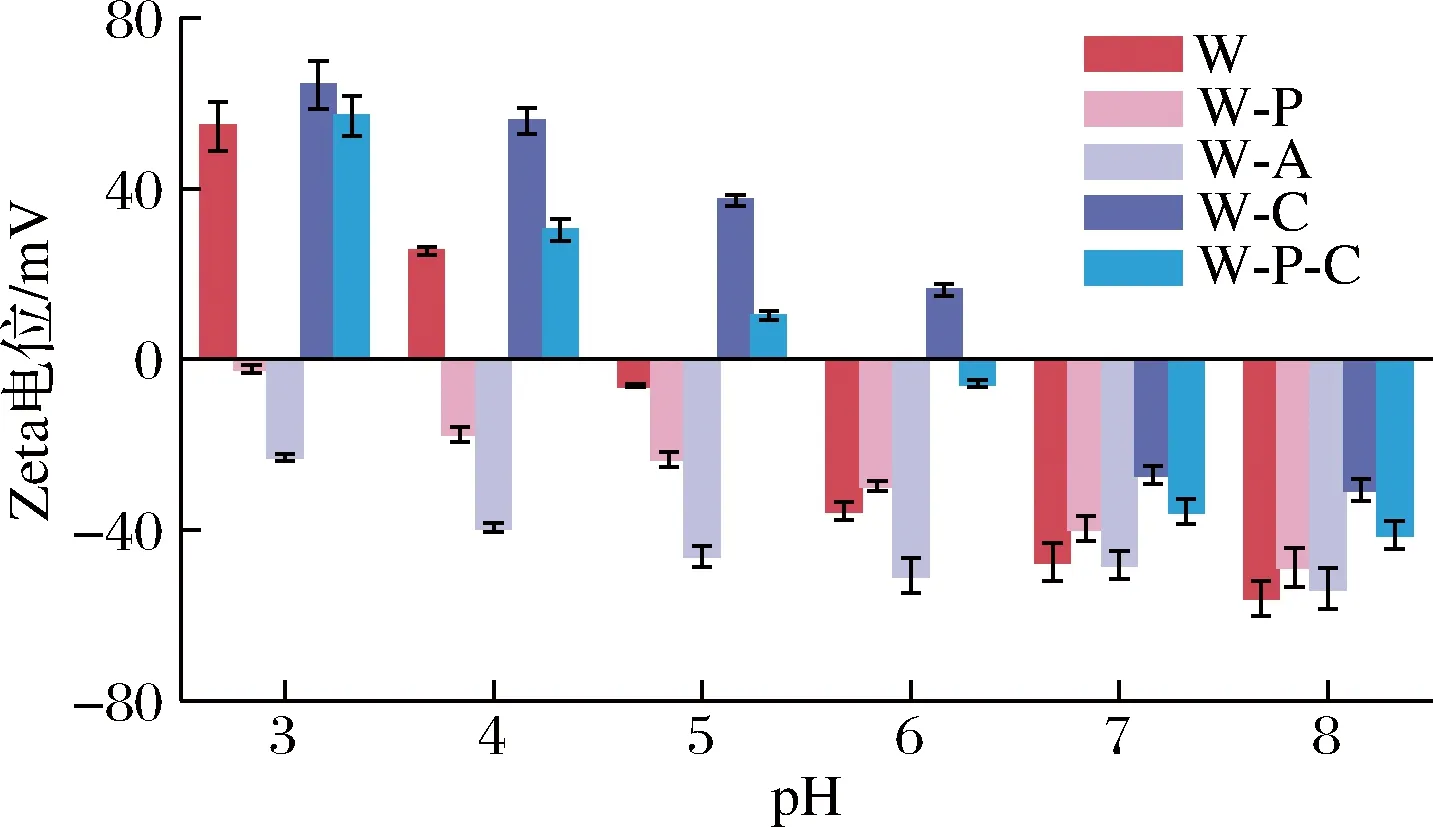
图3 各级乳状液在不同pH下的Zeta电位Fig.3 Zeta potential of primary, secondary and tertiary emulsions under different pH values
2.2 乳液在胃环境中的酸稳定性
经2 h胃消化后,W和W-A的平均粒径显著增大(图4),图5的宏观相分离现象也显示出这2者有明显的液滴聚结效应。而W-C也呈现出清晰的分层界线,因CS与WPI均带正电荷而使CS从界面上脱离下来,导致WPI依然可被胃蛋白酶消化而削弱了黏弹性界面结构[16],使乳液漂浮在胃液顶部。W-P和W-P-C的粒径分布变化不明显,说明界面层上PC的吸附限制了蛋白质的水解并阻止了液滴的絮凝,呈现出较强的分层稳定性(图5)。综上,只有W-P和W-P-C满足胃环境稳定性的要求,因此只有这2种体系才可被考虑用于体外模拟小肠消化的后续研究。
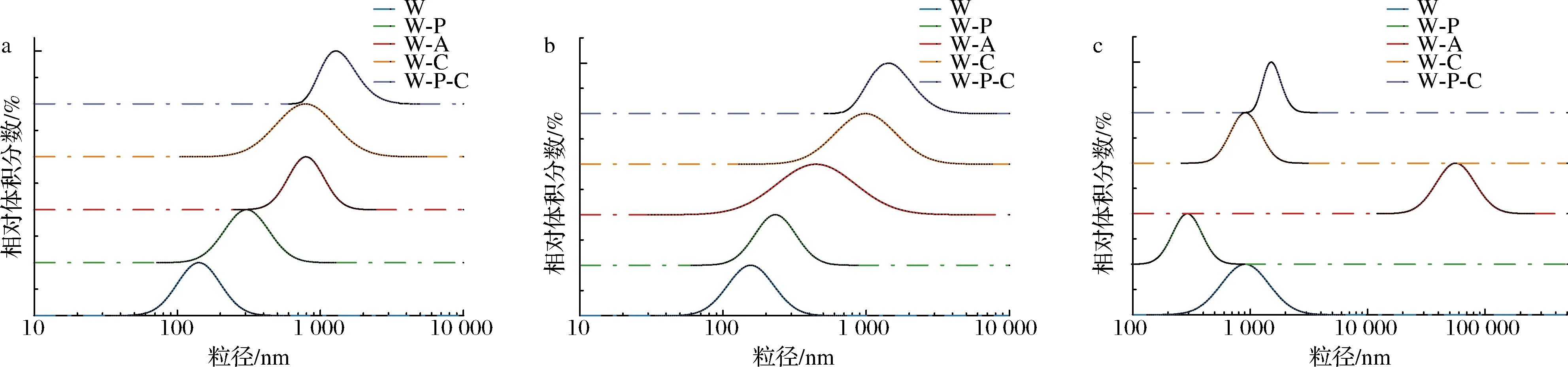
a-初始;b-口腔;c-胃图4 各级乳状液经过各消化阶段后的粒径分布Fig.4 Particle size distribution of primary, secondary and tertiary emulsions after exposure to different stages of the simulated gastrointestinal tract
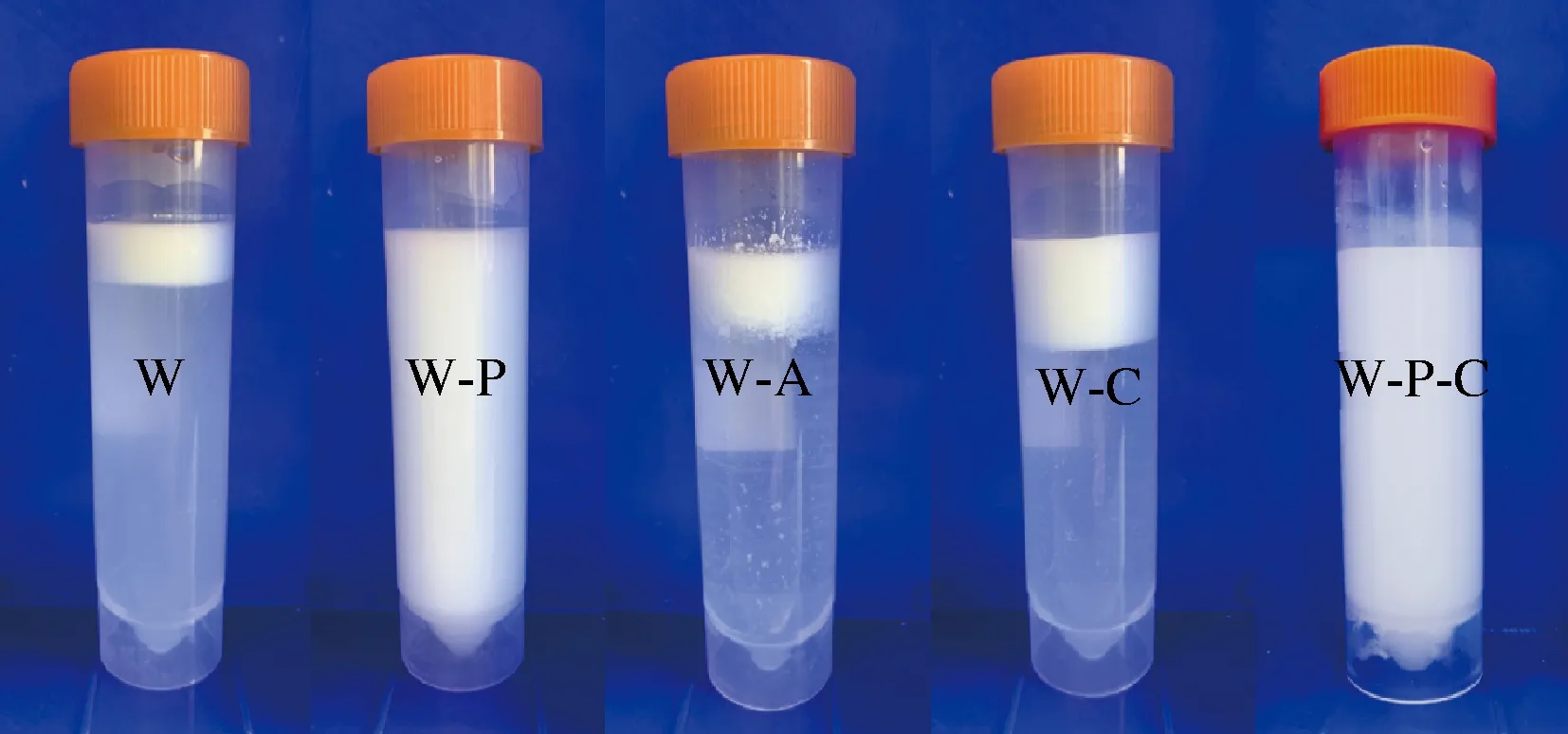
图5 各级乳状液经胃模拟消化后的相分离现象Fig.5 Phase separation of primary, secondary and tertiary emulsions after exposure to the simulated gastric digestion
2.3 乳液在小肠环境中的油脂消化速率
经过4 h的模拟消化后,各级乳液游离脂肪酸的最终释放比例均达到88%以上,接近完全消化(图6),说明油滴表面的蛋白或多糖在消化过程中逐渐解离下来,导致脂肪酶可直接吸附在油水界面并发生酶解。这些聚合物的解离现象可归因于以下几点:(1)因pH环境的变化,蛋白和多糖的带电量发生改变,静电吸附作用减弱,多层结构逐步解体;(2)胆盐因其较强的表面活性,可与界面上的蛋白和多糖分子竞争吸附[17-18];(3)作为油脂消化产物的2-单甘酯和游离脂肪酸也具有一定的表面活性,两者可替换部分蛋白和多糖。而这些亲脂性小分子物质无法抵抗油滴的聚结[19],导致后续脂肪酸的释放速率趋于平缓。
随着多层结构中吸附层数的增加,总游离脂肪酸释放量有所下降。消化初始阶段,部分PC由于其表面活性仍吸附在油滴表面,作为底物和消化酶间的物理屏障。随着消化时间的延续,CS在中性环境中的溶解度急剧下降,导致液滴出现絮凝或聚集现象,减少了胰脂肪酶的可作用面积。而CS又是弱的阴离子交换剂[20],可与胆盐结合,降低其增溶能力,促进消化产物在表面的积累,影响后续酶解反应的进行。
由图6-b可知,三级乳液相对于初级乳液,前2 h的游离脂肪酸释放量减少了20%以上,而后期则增加了10%以上。说明该多层结构可延缓油脂消化,但又不会完全抑制酶解。先前有学者通过体外模拟实验证明,在乳液外层添加CS有助于控制脂质消化速率,但继续添加PC时,反而降低了其延缓油脂消化的有效性,该研究认为当CS与阴离子聚合物形成复合物后,就不能有效抑制油脂消化[21]。这与本研究得到的实验结果存在差异,可能是因为层与层之间的吸附顺序不同导致各层的聚合物浓度也不同,在该研究构建的三级乳液中,少量的CS被体系中占比更大的PC所利用,影响了CS干扰油脂消化的能力。
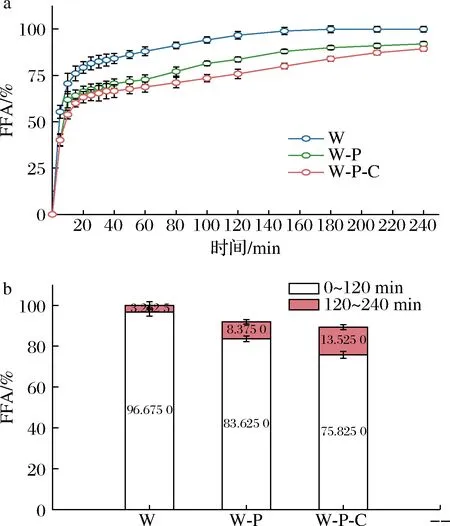
a-动力学曲线;b-前2 h和后2 h的总释放率图6 各级乳状液在小肠模拟消化过程中的游离脂肪酸释放情况Fig.6 Percent of released fatty acids during the simulated small intestinal digestion
3 结论
本研究以乳清分离蛋白为内层,分别以果胶、海藻酸钠、壳聚糖为外层构建多层乳液,探讨了不同界面组成对乳状液油滴在体外模拟胃肠道中的消化特性的影响。结果显示,只有由果胶构建的二级乳液以及由果胶和壳聚糖共同构建的三级乳液满足胃环境的酸稳定性要求,其可在2 h的胃模拟消化过程中保持较好的分层稳定性。其中,由果胶与壳聚糖共同包裹的三级乳液可进一步加剧油滴在小肠的中性环境中絮凝或聚结的程度。根据小肠阶段的体外模拟实验结果可知,随着乳状液界面组成层数的增加,油脂消化速率降低。同时,相对于初级乳液和二级乳液,三级乳液前期的游离脂肪酸释放量减少,而后期的游离脂肪酸释放量增加。因此,由果胶和壳聚糖构建的三级乳液具有延缓油脂消化能力,同时又不完全阻碍脂解反应,适用于生产通过诱导饱腹感效应来控制食欲的功能性食品。

