根肿病生防菌Zhihengliuella aestuarii B18定殖能力及防效分析
蒋欢 唐贵婷 吴朝君 张勇 彭玉梅 苏宇 赵冰峰 王旭祎

摘要 Zhihengliuella aestuarii B18是一株对十字花科根肿病菌Plasmodiophora brassicae具有抑制作用的优良生防菌株。为探明其生防潜能,本文通过抗生素抗性标记法、盆栽试验和田间小区试验研究了B18在不同土壤pH、土壤温度、土壤含水量、初始接种浓度、蔬菜作物以及不同土壤类型中的定殖动态。灭菌土试验結果表明:调节土壤pH 7.5~8.5,含水量10%~30%,放置于10~25℃,70 d后B18定殖菌量保持在105~107 cfu/g。盆栽试验结果表明:初始接种菌液浓度为109 cfu/mL时,45 d后根际土中定殖菌量可稳定在104~105 cfu/g。将50 mL浓度为2×109 cfu/mL的生防菌菌液接种于田间不同类型土壤后,第30天定殖菌量分别为病田8.7×105 cfu/g,病土1.02×105 cfu/g,健田8.5×104 cfu/g,健土2.6×104 cfu/g,即定殖能力由强到弱依次为:病田>病土>健田>健土。且病田中B18在根际土中可存活至45 d且菌量保持在104 cfu/g,根内可存活至31 d且菌量保持在104 cfu/g。田间调查结果显示B18在病田和病土中对榨菜根肿病的防效分别为4201%和47.53%,增产率分别为37.24%和40.22%。
关键词 生防菌; Zhihengliuella aestuarii B18; 定殖菌量; 根际土; 根肿病菌; 防效
中图分类号: S 436.344
文献标识码: A
DOI: 10.16688/j.zwbh.2020630
Analysis of the colonization ability and biocontrol efficacy of Zhihengliuella aestuarii B18 against clubroot disease
JIANG Huan, TANG Guiting, WU Chaojun, ZHANG Yong, PENG Yumei,
SU Yu, ZHAO Bingfeng, WANG Xuyi*
(Southeast of Chongqing Academy of Agricultural Sciences, Fuling 408099, China)
Abstract
Antagonistic Zhihengliuella aestuarii B18 is an excellent biocontrol strain which can inhibit Plasmodiophora brassicae. In order to explore its biocontrol potential, the colonization dynamics of B18 in different soil pH values, soil temperatures, soil water contents, initial inoculation concentrations, different vegetable crops and different soil types were studied by using antibiotic resistance labeling method and conducting pot experiments and field plot experiments. The results of sterilized soil test showed that, under the conditions of soil pH 7.5-8.5, water content 10%-30% and 10℃-25℃, the amount of colonized bacteria remained at 105-107 cfu/g after 70 days. The results of pot experiments showed that, when the initial inoculation concentration was 109cfu/mL, the amount of colonized bacteria in rhizosphere soil stably remained at 104-105 cfu/g after 45 days. When 50 mL of 2×109 cfu/mL biocontrol bacterial solution was inoculated in different soil types in the field, the amount of colonized bacteria on the 30th day was 8.7×105 cfu/g in the infected field, 1.02×105 cfu/g in the infected soil, 8.5×104 cfu/g in the healthy field, and 2.6×104 cfu/g in the healthy soil. These results indicated that, under different conditions, the colonization ability of B18 from strong to weak was as followed: infected field infected soil, healthy field and healthy soil. In the infected field, B18 could survive for 45 days in the rhizosphere soil with an amount of 104 cfu/g, and 31 days in the root with an amount of 104 cfu/g. The results of field investigation showed that B18 had control efficacy of 4201% and 47.53% against clubroot disease of mustard tuber in infected fields and infected soils, with yield increase rate of 37.24% and 40.22%, respectively.
Key words
biocontrol bacteria; Zhihengliuella aestuarii B18; colonization quantity; rhizosphere soil; Plasmodiophora brassicae; control effect
十字花科根肿病是由芸薹根肿菌Plasmodiophora brassicae Woron.引起的影响全球十字花科作物生产的土传病害[1]。在中国,根肿病常年危害面积占十字花科作物种植面积的 1/3以上,造成的产量损失达 20%~30%,发病严重田块产量损失可达 60%以上,有的甚至绝收[2-4]。根肿病菌是一种不可人工培养的专性寄生菌,病菌在土壤中存活时间长且有生理分化[5],经土壤、种子、流水等传播,防治十分困难。国内外针对该病原菌进行了大量防治技术的研究,包括抗病品种选育[6]、农业和化学防治[7-8]和生物防治[9-10],其中生物防治近年来越来越受到研究者的重视并初见成效。
生防微生物在实际应用中会受到诸多因素的影响,包括土壤环境条件的复杂性及多样性、土壤微生物之间的竞争、生防微生物与植物根部的亲和能力等,这通常也是造成生防菌在田间效果不稳定的重要原因。生防微生物被引入土壤后能否在寄主植物根围以及体内定殖关系到其对植物病害防效的稳定性和持续性,如果能成功定殖,则可少受或不受外界复杂生态环境的影响,充分发挥其防治植物病害的潜能。因此,生防菌在植物体内和根际土壤中的定殖能力是评定其是否具有产业化前景的一个重要指标。目前已发展出多种标记方法监测目标微生物施用后的定殖情况,常用的主要有抗生素抗性标记法[11-12]和荧光标记法[13-14]。抗生素抗性标记法具有简便、快捷、费用低等优点。任玉珍等[15]测定了艾草Artemisia argyi内生放线菌Ac10对4种抗生素(萘啶酸、利福平、氨苄西林、链霉素) 和5种杀菌剂(啶酰菌胺、啶菌噁唑、苯醚甲环唑、噁霜·锰锌、多抗霉素)的抗性,筛选出抗性菌株及其相应的抗药浓度,并采用加入相应浓度药剂的培养基,测定了Ac10在玉米、番茄、白菜和黄瓜4种植株体内的定殖能力及对这些植物胚轴和胚根生长的影响。Wu等[16]的研究表明,解淀粉芽胞杆菌Bacillus amyloliquefaciens SQY 162与有机肥混施后在盆栽和田间均可在烟草根际土壤中定殖并显著降低烟草青枯病的发病率。邱小燕等[17]的研究結果表明枯草芽胞杆菌B.subtilis菌株515-126在玉米植株的根际土壤、根表有很好的定殖能力,且在田间对玉米纹枯病相对防效达到49.37%。
Zhihengliuella aestuarii B18是一株从榨菜根际土壤中筛选出的对榨菜根肿病防治效果良好的菌株。为评价B18的潜在应用价值,有必要对B18的定殖能力进行全面的研究,本文通过抗生素抗性标记法对B18在土壤、榨菜根际以及根内定殖动态的影响因素进行研究,包括土壤pH、土壤温度、土壤含水量、菌悬液的初始接种浓度、不同蔬菜作物以及不同土壤类型对B18定殖能力的影响。以期为榨菜根肿病的防治以及B18在田间的应用提供可供参考的理论依据,具有理论和实践意义。
1 材料与方法
1.1 供试菌株、蔬菜种子以及培养基
供试菌株:根肿病菌菌根(未进行单孢分离)采自重庆市渝东南农业科学院根肿病试验田,-20℃保存;B18为本团队从榨菜根际土壤中筛选出的对榨菜根肿病防治效果良好的菌株,经鉴定其为刘志恒菌属真菌Zhihengliuella aestuarii,菌体于甘油中-80℃保存;MB18为B18抗利福平突变株,拮抗浓度为200 μg/mL。
供试蔬菜种子:榨菜Brassica juncea var.tumida‘涪杂2号,甘蓝B.oleracea var.capitata‘绿园4号,大白菜B.rapa var.glabra‘丰抗90。
豆粉液体培养基:大豆粉10.0 g,葡萄糖10.0 g,NaCl 2.5 g,蛋白胨 3.0 g,CaCO3 2.0 g,蒸馏水1 000 mL,pH 7.2~7.4;NA固体培养基:蛋白胨10.0 g,牛肉膏3.0 g,NaCl 5.0 g,琼脂粉15.0~18.0 g,蒸馏水1 000 mL,pH 7.0。
1.2 供试土壤的采集及处理
土壤采集自无根肿病菌的榨菜田,自然风干研碎后过40目筛,170℃干热灭菌2 h,翻搅再灭菌2 h,备用。
1.3 抗生素标记
吸取5 mL B18菌液接入含10 μg/mL利福平(Rif)的100 mL豆粉培养液中,180 r/min,30℃条件下振荡培养48 h后将菌液梯度稀释至10-6,吸取10-4、10-5和10-6 梯度的菌液100 μL涂布于含10 μg/mL Rif(记作Rif 10,下同)的NA平板,30℃黑暗倒置培养2~3 d,挑取单菌落于含更高浓度Rif的豆粉液体培养基继续培养,涂布于相同浓度的抗生素平板,每次培养液中Rif的浓度均增加20 μg/mL,直至200 μg/mL。然后用含Rif 200的NA平板检测并挑取能稳定生长,且抑制根肿病菌孢子萌发与野生型菌株差异不显著、菌落形态变化不大的突变菌株,命名为MB18。
1.4 根肿病菌孢子悬浮液制备
将-20℃保存的根肿病菌菌根(以下简称菌根)解冻洗净切成小块,按比例(m菌根∶m水=1∶5)加入纯水于榨汁机中打成匀浆,匀浆八层纱布过滤,滤液稀释至10-1、10-2、10-3后用血球计数板于显微镜下计数,计算滤液中的孢子浓度,最后将孢子浓度用纯水调至2×108个/mL备用。
1.5 MB18在不同pH,温度及含水量土壤中定殖菌量测定
每100 g供试土壤(处理方法见1.2)中加入MB18培养液(2×109cfu/mL)5 mL后做如下处理:1)加入无菌水10 mL,使含水量为15%,用HCl和NaOH粉末调节土壤pH至4.5、5.5、6.5、7.5、8.5和9.0(用HCl调节pH时记录加入的HCl体积V1,则加入无菌水的体积为10 mL-V1),室温(重庆涪陵4月日均气温约为16~25℃,下同)下放置;2)加入无菌水10 mL使含水量为15%,用NaOH粉末调节土壤pH(使用土壤pH计进行测定)至8.0~8.5之间,分别置于10、15、20、25、30、35℃和40℃黑暗培养;3)调节土壤pH至8.0~8.5之间,加入无菌水调节土壤含水量至5%、10%、15%、20%、25%和30%,室温下放置。
每处理3次重复,处理后每隔14 d对土壤中定殖菌量进行分离计数。
土样含菌数量(cfu/g)=每板平均菌落数×稀释倍数×基础液体积/[土样克数×(1-土样含水量) ×菌悬液加入量]。
式中,基础液体积:土样加入无菌水后的母液体积(mL);稀释倍数:母液进行梯度稀释后的倍数;菌悬液加入量:涂板时加入的菌液体积(mL)。
1.6 不同初始接种浓度下MB18在榨菜根际土以及根内定殖菌量测定
1.6.1 榨菜苗准备
将表面消毒(75%乙醇浸泡30 s,0.1%升汞浸泡5 min,灭菌水漂洗4次,晾干)的榨菜种子播种于营养基质上,于光照培养箱中28℃黑暗催芽2 d后,转移至组培架上(L∥D=16 h∥8 h,温度22℃)培养至两叶一心后移栽至无根肿病菌的榨菜土壤(土壤装于口径16 cm×高12 cm的塑料花盆中,每盆移栽1株)中,培养(L∥D=16 h∥8 h,温度22℃)7 d后做如下处理:
1)用移液枪分别吸取浓度为2×107、2×108、2×109 cfu/mL的MB18菌液接种于榨菜苗根围土壤中,每株10 mL;
2)用移液枪分别吸取浓度为2×107、2×108、2×109 cfu/mL的MB18菌液和浓度为2×108个/mL的根肿病菌休眠孢子悬浮液接种于榨菜苗根围土壤中,每株10 mL MB18菌液+10 mL根肿病菌休眠孢子悬浮液。
每处理移栽20株,第10天采集根际土和榨菜苗进行MB18分离计数,以后每7 d取样1次,最后1次取样为接种后45 d,共取样5次,每次每處理采集3株榨菜苗及其根围土壤。
1.6.2 根际土的采集及根际土中MB18定殖菌量测定
将植株整个根系完整挖出后,用采样铲轻敲根系,使与根系结合较松的土壤自然落下后弃去。将与根系紧密结合的土壤连同根系放入自封式采样袋,用手轻轻揉搓根系,使与根系结合较紧密的土壤落入采样袋中,所得样品即为根际土。取两份根际土,一份用于烘干后测定含水量,一份用于菌落计数。
1.6.3 根内MB18定殖菌量测定
分离根内标记菌株时,先将根组织进行表面消毒。用70%乙醇浸泡3 min,再经NaClO消毒5 min,然后用70%乙醇浸泡1 min,最后无菌水冲洗4次,取最后1次冲洗材料的无菌水100 μL涂平板,检测表面消毒是否彻底。后取1 g无菌材料置于研钵中,加9 mL无菌水研磨后静置15 min,取上清液梯度稀释后涂布于Rif 200的NA平板进行菌落计数。
每克土样含菌数量计算方法同1.5。
每克根组织含菌数量(cfu/g)=单菌落数×10×稀释倍数/根组织克数。
1.7 MB18在不同蔬菜作物(榨菜、甘蓝、大白菜)的根际土以及根内定殖菌量测定
菜苗准备方法同1.6.1,菜苗移栽后做如下处理:
1)用移液枪吸取浓度为2×109 cfu/mL的MB18菌液分别接种于榨菜苗、甘蓝苗和白菜苗根围土壤中,每株10 mL;2)用移液枪分别吸取浓度为2×109 cfu/mL的MB18菌液和浓度为2×108个/mL的根肿病菌休眠孢子悬浮液接种于榨菜苗、甘蓝苗和白菜苗根围土壤中,每株10 mL MB18菌液+10 mL根肿病菌休眠孢子悬浮液。
每处理移栽20株,样品采集方法、时间以及菌株定殖菌量的测定方法同1.6。
1.8 MB18在田间定殖菌量的测定及对榨菜根肿病的防治效果
从苗床拔出榨菜苗后分别在浓度为2×109 cfu/mL的MB18和B18菌液中浸根30 min后移栽至田间,同时用菌液进行灌根,处理如下:
1)病土(有根肿病旱地,下同)中榨菜苗用B18菌液浸根后每窝浇灌50 mL,3个重复(用于榨菜成熟时调查病情);用MB18菌液浸根后每窝浇灌50 mL,6个重复(其中3个用于榨菜成熟时调查病情,另3个用于田间定殖能力测定);2)病田(有根肿病水旱轮作地,下同)中榨菜苗处理同病土;3)健康土(无根肿病旱地)与健康田(无根肿病水旱轮作地)中榨菜苗用MB18菌液浸根后每窝浇灌50 mL,3个重复,用于田间定殖能力测定;4)CK:病土与病田中榨菜苗用相应的无菌培养液代替生防菌菌液浇灌,每窝50 mL,3个重复。
试验采取随机区组设计,每个小区长4 m,宽17 m,移栽60株,田间常规管理。第1次取样于移栽后10 d进行,以后每7 d取1次样。榨菜成熟时调查发病率、病情指数以及产量。
榨菜根肿病田间分级标准参照高明泉等[18]的分级方法。
产量测定:榨菜植株去除根部以及叶片,剩余的瘤茎用于产量测定。
病株率=发病株数/总株数×100%;
病情指数=∑(病级代表值×各级病株数)×100/(调查总株数×最高级病级代表值);
防治效果=[(对照病情指数-处理病情指数)/对照病情指数]×100%。
1.9 数据统计与分析
试验数据用SPSS 26.0软件中邓肯氏新复极差法进行差异显著性分析。
2 结果与分析
2.1 抗生素标记
标记菌株MB18与野生型菌株B18相比较,菌落形态与颜色无变化(图1),对根肿病菌休眠孢子的抑制率分别为71.85%(MB18)和73.89%(B18),抑制作用相当,可用于后续的定殖试验。
2.2 MB18在不同温度、pH和含水量的土壤中的定殖菌量
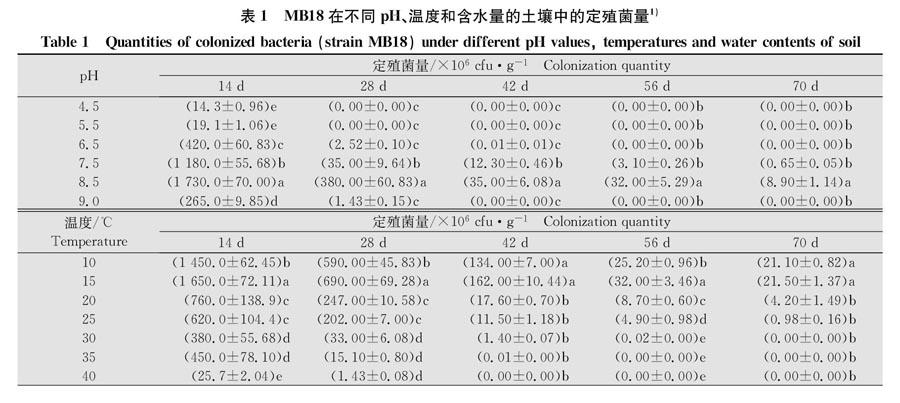
温度、土壤pH和含水量对MB18定殖影响显著(表1),MB18对pH敏感,土壤pH 7.5和8.5时定殖菌量最大且定殖时间长,接菌后70 d菌量仍可达6.5×105、8.9×106 cfu/g。pH 4.5~5.5时接菌后菌量迅速降低,第28天时菌量降为0。
MB18定殖能力随温度升高而逐渐减弱,温度越高,菌量减少得越快。10℃和15℃定殖菌量显著高于其他温度,接菌后70 d时菌量仍可达2.1×107 cfu/g,40℃下定殖菌量最低,接菌后42 d菌量降为0。
MB18定殖能力随土壤含水量升高而增强,土壤含水量为30%时定殖菌量最大,接菌后70 d菌量为3.8×107 cfu/g。土壤含水量5%时定殖菌量最低,接菌后56 d菌量降为0。
2.3 不同初始接种浓度下MB18在榨菜根际以及根内的定殖菌量
不同初始接种浓度对MB18定殖影响显著(表2),榨菜根际土以及根内定殖菌量隨接种浓度升高而增加,在接种浓度为109 cfu/mL 时定殖菌量最大,107 cfu/mL时定殖菌量最小;同一接种浓度下,当接种浓度为107 cfu/mL时,含根肿病菌的根际土中定殖菌量与无根肿病菌根际土中定殖菌量无显著差异,接种浓度为108 cfu/mL和109 cfu/mL时,接种后10~17 d,含根肿病菌的根际土中定殖菌量显著高于无根肿病菌的根际土;接种后24 d二者无显著差异,接种后31~45 d根肿病菌根际土定殖菌量低于无根肿病菌根际土。
MB18在根际土中定殖菌量高于根内,定殖时间也长于根内;根际土中在接种后45 d时各接种浓度下仍可回收到MB18;榨菜根内,接种浓度为108 cfu/mL和109 cfu/mL时,在接种后31 d及以后回收不到MB18,接种浓度为107 cfu/mL时,在接种后24 d及以后回收不到MB18。
2.4 MB18在不同蔬菜作物(榨菜、甘蓝、大白菜)的根际以及根内的定殖菌量
分别测定不同蔬菜作物根际土以及根内MB18定殖菌量,结果(表3)显示,菌株在不同蔬菜作物中定殖规律基本一致。根际土中定殖菌量在接种后24 d高于根内,且持续时间长于根内,接种后45 d菌量可稳定在104 cfu/g。根内接种后31 d菌量为0;除个别处理外,总的趋势为:接种后10~24 d接种根肿病菌的根际土中及根内定殖菌量高于无根肿病菌的处理。接种后31 d根内定殖菌量均为0。
2.5 MB18在田间定殖菌量测定
不同土壤类型对MB18定殖菌量影响显著(表4)。定殖菌量规律为:感染根肿病菌土壤中定殖菌量高于健康土壤,水旱轮作地(田)高于旱地(土),即病田>病土>健田>健土;根际土中定殖菌量高于根内,定殖时间长于根内;病田根际土中接种后45 d MB18定殖菌量为5.3×104 cfu/g,其余田块菌量为0;病田根内接种后31 d定殖菌量为4.2×104 cfu/g,其余田块根内菌量为0。
2.6 田间调查结果
MB18以及B18在田间对榨菜根肿病的防治效果如表5所示,结果显示经过MB18和B18处理后榨菜根肿病发病率和病情指数显著低于对照,产量显著高于对照,且两菌株之间的发病率、病情指数以及产量差异不大;MB18与B18对榨菜根肿病的防效明显,均在38%以上,榨菜产量也显著增加,增产率均在30%~40%之间。
3 结论与讨论
探究生防菌在施用过程中的定殖特性及其作用机制对于提高生防效果以更好地应用于生产意义重大[13]。多数生防菌在实验室内有很高的抑菌活性,但是在田间防效却不理想,这就要求研究者在研究生防菌自身理化性质的基础上,进一步研究影响生防菌定殖的土壤环境因素,优化生防菌在田间的生存环境,延长其在田间的存活时间,以便发挥更佳的防病效果。
研究表明,土壤pH对生防菌的定殖影响较大,不同生防菌对pH适应范围不同。Ownley等[19]研究发现生防菌荧光假单胞菌Pseudomonad fluorescens 2-79 在pH 为 6.0~6.6 时的定殖效果最好。马桂珍等[20]和王淑芳等[21]报道生防菌L1-9在酸性条件下对禾谷镰刀菌 Fusarium graminearum 抑菌活性稳定,且在土壤pH 7时在黄瓜根表土壤中定殖能力最好,速度最快。蒋欢等[22]研究发现,榨菜根肿病发病土壤pH主要分布在4.0~7.0,其中pH 5.0~60的土壤最多,在土壤pH 4.5~6.0时根肿病菌休眠孢子萌发率高且榨菜发病严重。本试验结果表明,B18对pH敏感,若土壤pH低于5.5,B18在土壤中的存活时间约为21 d,且0~21 d之间随着时间的延长菌量急剧减少。故B18田间防效不稳定的最主要原因可能是根肿病田土壤偏酸性,不利于菌株在植株根围的定殖,从而导致防效不佳。
土壤温度也是影响生防菌定殖的重要因素。Loper[23]报道低温有利于生防菌的定殖,可能是因为土壤中微生物的活动随温度降低而减弱,故与外源菌的竞争作用也随之减弱。党文芳[24]等的研究表明,生防菌贝莱斯芽胞杆菌Bacillus velezensis BHZ-29在土壤温度30℃时生长最好。本研究结果显示B18对土壤温度适应范围较广,10~25℃之间均能很好地存活至70 d而保持菌量在105~107 cfu/g,但10~15℃下B18定殖菌量更高,这与冬季栽培的十字花科作物移栽时的温度相近,故有利于B18对根肿病的控制。
生防菌在田间需要借助土壤自由水才能转移到植物根围土壤的生态位点上,所以土壤湿度影响着生防菌的定殖。杜婵娟等[25]的研究结果显示当土壤含水量为25%时,生防菌哈茨木霉gz-2在土壤中的定殖能力最好,王素芳等[26]和汪军等[27]的研究结果显示链霉菌 Streptomyces sp. S506和淡紫拟青霉 Paecilomyces lilacinus E7等拮抗菌在土壤含水量20%~25%时定殖最好。本研究结果显示B18在土壤含水量10%~30%之间都能很好地存活70 d且保持菌量在105~107 cfu/g,在土壤含水量30%时,定殖菌量显著高于其他处理。说明B18同其他生防菌一样,适合土壤含水量高的环境。
本研究显示,在初始接种浓度为109 cfu/mL时,B18定殖菌量最大,故田间施用109cfu/mL B18更有利于根肿病菌的防治。贾瑞敏等[28]的研究发现,生防菌浓度对甘蓝种子的萌发率、甘蓝苗期和结球期生长情况以及甘蓝根肿病的防效都存在显著影响,高浓度的生防菌对甘蓝种子萌发和幼苗生长均有抑制作用。因此,在实际应用中,筛选出生防菌对植株的最佳施用浓度才能更好地发挥其拮抗作用。另外B18在接种根肿病菌的榨菜根际土以及根内的定殖菌量在接种后10~24 d高于没有接种根肿病菌的处理,可能是因为根肿病菌与B18的竞争激发了B18的拮抗作用,从而使更多的B18定殖于植株根围与根内以抵抗病原菌,说明B18具有潜在的应用价值。
B18在不同蔬菜作物根际土以及根内定殖规律相似,说明B18应用范围不只局限于榨菜,可用于不同的十字花科作物。
B18在田间的定殖规律与室内盆栽试验结果一致,即根际土定殖菌量与定殖时间均高于根内,且带菌土壤高于健康土壤,水旱轮作地(田)高于旱地(土),即病田>病土>健田>健土,生防菌在田间存活时间为31~45 d,说明田间单独施用B18菌液后菌量迅速减少直至死亡,存活时间短,导致其防效不佳,故后续有必要将B18制备成菌肥或菌剂,以保证其在田间的菌量与存活时间。
综上所述,生防菌株B18对pH敏感,对土壤温湿度适应范围较广,但在10~15℃的低温以及土壤含水量25%~30%的环境下定殖菌量更高且定殖时间更长,田间施用浓度为109 cfu/mL较为合适,可施用于不同的十字花科作物以防治根肿病。但施用于田间后菌量迅速减少,定殖时间短,导致对榨菜根肿病的防效不稳定,故B18需固定于合适的载体上,如与生物质碳或偏碱性的有机肥等混合后再施入田间,首先满足B18对pH的要求,其次为B18 提供营养以及保护,以延长其在田间的存活时间,从而提高其对根肿病的田间防效。
参考文献
[1] DIXON R. The occurrence and economic impact of Plasmodiophora brassicae and clubroot disease [J]. Journal of Plant Growth Regulation, 2009, 28(3): 194-202.
[2] CHAI Ali, XIE Xuewen, SHI Yanxia, et al. Special issue: research status of clubroot (Plasmodiophora brassicae) on cruciferous crops in China [J]. Canadian Journal of Plant Pathology, 2014, 36(S1): 142-153.
[3] 王靖, 黄云, 李小兰, 等. 十字花科根肿病研究进展[J]. 植物保护, 2011, 37(6): 153-158.
[4] 柴阿丽, 朱發娣, 王惟萍, 等. 我国芸薹根肿菌遗传类群分化研究[J]. 华北农学报, 2015, 30(S1):309-315.
[5] HATAKEYAMA K, SUWABE K, TOMITA R N, et al. Identification and characterization of Crr1a, a gene for resistance to clubroot disease ( Plasmodiophora brassicae Woronin) in Brassica rapa L. [J/OL]. PLoS ONE, 2013, 8(1): e54745, 10.1371/journal.pone.0054745.
[6] 王静. 十字花科抗根肿病种质的筛选及应用[D]. 杨凌:西北农林科技大学, 2019.
[7] 常文程, 刘彬, 张陈文, 等. 应用非化学防治技术防控十字花科作物根肿病[J]. 上海蔬菜, 2019(5):86-88.
[8] 陈秀, 张颂函, 张正炜, 等. 4种杀菌剂不同处理模式防治甘蓝根肿病田间药效评价[J]. 农药科学与管理, 2018, 39(4): 51-54.
[9] LAHLALI R, MCGREGOR L, SONG T, et al. Heteroconium chaetospira induces resistance to clubroot via upregulation of host genes involved in jasmonic acid, ethylene, and auxin biosynthesis [J/OL]. PLoS ONE, 2014, 9(4): e94144, 10.1371/journal.pone.0094144.
[10]FU Lina, LI Hanmei, WEI Lanfang, et al. Antifungal and biocontrol evaluation of four lysobacter strains against clubroot disease [J]. Indian Journal of Microbiology, 2018, 58(3): 353-359.
[11]王卿, 林玲, 罗楚平, 等. 生防内生枯草芽孢杆菌 Jaas ed1在西瓜植株内的定殖能力检测[J]. 西南农业学报, 2015, 28(5): 2079-2085.
[12]王恒煦, 刘泽平, 王志刚, 等. 3株芽孢杆菌在水稻根际定殖促生及其在土壤中的存活[J]. 生态与农村环境学报, 2019, 35(7): 892-899.
[13]祁超, 寸海春, 何鹏飞, 等.生防菌YN201490 在黄瓜植株体内的定殖能力及防病机制的初步研究[J]. 云南大学学报(自然科学版), 2019, 41(1): 172-180.
[14]刘海洋, 姚举, 张仁福, 等. 甲基营养型芽胞杆菌AL7对棉花黄萎病的盆栽防治效果及定殖能力[J]. 中国生物防治学报, 2017, 33(3): 378-384.
[15]任玉珍, 杨琴琴, 李润润, 等. 艾草内生放线菌 Ac10 在植株体内定殖能力的测定[J]. 云南农业大学学报 (自然科学),2016,30(2): 358-362.
[16]WU Kai, YUAN Saifei, WANG Lili, et al. Effects of bioorganic fertilizer plus soil amendment on the control of tobacco bacterial wilt and composition of soil bacterial communities [J]. Biology and Fertility of Soils, 2014, 50(6):961-971.
[17]邱小燕, 张敏, 胡晓, 等. 枯草芽孢杆菌的定殖能力及对玉米纹枯病的防治效果[J]. 四川农业大学学报,2010,28(4):492-496.
[18]高明泉, 彭洪江, 王旭祎, 等. 涪陵榨菜根肿病的危害与产量损失测定[J]. 植物保护, 2002, 28(6): 31-33.
[19]OWNLEY B H, WELLER D M, THOMASHOW L S. Influence of in situ and in vitro pH on suppression of Gaeumann-omyces graminis var. tritici by Pseudomonas fluorescens 2-79 [J]. Phytopathology, 1992, 82(2): 178-184.
[20]马桂珍, 付泓润, 王淑芳, 等. 海洋多粘类芽孢杆菌L1-9 菌株发酵液抗菌谱及稳定性测定[J]. 海洋通报, 2013, 32(3): 316-320.
[21]王淑芳, 汪晶晶, 曹雪梅, 等. 土壤因子对海洋多粘類芽胞杆菌L1-9在黄瓜根表土壤定殖的影响[J]. 中国生物防治学报, 2017, 33(5): 675-680.
[22]蒋欢, 彭玉梅, 董代文, 等. 土壤酸碱度与榨菜根肿病的关系分析[J]. 南方农业学报, 2017, 48(9): 1617-1623.
[23]LOPER J E. Lognormal distribution of bacterial population in the rhizosphere [J]. Phytopathology, 1984, 74(12): 1456-1460.
[24]党文芳, 李雪艳, 杨红梅, 等. 土壤因子对棉花黄萎病拮抗菌Bacillus velezensis BHZ-29数量及抑菌活性的影响[J]. 西南农业学报, 2020, 33(8): 1709-1715.
[25]杜婵娟, 付 岗, 潘连富, 等. 哈茨木霉gz-2菌株在土壤中的定殖规律研究[J]. 西南农业学报, 2016, 29(1): 138-142.
[26]王素芳, 王占武, 李洪涛, 等. 土壤因子对链霉菌S506定殖和促生功能的影响[J]. 中国生态农业学报, 2009, 17(2): 335-338.
[27]汪军, 潘江禹, 毛超, 等. 土壤物理因素和栽培方式对淡紫拟青霉E7在香蕉根际定殖和促生作用的影响[J]. 果树学报, 2013, 30(2): 274-280.
[28]贾瑞敏, 胡礼芳, 王彤彤, 等. 三株生防菌对甘蓝根肿病的防治效果及促生作用研究[J]. 中国生物防治学报, 2020, 36(3): 405-413.
(责任编辑:杨明丽)

