甜菜夜蛾化学感受蛋白SexiCSP2结合特性和机理研究
邓培渊 王林青 袁洪哲 李长看


摘要 为阐明甜菜夜蛾Spodoptera exigua化学感受蛋白识别外源化合物的特性和作用机制,运用Western blotting法分析SexiCSP2蛋白在成虫各组织的表达谱,荧光竞争结合试验法测定SexiCSP2蛋白与25种外源配基的结合特性,运用分子对接、分子动力学、结合自由能计算等方法研究SexiCSP2与配基的结合模式。结果显示SexiCSP2在成虫接触和非接触性器官中均有表达,与己醛结合能力最强,解离常数为1.3 μmol/L;分子模拟结果显示SexiCSP2与己醛结合形成1个氢键,两者结合自由能为-32.94 kJ/mol,主要驱动力为范德华力,主要抑制力为非极性溶剂化能。这些结果说明SexiCSP2在甜菜夜蛾识别外源化合物中起重要作用,可以作为防控甜菜夜蛾的有效靶标。
关键词 甜菜夜蛾; 化学感受蛋白; Western blotting; 荧光竞争结合试验; 分子动力学
中图分类号: Q 966
文献标识码: A
DOI: 10.16688/j.zwbh.2020372
The binding specificity and mechanism of chemosensory protein SexiCSP2 in the beet armyworm, Spodoptera exigua
DENG Peiyuan, WANG Linqing, YUAN Hongzhe, LI Changkan*
(Zhengzhou Normal University, Research Centre of Biological Species Resources, Zhengzhou 450044, China)
Abstract
To determine the binding characteristics and mechanism of Spodoptera exigua chemosensory proteins (CSPs) in discriminating exogenous compounds, the expression profiles of SexiCSP2 in adult tissues were analyzed by Western blotting, the binding specificities of SexiCSP2 and 25 foreign ligands were tested through fluorescence competitive binding assay. Moreover, the binding pattern was studied by using molecular docking, molecular dynamics simulation and binding free energy calculation methods. The results showed that SexiCSP2 was expressed in both contact and non-contact organs. It had a strongest binding ability to hexanal with a dissociation constant of 13 μmol/L. Molecular simulation results showed that hexanal formed a hydrogen bond with SexiCSP2, and the binding free energy was -32.94 kJ/mol; the van der Wals was the main driving force, and the nonpolar solvation energy was the main resistance force. These data indicated that SexiCSP2 might play an important role in the process of discriminating exogenous compounds and could be used as an effective target for the prevention and control of S.exigua.
Key words
Spodoptera exigua; chemosensory protein; Western blotting; fluorescence competitive binding assay; molecular dynamics
昆蟲之间以及昆虫与外界环境之间联系主要靠化学通讯来完成,研究发现昆虫触角感受器中存在几类在感受外界化学信息过程中起关键作用的蛋白,如气味结合蛋白(odorant binding protein, OBP)[1-2]和化学感受蛋白(chemosensory protein, CSP)[3]等。它们与昆虫寻找寄主、交配产卵、躲避天敌等行为密切相关[4]。OBP主要结合和转运挥发性的化合物,CSP主要结合和转运非挥发性的化合物,与OBP相比,CSP的分布和功能更加多样化[5],如烟芽夜蛾Heliothis virescens的CSP在足部有较高的表达量[6];东亚飞蝗Locusta migratoria的部分CSP在生殖器中特异表达[7];美洲大蠊Periplaneta americana的PameP10在新生足中的表达量是正常足的30倍,可能参与了足的再生[8];甜菜夜蛾SexiCSP3在雌虫卵巢中的表达量远高于其在雄虫精巢中的表达量,参与调控产卵行为[9];意大利蜜蜂Apis mellifera ligustica的CSP5在卵中特异表达,影响了幼虫体壁的发育[10]等。尽管关于依据CSP时空表达分析其生理功能已有大量报道,但目前为止没有被广泛认同的假说,一般认为参与化合物的结合和释放是其主要功能之一[11],如东亚飞蝗CSPⅡ与直链油酸酰胺特异结合[12],甜菜夜蛾SexiCSP3能有效结合芳香族化合物[13],甘蓝夜蛾Mamestra brassicae的MbraCSPA6与含12~18个碳原子的长链脂肪烃类化合物及其卤代物结合能力较强[14],这些研究表明CSP参与了昆虫对外界化合物的感受和结合,但仍缺乏更深入的机理研究。
甜菜夜蛾是一种为害粮、棉、蔬菜等多种作物的多食性和间歇性暴发的重要农业害虫,特别是在高龄幼虫阶段大量取食叶片,剥食植物茎秆,对作物造成毁灭性的损害[15],对其嗅觉相关蛋白功能的研究是探索有效防治方法的重要途径。研究发现SexiCSP2基因广泛分布于嗅觉组织和非嗅觉组织[9],推测其可能有重要生理功能。本试验以其为研究对象,采用Western blotting方法检测其在蛋白水平的表达谱;并以1-NPN为荧光探针,利用纯化的重组SexiCSP2蛋白进行荧光竞争结合试验,参考Li等[16]和Qiao等[17]的方法,测定其与25种绿色植物挥发物[18]和虫害诱导挥发物[19]的结合能力;运用分子模拟分析SexiCSP2与气味分子间的结合模式和关键氨基酸;为阐明化学感受蛋白作用的分子机制提供理论依据。
1 材料与方法
1.1 供试昆虫
在相对湿度为70%~80%,室温26℃,光周期L∥D=14 h∥10 h条件下,在郑州生物物种资源研究重点实验室以人工饲料[20]饲养甜菜夜蛾。成虫以5%的蜂蜜水补充营养。
1.2 主要试剂、材料和仪器
总RNA提取试剂盒、第一链cDNA合成试剂盒、限制性内切酶购自TaKaRa公司,pfu DNA聚合酶,T4连接酶和预染蛋白Marker购自Ferments公司,1-NPN和配基化合物购自Sigma公司,碱性磷酸酶(AP)标记的IgG及相关试剂购自Amersco公司,荧光光度计型号为Jasco FP-750。分子模拟试验在河南省涉鸟故障工程技术研究中心YASARA分子模拟平台完成。
1.3 引物设计和cDNA模板的制备
1.3.1 引物设计
依据甜菜夜蛾SexiCSP2成熟编码框序列(EF186794.1)设计引物,上游引物:5′-AACATATG-
CGGCCCGACGACTCCCACT-3′;下游引物:5′-GCGAATTCAATTCGGAACTAGAAGAACT-3′。引物前两位为保护碱基,3~8位分别为 NdeⅠ和EcoRⅠ酶切位点。
1.3.2 组织粗蛋白的提取和触角第一条链cDNA的合成
分别取羽化后3 d的雌、雄成虫触角、头、翅、足、胸、腹各约5 mg提取粗蛋白,并提取雄虫触角总RNA,并按照试剂盒说明书合成cDNA。
1.4 SexiCSP2基因的克隆和表达
扩增反应体系(20 μL):取1.3.2中合成的雄虫触角cDNA约50 ng, 2 μL 10×PCR buffer,1.6 μL dNTP mix,正反引物(10 μmol/L)各1 μL,pfu酶(5 U/μL)0.2 μL,其余为超纯水。扩增反应程序:95℃预变性4 min;95℃变性30 s,60℃退火30 s,72℃延伸30 s,30个循环; 72℃延伸10 min,以超纯水替代cDNA做阴性对照。
上述扩增产物和载体pET-30b(+)经NdeⅠ和EcoRⅠ双酶切后连接,转化BL21(DE3)感受态细胞,鉴定正确的重组子37℃培养至OD600为0.7,加入IPTG(终浓度为0.4 mmol/L)培养4 h,SDS-PAGE电泳检测重组蛋白的表达。
1.5 重组蛋白的复性和纯化
为确定重组蛋白的表达形式,诱导表达细胞超声波破碎后经12 000 r/min离心沉淀,运用SDS-PAGE电泳法分别检测上清液和沉淀,若重组SexiCSP2蛋白为包涵体,加入尿素(终浓度8 mol/L)和二硫苏糖醇(1 mol/L)低温破碎,于4℃ 12 h透析3次使蛋白复性。重组SexiCSP2蛋白运用离子交换层析(DE-52)和分子筛(Superose-12)法[16]依次纯化。
1.6 蛋白质印迹(Western blotting)检测
试验共免疫3只新西兰大白兔,将含200 μg重組蛋白的蛋白溶液与同体积的弗氏完全佐剂混合使其充分乳化后在大白兔背部皮下多点注射,每隔1周用弗氏不完全佐剂替代弗氏完全佐剂乳化蛋白加强免疫1次,共4次,末次免疫7 d后取血,分离血清。
按照AP(碱性磷酸酶)标记的羊抗兔IgG试剂盒说明书方法,以制备的兔多克隆抗体为一抗,AP标记的羊抗兔IgG为二抗,以粗提的各组织蛋白为抗原,检测SexiCSP2蛋白表达谱。
1.7 荧光竞争结合试验
1.7.1 SexiCSP2蛋白与1-NPN结合常数的测定
设定337 nm激发光波长,扫描发射光350~500 nm波长范围,在4 μmol/L SexiCSP2蛋白中加入2~16 μmol/L的1-NPN,反应2 min,记录峰值位置和强度变化。
1.7.2 配体与SexiCSP2蛋白结合常数的测定
在4 μmol/L SexiCSP2蛋白中加入8 μmol/L的1-NPN,分别加入不同浓度的外源配体(表1),扫描350~500 nm波长范围。
1.7.3 数据分析
运用GraphPad Prism 5软件计算蛋白和荧光探针1-NPN的解离常数K1-NPN值。 假定蛋白中配基的结合位点数为1,根据竞争配基
替换50% l-NPN时的浓度(IC50)和自由 l-NPN浓度([1-NPN])计算配基的解离常数Ki。
Ki=IC50/(1+[1-NPN])/K1-NPN
1.8 SexiCSP2与气味分子结合的分子模拟
1.8.1 SexiCSP2模型和化合物结构的获取
运用YASARA程序的同源建模模块构建SexiCSP2的三维结构模型,运用ChemBioOffice 10.0软件构建与SexiCSP2结合能力最强(解离常数Ki值最小)的化合物的三维结构模型,并进行能量最小化优化。
1.8.2 SexiCSP2与配体的分子对接
以SexiCSP2为受体,结合能力最强外源化合物为配体,运用YASARA分子模擬软件进行结构优化,包括去H2O、加H质子化和添加缺失原子[21];运用AutoDock 4.0进行刚性分子对接,化合物的自由旋转键由程序自动识别,对接结果运用拉马克遗传算法,能量匹配通过半经验自由能的计算方法进行评价[22]。
1.8.3 分子动力学模拟
运用YASARA平台md_run.mcr程序包进行分子动力学模拟,SexiCSP2和小分子的对接复合物溶于TIP3P显性H2O模型中,设为周期性边界条件,溶质与模型边界的最小距离为7 ,体系中添加0.9%的 Cl-平衡多余的正电荷。模拟在pH 7.4和298 K和1个大气压条件下进行,采用NVT正则系综,SHAKE算法[23]限制H原子键的收缩,积分步长为2 fs, 采样间隔为50 ps,均方根偏差(root mean square deviation,RMSD)值达到平衡状态后继续运行不少于5 ns。
1.8.4 结合自由能计算和残基能量分解
采用MM-PBSA(molecular mechanics-Poisson-Boltzmann surface area)方法[24]计算溶液环境下配体和蛋白的结合自由能。能量值进一步细分为4项,公式如下:
ΔG=ΔEele+ΔEvdw+ΔGpb+ΔGnopolar
公式中ΔG为结合自由能,ΔEele为静电作用力,ΔEvdw为范德华力,ΔGpb为极性溶剂化能,ΔGnopolar为非极性溶剂化能。
2 结果与分析
2.1 SexiCSP2基因的原核表达和重组蛋白的纯化
反转录RT-PCR方法扩增出SexiCSP2基因,并成功构建pET-30b-SexiCSP2重组子,经测序验证:SexiCSP2基因序列与GenBank公布的序列一致,并与pET-30b正确连接。
如图1所示:IPTG诱导重组子pET-30b-SexiCSP2表达后,在约14 kD处生成一条特异性条带,诱导的空载体pET-30b(+)和未经诱导的pET-30b-SexiCSP2无此条带,说明SexiCSP2基因在细菌中得到了正确表达。
大量表达pET-30b-SexiCSP2,超声破碎后离心,检测发现重组蛋白大部分存在于沉淀中,说明重组蛋白以包涵体的形式存在;在沉淀中加 8 mol/L 尿素和 1 mol/L 二硫苏糖醇破碎包涵体,纯化后得到高纯度的重组蛋白,无明显的杂带(图1泳道4)。
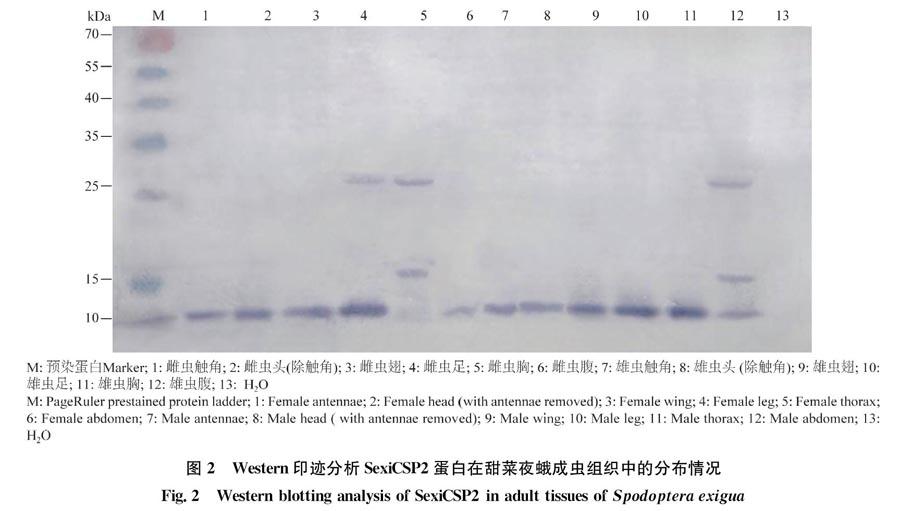
2.2 SexiCSP2的Western blotting检测
检测SexiCSP2蛋白在成虫各组织的分布发现:除雌虫胸和腹部外,其他部分均有较强的杂交信号,雌雄个体间有一定差异(图2)。
2.3 荧光竞争结合试验
设置激发光波长337 nm扫描SexiCSP2蛋白与1-NPN复合物,4 μmol/L SexiCSP2蛋白逐步加入0~12 μmol/L 1-NPN时荧光强度显著增加(图3),计算1-NPN的解离常数为1.78 μmol/L;通过竞争结合试验测定配基(表1)与SexiCSP2蛋白的结合能力,结果如图4和表1所示:SexiCSP2与己醛结合能力最强,解离常数为1.3 μmol/L,与对甲基苯酚、邻羟基苯甲醛、间甲基苯酚和苯乙酮结合能力次之,解离常数分别11.7,10.8,18 μmol/L和21.2 μmol/L,与苯基乙醇和2-庚酮结合能力较弱,解离常数分别42.2 μmol/L和75 μmol/L;其他配基浓度达到200 μmol/L时复合物荧光强度没有显著变化。
2.4 分子对接研究
2.4.1 SexiCSP2的同源建模
经同源搜索,发现3个与目的蛋白序列具有较高相似性的模板,故采用多源建模,3个模板登录号及相似性分别为:1NBV(65%),2JNY(57%),2VGS(54%),Z-score值为0.782,模型经动力学优化后保存模型。
2.4.2 SexiCSP2与己醛对接结果
因SexiCSP2的活性位点不明确,与己醛对接中设置80×87×90的栅格盒子覆盖SexiCSP2整个空间结构,格点间距为0.375 ,聚类分析后选取柔性强和结合能量低的构型为最优结合模式(图5),对接结果表明己醛结合于SexiCSP2结合腔的底部,并与Ala58形成一个氢键,键长为2 。
2.4.3 对接复合物的分子动力学模拟
为验证对接复合物的稳定性,运用分子动力学模拟分析单体和对接复合物中SexiCSP2主链原子的均方根偏差(RMSD),由图6可以看出:在约15 ns时复合物RMSD在3.5 左右波动,表明体系趋于收敛平衡;稳定状态时单体SexiCSP2的RMSD在5 左右波动,RMSD值高于复合物中SexiCSP2的RMSD值,表明己醛的结合使SexiCSP2结构更加稳定,说明分子对接的结果是可靠的。
2.4.4 结合自由能的计算和能量分解
基于MM-PBSA方法计算SexiCSP2和己醛结合自由能为-32.94 kJ/mol(表2)。说明SexiCSP2和己醛的结合能自发进行。结合自由能的分解发现静电作用力、范德华力和非极性溶剂化能促进复合物的形成,贡献值分别为-82.96,-20.47 kJ/mol和-30.43 kJ/mol,其中范德华力贡献最大;极性溶剂化能抑制两者的结合,贡献值为100.50 kJ/mol;表2中单个能量项的标准偏差(SD)均低于1%,说明结合自由能的计算值是可靠的。
3 讨论
CSPs在昆蟲组织中分布广泛,但一般在接触性器官中表达量较高,以利于感受外界化学刺激。如家蚕Bombyx mori的BmCSP1、BmCSP2在足和触角中的表达量较高[25],烟芽夜蛾Heliothis virescens的HvirCSP1、HvirCSP2、HvirCSP3在雌、雄成虫足部有较高的表达量[6];本研究发现SexiCSP2不仅在接触性器官中如触角,足和翅中表达,在腹部和胸部等非接触器官也有表达,表达模式在雌雄间也存在差异,这与家蚕CSP4的表达模式是相似的[26];说明SexiCSP2不仅有感受外界化学刺激的嗅觉功能,还可能具有非嗅觉的生理功能。
虽然昆虫CSP对化合物结合的特异性比OBP弱,但仍有一定的选择性[27]。CSP分为3个亚类,同一亚类具有相似的结合特性,CSP1s亚类主要结合长烷基链的脂肪酸类化合物,CSP2s结合芳香族化合物[28],且已经在意大利蜜蜂[29],沙漠蝗Schistocerca gregaria[30]等昆虫中得到证实。本研究也发现SexiCSP2蛋白不与长链的酯和醇类结合,与芳香族的甲基苯酚类、苯甲醛等有较强的结合能力,符合CSP2s亚类的特性;但值得注意的是其与己醛的结合能力比芳香族化合物高一个数量级,综合分析我们认为结合芳香族化合物可能是CSP2s的共性,考虑到CSP在物种内的分化高于物种间,每个CSP很可能还有特异结合的化合物,如本研究中SexiCSP2和己醛,其他CSPs结合试验中未发现特异结合物可能是由于测试的化合物数量不够多;此外,研究发现己醛对绿豆象Callosobruchus chinensis[31]、槐绿虎天牛Chlorophorus diadema[32]和西藏簇角缨象天牛Cacia cretifera thibetana[33]均有驱避作用,但虫害诱导寄主产生的大量挥发性己醛对巴氏新小绥螨Neoseiulus barkeri[34]和灰茶尺蠖Ectropis grisescens Warren[35]具有强烈的引诱作用,比较这些结果推测SexiCSP2可能参与了昆虫识别寄主的生理过程。
解析甘蓝夜蛾Mamestra brassicae的MbraCSPA6、沙漠蝗的CSPsg4和家蚕的BmorCSP1等化学感受蛋白晶体结构发现其近似圆型,配基结合于由α螺旋组成的疏水腔内[36],本研究中通过分子对接也发现己醛结合于SexiCSP2三维结构中由α螺旋形成的底部腔体内,H键是SexiCSP2与己醛结合的分子基础,范德华力是主要驱动力,但还需经生物学试验进一步验证。
参考文献
[1] ZHOU Jingjiang. Odorant-binding proteins in insects [J]. Vitamins and Hormones, 2010, 83: 241-272.
[2] VOGT R G, RIDDIFORD L M. Pheromone binding and inactivation by moth antennae [J]. Nature, 1981, 293(5828): 161-163.
[3] WANNER K W, WILLIS L G, THEILMANN D A,et al. Analysis of the insect os-d-like gene family [J]. Journal of Chemistry Ecology, 2004, 30(5): 889-911.
[4] VOSSHALL L B, STOCKER R F. Molecular architecture of smell and taste in Drosophila [J]. Annual Review Neuroscience, 2007, 30(1): 505-533.
[5] 李娜, 张帅, 雒珺瑜, 等. 棉蚜化学感受蛋白AgosCSP2的基因克隆、时空表达动态及气味结合特征分析[J]. 棉花学报, 2014, 26(3): 228-236.
[6] PICIMBON J F, DIETRICH K, KRIEGER J, et al. Identity and expression pattern of chemosensory proteins in Heliothis virescens(Lepidoptera, Noctuidae) [J]. Insect Biochemistry and Molecular Biology, 2001, 31(12): 1173-1181.
[7] ZHOU Xianhong, BAN Liping, IOVINELLA I, et al. Diversity, abundance and sex-specific expression of chemosensory proteins in the reproductive organs of the locust Locusta migratoria manilensis [J]. Biological Chemistry, 2012, 394(1): 43-54.
[8] KITABAYASHI A N, ARAI T, KUBO T, et al. Molecular cloning of cDNA for p10, a novel protein that increases in the regenerating legs of Periplaneta Americana (American cockroach) [J]. Insect Biochemistry and Molecular Biology, 1998, 28(10): 785-790.
[9] GONG Liang, LUO Qi, RIZWAN-UL-HAQ M, et al. Cloning and characterization of three chemosensory proteins from Spodoptera exigua and effects of gene silencing on female survival and reproduction [J]. Bulletin of Entomological Research, 2012, 102(5): 600-609.
[10]MALESZKA J, FORT S, SAINT R, et al. RNAi-induced phenotypes suggest a novel role for a chemosensory protein CSP5 in the development of embryonic integument in the honeybee (Apis mellifera) [J]. Development Genes and Evolution, 2007, 217(3): 189-196.
[11]徐浩智, 游銀伟, 张龙. 昆虫化学感受蛋白及其功能研究进展[J]. 农业生物技术学报, 2015, 23(1): 118-125.
[12]BAN Liping, SCALONI A, D'AMBROSIO C, et al. Chemosensory proteins of Locusta migratoria [J]. Insect Molecular Biology, 2003, 12(2): 125-134.
[13]邓培渊, 袁伟, 李玉华, 等. 甜菜夜蛾化学感受蛋白SexiCSP3结合特性分析[J]. 环境昆虫学报, 2015, 37(5): 979-986.
[14]CAMPANACCI V, LARTIGUE A, HLLBERG B M, et al. Moth chemosensory protein exhibits drastic conformational changes and cooperativity on ligand binding [J]. Proceedings of the National Academy of Sciences of the USA, 2003, 100(9): 5069-5074.
[15]夏晓明, 工开运, 姜兴印, 等. 甜菜夜蛾抗药性现状及综合治理研究进展[J]. 农药, 2003,42(8): 1-5.
[16]LI Sha, PICMBON J F, JI Shidong, et al. Multiple functions of an odorant-binding protein in the mosquito Aedes aegypti [J]. Biochemical and Biophysical Research Communications, 2008, 372(2): 464-468.
[17]QIAO Huili, DENG Peiyuan, LI Dandan, et al. Expression analysis and binding experiments of chemosensory proteins indicate multiple roles in Bombyx mori [J]. Journal of Insect Physiology, 2013, 59(7): 667-675.
[18]王香萍, 方宇凌, 张钟宁. 小菜蛾对合成植物挥发物的活性反应[J]. 昆虫学报, 2005, 48(4): 503-508.
[19]祝传书, 赵惠燕. 虫害诱导的植物挥发物[J]. 西北农林科技大学学报(自然科学版), 2003, 31: 183-186.
[20]肖伟, 邓新平, 刘怀. 甜菜夜蛾幼虫饲养技术的改进[J]. 昆虫知识, 2005, 42(5): 581-583.
[21]KRIEGER E, KORAIMANN U, VRIEND G. Increasing the precision of comparative models with YASARA NOVA-a self-parameterizing force field [J]. Proteins, 2002, 47(3): 393-402.
[22]MORRIS G M, HUEY R, LINDSTROM W, et al. Autodock4 and AutoDockTools4: automated docking with selective receptor flexibility [J]. Journal of Computational Chemistry, 2009, 30(16): 2785-2791.
[23]王红寅, 林东强, 姚善泾, 等. 4-巯乙基吡啶配基与IgG相互作用的分子模拟研究[J]. 化学学报, 2010, 68(16): 1597-1602.
[24]HU Guodong, WANG Jihua. Ligand selectivity of estrogen receptors by a molecular dynamics study [J]. European Journal of Medicinal Chemistry, 2014, 74: 726-735.
[25]PICIMBON J F, DIETRICH K, ANGELI S, et al. Purification and molecular cloning of chemosensory proteins from Bombyx mori [J]. Archives of Insect Biochemistry and Physiology, 2000, 44(3): 120-129.
[26]邓培渊, 乔惠丽, 李丹丹, 等. 家蚕化学感受蛋白BmCSP4 表达谱及结合特性分析[J]. 昆虫学报, 2011, 54(8): 869-876.
[27]BRIAND L, NESPOULOS C, HUET J C, et al. Ligand binding and physicochemical properties of ASP2, a recombinant odorant-binding protein from honeybee(Apis mellifera L.) [J]. European Journal of Biochemistry, 2001, 268(3): 752-760.
[28]LARTIGUE A, CAMPANACCI V, ROUSSEI A, et al. X-ray structure and ligand binding study of a moth chemosensory protein [J]. The Journal of Biological Chemistry, 2002, 277(35): 32094-32098.
[29]FORT S, WANNER K W, MALESZKA R. Chemosensory proteins in the honey bee: Insights from the annotated genome, comparative analyses and expressional profiling [J]. Insect Biochemistry and Molecular Biology, 2007, 37(1): 19-28.
[30]TOMASELLI S, CRESCENZI O, SANFELICE D, et al. Solution structure of a chemosensory protein from the desert locust Schistocerca gregaria [J]. Biochemistry, 2006, 45(35): 10606-10613.
[31]王宏民, 楊萌萌,王耀文,等. 绿豆象成虫对绿豆豆荚挥发物的触角电位和行为反应[J]. 昆虫学报, 2017, 60(2): 148-154.
[32]郄博蕊, 刘强,李敏, 等. 槐绿虎天牛对国槐6种挥发物的EAG及行为反应[J].天津师范大学学报(自然科学版), 2016, 36(3): 59-63.
[33]毛祥忠, 杨斌, 马云强, 等. 西藏簇角缨象天牛对核桃树七种挥发物的EAG和行为反应[J].应用昆虫学报,2020, 57(4):938-945.
[34]胡军华, 王雪莲, 张耀海, 等. 巴氏新小绥螨对柑桔全爪螨处理的枳橙叶片挥发物的行为反应[J]. 应用昆虫学报,2016, 53(1):30-39.
[35]范培珍, 韩善捷, 韩宝瑜. 灰茶尺蠖为害诱导茶树释放的互利素的鉴定[J]. 中国生物防治学报,2020,36(1):65-71.
[36]JANSEN S, CHMELIK J, ZIDEK L, et al. Structure of Bombyx mori chemosensory protein 1 in solution [J]. Archives of Insect Biochemistry and Physiology, 2007, 66(3): 135-145.
(责任编辑:杨明丽)

