鲤鱼鳞酶解工艺优化及酶解液抗氧化活性研究
于海洋,彭新颜,崔晓颖,常高坦,刘凯丽
(1.山东商务职业学院食品工程系,山东 烟台 264670;2.烟台大学生命科学学院,山东 烟台 264005)
我国是世界第一大淡水鱼生产消费国,随着鱼类产业的迅猛发展,在鱼类加工过程中产生了大量的副产物,占鱼类总产量的30%~50%,其中每年鱼鳞下脚料就高达30万吨[1]。研究表明,鱼鳞含有丰富的蛋白质,较多的卵磷脂、多种不饱和脂肪酸,还含有钙、铁、锌等多种矿物质和多种微量元素。但由于加工技术落后、资源综合利用观念薄弱,鱼鳞在加工时多数被直接丢弃,易造成严重的环境污染和资源浪费[2-3]。
近年来,利用酶水解技术对海洋资源副产物进行高值化、生态化利用,特别是功能多肽的制备日益受到国内外专家的关注[4-6]。研究表明,抗氧化肽的活性不仅与原料的来源、理化性质有关,还受抗氧化肽的制备工艺及水解程度等影响。但国内对海洋废弃物多肽的抗氧化效果评价多限于某些化学指标的测定,灵敏度不高。电子自旋共振(electron spin resonance,ESR)法可用于定性和定量检测物质原子或分子中所含的不配对电子,是目前检测自由基最灵敏的方法[7]。因此,本研究以消费量较大的淡水鱼——鲤鱼(Cyprinus carpio)的鱼鳞为原料,利用ESR法测定碱性蛋白酶解产物的自由基清除能力和Fe2+螯合能力,并通过单因素和响应面试验设计优化抗氧化肽的制备条件,以期为淡水鱼鳞的深加工及综合利用提供技术指导,并有望提高鱼鳞的利用率和附加值,为生产功能性食品寻求新途径。
1 材料与方法
1.1 材料与仪器
淡水鱼鳞:市售;碱性蛋白酶(6×104U/g):丹麦诺维信(NOVO)公司;丁基羟基茴香醚(butylated hydroxyanisole,BHA)、二甲基吡咯啉氮氧化物(dimethyl pyrroline nitrogen oxide,DMPO)、菲洛嗪(Ferrozine):Sigma公司;抗坏血酸、硫酸亚铁、过氧化氢、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、核黄素、氯化亚铁(分析纯):烟台鲁杰试剂公司。
ER 200D-SRC电子自旋共振仪(ESR仪):德国Bruker公司;GT16-3型高速台式离心机:北京医用离心机厂;AL-104型精密电子天平:瑞士梅特勒-托利多仪器设备有限公司;pB-10型pH计:新锐仪表仪器有限公司;UV2600/2700紫外可见分光光度计:日本岛津公司;ZHWY-1102双层恒温培养振荡器:上海智城分析仪器制造有限公司;LGJ-18S真空冷冻干燥机:北京松源华兴科技发展有限公司。
1.2 鱼鳞胶原粗蛋白酶解过程
参考华萍[8]的试验方法并有所改动:洗净鱼鳞→烘干、切碎→酸浸脱钙(0.4 mol/L HCl,浸泡24 h并换一次酸)→清水冲洗至中性→石灰水浸泡24 h除杂→冲洗过滤至中性→调整pH值至2.5→35℃下胃蛋白酶提取胶原蛋白(提取60 h)→过滤后将滤液盐析24 h(0.9 mol/L氯化钠)→离心(16 000×g,20 min)→透析24 h后冻干→得胶原蛋白→酶解→离心分离(4 000×g,20 min)→取上清液浓缩→真空干燥→得鱼鳞胶原蛋白酶解物。
1.3 水解度的测定
根据pH-Stat法[9],水解度计算公式为:DH/%=h/htot×100,式中:htot为每克蛋白质具有肽键的毫摩尔数,mmol/g蛋白质,鱼鳞胶原蛋白htot为8.41 mmol/g蛋白质[10];h为每克蛋白质中水解的肽键量,mmol/g蛋白质。
1.4 ESR法测定羟基自由基(·OH)和超氧阴离子自由基(O2-·)清除能力
羟基自由基由Fenton反应产生,参照Liu等[11]的方法稍有改动。水解样品(50 μL)作对照,依次加入到50 μL的二甲基吡咯啉氮氧化物(DMPO)、10 mmol/L的硫酸亚铁、50 μL的过氧化氢(10 mmol/L)溶液,启动反应,将反应体系吸入密封的毛细管中,3 min后用ESR光谱仪记录DMPO-OH加合物图谱。ESR操作参数:中心磁场3 385 Gs,微波功率20 mW,调制频率100 kHz,调制幅度1.0 Gs,扫场时间300 s。超氧自由基利用紫外照射的EDTA/核黄素系统产生[12]。混匀后于365 nm紫外灯下照射1 min,吸入石英毛细管后测定。
清除率/%=(H0-H)/H0×100
式中:H和H0分别为样品与空白波谱信号强度。其中羟基自由基以波谱信号第2个峰信号强度(高度)表示;超氧自由基以波谱第一峰来表示。
1.5 Fe2+螯合能力的测定
参照彭新颜等[9]的方法稍作修改进行研究。对于Fe2+的鳌合:1 mL 20 μmol/L 的 FeCl2与 1 mL 0.5 mmol/L的菲咯嗪混合后向其中添加0.5 mL的鱼鳞水解物,在562 nm下读取吸光值。

1.6 碱性蛋白酶单因素水解试验
1.6.1 最佳酶解温度
在酶解时间为4 h,底物浓度20 mg/mL,加酶量4%,pH8.5的条件下,选取酶解温度分别为50、55、60、65、70℃,研究酶解温度对水解度和O2-·、·OH清除率的影响。
1.6.2 最适加酶量
在底物浓度20 mg/mL,酶解时间为4 h,pH8.5,酶解温度65℃的条件下,选取酶的添加量分别为2%、3%、4%、5%、6%,研究加酶量对水解度和 O2-·、·OH 清除率的影响。
1.6.3 最佳底物浓度
在酶解时间为4 h,pH8.5,加酶量为4%,酶解温度65℃的条件下,选取底物浓度分别为5、10、15、20 mg/mL,研究底物浓度对水解度和O2-·、·OH清除率的影响。
1.6.4 最适pH值
在酶解时间为4 h,加酶量为4%,酶解温度65℃,底物浓度20 mg/mL的条件下,选取pH值分别为7.0、7.5、8.0、8.5、9.0,研究 pH 值对水解度和 O2-·、·OH 清除率的影响。
1.6.5 最适水解时间
在加酶量4%,底物浓度20 mg/mL,pH8.5,酶解温度 65 ℃的条件下,在酶解时间分别为 1、2、3、4、5 h,研究酶解时间对水解度和O2-·、·OH清除率的影响。
1.7 响应面优化试验
根据单因素筛选出酶解温度、pH值、酶解时间作为优化因素,通过Box-Behnken设计,以O2-·、·OH清除率和Fe2+螯合能力为指标,采用响应面分析,数据分析采用Design Expert 8.0,因素水平见表1。

表1 Box-Behnken试验设计Table 1 Box-Behnken experimental design
1.8 数据统计分析
每个试验重复3次,结果表示为平均数±标准差。采用Sigmaplot12.0和Excel6.0作图,数据统计分析采用Statistix8.1软件包中Linear Models程序和Design-Expert 8.0分析软件,差异显著性(P<0.05)使用Tukey HSD程序分析。
2 结果与分析
2.1 酶解温度和加酶量的确定
酶解温度和加酶量对鱼鳞蛋白水解效果的影响见图1。

图1 酶解温度和加酶量对鱼鳞蛋白水解效果的影响Fig.1 Effect of temperature and enzyme dose on hydrolysis efficiency of carp scales protein
如图1所示,当酶解温度为65℃时,·OH清除率、O2-·清除率及水解度全部达到最大值,分别为84.33%、47.27%和34.83%。这是因为提高温度后,酶解速度显著提高,从而促进鱼鳞胶原蛋白水解为抗氧化多肽。当酶解温度过高时,蛋白酶失活变性,降低了酶解效率,导致·OH清除率、O2-·清除率及水解度下降。因此,酶解温度不宜过高,65℃较适宜。酶浓度会影响鱼鳞胶原蛋白的酶解效果,从而影响酶解液的抗氧化活性[13]。由图1可知,加酶量提高后,·OH清除率在加酶量为4%时取得最大值为71.20%,O2-·清除率在加酶量为6%时才能取得最大值为38.33%,水解度在加酶量为5%时取得最大值为42.47%,但由于此时水解过度,导致·OH清除率和O2-·清除率下降。综合考虑成本等因素,加酶量采用4%。
2.2 底物浓度、pH值和酶解时间的确定
底物浓度、pH值和酶解时间对鱼鳞蛋白水解效果的影响见图2。

图2 底物浓度、pH值和酶解时间对鱼鳞蛋白水解效果的影响Fig.2 Effect of substrate concentration,pH and hydrolysis time on hydrolysis efficiency of carp scales protein
如图2所示,底物浓度在5mg/mL~25mg/mL,随着底物浓度的增加,·OH清除率、O2-·清除率及水解度逐渐增大,但当底物浓度增大到一定程度后,其变化就较平缓。在25 mg/mL时,·OH清除率以及水解度达到最大值,分别为86.73%和45.03%。但O2-·清除率在20 mg/mL时最大,达到38.57%,而在这两种底物浓度时,水解物的·OH清除率、O2-·清除率及水解度方面并没有显著差异(P>0.05)。这可能是由于低浓度的鱼鳞胶原蛋白可有效地和酶接触,而当鱼鳞胶原蛋白浓度进一步升高时,酶与底物接触的机会减小,胶原蛋白未被完全水解,酶解液的抗氧化活性也受到影响[14]。因此,底物浓度以20 mg/mL为宜。
酶解环境的pH值能够影响到酶的稳定性、空间构象、解离程度和解离状况等方面,进而影响酶解反应[15]。如图2所示,随着pH值的增大,·OH清除率、O2-·清除率和水解度开始逐渐增大,当pH值为8.5时,·OH、O2-·清除率及水解度均达到最大值,分别为68.87%、52.77%和44.20%。此后,随着pH值进一步增加,酶解液的自由基清除率和水解度均开始下降。以上结果说明,酶解pH值与水解物抗氧化活性之间不存在线性关系,酶解pH值以8.5为宜。
如图 2 所示,在 1 h~4 h,·OH、O2-·清除率和水解度不断上升,在 4 h 时,·OH、O2-·清除率、水解度全部达到最高值,分别为82.60%、54.77%和42.43%,表现出最强的抗氧化效果。酶解时间继续延长,抗氧化效果反而下降。说明酶解时间与鱼鳞水解物抗氧化活性之间不存在线性关系,只有在特定的水解度下,才具有最大的抗氧化能力。这可能是因为具有抗氧化活性的肽段被进一步水解为更小的肽段和氨基酸,导致肽段失活变性。所以,酶解时间以4 h为宜。
2.3 响应面试验分析
根据单因素试验结果,选取酶解温度、pH值、酶解时间为变量,进行三因素三水平的响应面试验。碱性蛋白酶解工艺条件优化根据Box-Behnken试验设计进行了17组试验,5组为中心点重复试验,具体结果见表2。

表2 Box-Behnken试验设计及结果Table 2 Box-Behnken experimental design and results
本试验利用Design-Expert 8.0软件对O2-·清除率、·OH清除率与Fe2+螯合能力等因素进行多元回归拟合,得二次多项式拟合方程为Y1=65.22+4.98X1-0.84X2+5.79X3+1.62X1X2+1.38X1X3+0.53X2X3-7.65X12-3.50X22-4.39X32,Y2=86.23 +5.11X1+2.47X2+5.48X3-1.14X1X2+5.92X1X3+1.04X2X3-10.98X12-11.21X22-16.07X32,Y3=59.97+2.40X1+0.716X2+3.29X3+1.42X1X2+1.23X1X3-0.98X2X3-5.30X12-5.74X22-4.24X32。
O2-·清除率、·OH 清除率、Fe2+螯合能力的二次回归方程方差分析见表3、表4和表5。

表3 O2-·清除率的二次回归方程方差分析Table 3 Analysis of variance of regression equation of O2-·scavenging activity
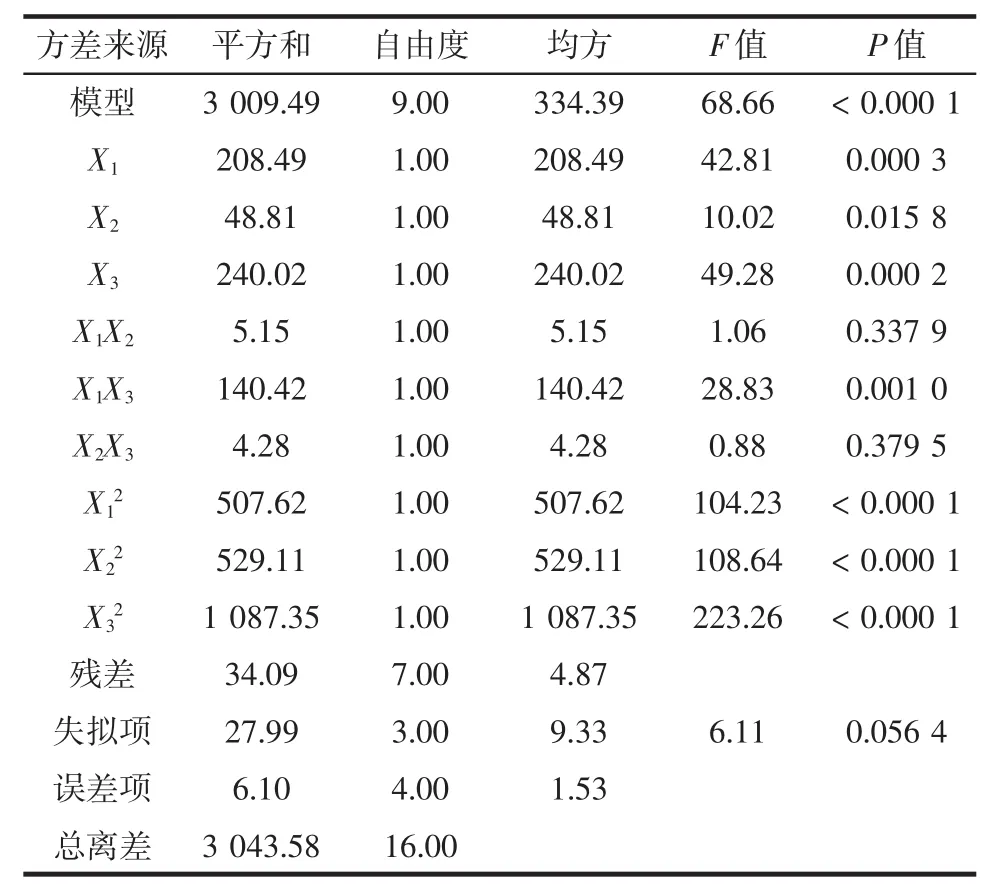
表4 ·OH清除率的二次回归方程方差分析Table 4 Analysis of variance of regression equation of·OH scavenging activity
由表3可知,方程回归模型的决定系数R2=0.9832,P<0.000 1,说明模型达到高度显著水平,失拟项P=0.165 2,影响不显著,说明该方程拟合良好;由表4可知,方程回归模型的决定系数R2=0.988 8,P<0.000 1,说明模型达到高度显著水平,失拟项P=0.056 4,影响不显著,说明该方程拟合良好;由表5可知,方程回归模型的决定系数R2=0.987 8,P<0.000 1,说明模型达到高度显著水平,失拟项P=0.093 1,影响不显著,说明该方程拟合良好。因此,可应用3个方程描述各响应变量与两个相应值之间的关系,以评价各因素对相应值影响的显著性。

表5 Fe2+螯合能力的二次回归方程方差分析Table 5 Analysis of variance of regression equation of Fe2+chelating ability
由表3可以看出,响应值为O2-·清除率的模型:一次项X1(酶解温度)和X3(酶解时间)影响极显著,各响应因素影响程度依次为X3>X1>X2,酶解时间对于酶解液O2-·清除率的影响最大;酶解温度、酶解时间、pH值的交互作用影响不显著;二次项对应的响应值影响均极显著。
响应值为·OH清除率的模型:一次项X1(酶解温度)和X3(酶解时间)影响极显著,一次项X2(pH值)对·OH清除率达到显著水平,各响应因素影响程度依次为X3>X1>X2,酶解时间对于酶解液·OH清除率的影响最大;酶解温度与酶解时间的交互作用影响极显著,酶解温度与pH值、pH值与酶解时间交互作用影响不显著;二次项对应的响应值影响均极显著。
响应值为Fe2+螯合能力的模型:一次项X1(酶解温度)和X3(酶解时间)影响极显著,一次项X2(pH值)对Fe2+螯合能力未达到显著水平,各响应因素影响程度依次为 X3>X1>X2,酶解时间对酶解液 Fe2+螯合能力的影响最大;酶解温度与pH值、酶解温度与酶解时间的交互作用影响显著,pH值与酶解时间交互作用影响不显著;二次项对应的响应值影响均极显著。各因素对响应值影响的响应面图见图3~图5。

图3 各因素对O2-·清除率的影响Fig.3 Response surface plots for the interactive effects of different variables on O2-·scavenging activity
通过图3、图4和图5即可对各因素影响抗氧化活性效应进行分析与评价。响应面为平滑的曲面,且开口向下,说明在响应曲面上存在最大响应值,可从中确定最佳因素水平范围。根据Box-Behnken试验所得的二次多项式回归方程和结果,对所建立的数学模型进行工艺参数的优化,得到最佳酶解条件组合为pH8.56、酶解温度66.66℃、酶解时间4.39 h,此时O2-·清除率为67.94%,·OH清除率为87.30%,Fe2+螯合能力为61.00%。为了验证模型预测的准确性,根据实际对试验条件进行调整后,选取酶解时间4.4 h、pH8.5、酶解温度66.0℃,做3组平行试验,得到的O2-·清除率达65.34%,·OH清除率80.24%,Fe2+螯合能力达59.73%,此结果与最佳理论条件下所得的结果接近。

图4 各因素对·OH清除率的影响Fig.4 Response surface plots for the interactive effects of different variables on the·OH scavenging activity

图5 各因素对Fe2+螯合能力的影响Fig.5 Response surface plots for the interactive effects of different variables on Fe2+chelating ability
2.4 鱼鳞胶原蛋白酶解液与常用抗氧化剂之间的比较
鱼鳞胶原蛋白酶解液与常用抗氧化剂之间的比较结果见表6。
如表6所示,鱼鳞胶原蛋白酶解液在O2-·清除能力、·OH清除能力和Fe2+螯合作用方面均高于未水解鱼鳞胶原蛋白(P<0.05)。O2-·清除率为 65.34%,未达到BHA及抗坏血酸的水平。而在·OH清除率和Fe2+螯合作用方面达到(P>0.05)或超过(P<0.05)BHA及抗坏血酸的抗氧化活性。因此,鱼鳞胶原蛋白酶解液是具有抗氧化潜力的多肽物质。
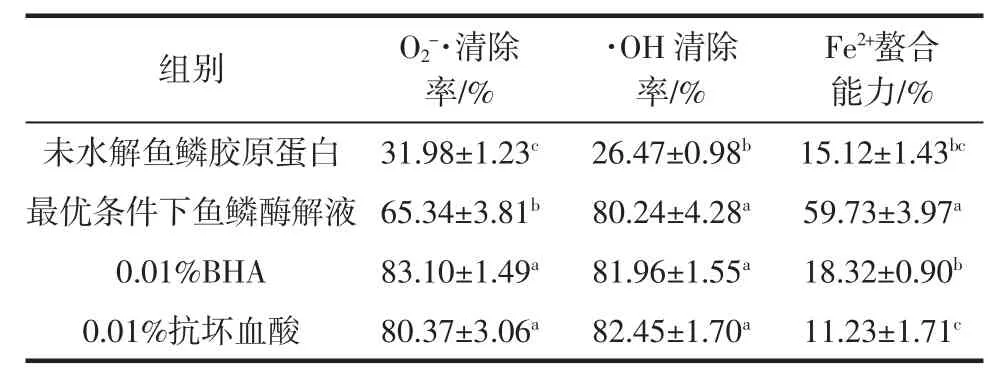
表6 鱼鳞胶原蛋白酶解液与常用抗氧化剂之间的比较结果Table 6 Comparison of antioxidant activities between scale collagen hydrolysate and common antioxidants
3 讨论
近年来,利用响应面分析方法对酶水解影响因素进行优化,获得制备抗氧化多肽的最佳条件,取得了良好的效果。如Ren等[16]对草鱼肌浆蛋白进行酶解,通过响应面设计优化后发现,在酶与底物比例为0.79%、水解时间为5.69 h、反应温度在52.15℃的条件下,酶解产物的自由基清除率最高。Lin等[17]获得了碱性蛋白酶制备抗氧化肽的最佳条件:底物浓度5.16%、酶用量2.37%和pH值为6.66时,水解产物的还原能力在700 nm时高达1.533。Wang等[18]通过酶水解和超滤法得到了分子量为10 kDa~30 kDa蛋清抗氧化肽,并利用Box-Behnken设计的响应面法研究了脉冲电场处理参数对抗氧化活性的影响。Yang等[6]响应面设计得出磷酸浓度为6.7%、底物浓度为50%、蒸煮时间为180 min时,DPPH自由基清除效率最高。Teng等[19]、Lin 等[17]、Fang 等[14]和 ÁLVAREZ 等[15]也通过响应面法获得了制备不同蛋白抗氧化肽的最优条件。在本试验利用单因素试验以及响应面法,通过测定O2-·、·OH清除率及Fe2+的螯合能力,也得到了酶解鱼鳞胶原蛋白的最佳工艺条件。
抗氧化剂可以通过螯合过渡金属离子来抑制氧化的发生。其中,铁离子对细胞中活性氧自由基的形成起关键作用,因此试验检测了Fe2+螯合能力[13]。结果表明,与常用抗坏血酸和BHA比,最优条件下鱼鳞胶原蛋白酶解液 Fe2+螯合能力更强(P<0.05),这可能是由于蛋白酶解使得肽键断裂,自由氨基和羧基浓度的增加隔离了体系内促氧化的金属离子,从而提高了抗氧化效果。另一方面可能是由某些氨基酸残基的暴露增加引起的,如组氨酸就具有金属螯合能力。通过对鱼鳞胶原蛋白质的酶解,使具有金属螯合能力的氨基酸残基更多地暴露出来,增强了Fe2+的螯合能力。
ESR检测仪是测定自由基的最直接有效的重要工具,可以准确地测定出物质的抗氧化活性,因此,ESR技术被广泛应用于蛋白多肽自由基测定试验中。Liu等[11]通过应用ESR技术检测发现,猪血浆蛋白水解物具有一定的O2-·、·OH、DPPH自由基的清除能力。Peng等[12]通过ESR仪测定了不同分子量范围多肽自由基的清除能力,研究表明,分子量为0.1 kDa~2.8 kDa范围的多肽自由基清除效果最好。本试验鱼鳞胶原蛋白酶解液的自由基清除能力明显高于未水解物(P<0.05)。Sudhakar等[20]也研究表明,所得到的水解多肽具有较高的自由基清除效果。鲢鱼鳞的胃蛋白酶水解物自由基清除活性最高,经超滤后得到5个部分,利用ESR法发现,分子量<1 kDa多肽部分的DPPH自由基、O2-·、·OH清除效果最佳,且可减轻H2O2诱导肠上皮Caco-2细胞的氧化应激损伤[21]。
越来越多的研究表明,蛋白酶解后,所得到的特定多肽段抗氧化效果更好。如Cai等[22]得到分子量分别为640.74、618.89 Da和484.56 Da的草鱼皮多肽段,具有较强的·OH和DPPH自由基清除能力。Wang等[23]也证实,分子量为1 kDa和1 kDa~3 kDa的玉米蛋白多肽,具有提高超氧化物歧化酶(superoxide dismutase,SOD)活性的作用。Girgih等[24]水解大西洋鳕鱼后,再利用膜过滤和反相液相色谱法将分子量小于1 kDa的部分继续纯化为四部分,其中三部分多肽组分具有较好的抗氧化效果。与之相似,卢素珍等[25]和Huang等[13]分别利用草鱼鳞和尖吻鲈及鲻鱼为原料,发现水解多肽的抗氧化效果要优于未水解物。这可能是由于蛋白水解后,其致密结构被破坏,从而使更多具有抗氧化能力的氨基酸残基暴露,抗氧化效果增强。研究发现,自由基清除作用可能是通过阻断自由基的链式反应或螯合作用来实现抗氧化作用的,小分子多肽可在溶液与溶质界面或者固相与气相界面形成薄膜,从而防止氧化的发生[12]。本试验也说明,多肽的自由基清除能力和Fe2+螯合能力对鱼鳞蛋白多肽的抗氧化性起着重要作用。
4 结论
综合响应面优化结果及现实因素,确定鱼鳞胶原蛋白实际水解工艺条件为酶解时间4.4 h、温度66.0℃、pH8.5、底物浓度20 mg/mL、加酶量4%。此时酶液物的Fe2+螯合能力、O2-·、·OH 清除率分别为59.73%、65.34%和80.24%,达到了响应面最佳工艺效果。

