枯草芽胞杆菌Qh-618对燕麦叶斑病防治效果研究
冶福春,马文林,杨晓龙
(青海农牧科技职业学院,西宁 812100)
燕麦Avena sativa是禾本科Gramineae早熟禾亚科Pooideae燕麦族Aveneae燕麦属Avena一年生草本植物,目前在全球均有分布[1-3],因其富含蛋白质、抗氧化物和矿物质等多种营养成分,具有调节血脂、延缓衰老、改善血液循环等保健功能,被认为具有独特的营养价值、生态价值和医疗价值等[4]。此外,燕麦的叶片和秸秆柔嫩多汁,适口性好,粗脂肪、粗蛋白含量高,纤维含量低,是农牧区冬春补饲与抗灾保畜的优良饲草料,在畜牧业发展中具有举足轻重的地位[5]。近年来,随着国内外对燕麦的需求量增加,燕麦的种植面积正逐渐扩大[6]。然而,燕麦病害严重制约其生产,不仅影响燕麦的产量及品质,部分还可能产生毒素,导致取食燕麦的人、畜代谢紊乱[7,8]。
我国当前在燕麦病害方面的研究相对较少,其中真菌性病害25种,主要包括根腐病Pythium spp.,叶斑病Drechslera avenae、秆锈病Puccinia graminis、白粉病Blumeriagraminis、纹枯病Rhizoctonia cerealis、坚黑穗病Ustilago segetum等;细菌性病害4种,主要包括条纹叶枯病Pseudomonas syringae pv.striafaciens、细菌性斑点病P.syringae pv.coronafaciens等;国际上报道的燕麦病毒性病害共5种,而我国目前发现两种,分别是由燕麦红条花叶病毒ORSMV引起的花叶病和由大麦黄矮病毒BYDV引起的红叶病;而坏死斑驳病毒ONMV、燕麦花叶病毒OMV及病毒性矮缩病毒OBDV引起的花叶病在我国未见报道[8,9]。我国对燕麦病害的研究存在主要病害种类、病原菌类型及流行规律等了解不清的问题,对很多主要病害以及多发病害缺乏深入、系统地研究[8]。
近年来,燕麦叶斑病危害日趋严重,已成为燕麦生产中的主要病害,多数燕麦主产区都有发生[10,11]。该病害由半知菌类内脐孺孢属(又称德氏霉属)燕麦内脐蠕孢菌D.avenae (Eidam) Shoemaker引起,有性阶段为子囊菌门燕麦核腔菌Pyrenophora avenae Eidam Ito et Kurib[12]。袁军海等[13]研究发现,燕麦叶斑病在冀西北地区发生范围广泛,84.31%的品种感病,病叶率达90%以上,造成燕麦光合作用下降、产量降低,一般减产5%~10%,严重时高达30%。
针对该病害,生产上主要采用化学药剂进行防治。40%多菌灵对燕麦叶斑病的防治效果较佳,但是化学防治高毒、对环境污染严重、对人畜不安全、易诱导病原物抗性的产生,不利于有机燕麦产业的发展,加之燕麦生产经济效益低,化学防治在燕麦生产上并不可取[14]。有研究人员认为,选育燕麦抗病品种是燕麦叶斑病防治最经济、最有效以及对自然环境安全的一种防治措施。对于抗病品种的选育,主栽品种(系)是其抗病基因的重要来源,但截至目前,未发现有关我国燕麦主栽品种(系)抗叶斑病鉴定的相关报道。因此,环境友好的生物防治措施逐渐被运用于燕麦叶斑病的防治当中。
植物病害生物防治,指利用一些有益微生物或其代谢产物对农作物病害进行有效防治[15]。因其无抗药性、对环境无污染、人畜友好,正逐渐被人们所关注,成为未来病害防治的有效措施。目前,燕麦叶斑病的生物防治研究较少,筛选获得高效防治燕麦叶斑病的生防菌株对整个燕麦产业发展尤为重要和急迫。
本研究主要从燕麦叶斑病发生生境开展相关生防菌株筛选及其防病促生功能研究。通过平板对峙及水解酶活性测定试验,从燕麦生境中分离获得一株生防菌株Qh-618,经过生理生化试验、16S rDNA及gyrB基因测序鉴定其为枯草芽胞杆菌。体外评估试验结果显示,生防菌 Qh-618对多种病原真菌都具有较强的抑菌活性,对德氏霉菌D.avenae的孢子萌发也具有显著的抑制效果;此外水解酶活性检测发现Qh-618具有较强的蛋白酶、半乳糖苷酶、嗜铁素酶及乙烯产生活性;进一步温室试验、田间试验结果表明,生防菌Qh-618对燕麦生长具有较强的促进作用,对燕麦叶斑病的防治效果达58.57%以上。综上所述,枯草芽胞杆菌B.subtilus Qh-618是一株对燕麦叶斑病具有高效防治潜力的生防促生菌株。本研究的顺利完成为后期燕麦叶斑病高效生物农药开发及应用提供了理论依据。
1 材料与方法
1.1 土样、供试植物材料
燕麦根围土采集于青海省西宁市湟源县(101°25643′E,36°68243′N,海拔高度2753米)燕麦种植基地。试验所选植物为燕麦“巴燕4号”,属于早熟品种,由青海畜牧兽医科学院草原研究所创制,适合于在当地海拔较高地区种植,生产特性表现较佳。
1.2 供试菌株和培养基
供试的5个病原真菌为德氏霉菌属Drechslera sp.、镰刀菌属Fusarium sp.、灰霉菌属Botrytis sp.、赤霉病菌Gibberella sp.和蔓枯病菌Ascochyta sp.由本实验室自主分离于相关病害发病组织,并纯化、保存。生防菌株的分离和培养采用LB培养基(胰蛋白胨10 g/L、酵母浸粉5 g/L,NaCl 10 g/L,琼脂粉15 g/L,调节pH至7.0),病原真菌的活化培养采用PDA 培养基(葡萄糖20 g/L,马铃薯200 g/L,琼脂粉15 g/L,调节pH至7.0);病原真菌的平板对峙采用WA培养基(蛋白胨5 g/L,葡萄糖10 g/L,肉汁浸膏3 g/L,氯化钠5 g/L,琼脂20 g/L,调节pH至7.0)[16]。
1.3 拮抗细菌的分离与筛选
从青海省西宁市湟源县燕麦种植区采集健康燕麦的根际土壤10份、健康植株叶片10份,分别使用无菌袋保存。生防菌株的分离参考文献报道[17],称取10 g土壤,置于90 mL无菌水的锥形瓶中,28 ℃、180 r/min振荡培养30 min。取振荡好的土壤浸出液按不同倍数进行稀释,并将不同稀释倍数的土壤浸出液均匀涂布于LB固体培养基,将平板置于28 ℃培养箱培养48 h获得细菌单菌落,最后挑取形态不同的细菌菌落,经平板划线纯化后进行统一编号保存。
1.4 体外平板对峙试验
采用平板对峙法评估生防菌对病原菌的拮抗效果。将待试生防菌株接种于LB液体培养基中,28 ℃,180 r/min振荡培养24 h待用。将5个病原真菌分别接种于PDA平板进行活化,待真菌长满平板后,利用无菌的打孔器将长满菌的平板打成直径为0.8 cm的菌饼。于直径9 cm WA平板中心接种0.8 cm的菌饼,将拮抗菌株接种距离真菌菌饼2.5 cm处,以无菌水作为对照,每个处理3次重复。随后将平板置于25 ℃培养箱培养5 d,待菌丝长满平板边缘,统计抑菌圈的直径,并拍照记录。
1.5 生防细菌的鉴定及进化树分析
1.5.1 细菌生理生化反应测定 本试验参照《伯杰氏细菌鉴定手册》的方法[17],对筛选获得的生防菌株Qh-618进行革兰氏细菌染色、运动性试验、生长温度试验、接触酶试验、耐盐性试验、V-P 试验、柠檬酸盐利用、硝酸盐还原、明胶液化试验、淀粉水解试验、氧化酶试验、山梨醇发酵、水杨苷发酵、MR、尿素苷试验、鸟氨酸脱羧酶试验、色氨酸肉汤试验、苯丙氨酸试验、七叶苷试验、硫化氢试验、西蒙氏枸橼酸盐试验、精氨酸双水解酶试验、甘油利用等生理生化试验。
1.5.2 16S rDNA及gyrB基因扩增、测序鉴定及进化树分析 利用细菌DNA提取试剂盒提取细菌DNA,并以其为模板,对 16S rRNA 编码基因和 gyrB基因进行 PCR扩增。16S rDNA 通用引物 16S-F:5'-AGAGTTTGATCCTGGCTCAG-3';16S-R:5'-TACGGCTACCTTGTTACGAC TT-3';gyrB 引物:gyrB1:5'-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3';gyrB2:5'-AGCAGGGTACGGATG TGCGAGCCRTCNACRTCNGCRTCNGTCAT-3'。PCR 反应体系(50 μL):2×Taq Master Mix 25 μL,上下游引物各 0.5 μL,生防菌 DNA 模板 0.5 μL,ddH2O 23.5 μL。PCR 反应条件:98 ℃预变性 1 min;98 ℃变性 10 s;55 ℃退水20 s;72 ℃延伸30 s;35 个循环;最后72 ℃延伸5 min。PCR 产物经1%琼脂糖水平电泳检测后,送测序公司(南京擎科生物科技有限公司)测序分析,采用MEGA 7.0 软件中的最大似然法构建生防菌株Qh-618与其他相近菌株之间的进化树[16]。
1.6 水解酶活性测定
1.6.1 蛋白酶活性测定 在蛋白酶平板上(A:脱脂奶粉8 g,溶于300 mL去离子水中,115 ℃灭菌10 min:B:琼脂粉 8 g,定容至300 mL,121 ℃灭菌20 min,A与B分别灭菌后混合)接种生防菌Qh-618,28 ℃培养3 d后观察透明圈有无,并记录大小[18]。
1.6.2 几丁质酶活性测定 将细菌接种于以胶体状几丁质为唯一碳源的培养基(Chi-Ayers)上培养(磷酸二氢铵1.0 g/L,氯化钾0.2 g/L,水合硫酸镁0.2 g/L,胶体状几丁质1%(w/v)100 mL,琼脂粉 20 g/L,调节pH至7.0),28 ℃ 培养3 d后观察透明圈有无,并记录大小[18,19]。
1.6.3 多聚半乳糖醛酸酶活性测定 将生防菌接种于多聚半乳糖醛酸酶活性测定平板上(PGA 10 g/L,酵母浸粉 10 g/L,醋酸钠(pH 5.5)110 mmol/L,EDTA 2.2 mmol/L,琼脂粉 20 g/L)。28 ℃培养3 d后,用1 g/L的刚果红染1 h后,倒掉染液,再用1 mol/L的氯化钠浸泡1 h,观察透明圈有无,并记录大小[20]。
1.6.4 产嗜铁素活性测定 首先配置A、B溶液,A:①60.5 mg铬天青S溶于50 mL去离子水;②10 mL三价铁溶液(1 mmol/L FeCl3·6H2O盐酸为溶剂);③72.9 mg CTAB溶于40 mL去离子水。上述3个溶液混合定容至100 mL,pH调至中性,121 ℃灭菌20 min;B:30.24 g Pipes加入900 mL WA培养基,pH 6.8,121 ℃灭菌20 min。将A、B液混合倒平板,将生防菌接种于制作好的测定平板上,28 ℃恒温培养3 d后观察透明圈有无,并记录结果[18,21]。
1.6.5 产吲哚乙酸活性测定 首先称取二甲氨基苯甲醛8 g,溶于760 mL 95%酒精和160 mL浓盐酸中,制得埃利希氏试剂。将生防菌接种于1%胰蛋白胨水溶液(pH 7.2~7.6)液体培养基,于28 ℃恒温培养2 d,将前期配置的埃利希氏试剂加入生防菌培养液中,观察液面是否变红[18,22]。
1.7 生防菌对燕麦德氏霉菌孢子萌发影响
将培养好的生防菌悬液用细菌过滤器过滤,取滤液2 mL均匀涂于含有水琼脂培养基的90 mm平板上,待滤液完全渗入培养基后,吸取浓度为105孢子/mL燕麦德氏霉菌孢子悬浮液 100 μL,均匀涂布于前期准备的含有生防菌悬浮液的平板上,并做好标记。将平板置于25 ℃培养箱中培养,分别于1、3、6、12和18 h镜检孢子萌发情况,并记录萌发率。以无菌水作为对照,每个处理重复3次。孢子萌发率(%)=孢子萌发数/(孢子萌发数+未萌发孢子数)×100%。
1.8 生防菌对多种病原真菌的影响
首先对燕麦“巴燕4号”种子进行表面消毒,利用70%乙醇溶液处理30 s,3%~5%次氯酸钠溶液处理3 min,随后用无菌水漂洗3~5次。将消毒好的燕麦种子置于28 ℃培养箱中催芽。将萌发的燕麦种子置于生防菌菌悬液(1×106CFU/mL)中浸泡1 h进行预处理,随后将种子捞出,晾干,待用。将前期生防菌预处理燕麦种子置于含有5种参试病原真菌的水琼脂平板表面(1×104孢子/板),每个平板4粒种子,25 ℃共培养7 d。其中以未接种生防菌的燕麦种子作为对照。观察种子发芽及发病情况,并计算生防菌对种子萌发促进作用及对病原真菌的抑菌率。萌发率(%)=(处理种子发芽率-对照种子发芽率)/对照种子发芽率×100,抑菌率(%)=(处理种子发病率-对照种子发病率)/对照种子发病率×100。
1.9 叶绿素含量测定
本研究叶绿素含量采用叶绿素仪(SPAD仪,型号:霍尔德 HED-YB)进行测定。选择生长一致受光方向一致的燕麦苗进行测定。将燕麦叶片置于叶绿素仪测量位置,并按下测量压头2~3 s,测定叶绿素含量,并记录测量值。每个处理重复3次,每个重复取9片相同部位叶片。
1.10 温室试验
促生试验共设2个处理,Qh-618处理组和清水对照。每个处理4个重复,每个重复50粒燕麦种子。将燕麦种子均匀播撒于无菌基质的盆钵(口径12 cm,底径9.5 cm,盆高13 cm)中。置于温度为 28 ℃、光周期16L:8D、相对湿度70%以上的温室条件下培养。待燕麦出苗3 d后,利用1×107CFU/mL的Qh-618菌悬液进行喷雾接种,每盆苗接种20 mL,均匀喷施,直至液体布满燕麦全株,以无菌水作为对照。分别于生防菌接种后5和10 d,统计各处理组燕麦苗的生长指标(包括:叶绿素含量、根长、苗长、根鲜重、根干重、苗鲜重以及苗干重)。
Qh-618对燕麦德氏霉菌温室防治试验,首先利用1×107CFU/mL的Qh-618菌悬液对燕麦苗进行喷施接种,生防菌接种5 d后,叶部喷雾接种燕麦德氏霉孢子悬浮液(1×105孢子/mL),均匀喷施,直至燕麦全株湿润,随后进行保湿处理,分别于病原菌接种处理后3和5 d对燕麦叶斑病发病情况进行统计,并计算出各处理组的病害严重度。参考前期燕麦叶斑病病害分级标准[6]进行病害调查统计。具体病情指数分级标准如下:0 级,无病斑;1 级,病斑面积占整片叶面积的 1%~10%;2 级,软病斑面积占整片叶面积的11%~25%;3 级,病斑面积占整片叶面积的25%~50%;4 级,病斑面积占整片叶面积的51%以上。病情指数=[∑(病级数×该病级植株数)/(最高病级×总植株数)]×100。
1.11 田间试验
试验地在青海省西宁市湟源县(101°25643′ E,36°68243′ N,海拔高度2753 m)燕麦种植基地开展。选择合适田块设置生防细菌处理、清水对照,每个处理 4 次重复,每个小区面积 1亩。按前期菌液制作方法配制生防菌菌悬液,播种当天用 5×107CFU/mL菌悬液20 mL浸种处理 5 min,待出苗后用1×107CFU/mL菌悬液进行地上部喷雾处理,每株苗喷雾20 mL。30 d后做同样处理。空白对照不进行浸种,其他方面与生防菌处理相同,将菌悬液调换成清水,田间管理措施相同。于播种后60 d对燕麦生长指标(叶绿素、麦苗株高、鲜重、干重)及发病情况进行统计,调查病害发病率并计算生防效果。采收期对各处理组的产量进行统计,并计算出增产效果。
1.12 数据统计与分析
试验数据采用IBM SPSS Statistics 20.0统计软件进行方差分析,采用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 拮抗细菌的分离、筛选及鉴定
本研究共计分离获得生防菌株280株。通过平板拮抗试验(图1),最终筛选获得一株高效生防菌株Qh-618。结果显示,菌株Qh-618对多种真菌德氏霉菌、镰刀菌、灰霉菌、赤霉病菌、蔓枯病菌都具有强的拮抗效果,抑制率分别为61.7%、39.7%、69.7%、45.5%、62.1%。孢子萌发试验结果表明,菌株Qh-618处理能够显著抑制燕麦德氏霉菌的孢子萌发(图2),处理18 h后,对燕麦德氏霉菌的孢子萌发抑制率达63.5%。通过生理生化测定试验及16S rDNA测序,初步鉴定其为枯草芽胞杆菌B.subtilis(表1,图3),进一步对gyrB基因序列构建系统发育树,菌株Qh-618与枯草芽胞杆菌模式菌株聚在同一簇上(图3),综合上述结果,最终鉴定菌株Qh-618为芽胞杆菌属枯草芽胞杆菌。
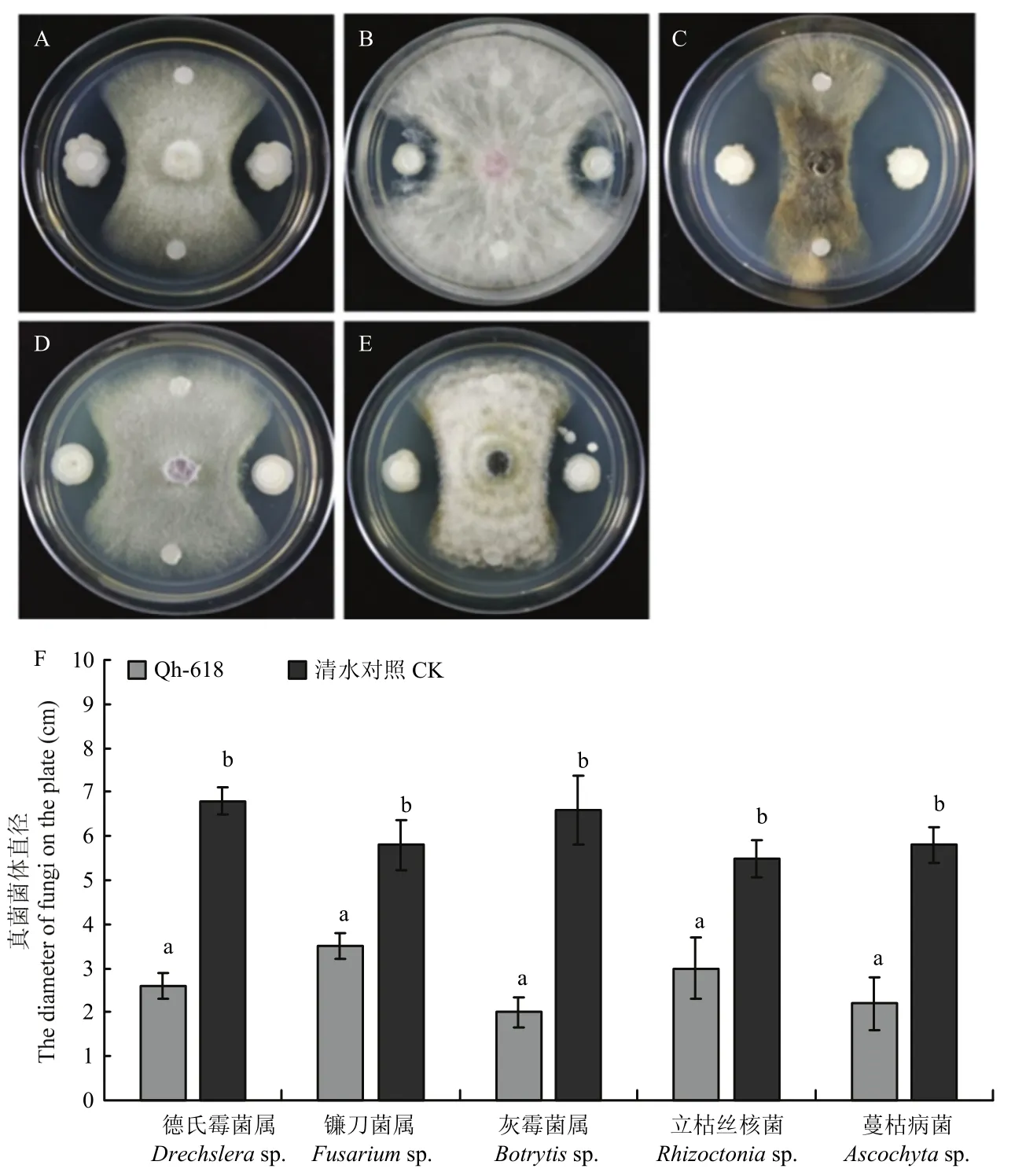
图1 生防菌Qh-618对多种病原真菌平板拮抗效果Fig.1 Antagonistic effect of Qh-618 on a variety of pathogenic fungi
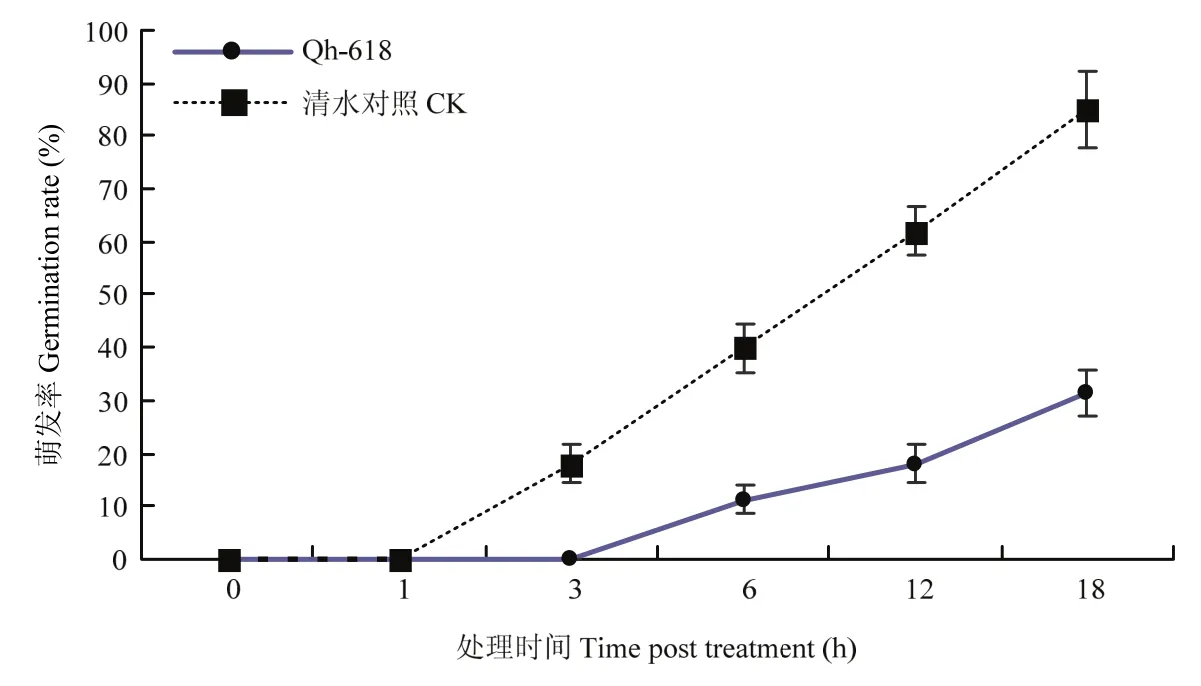
图2 生防菌Qh-618对燕麦德氏霉菌孢子萌发的影响Fig.2 Effect of Qh-618 on spore germination of D.avenae

表1 生防菌株Qh-618生理生化反应Table 1 The physiological and biochemical reaction of bacterial strain Qh-618
2.2 生防菌Qh-618对多种病原真菌的影响
平板对峙与燕麦种子萌发试验结果表明,生防菌株Qh-618对5种病原真菌抑菌率达61.17%~83.76%(表2)。此外,与清水对照相比,Qh-618能够显著提升燕麦种子的发芽,发芽率提升分别为7.4%~18%。以上结果表明,生防菌株Qh-618具有广谱抑菌活性。此外,研究发现生防菌株Qh-618具有较强的蛋白酶、多聚半乳糖醛酸酶、嗜铁素霉、产吲哚乙酸等活性(图4)综合上述结果显示,生防菌株Qh-618具有较强的生防潜力。
2.3 生防菌Qh-618对燕麦叶斑病盆栽防治效果
温室盆栽结果显示,清水对照组的燕麦于病原菌接种后3 d,燕麦叶斑病病情指数达69,接种5 d后,病情指数达85;生防菌Qh-618处理组的燕麦病情指数分别为35和52,防治效果分别为49.3%和38.8%(表3)。以上结果表明,生防菌Qh-618对燕麦叶斑病具有显著的防治效果。

表3 生防菌Qh-618对燕麦德氏霉菌的温室防治效果Table 3 The Biocontrol effect of Qh-618 on D.avenae in greenhouse
2.4 生防菌Qh-618对燕麦温室促生效果
经生防菌Qh-618处理5 d的燕麦苗叶绿素含量、根长、苗长、根鲜重、根干重、苗鲜重以及苗干重均显著高于清水对照组(表4)。其中根长与鲜重的增加最为显著,促生效果达50%以上。与清水对照相比,生防菌Qh-618处理10 d后燕麦根鲜重、苗鲜重增加显著,各增长率达15.6%~55.1%,对燕麦根长、根干重与苗干重的促生效果最为显著,分别为69.1%、59.6%和50%(表4)。以上结果表明,生防菌Qh-618对燕麦的生长促生效果显著。
2.5 生防菌Qh-618对燕麦田间应用效果
田间试验结果表明,生防菌Qh-618处理组燕麦的叶绿素含量、株高、鲜重、干重均显著高于对照组。采收期对各处理燕麦产量统计的结果显示,Qh-618处理组亩产量达 226.3 kg,显著高于对照组亩产量203.6 kg(表5);生防菌Qh-618处理组燕麦叶斑病的病情指数12.56,对照组病情指数30.32,防治效果达58.57%(表5)。
3 讨论
近年来,燕麦叶斑病危害日趋严重,成为燕麦生产中主要病害,在全世界大多数燕麦主产区都有发生[10,11]。利用生防菌防治燕麦病害,不仅能直接抑制燕麦德氏霉菌菌丝的生长、侵入及扩展,还可以促进燕麦生长、提升其免疫力,进而减轻病害发生所带来的产量及品质的下降。
据中国农药信息网(http://www.chinapesticide.org.cn/)数据显示,迄今为止,我国已登记的生物农药有效成分已逾50种,产品数量已超千余种[23],但还没有以燕麦为对象登记的生物农药。本研究筛选获得的生防菌株Qh-618是从青海燕麦叶斑病发生生境中分离获得的,对燕麦病害防治潜力较大,尤其对燕麦叶斑病具有显著防治效果。经生理生化测定试验及测序鉴定,生防菌株Qh-618属于枯草芽胞杆菌。前期研究表明,枯草芽胞杆菌作为一种有高效的生防细菌具有广泛的应用前景,目前也有一些优势菌株作为生物农药投入到作物生产过程中,其中包括黄瓜、草莓、西瓜、葡萄、辣椒、番茄、水稻、小麦、玉米、棉花等作物,对相应的病害防治效果显著[24]。但在燕麦病害的生物防治过程中,针对枯草芽胞杆菌报道较少,相关生防产品尚属空白,本研究为燕麦病害生物防治及生物农药开发提供重要的资源。
生防菌防治植物病害的作用机制主要通过产生抑菌物质、竞争营养物质、抢占生态位点以及诱导植物产生系统抗性等手段[25-27]。生防芽胞杆菌能够产生脂肽类抗生素(伊枯草菌素(Iturin)家族、表面活性素(Surfactin)和泛革素(Fengycin A、B)等)和拮抗蛋白两类拮抗因子,对病原菌有抗生作用[25]。芽胞杆菌的竞争作用包括营养竞争和空间位点竞争,而且以空间位点竞争为主,在植物根围形成致密的生物膜能提高芽胞杆菌在宿主体内的定殖力,并且对植物防御病原物的侵染有重要作用。Chen等[29]发现枯草芽胞杆菌3610菌株在番茄根部形成致密的生物膜,提高其在番茄根围的定殖能力,通过构建生物膜的减弱和增强突变体,并检测突变体对青枯病菌Ralstorinia solanacearum的生防能力发现,枯草芽胞杆菌3610生物膜的形成能力与生防效果正相关。Niu等[30]研究发现,利用蜡质芽胞杆菌AR156喷施拟南芥,可诱导植株体内防御相关基因的表达,提高植物系统抗性,保护植物免受病原菌入侵。为初步探究菌株 Qh-618对燕麦德氏霉菌的防病机制,本研究也对生防菌防治燕麦病害生防机制进行研究,结果发现枯草芽胞杆菌Qh-618处理能够显著抑制燕麦德氏霉菌的孢子萌发(图2);平板对峙试验结果显示,枯草芽胞杆菌Qh-618对多种病原真菌都具有显著的抑制效果,其中包括德氏霉菌属Drechslera sp.、镰刀菌属Fusarium sp.、灰霉菌属Botrytis sp.、赤霉病菌Gibberella sp.、蔓枯病菌Ascochyta sp.(图1)。上述结果表明,生防菌株Qh-618对真菌病害防治谱较广,且抑菌物质的产生可能是枯草芽胞杆菌Qh-618生物防治作用主要机理之一,但枯草芽胞杆菌 Qh-618的抑菌活性物质尚需进一步分离鉴定,具体的抑菌活性物质产生机制也仍需深入研究与探讨。另外,枯草芽胞杆菌Qh-618是否存在诱导系统抗性作用,有待进一步研究[30-32]。
温室试验及田间试验结果显示,枯草芽胞杆菌 Qh-618对燕麦叶斑病的防治效果显著,对燕麦生长具有较强的促进作用(表 2、3)。但生防菌的生防效果易受土壤温湿度、pH、作物生长状况及土壤中生态系统等微环境因素的影响,导致防治效果不稳定,极大限制生防芽胞杆菌的大面积推广应用[16,33]。尽管生防菌枯草芽胞杆菌 Qh-618在燕麦上表现出较好的防病和增产效果,但研究人员仍旧需要综合考虑防治对象的发病规律、栽培技术、土壤特性、使用成本及微生物菌剂的产品特性,开发出简单实用的田间应用技术,使该菌剂的田间防效更加稳定。此外,该菌剂使用后对土壤微生物群落、理化性质、土壤酶活性的影响方面在未来也有待进一步研究。上述问题的解析,也将更好地为枯草芽胞杆菌 Qh-618相关生防产品开发与应用提供理论依据。

