申氏杆菌37-1中群体感应淬灭内酯酶AiiS的功能分析
饶荣华,张俊威,吴小刚*
(1.广西农业环境与农产品安全重点实验室/广西大学农学院,南宁 530004;2.中国农业大学植物保护学院,北京 100193)
群体感应系统(quorum sensing,QS)是细菌群体利用自身产生的信号分子进行交流,调控相关基因表达,从而影响细菌多种生物学性状的一种重要调控机制[1]。这一调控机制赋予了细菌一定的社会性能力,可帮助其快速适应外部多变的环境[2]。目前研究表明,QS系统控制细菌的生物学功能,包括胞外裂解酶的产生、生物发光、抗生素的合成及Ti质粒的结合转移等[3]。许多植物革兰氏阴性病原细菌的致病相关基因表达也受QS系统严格调控,如引起马铃薯、大白菜和胡萝卜等多种作物软腐病的胡萝卜软腐果胶杆菌Pectobacterium carotovorum subsp.carotovora(Pcc),在侵染寄主植物的过程中可合成果胶酶、纤维素酶和蛋白酶等胞外酶,从而破坏植物细胞壁,造成软腐症状[4]。而这些胞外水解酶的产生即受到ExpI/ExpR QS系统的严格调控[5]。除果胶杆菌外,QS系统还影响其他植物病原细菌的致病性,如根癌土壤杆菌Agrobacterium tumefaciens中TraI/TraR QS系统利用其产生的信号分子3-氧-辛酰高丝氨酸内酯(3-oxo-octanoyl-homoserine lactone,3-oxo-C8-HSL)激活tra调节子的表达,引起感病寄主植物的根癌病[6]。同样,引起玉米细菌性枯萎病的斯氏泛菌 Pantoea stewartii ssp.stewartii,其主要致病因子胞外多糖(exopolysaccharide)的产生受EsaI/EsaR QS系统的调控,QS系统相关突变体的致病力较野生菌株显著降低[7]。这些研究结果表明,QS系统广泛参与调控植物病原细菌的致病性。
QS系统在植物病原细菌致病过程中起到关键作用,但该系统缺失并不影响细菌的生长,因此QS系统作为细菌病害防治的新靶点是目前微生物学领域的研究热点和重点之一,而对细菌QS系统的干扰和破坏被称为群体感应淬灭(quorum quenching,QQ)[8]。根据QS系统分子机制的特点,目前QQ的作用靶点主要有3种策略:(1)抑制信号分子的合成;(2)特异性降解合成的信号分子,使其浓度下降到QS系统被激活的阈值以下;(3)阻止信号分子-受体蛋白互作[9],其中以N-酰基高丝氨酸内酯(N-acyl homoserine lactones,AHLs)信号分子降解酶的研究最为深入。AHL降解酶主要分为AHL内酯酶、AHL酰基转移酶和AHL氧化还原酶[10]。来源于芽胞杆菌Bacillus sp.240B1中的AiiA内酯酶是最早发现的AHL降解酶,Dong等[11]将aiiA基因转入烟草和马铃薯植株中,可显著提高植株对Pcc的抗病性。AHL内酯酶除具有较高的AHL降解活性外,目前还发现了热稳定性较好的耐热酶[12],因此这类酶具有较好的市场应用前景。AHL酰基转移酶则通过水解AHL信号分子酰基侧链上的酰胺键生成高丝氨酸内酯和相应脂肪酸。最早鉴定的AHL酰基转移酶是来源于拉尔氏菌Ralstonia sp.XJ12B中的AiiD,过量表达AiiD可使铜绿假单胞菌Pseudomonas aeruginosa PAO1游动性、蛋白酶和绿脓菌素产量显著降低[13]。AHL氧化还原酶是研究较少的一类QQ降解酶,该酶主要是对AHL信号分子酰基侧链进行修饰,从而降低AHL信号分子的活性,但这类酶具有QQ活性较低的缺点[14]。
本研究利用原位培养法从广西多地植物根围土样中分离细菌,结合 AHL信号分子检测平板,筛选得到一株具有较强AHL降解活性的菌株Shinella sp.37-1。本文进一步研究了菌株37-1中aiiS基因编码产物对多种AHL信号分子的降解作用,明确aiiS基因对植物病原菌Pcc Z3-3中AHL信号分子、果胶酸盐裂解酶及致病性的影响,研究结果为构建新型高效生防菌株和转基因抗病作物提供了重要的遗传资源。
1 材料与方法
1.1 菌株、质粒和培养条件
本试验中用到的菌株、质粒和引物列于表1中。申氏杆菌Shinella sp.37-1、胡萝卜软腐果胶杆菌P.carotovorum subsp.carotovorum Z3-3、苍白杆菌Ochrobactrum sp.T63和根癌土壤杆菌A.tumefaciens NTL4 (pZLR4)于28 ℃在LB或ABM培养基中培养[15,16]。抗生素使用浓度为卡那霉素(Km)50 μg/mL和庆大霉素(Gm)50 μg/mL。用于重组质粒筛选的5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)终浓度为40 μg/mL。

表1 本实验所用菌株、质粒和引物Table 1 Strains,plasmids,and primers used in this study
1.2 土壤细菌的分离及QQ活性菌株的筛选
采集广西多地作物的根围土样,利用原位培养法分离根围细菌[22]。取一定量土样平铺于直径为15 cm的培养皿中,加入适量灭菌水保湿。土样表面放置细菌捕集器,该细菌捕集器由两层微孔滤膜(下层滤膜孔径为0.45 µm,下层滤膜孔径为0.2 µm)组成。上述装置封闭,28 ℃培养7 d后,将细菌捕集器中培养基置于灭菌水中,梯度稀释后涂布LB培养基平板上,挑选不同形态的单菌落,4 ℃保存备用。
QQ活性细菌的筛选方法参考文献[17]。候选菌株接种于0.5 mL ABM培养液中,28 ℃培养48 h后,加入 5 µL 5 mmol/L N-己酰基-L-高丝氨酸内酯(N-hexanoyl-L-homoserine lactone,C6-HSL)并继续培养 2 h。将上述菌液12000 r/min离心2 min,取5 µL上清液滴于A.tumefaciens NTL4 (pZLR4)报告菌平板上,晾干后于28 ℃培养12 h,记录试验结果。
1.3 菌株37-1鉴定
以菌株37-1基因组为模板,利用16S rDNA通用引物530F/1492R和63F/1387R(表1)分别进行PCR,扩增得到的两条DNA片端送上海生工公司测序。利用软件MEGA7.0进行遗传距离分析,采用邻位相连法(Neighbor Joining,NJ)构建菌株37-1和相关菌株的系统进化树,1000次自展检验(bootstrapping)评估进化树的可信度[23]。
1.4 菌株37-1中QQ酶编码基因的克隆
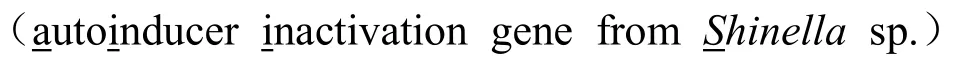
1.5 AiiS活性位点突变
利用软件DNAMAN对AiiS蛋白氨基酸序列比对分析,利用Fast Mutagenesis System定点突变试剂盒(北京全式金生物技术有限公司)对 AiiS氨基酸序列中保守的“G98-X-Nuc100-X-G102”结构域和 Asp(D221)和His(H250)残基进行定点突变。菌株BL21(p28a-aiiS)及其衍生体于37 ℃培养6 h后,加入5 µL 5 mmol/L C6-HSL,并于28 ℃继续培养2 h。各取菌液600 µL,12000 r/min离心1 min。将上清液用等体积的乙酸乙酯萃取,风干有机相后溶于50 µL甲醇。各取5 µL与报告菌A.tumefaciens NTL4 (pZLR4)(OD600=0.8)混合,培养6 h后,检测β-半乳糖苷酶活性。β-半乳糖苷酶活性的定量检测参照文献[12]。
1.6 AiiS降解AHL信号分子机制解析
AiiS与C6-HSL标准品(终浓度50 mmol/L)28 ℃反应3 h后,等体积乙酸乙酯萃取反应液。将乙酸乙酯蒸干后,用甲醇溶解反应产物。本试验以加热变性AiiS蛋白处理作为阴性对照,以10 mmol/L NaOH处理为阳性对照。利用超高效液相色谱-串联质谱仪(Agilent 1260-6460)对AiiS降解产物进行检测[12]。色谱检测波长为210 nm,流动相为甲醇:水(v:v)=40:60,流速0.2 mL/min,色谱柱为XBridge C18 (2.1 mm×150 mm,3.5 μm)。质谱条件为:ESI (+) 离子源,全扫描模式(m/z 100~250),喷雾气体为氮气(气压为0.1 MPa),气体流速为13 mL/min,喷雾电压4000 V,温度为350 ℃。
1.7 aiiS基因影响Pcc Z3-3AHL信号分子、果胶酸盐裂解酶和致病性
利用引物 AiiS-F/AiiS-R将 aiiS基因克隆至 pBBR1MCS-2中,获得穿梭质粒 pBBR-aiiS,将质粒pBBR1MCS-2和pBBR-aiiS分别转入Pcc Z3-3中,获得菌株Z3-3 (pBBR1MCS-2)和Z3-3 (pBBR-aiiS)。为定量检测Z3-3中AHL信号分子产量,菌株Z3-3及其衍生菌株于28 ℃培养,接种6 h后每隔2 h取样一次,测定菌液OD600并提取AHL信号分子[17]。AHL信号分子与A.tumefaciens NTL4 (pZLR4)混合培养6 h后,测定β-半乳糖苷酶活性[12]。
为检测Pcc Z3-3中果胶酸盐裂解酶含量,Z3-3及其衍生菌株于LB培养液中培养24 h。取1 mL培养液离心,将上清液与果胶酸盐裂解酶反应缓冲液混合(0.1 mol/L Tris-HCl,pH=8.5;0.1 mmol/L CaCl2;0.5% polygalacturonate),测定混合液在OD 230 nm处的吸光值[25]。
菌株Z3-3致病性测定参照文献[26]。菌株Z3-3及其衍生菌株接种于LB培养液,28 ℃过夜培养。用LB培养液将各菌株OD600调至1.0。各取5 μL菌液接种于大白菜、胡萝卜和马铃薯上,28 ℃保湿培养24 h后,记录试验结果。试验中每处理设置3个重复。
1.8 碳源对aiiS基因表达的影响
以菌株 37-1基因组为模板,引物 aiiSp-F/aiiSp-R扩增 aiiS基因启动子区域,构建报告质粒p970Km-aiiSp。将质粒p970Km-aiiSp并转化至菌株37-1中,得到报告菌株37-1 (p970Km-aiiSp)。分别将甘露醇、山梨醇、柠檬酸钠、丁二酸钠、乙酸钠、果糖、葡萄糖和蔗糖加入ABM基本培养液(碳源的终浓度为0.2%)中,菌株37-1 (pRG970-aiiSp)于28 ℃培养48 h后,各取200 μL菌液检测报告质粒aiiS-lacZ中β-半乳糖苷酶活性[12]。
1.9 数据统计与分析
试验数据采用Excel和DPS软件进行统计与分析。
2 结果与分析
2.1 AHL信号分子降解菌株的筛选及分类鉴定
本研究从广西各地采集不同作物的根围土样,利用原位培养法分离得到 2000多株菌落形态各异的候选细菌。通过AHL信号分子报告菌A.tumefaciens NTL4 (pZLR4)检测平板,筛选得到7株具有QQ降解活性的候选菌株。这些候选菌株中,菌株 37-1降解AHL信号分子活性最强(图1)。为进一步鉴定菌株37-1分类地位,本研究以37-1基因组为模板,分别以530F/1492R和63F/1387R为引物,PCR扩增得到两条DNA片段,这两条DNA片段经测序拼接后即为菌株37-1的16S rDNA序列。16S rDNA序列系统发育分析结果表明,菌株37-1与申氏杆菌属Shinella sp.细菌16S rDNA序列一致性在97.8%以上,因此菌株37-1属于申氏杆菌(图2)。
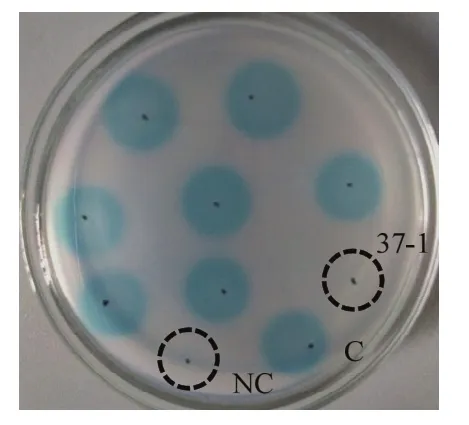
图1 AHL信号分子降解菌株的筛选Fig.1 Screening the bacteria with QQ activity
2.2 菌株37-1中aiiS基因的克隆
为筛选菌株37-1中参与降解AHL信号分子的相关基因,全基因组序列分析发现菌株37-1全基因组存在一个全长为819 bp的α/β水解酶结构域蛋白编码基因aiiS。序列分析表明,AiiS与Agrobacterium vitis中的α/β水解酶WP_156592277氨基酸序列一致性为84.93%,因此AiiS可能属于α/β水解酶家族蛋白(图3)。利用引物AiiS-F/AiiS-R,将aiiS基因克隆至表达载体pET-28a (+)中,获得表达质粒p28a-aiiS。SDS-PAGE试验结果发现,外源添加IPTG可诱导表达一个29 kDa蛋白,与预测的AiiS蛋白大小一致(图4A)。AHL信号分子检测试验表明,经IPTG诱导后,大肠杆菌 BL21 (p28a-aiiS)可降解多种不同类型 AHL信号分子(C6-HSL、3-oxo-C8-HSL和3-oxo-C12-HSL),而对照菌株大肠杆菌BL21 (pET-28a)则不能降解上述3种信号分子(图4B)。氨基酸序列分析进一步表明,AiiS具有保守的“G98-X-Nuc100-X-G102”结构域和Asp(D221)和His(H250)残基(图4C)。将这5个位点分别点突变后,AiiS丧失降解C6-HSL信号分子的能力,表明“G98-X-Nuc100-XG102”、Asp(D221)和His(H250)是AiiS活性所必需的(图4D)。这些结果表明,菌株37-1中aiiS基因参与降解AHL信号分子。
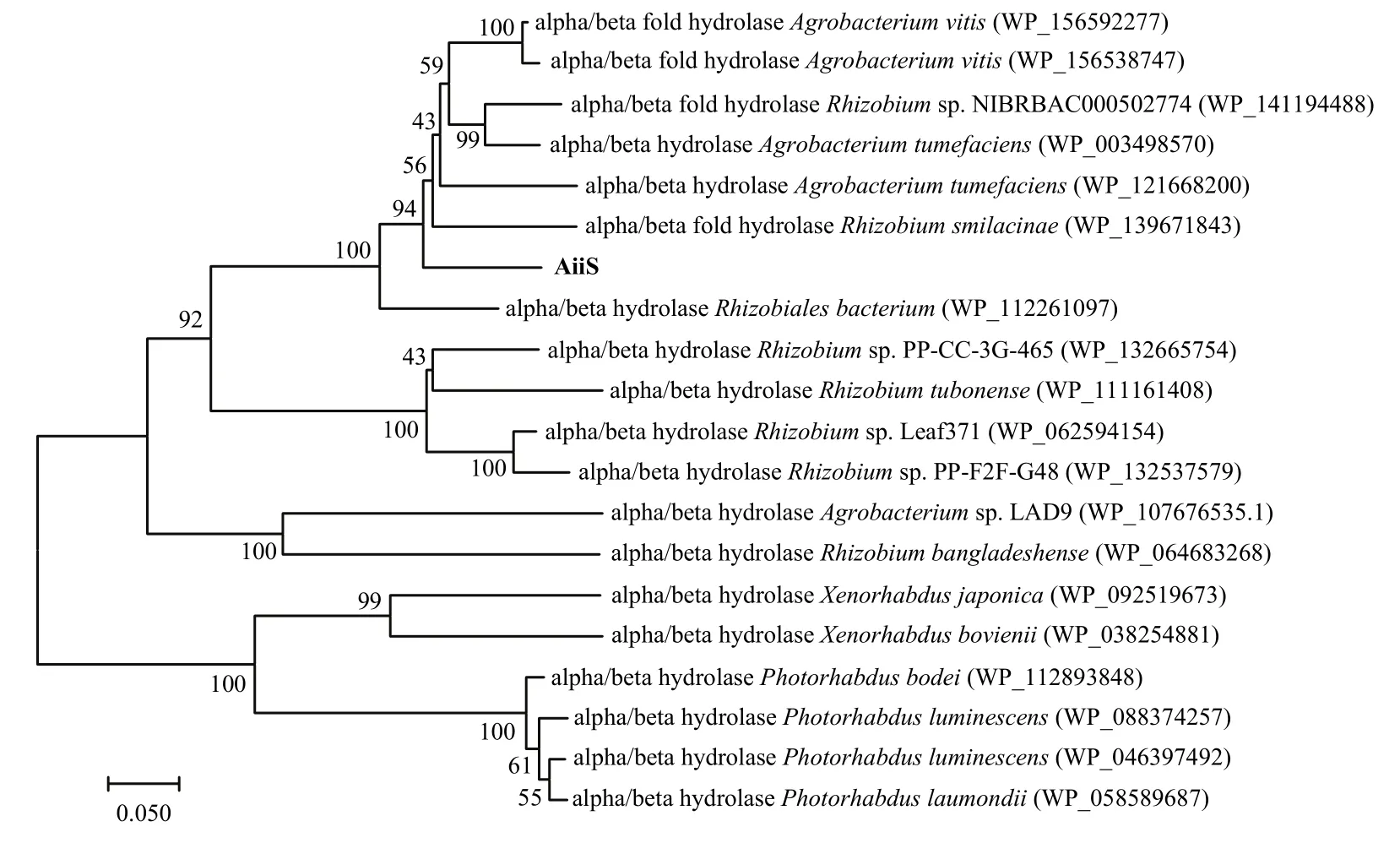
图3 AiiS蛋白系统发育分析Fig.3 Phylogenetic analysis of AiiS protein
2.3 AiiS降解机制解析
为明确AiiS降解AHL信号分子的作用机制,课题组利用超高效液相色谱-串联质谱仪分析分析AiiS与C6-HSL的反应产物。研究结果表明,AiiS与C6-HSL信号分子的反应产物中出现一个保留时间为1.86 min的新峰,该峰与NaOH处理C6-HSL后产生的开环产物正己醇-高丝氨酸(C6-HS)具有相同的保留时间;而热变性处理的AiiS蛋白与C6-HSL反应并没有出现该峰(图5A-D)。质谱分析进一步表明,新生成的产物荷质比(mass-to-charge ratio,m/z)为217.1,加钠(M+Na)的荷质比为240.1,比标准C6-HSL加钠的荷质比(M+Na,m/z=222.1)增加18,即一个H2O的分子量。该分子量与C6-HSL经NaOH处理后的开环产物C6-HS(m/z=217.1)分子量一致。而热变性AiiS的反应产物与标准C6-HSL的荷质比一致为222.1(图5E-H)。上述结果表明,AiiS属于AHL内酯酶,水解高丝氨酸内酯环的内酯键,使酯环打开,从而生成高丝氨酸。
2.4 AiiS抑制胡萝卜软腐果胶杆菌Z3-3致病性
胡萝卜软腐果胶杆菌Z3-3通过QS系统调控相关毒性因子的表达,如果胶酸盐裂解酶的产生等。为检测AiiS是否影响菌株Z3-3中相关毒性因子的表达,本研究将aiiS基因转入胡萝卜软腐果胶杆菌Z3-3中。研究结果表明,过量表达aiiS基因虽不影响该菌株的生长,但可显著降低AHLs的产量(图6A)。而果胶酸盐裂解酶活性检测试验表明,重组菌株 Z3-3(pBBR-aiiS)培养液中果胶酸盐裂解酶活性显著低于野生型菌株Z3-3和对照菌株Z3-3(pBBR1MCS-2),表明AiiS可显著降低菌株Z3-3果胶酸盐裂解酶的活性(图6B)。
将野生型菌株Z3-3、空载体对照菌株Z3-3 (pBBR1MCS-2)和重组菌株Z3-3 (pBBR-aiiS)分别接种到白菜叶片、马铃薯切片和胡萝卜切块上。28 ℃保湿培养24 h后,试验结果表明接种重组菌株Z3-3 (pBBR-aiiS)的白菜叶片、马铃薯和胡萝卜和发病面积显著小于野生型菌株Z3-3和空载体对照菌株Z3-3 (pBBR1MCS-2)(图6C)。上述结果表明,AiiS可以显著降低胡萝卜软腐果胶杆菌Z3-3的致病性。
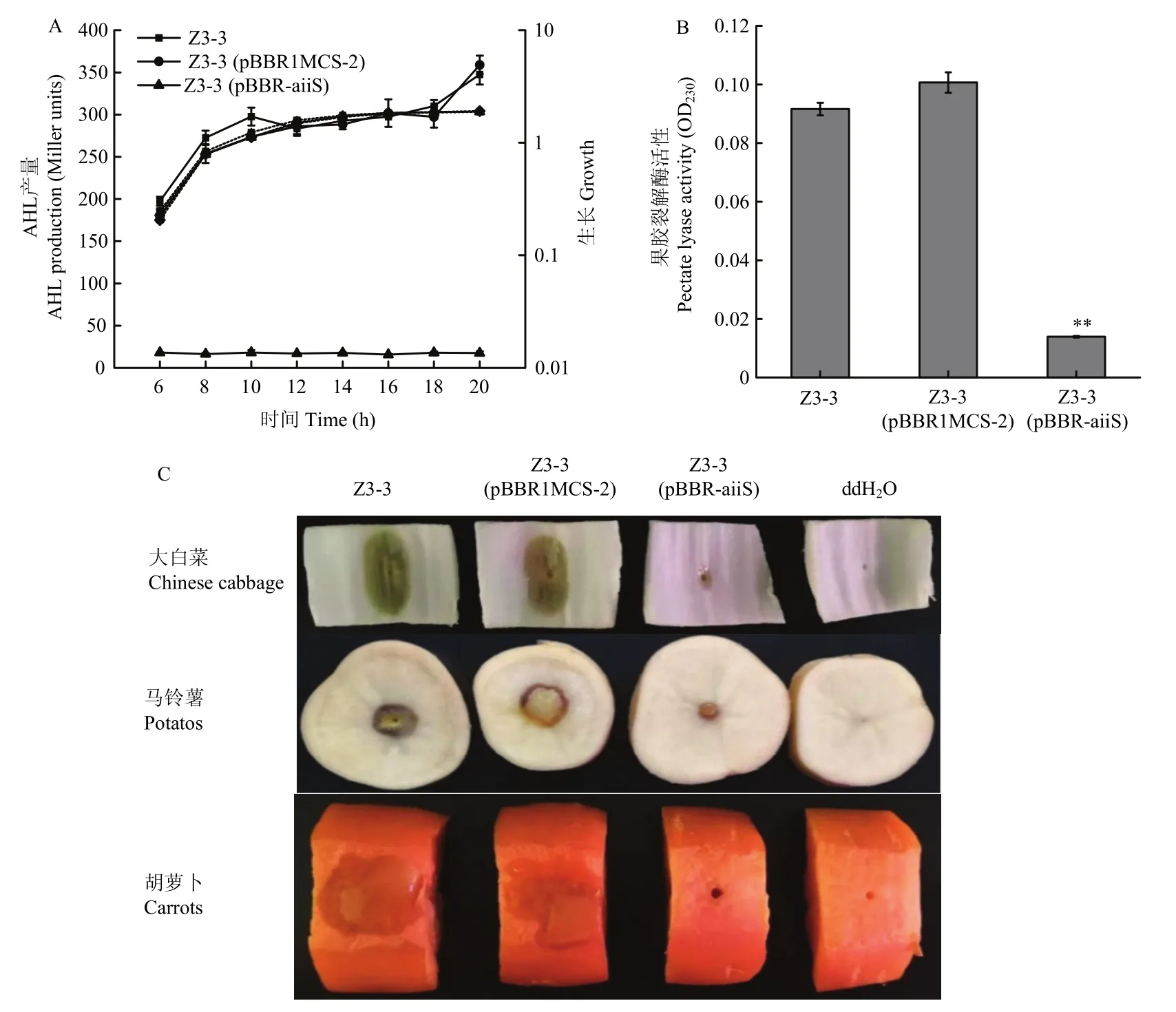
图6 AiiS影响Pcc Z3-3致病性Fig.6 Effect of AiiS on pathogenicity of Pcc Z3-3
2.5 不同碳源影响菌株37-1中基因aiiS的表达
外界环境条件可显著影响生防菌株的效果,为研究菌株37-1后续的商品化,本研究构建了aiiS基因报告质粒p970Km-aiiSp,并检测了不同碳源对aiiS基因表达的影响。研究结果表明,与葡萄糖、果糖及甘露醇等碳源相比,以柠檬酸钠、丁二酸钠为唯一碳源时,菌株37-1 (p970Km-aiiSp)的β-半乳糖苷酶活性显著升高(图7),可显著提高菌株37-1中aiiS基因的表达水平。
3 讨论
QQ是防治植物细菌性病害以及消减生物膜污染的重要策略之一,而目前 QQ淬灭酶编码基因主要通过分离土壤中可培养细菌及宏基因组文库方法获得[8]。由于细菌分离技术和异源基因表达的局限性,从而制约了从细菌中挖掘新型 AHL淬灭酶生物资源[10]。本研究利用原位培养法分离土壤根围细菌,提高了土壤中细菌的分离效率,并从获得的细菌资源库中筛选到多株具有降解AHL信号分子的候选菌株,其中菌株37-1具有较好AHL降解活性(图1)。16S rDNA序列分析表明,菌株37-1属于申氏杆菌,目前研究表明,申氏杆菌属中的部分细菌如申氏杆菌HZN7和S.zoogloeoides BC026可降解尼古丁[27]、吡啶[28]和乙草胺[29]等有毒物质,但未有该属细菌降解AHL信号分子的报道。前期研究表明,申氏杆菌属属于α-变形杆菌纲根瘤菌科,成立于2006年[30]。到目前为止,该属中仅有7个种[31]。由于该属细菌具有高度相似的16S rDNA序列及生理生化性状,因此很难通过传统的16S rDNA序列分析以及生理生化鉴定对该属细菌进行分类鉴定[31],后续课题组将利用 gyrA-gyrB-rpoB-rpoC多基因序列比对的方法对菌株37-1进行鉴定。
为克隆菌株37-1降解AHL信号分子的相关基因,本文对菌株37-1进行全基因组测序,并通过功能结构域筛选得到aiiS基因。研究表明aiiS基因编码产物可降解短链信号分子C6-HSL和中长链信号分子3-oxo-C8-HSL和3-oxo-C12-HSL等不同类型的AHL信号分子,表现出较好的底物兼容性(图4B)。蛋白序列分析表明,AiiS属α/β水解酶家族蛋白(图3),其序列中包含了保守的氨基酸序列“G-X-Nuc-X-G”以及组氨酸残基和相对保守的天冬氨酸残基,对这些位点分别点突变后,可影响AiiS对C6-HSL信号分子的降解活性,表明这些位点是该蛋白发挥功能所必须的(图4C,D)。AHL信号分子降解机制分析表明,AiiS通过水解高丝氨酸内酯环的内酯键,生成高丝氨酸,从而破坏AHL信号分子的生物活性,这些结果表明AiiS属于AHL内酯酶(图5)。但AiiS与已报道的α/β水解酶家族的AHL内酯酶一致性较低,如与来源于Rhodococcus sp.BH4 中的JydB一致性为41.4%[32],与来源于Ochrobactrum sp.中的AidH一致性为41.1%[17],与来源于Microbacterium testaceum StLB037中的AiiM一致性为29.3%[33],因此推测AiiS是AHL内酯酶的一个新亚型。
生测试验发现,胡萝卜软腐果胶杆菌Z3-3中过量表达aiiS基因并不影响该菌株的生长,但可显著降低该菌AHL信号分子和果胶酸盐裂解酶的产生,进而消弱该病原菌对白菜、马铃薯和胡萝卜的致病性(图6)。这些结果表明aiiS基因可抑制菌株Z3-3中受QS系统调控的致病因子的表达。目前AHL淬灭酶相关遗传资源的利用仅局限在实验室中,商品化产品较少[9]。而生防菌的防治效果往往受到环境因素的影响,转录报告试验表明,柠檬酸钠和丁二酸钠显著提高菌株37-1中aiiS基因的表达,而葡萄糖、果糖等碳源并不影响aiiS基因的表达(图7)。下一步工作将详细研究环境因子对菌株37-1中aiiS基因表达的调控作用,为新型生防制剂的研发奠定基础。

