红肉番石榴果胶的理化特性及其体外降脂作用
吕冰冰,谢笔钧,孙智达
(华中农业大学食品科学技术学院,湖北武汉 430070)
果胶是一类由α-1,4-D-吡喃半乳糖醛酸连接的聚合物,果胶的生物活性由其化学结构决定,其化学结构与来源、品种、产地及提取方法有关。有研究表明,果胶的甲氧基化程度和分子量是决定不同果胶功能属性的重要参数[1]。果胶具有降血脂、降血糖[2]、抗肿瘤[3]、抗氧化[4]等多种生物活性[5]。果胶在人体胃肠道不能被消化[6],同时可以结合胆酸盐,影响胆固醇的吸收转运,从而调节血脂水平[7]。
番石榴(Psidium guajavaL.)为桃金娘科番石榴属植物,果实卵形或洋梨形,果皮有平滑和粗糙两种,果肉滑嫩,香气独特,被认为是类胡萝卜素、果胶、膳食纤维以及其他植物化学物质如抗坏血酸、花青素的理想来源[8]。有学者从红肉番石榴中提取果胶-番茄红素复合物,并建立数学模型阐明复合机制[9]。华德洪[10]从番石榴中提取多糖进行分离纯化,证明了番石榴多糖的抗氧化、抗糖化的生物活性。目前对番石榴可食用部位活性成分的研究主要在多酚的提取和抗氧化活性[11]及果胶、非果胶多糖的提取分离纯化[10,12],对于番石榴果胶理化特性还未见报道,其降脂活性尚不明确。本实验从红肉番石榴果皮、果肉中提取番石榴果皮果胶(Peel pectin,PEP)和果肉果胶(Pulp pectin,PUP),采用傅里叶红外光谱、气相色谱法、扫描量热法、流变学特性分析、纳米粒度电位分析仪、扫描电子显微镜方法研究其理化性质,并表征其结构特征,通过体外实验研究其体外降脂活性,为其进一步研究利用果胶提供参考依据。
1 材料与方法
1.1 材料与仪器
红肉珍珠番石榴 果皮粗糙,9月份产自福建;D-半乳糖醛酸 纯度97%,货号G8120,北京索莱宝科技有限公司;咔唑 货号C804607-25g,上海润捷化学试剂有限公司;柠檬酸、无水乙醇、氢氧化钠、盐酸、浓硫酸、冰醋酸、胆固醇 分析纯,国药集团化学试剂有限公司;苹果果胶(粉末态,纯度65%,货号P885045-100g)、胆酸钠(纯度95%,货号S874962-5g)、牛磺胆酸钠(纯度95%,货号S817405-1g)、消胆胺树脂(货号C872070-1g,纯度BR) 上海麦克林生化科技有限公司;柑橘果胶(粉末态,纯度74%,货号P9135-100g) Sigma公司;邻苯二甲醛(纯度98%,货号P108632-5g) 阿拉丁试剂有限公司;玉米油(食品级,其中饱和脂肪占14.4%,单不饱和脂肪30.2%,多不饱和脂肪55.4%) 山东鲁花集团有限公司。
GZX-9140 MBE数显鼓风干燥箱 上海博迅实业有限公司;FS-600N超声波分散仪 上海生析超声仪器有限公司;X-30R离心机 美国贝克曼有限公司;UV-2100型紫外可见分光光度计 上海尤尼柯仪器有限公司;SHZ-D型循环水真空泵 武汉科尔仪器设备有限公司;ER-52AA旋转蒸发器 上海亚荣生化仪器厂;Beta2-8LD冷冻干燥机 德国Christ公司;Nexus 470 FT-IR傅里叶变换红外光谱仪 美国 Nicolet公司;GC-MS- QP2010 日本岛津公司;Dawn Heleos II 18角度激光光散射仪 美国WYATT公司;ZetasizerNano ZS纳米粒度电位分析仪 英国马尔文仪器有限公司;DSC204F型差示扫描量热仪 耐驰仪器上海有限公司;JSM-6930LV扫描电镜 日本NTC公司;DHR-2流变仪 美国TA仪器公司。
1.2 实验方法
1.2.1 番石榴果胶的提取 参考崔灵敏等[12]方法,将新鲜的番石榴削皮,果皮厚度约2 mm,所得番石榴果肉除去籽,切片成5 mm厚的小块,然后将番石榴果皮、果肉在95 ℃蒸3 min灭酶,在50 ℃条件下烘干至恒重。原料粉碎后分别过80目筛得到番石榴果皮粉、番石榴果肉粉。将过筛后的原料粉末用80%的热乙醇洗涤以除去黄酮,待洗涤液冷却后用真空泵抽滤,所得滤渣再反复用热乙醇洗涤,洗至滤液中无黄酮检出,采用硝酸铝比色法[13]测定洗涤液中黄酮含量。然后将滤渣在50 ℃干燥,待用。
取20 g干燥滤渣按1:40 g/mL的料液比与pH为2.5的柠檬酸溶液提取液混合,再用10%的柠檬酸溶液将混合液pH调节至2.5,并于80 ℃水浴提取2 h,将溶液冷却至室温。然后采用超声细胞破碎仪以90 W的功率连续超声30 min,并在25 ℃下以6700×g离心10 min,取上清液,以4倍体积的95%乙醇沉淀过夜,过滤后的滤渣加入100 mL丙酮洗涤2次,洗涤后的果胶置通风橱除去残留溶剂后,于50 ℃烘箱干燥至恒重,用50 mL蒸馏水溶解干燥后的样品,利用3500 Da的透析袋透析72 h,以除去小分子的杂质。所得透析液用真空旋转蒸发仪于50 ℃浓缩至原体积的1/10,将浓缩后的样品放入−20 ℃冰箱冻结12 h,然后放入冻干机在−100 ℃冷冻干燥48 h,分别得到番石榴果皮和果肉的水溶性果胶。果胶质量与原料质量之比即为果胶得率。
1.2.2 番石榴果胶的理化特性
1.2.2.1 果胶的基本成分测定 水分含量测定参照GB/T 5009.3-2016直接干燥法;脂肪含量测定参照GB/T 5009.6-2016索氏抽提法;灰分含量测定参照GB/T 5009.4-2010直接灰化法。
采用考马斯亮蓝法测蛋白含量[14],将牛血清白蛋白标准品配制成浓度为:0、0.01、0.02、0.04、0.06、0.08、0.10 mg/mL,取1 mL样品,加入5 mL考马斯亮蓝贮备液,摇匀,静置10 min,于595 nm波长测紫外吸光度,标准曲线为:y=5.765x+0.6085(R2=0.9904)。配制0.4 mg/mL的果胶溶液,按上述方法测定吸光度,代入标准曲线计算蛋白含量。
采用硫酸-苯酚法[15]测果胶中总糖含量,配制浓度为0、0.01、0.02、0.04、0.06、0.08、0.10 mg/mL葡萄糖标准溶液,吸取1 mL待测液于具塞试管中,加入1 mL 5%苯酚溶液,摇匀,加入4 mL浓硫酸溶液,摇匀,静置20 min,于490 nm波长测紫外吸光度,标准曲线为:y=10.233x−0.106(R2=0.9978)。配制0.04 mg/mL的果胶溶液,按上述方法测定吸光度,代入标准曲线计算总糖含量。
半乳糖醛酸含量测定参考陈巧巧等[16]的方法并加以改进,将果胶配制成0.05 mg/mL溶液,1 mL果胶溶液,加入5 mL的四硼酸钠-浓硫酸溶液溶液,沸水浴5 min,取出冰浴,冷却后加入0.15%间羟基联苯溶液0.1 mL,混匀,静置10 min,在520 nm处测定其吸光度。配制标准系列浓度的半乳糖醛酸溶液,绘制半乳糖醛酸标准曲线为:y=7.8804x−0.0017(R2=0.9990)。
1.2.2.2 红外光谱分析 将溴化钾放入100 ℃干燥箱中干燥8 h,样品放入40 ℃干燥箱中干燥8 h。干燥后的样品与溴化钾以质量比为1:50混合均匀并压成薄片,于傅里叶变换红外光谱仪上进行红外光谱分析,测量波数范围4000~400 cm−1,扫描次数为64次。
1.2.2.3 分子量测定 利用凝胶渗透色谱法-多角度激光光散射(GPC-MALLS)联用技术测定果胶分子量,色谱柱为 Shodex OHpak SB-804 HQ,SB-806 HQ(8 mm×300 mm),流动相为0.1 mmol/L硝酸钠水溶液,使用前将流动相超声10 min脱气,进样前将流动相流速调为0.3 mL/min平衡色谱柱8 h。将样品及标样配制浓度为1 mg/mL,用0.45 μm滤膜过滤,进样量为100 μL,流动相流速为0.4 mL/min,柱温为25 ℃,检测器为RID示差折光检测器,分析前用分子量40 kDa右旋糖酐标样校正分子量,以确保其准确性。
1.2.2.4 中性糖组成测定 参考崔灵敏等[12]方法,利用气相色谱-质谱联用仪(Gas ChromatograpHy-Mass Spectrometer,GC/MS),将岩藻糖、半乳糖、葡萄糖、鼠李糖、木糖、甘露糖、阿拉伯糖标准品用蒸馏水配制成4.301 mg/mL溶液,然后分别稀释至172.040、17.204、8.602、4.301、0.430 μg/mL。通过内标法,依据单糖和肌醇在检测器上的峰面积之比进行单糖的定量分析。先将标准单糖稀释系列浓度与肌醇混合,计算不同浓度单糖与肌醇的峰面积比,以单糖浓度为横坐标,单糖与肌醇峰面积之比为纵坐标,做标准曲线。将待测样品与肌醇混合,得到样品中单糖与肌醇峰面积之比,通过标准曲线计算样品中各单糖含量。
色谱柱为Rxi-5MS(30.0 m×0.25 mm)型,柱温155.0 ℃,注射温度为250 ℃,流速为1.02 mL/min。质谱条件:接口温度为250 ℃,离子源温度为200 ℃,溶剂切除时间为5 min,MS检测器模式为选择离子模式(SIM)。
1.2.2.5 果胶溶液粒径和Zeta电位测定 参考崔灵敏等[12]方法,用蒸馏水将果胶配制成1 mg/mL的溶液,吸取1 mL果胶溶液加入样品池,将样品池插入仪器中,等待温度平衡,测量Zeta电位和粒径。
1.2.2.6 热稳定性测定 参考Saeid等[17]方法,利用差示扫描量热法(differentia lscanning calorimetry,DSC)测定。将样品取5 mg左右放入小坩埚,用压片机进行压片,记录每一个样品的质量,氮气为保护气体和冷却气体,以10 ℃/min的程序进行升温,以25 ℃为起点,升温到400 ℃。
1.2.2.7 流变学特性测定 参考Zhang等[18]方法加以改进,使用AR2000ex型流变仪利用流变仪进行检测,锥板直径为40 mm,锥角2°。配制浓度为1、5、10 mg/mL的样品,吸取1 mL左右的样品溶液到流变仪平板上,调整锥板和平板间距到1.00 mm,剪切速率范围为0.1~100 s−1进行测定。
1.2.2.8 微观形态观察 将果胶配制成20 mg/mL溶液,冷冻干燥,取干燥的果胶沾到样品台,用溅射镀膜法进行镀金处理,高真空条件下使用扫描电子显微镜(Scanning electron microscope,SEM)对样品进行微观形态分析。
1.2.3 番石榴果胶的体外降脂作用测定
1.2.3.1 番石榴果胶吸附脂肪的测定 参考隋勇[19]实验方法,准确称取0.1 g样品放入离心管中,加入10 mL 0.01 mol/L的盐酸溶液,样品溶解后,称重记为m1。取3 g的玉米油加入,在37 ℃恒温振荡1 h,用0.1 mol/L的NaOH溶液,调节pH至7,在37 ℃恒温振荡1 h。3800×g离心10 min,上层的脂肪与下层溶液分层。吸取上层脂肪于干燥烧杯中,称重记为m2,将其置于120 ℃烘箱中2 h,取出冷却,称量记为m3。将下层溶液与离心管称重记为m4。按照下式计算吸附脂肪吸附能力。

式中:m0为样品质量,以g计。
1.2.3.2 番石榴果胶结合胆固醇胶束的测定 胆固醇胶束液制备[20]:1 mL胶束液中含有10 mmol/L牛磺胆酸钠、2 mmol/L胆固醇、5 mmol/L油酸、132 mmol/L NaCl、15 mmol/L磷酸缓冲液(pH为7.4)。以300 W功率超声20 min使胶束液完全混合。胆固醇标准曲线的绘制:取标准系列浓度的胆固醇溶液0.4 mL,加入0.2 mL 1 mg/mL邻苯二甲醛溶液,加4.0 mL冰醋酸、浓硫酸混合液(v:v=1:1),混匀,显色10 min。于550 nm波长处测定吸光值,绘制标准曲线为:y=1.6545x+0.0493(R2=0.9940)。
参考Nagaoka等[21]实验方法,称取20 mg的果胶样品加入1 mL 0.01 mol/L 的盐酸溶液,37 ℃ 恒温振荡消化1 h,以0.1 mol/L的氢氧化钠溶液调节pH为6.3,加入2 mL胆固醇胶束液。将混合液在37 ℃温度下振荡2 h,6700×g离心20 min,测定上清液其中胆固醇含量,以释放胆固醇的量,表示番石榴果胶结合胆固醇胶束的量。

式中:W为胆固醇胶束结合量(mg/100 mg);c1为试验组上清液胆固醇的质量浓度(mg/mL);c2为空白组上清液胆固醇的质量浓度(mg/mL);V为溶液体积(mL);m为样品质量(mg)。

式中:W1为果胶对胆固醇胶束结合量(mg/100 mg);W2为考来烯胺对胆固醇胶束结合量(mg/100 mg)。
1.2.3.3 番石榴果胶结合胆酸盐的测定 参考胡凯[22]方法,分别称取20 mg的样品,加入2 mL 0.01 mol/L的盐酸溶液,在37 ℃恒温振荡消化1 h,以0.1 mol/L的氢氧化钠溶液调节pH为6.3,随后每个样品中加入8 mL胆酸盐溶液(0.3 mmol/L牛黄胆酸钠、0.3 mmol/L胆酸钠,以pH6.3的0.1 mol/L磷酸缓冲液配制),在37 ℃恒温振荡2 h。6700×g离心20 min,测定上清液中的胆酸盐含量。

式中:W为胆酸盐结合量(μmol/100 mg);c1为空白组上清液胆酸盐的质量浓度(μmol/mL);c2为试验组上清液胆酸盐的质量浓度(μmol/mL);V为溶液体积(mL);m为样品质量(mg)。

式中:W1为果胶结合胆酸盐量(μmol/100 mg);W2为考来烯胺结合胆酸盐量(μmol/100 mg)。
胆酸盐标准曲线的绘制:分别以0.1 mol/L、pH6.3的磷酸缓冲溶液配制0.3 mmol/L的牛磺胆酸钠、胆酸钠溶液,稀释系列浓度,取胆酸盐1.0 mL,再加入7 mL质量分数为60%的硫酸溶液,于70 ℃水浴20 min,取出冰浴5 min,在387 nm处测定吸吸光度。绘制标准曲线,牛磺胆酸钠标准曲线为:y=2.2407x+0.0437(R2=0.9963);胆酸钠标准曲线为:y=1.1712x+0.0170(R2=0.9911)。
1.3 数据处理
数据均平行测定三次,并用Microsoft Excel 2019处理,使用SPSS新复极差法进行方差分析,Origin8.0作图。
2 结果与分析
2.1 番石榴果胶的理化特性
2.1.1 果胶基本成分测定 采用超声波辅助柠檬酸法分别提取番石榴果皮和果肉中水溶性果胶,PEP得率为7.88%,PUP得率为6.32%,其基本成分如表1所示。PEP和PUP的总糖含量分别为85.75%±0.18%、83.06%±0.29%,二者均含极少量蛋白质和脂溶性成分。PEP、PUP半乳糖醛酸含量分别为60.39%±0.09%、59.44%±0.24%。半乳糖醛酸含量反映了果胶的纯度,半乳糖醛酸含量越高,果胶纯度越高。

表1 番石榴果胶的基本成分测定结果(%)Table 1 Results of determination of basic components of guava pectin (%)
2.1.2 红外光谱分析 果胶是一种广泛存在于植物细胞壁中的结构性杂多糖,果胶的结构组成在很大程度上取决于果胶的来源类型、水果的成熟度[23]和提取条件(例如,酸碱及对应的试剂种类、纯化和干燥步骤等)。傅里叶变换红外光谱可以反映果胶结构中存在的主要官能团。图1表明,3423 cm−1处的强峰是由果胶分子的分子间和分子内氢键中存在的O-H基团的伸缩振动引起的吸收,在大约2940 cm−1处的峰对应于果胶中的C-H基团(CH、CH2和CH3)的对称和非对称伸缩振动[24]。在1633和1747 cm−1处的峰分别对应游离羧基(-COO−)和酯化羧基(-COO-R)。基于二者的比值也可计算果胶的酯化度(即酯化羧基的峰高度与二者峰高和之比[25]),根据图1,计算可得:PEP酯化度为56.29%,属于高酯果胶;PUP酯化度为48.57%,属于低酯果胶。果胶在973和1018 cm−1附近对应吡喃型糖的特征吸收峰,说明这两种果胶的构型均为吡喃型糖苷键连接[12]。
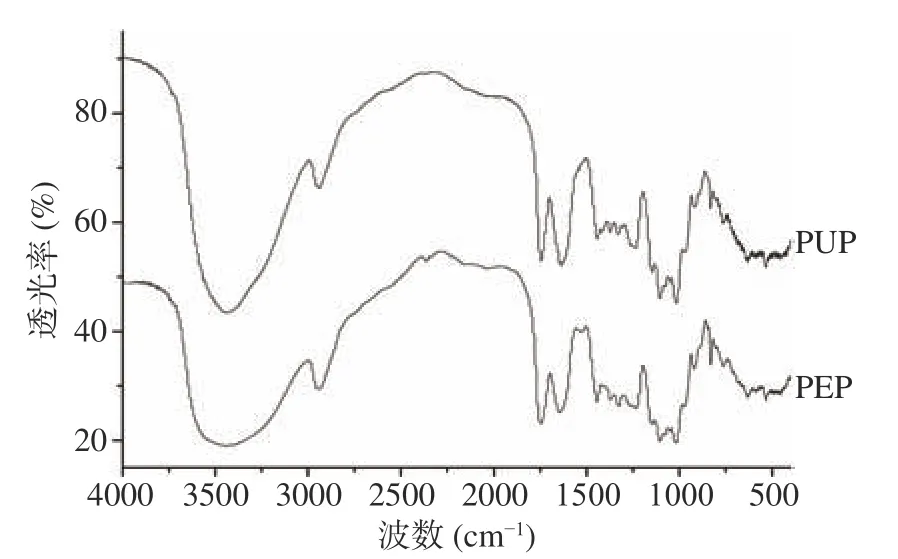
图1 番石榴果胶的红外光谱图Fig.1 Infrared spectra of guava pectin
2.1.3 分子量测定 果胶的功能特性在很大程度上取决于果胶的分子量[25]。两种果胶的相对分子质量分布见图2,其分子特征参数见表2。PEP出现两个峰,保留时间分别为18.31、20.46 min,重均分子量Mw分别为618.40 kDa(43.4%)、93.90 kDa(56.6%)。PUP出现三个峰,保留时间分别为15.75、17.86和20.37 min,Mw分别为1168.00 kDa(11.0%)、120.30 kDa(53.9%)和64.94 kDa(35.1%),表明两种果胶均由不同分子量片段的果胶组成。多分散系数(Mw/Mn)表示分子量分布的宽度,各峰的多分散系数均高于1,表明这两种果胶均具有广泛的分子量分布,是一种非均一的天然多糖[26]。

表2 番石榴果胶的相对分子量Table 2 Relative molecular weights of guava pectin
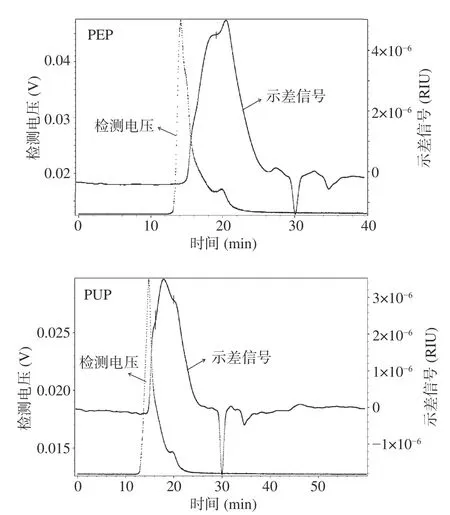
图2 番石榴果胶的分子量色谱图Fig.2 Molecular weight chromatogram of guava pectin
2.1.4 中性糖组成测定 果胶分子的结构主链由α-D-半乳糖醛酸基通过1,4糖苷键连接而成,在主链中存在不同单糖构成的侧链。标准曲线与各单糖含量见表3。如图3,两种番石榴果胶所含的中性糖种类一致,中性糖组成均以阿拉伯糖居多、其次是半乳糖,阿拉伯糖在PUP、PEP中含量分别为:88.48%±0.07%、83.86%±0.04%。两种果胶中鼠李糖、岩藻糖、木糖、甘露糖、葡萄糖呈微量状态,但是在二者中的含量相差不大。

图3 中性糖组成气相色谱图Fig.3 Gas chromatogram of neutral sugars

表3 番石榴果胶的中性糖组成Table 3 Composition of neutral sugars in guava pectin
2.1.5 溶液粒径和Zeta电位 如图4所示,两种果胶均带负电荷,均属于阴离子多糖,二者所带电荷量无显著性差别。溶液的粒径越小,所带电荷越多,溶液体系越稳定。PUP的粒径显著大于PEP,表明PEP溶液更稳定。

图4 番石榴果胶Zeta 电位与粒径分析Fig.4 Zeta potential and particle size analysis of guava pectin
2.1.6 热稳定性 差示扫描量热曲线,显示了两个峰,第一个峰为吸热峰在96.42 ℃,此位置吸热峰是由于水的存在,升温导致水分蒸发,从而产生吸热现象[27]。同时,这也可能是由于半乳糖醛酸之间的氢键以及结构的改变,如半乳糖醛酸环的4C1构象向1C4构象的转变[28]。它代表果胶样品的持水能力,并与果胶结构的亲水基团有关[28]。由图5可知,PUP的峰面积较大,表明PUP吸收更多能量使水分蒸发,这表明PUP的持水能力更强。第二个峰为放热峰在269.85 ℃,这是由于果胶发生降解,从而释放热量。PEP、PUP的放热峰出现的温度相同,表明两种果胶具有相同的热稳定性。

图5 番石榴果胶的DSC分析Fig.5 DSC analysis of guava pectin
2.1.7 流变学特性 图6显示了PEP、PUP在不同浓度、不同剪切速率下的粘度变化,两种果胶的粘度都随着溶液浓度的增加而增加,在不同浓度下PUP的粘度均高于PEP。两种果胶的粘度都随着剪切速率的增加而逐渐降低,这表明这两种果胶溶液具有非牛顿流体的假塑性行为(剪切变稀)[29]。假塑性行为是由于聚合物网络的解缠和部分链取向在剪切流动方向。在进一步增加剪切速率后,由于剪切变形引起的微观结构发生变化,分子间的相互作用减少,从而使黏度降低到一个固定值[30]。

图6 番石榴果胶溶液的表观粘度Fig.6 Apparent viscosity of guava pectin solution
2.1.8 微观形态观察 由图7可见,PEP、PUP微观形貌均为片状,表面有褶皱及凸起,但PUP褶皱更深。PEP边缘呈细丝状,形似触角,且细丝较多,PUP初具细丝形状。果胶的来源不同,提取方式的不同会导致果胶的表面结构有所差异,如从芒果皮中提取的果胶呈片状,褶皱不明显,有明显的孔洞[12]。

图7 番石榴果胶扫描电镜图Fig.7 SEM of guava pectin
2.2 番石榴果胶的体外降脂作用
2.2.1 番石榴果胶吸附脂肪的测定 为了说明番石榴果胶的生物活性的真实性,选择了市售苹果果胶、柑橘果胶与之比较,不同来源的果胶对脂肪的吸附结果见图8,PUP对脂肪的吸附能力显著高于其它几种来源的果胶(P<0.05),PEP与柑橘果胶对脂肪的吸附无显著性差别(P>0.05),而苹果果胶对脂肪的吸附效果最差。提取方法也影响果胶对脂肪的吸附,李向阳等[31]采用不同方法提取苹果果胶,研究苹果果胶对芝麻油的吸附效果,其实验方法与计算方法与本文相同,普通酸提、万能破碎、超声波法提取的苹果果胶对脂肪的吸附均小于PEP、PUP,蒸汽爆破提取苹果果胶对脂肪的吸附也小于PUP。果胶对脂肪的吸附有以下原因:溶解后的多糖分子链充分舒展,然后分子间相互作用形成网络结构将脂肪包裹在网络中;多糖溶液具有黏滞性,可黏着油脂而对其产生黏滞作用[32]。有研究表明果胶溶液在水中形成网络结构,吸附脂肪,从而影响脂肪的消化,且这一特性主要与果胶的流变学特性有关,果胶溶液表观粘度大,分子间相互作用强,对脂肪的吸附作用越大,越能抑制脂肪消化[33]。由图6可知,在1、5、10 mg/mL浓度下,PUP溶液的表观粘度均高于PEP,这可能是PUP吸附脂肪的效果优于PEP的原因。另外,果胶中酯基的疏水性也有利于与脂肪的相互作用。

图8 不同来源果胶对脂肪的吸附Fig.8 Adsorption of fat by pectin from different sources
2.2.2 番石榴果胶结合胆固醇胶束的测定 血浆胆固醇水平高,尤其是低密度脂蛋白胆固醇水平高,表明患心血管疾病的风险增加。胆固醇可溶于胆盐混合胶束中,在胆汁酸协助下直接被肠黏膜细胞吸收,在内质网内形成乳糜微粒,经淋巴系统进入血液循环[34]。血浆胆固醇水平受饮食和胆固醇生物合成、摄取和分泌的影响。果胶等多糖可以与胆固醇竞争进入胆盐胶束,竞争混合胶束的空间并取代胆固醇,从而降低胆固醇在胶束中的溶解度,抑制人体对胆固醇的吸收[35]。在体外模拟胆固醇溶解的实验中,人工胶束是最常用的一种基质,常用胆固醇、蛋黄卵磷脂、牛磺胆酸钠和油酸来制备[36]。考来烯胺是一种阴离子螯合树脂,作为降脂药,可与胆汁酸呈不可逆性结合,促进胆汁酸的排出,加速胆固醇向胆汁酸的转化,降低血浆胆固醇水平。PEP、PUP、苹果果胶、柑橘果胶结合胆固醇胶束能力见表4,PEP、PUP、苹果果胶、柑橘果胶相对于同剂量考来烯胺的结合量分别为44.96%±0.05%、48.23%±0.08%、45.78%±0.04%、47.63%±0.04%。PUP、柑橘果胶对胆固醇胶束的结合能力显著高于PEP、苹果果胶(P<0.05),PUP对胆固醇胶束的结合能力高于柑橘果胶,但无显著性差异。

表4 不同来源果胶结合胆固醇胶束的能力Table 4 Ability of pectin from different sources to bind cholesterol micelles
2.2.3 番石榴果胶结合胆酸盐的测定 胆汁酸(盐)是肝内胆固醇衍生产物,最主要的功能是促进胆固醇的转运,从而维持胆固醇在体内平衡[37]。胆汁酸一般都是以盐(Na、K)及结合型的形式存在的,所以胆汁酸往往被称之为胆酸盐。胆酸盐可分为游离型胆酸盐和结合型胆酸盐,牛磺胆酸钠为结合型胆酸盐,胆酸钠为游离型胆酸盐,本研究选取牛磺胆酸钠、胆酸钠作为对象具有代表性。PEP、PUP、苹果果胶、柑橘果胶对牛磺胆酸钠、胆酸钠的结合能力见表5,不同来源的果胶对胆酸钠的结合能力均高于牛磺胆酸钠。PUP对牛磺胆酸钠、胆酸钠结合量均显著高于PEP、苹果果胶、柑橘果胶(P<0.05),PEP、苹果果胶、柑橘果胶对牛磺胆酸钠结合量无显著性差异(P>0.05),柑橘果胶对胆酸钠的结合量均显著高于PEP、苹果果胶(P<0.05)。在相同质量浓度(2 mg/mL)下,PEP、PUP两种果胶对牛磺胆酸钠的结合能力均大于酸提木耳多糖[38]。钱雅雯[39]采用超声辅助提取籽瓜水溶性多糖,籽瓜多糖对牛磺胆酸钠的结合量为0.13 μmol/100 mg,低于PUP,与PEP相差不大。研究表明[40]胆酸盐可以直接被多糖吸附;多糖分子形成粘性网络,从而限制胆酸盐的释放,果胶与胆酸盐的结合可以认为是吸附效应和粘性效应双重作用,随着果胶溶液表观粘度的增加,果胶对胆酸盐的结合能力增大。PUP吸附胆酸盐的效果优于PEP,这与两种果胶流变学特性研究结果一致。

表5 不同来源果胶对胆酸盐的结合Table 5 Binding of pectin from different sources to cholate
3 结论
本实验采用超声辅助柠檬酸提取方法从番石榴果皮、果肉中提取了果胶,并对其结构和理化性质进行表征。结果表明:PEP半乳糖醛酸含量为60.39%±0.09%,酯化度为56.29%,重均分子量有两个级分(618.40、93.90 kDa);PUP半乳糖醛酸含量为59.44%±0.24%,酯化度为48.57%,重均分子量有三个级分(1168.00、120.30、64.94 kDa);两种果胶的中性糖种类相同,但含量有差别;PEP溶液粒径显著小于PUP(P<0.05);两种果胶均呈现假塑性流体的特性,但同一浓度下,PUP溶液表观黏度高于PEP;扫描电镜图显示,两种果胶微观形态有差别,其中PEP边缘有较多触角状细丝,PUP褶皱更深。以上结果均说明这两种果胶分子结构存在差异。PEP、PUP体外降脂实验中,PUP体外降脂活性优于PEP。

