不同地区米酒曲细菌多样性解析及表型预测
王文平,熊英梅,陈赛浙,侯强川,刘忠军,郭 壮,
(1.湖北文理学院,湖北省食品配料工程技术研究中心,湖北襄阳 441053;2.湖北尧治河楚翁泉酒业有限公司,湖北襄阳 441600;3.襄阳市酿酒生物技术与应用企校联合创新中心,湖北襄阳 441053)
米酒曲通常是在特定的生态环境内,用成曲在开放体系中培养生产而成,含有丰富的微生物种类和酶系[1]。米酒曲在米酒发酵过程中起发酵和糖化生香作用,并最终决定了成品酒的产率和品质风味[2]。米酒曲中主要存在霉菌、酵母菌和细菌3个微生物类群,其中霉菌可降解淀粉和发酵糖类等物质,酵母菌可将糖类物质转化成酒精,而细菌则赋予米酒独特的风味品质[3]。按照传统方式制作的米酒曲受“母种”质量的影响较大,加之季节气候、生产和地理环境等综合因素的影响,故而米酒曲的质量参差不齐,且容易混入产毒性的菌株[4]。蔡海莺等[5]通过对12种甜米酒酒曲细菌类群进行分离鉴定和测序发现,其含有大量芽孢杆菌(Bacillus)、少量的病原菌和腐败菌。
近年来,以MiSeq等第二代高通量测序技术为代表的分子生物学手段被广泛应用于米酒[6]、泡菜[7]和臭豆腐[8]等发酵食品微生物群落结构的解析中,在非优势和不可培养微生物类群检测方面具有较大优势,有效弥补了传统纯培养方式的不足。本研究以采集自广西壮族自治区南宁市和湖北省孝感市的米酒曲为研究对象,在采用Illumina MiSeq高通量测序技术对其细菌多样性进行解析的基础上,进一步采用BugBase软件对其细菌类群的表型进行分析,以期为后续米酒品质和安全性的提升提供数据支撑。
1 材料与方法
1.1 材料与仪器
广西壮族自治区南宁市米酒曲样本 分别采集自淡村农贸市场(108°31′E,22°78′N)、琅东农贸市场(108°38′E,22°82′N)、仙 葫 农 贸 市 场(108°44′E,22°81′N);湖北省孝感市米酒曲样本 分别采集自大东门农贸市场(113°92′E,30°92′N)、严桥市场(113°94′E,30°94′N)。每个地区采集米酒曲样本10个,合计采集20个;所有米酒曲样本均以糯米为原料制作而成,部分样本中含有辣蓼草等中草药;基因组提取试剂盒 德国QIAGEN公司;Fast-Pfu Fly DNA Polymerase、FastPfu Fly DNA聚合酶(5 U/μL)、dNTPs Mix 北京全式金生物技术有限公司。
vetiri梯度基因扩增仪 美国ABI公司;MiSeq高通量测序平台 美国Illumina公司;ND-2000C微量紫外分光光度计 美国Nano Drop公司;R930机架式服务器 美国DELL公司。
1.2 实验方法
1.2.1 宏基因组DNA的提取、PCR扩增及Illumina高通量测序 取1.0 g研磨碎的米酒曲样本使用DNA提取试剂盒进行宏基因组DNA提取,按照Wang等[9]方法进行16S rRNA V3~V4区扩增,合格的PCR产物送至上海美吉生物医药科技有限公司使用MiSeq PE300平台测序。
1.2.2 生物信息学分析 参照Wang等[10]的方法对序列进行拼接和质控,使用QIIME(v1.9.1)平台[11]对质控后的数据进行多样性评价,使用PyNAST[12]将序列对齐,使用UCLUST两步法建立操作分类单元(Operational taxonomic units,OTU)[13],使用SILVE数据库[14]、Greengene数据库[15]和RDP(Ribosomal Database Project,Release 11.5)数据库[16]确定细菌分类学地位。
1.2.3 核酸登录号 本研究中所有序列数据已提交至MG-RAST数据库,ID号为mgp97489。
1.3 数据处理
使用R软件的ggpubr包和ggplot2包绘制香农指数(Shannon Index)、辛普森指数(Simpson Index)和发现物种数(Observed Species)的小提琴图,使用柱形图评估米酒曲中优势细菌门和属的相对含量及其分布,采用威尔科克森符号秩(Wilcoxon)检验进行显著性分析,基于加权和非加权距离主坐标分析多元方差分析(multivariate analysis of variance,MANOVA)解析2个地区米酒曲细菌类群的β多样性,使用R软件的UpSetR包基于OTU水平分析不同样本间OTU的分布,将OTU矩阵与样本的分类信息上传至BugBase网站(https://bugbase.cs.umn.edu/)进行表型预测。
2 结果与分析
2.1 不同地区米酒曲细菌类群α和β多样性的比较分析
本研究采用Illumina高通量测序技术对20个米酒曲样本进行测序,共得到高质量序列686478条,平均每个样本34324条。香农指数、辛普森指数和发现物种数是评价α多样性的重要指标。两个地区米酒曲样本的α多样性结果如图1所示。
由图1可知,南宁地区米酒曲细菌类群的香农指数显著低于孝感地区(P<0.05),但两者的辛普森指数和发现物种数并无显著性差异(P>0.05)。由此可见,南宁地区米酒曲细菌类群的多样性偏低。
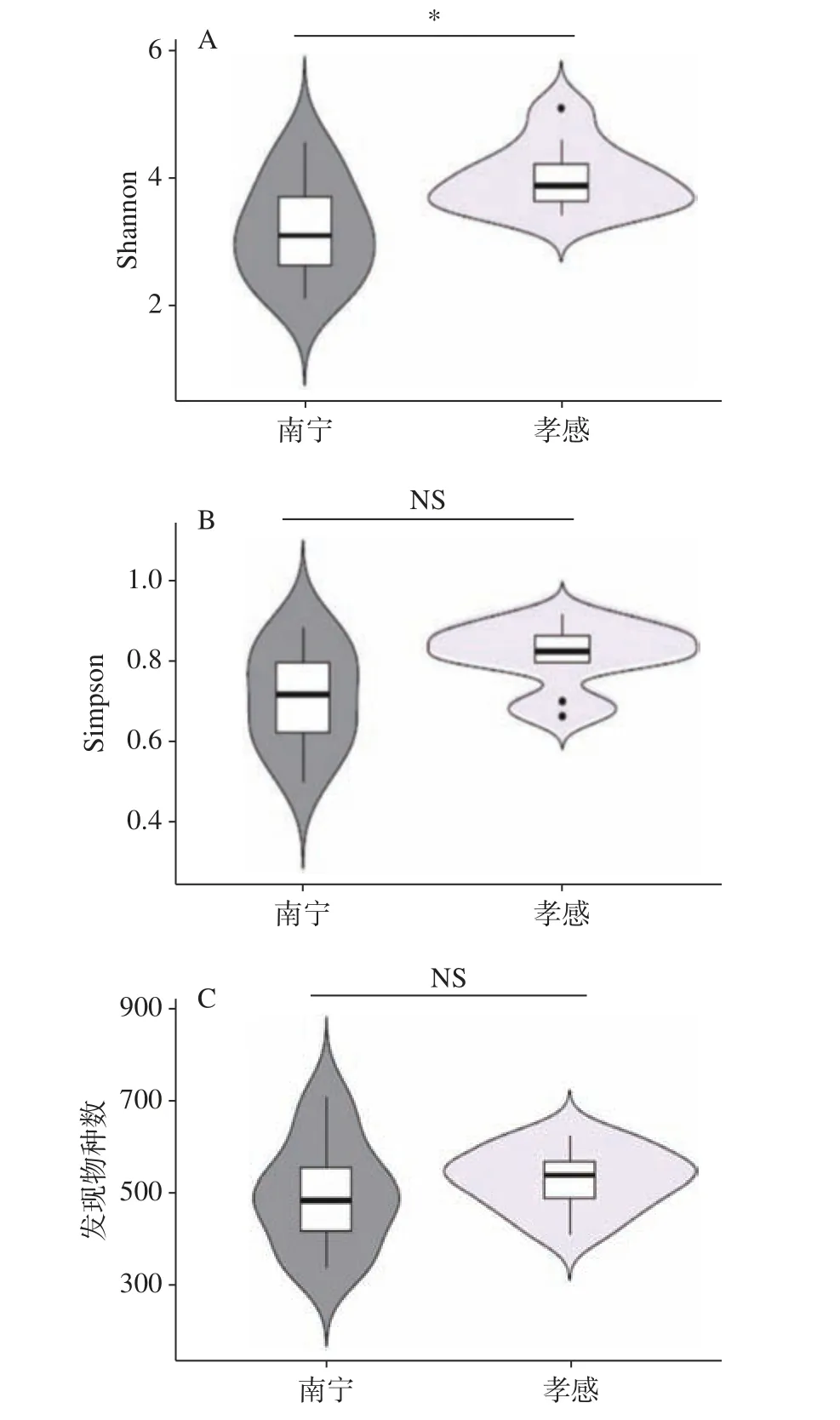
图1 不同地区米酒曲香农指数(A)、辛普森指数(B)和发现物种数(C)α多样性指标比较分析Fig.1 Comparative analysis of α diversity indexes including Shannon index (A), Simpson index (B) and the number of observed species (C) of rice wine koji from different regions
本研究进一步对2个地区米酒曲细菌类群的β多样性进行了解析,结果如图2所示。
由图2A可知,虽然2个地区的米酒曲样本在空间排布上存在部分交叠现象,但整体呈现分离趋势,经MANOVA检验发现2个地区米酒曲细菌群落结构差异显著(P<0.05)。由图2B可知,虽然2个地区样本在空间排布上亦呈现出明显的分离趋势,其中南宁地区样本聚集为三簇,而孝感地区聚集为两簇,但经MANOVA检验发现两者差异并不显著(P>0.05)。由此可见,2个地区米酒曲蕴含细菌类群的种类具有相似性,但其丰度可能存在一定差异。鉴于上述分析结果,本研究进一步在分类学地位“门”和“属”水平上对2个地区米酒曲细菌类群进行了比较分析。
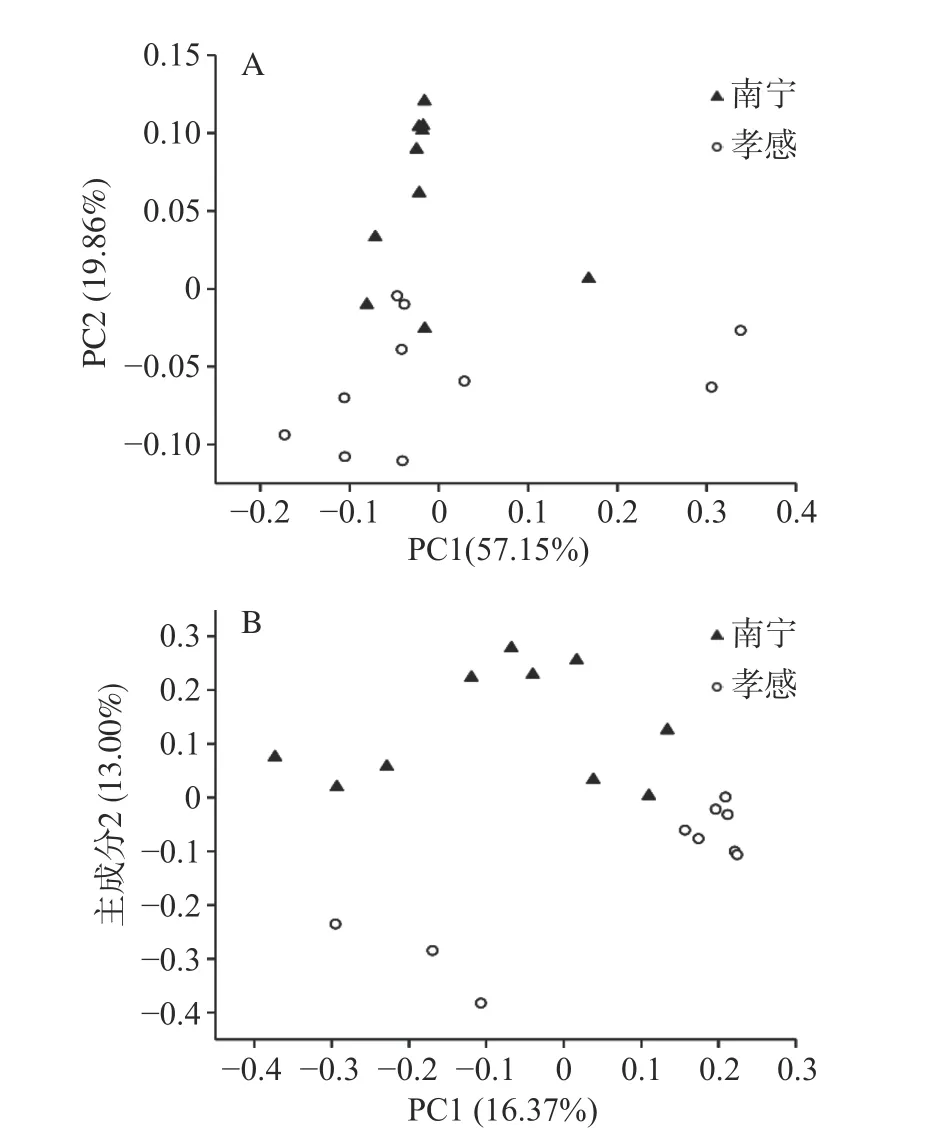
图2 基于加权(A)和非加权(B)UniFrac距离的主坐标分析Fig.2 Principal coordinate analysis based on weighted (A) and unweighted (B) UniFrac distance
2.2 不同地区米酒曲细菌类群门、属结构分析
南宁和孝感地区米酒曲相对含量大于1.0%细菌门的构成如图3所示。
由图3可知,南宁地区米酒曲中平均相对含量>1.0%的细菌门为Firmicutes(厚壁菌门,94.58%)和Proteobacteria(变形菌门,5.14%),孝感地区为Firmicutes(厚壁菌门,83.01%)、Proteobacteria(变形菌门,15.15%)和Cyanobacteria(蓝细菌,1.07%)。由图3可知,两个地区的米酒曲样本中隶属于Firmicutes和Proteobacteria的细菌类群含量差异显著(P<0.05)。相对含量>1.0%的细菌属及其显著性分析如图4所示。
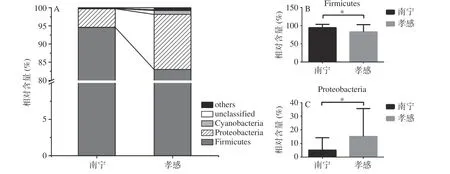
图3 不同地区米酒曲相对含量>1.0%的细菌门及显著性分析Fig.3 Bacterial phyla with relative abundance >1.0% of rice wine koji from different regions and their significance analysis
由图4可知,南宁地区米酒曲中平均相对含量>1.0%的细菌属为Lactobacillus(乳杆菌属,62.03%)、Weissella(魏斯氏菌属,16.29%)、Lactococcus(乳球菌属,9.74%)、Pediococcus(片球菌属,2.64%)、Leuconostoc(明串珠菌属,2.36%)、Salmonella(沙门氏菌属,2.28%)和Gluconobacter(葡糖杆菌属,1.45%),孝感地区米酒曲为Weissella(魏斯氏菌属,50.14%)、Lactococcus(乳球菌属,15.42%)、Lactobacillus(乳杆菌属、5.08%)、Pediococcus(片球菌属,4.55%)、Leuconostoc(明串珠菌属,3.07%)、Enterobacter(肠杆菌属,2.88%)、Macrococcus(巨型球菌属,2.86%)、Staphylococcus(葡萄球菌属,2.08%)、Acinetobacter(不动杆菌属,1.43%)、Salmonella(沙门氏菌属,1.41%)和Acetobacter(醋酸杆菌属,1.11%)。由此可见,南宁地区米酒曲细菌类群以Lactobacillus为主,而孝感地区以Weissella为主,经Wilcoxon检验发现上述两个属在不同地区米酒曲中的相对含量差异均极显著(P<0.001)。除此之外,孝感地区米酒曲中Enterobacter的相对含量高度显著偏高(P<0.01)。由此可见,虽然同一细菌属在两个地区米酒曲中均存在,但其相对含量存在较大差异,这也与图2得到的结论一致。
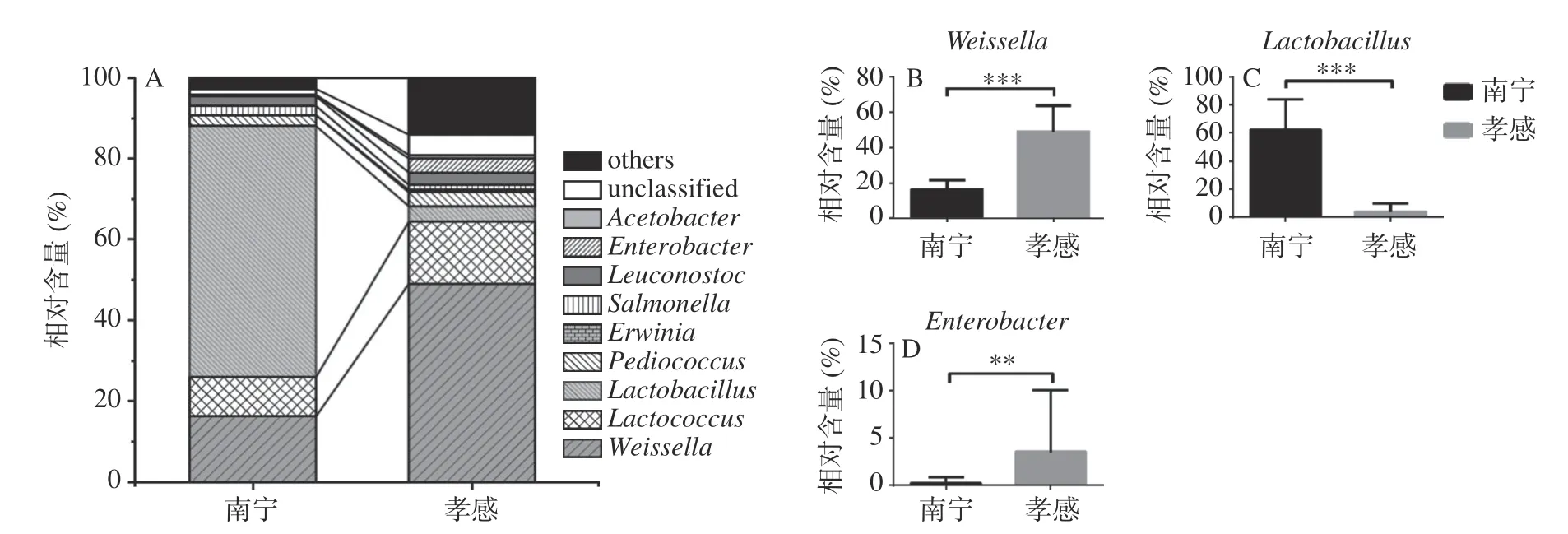
图4 不同地区米酒曲相对含量>1.0%的细菌属及显著性分析Fig.4 Bacterial genera with relative abundance >1.0% of rice wine koji from different regions and their significance analysis
乳酸菌能够产生乳酸菌素等物质,在米酒的发酵过程中能够抑制杂菌的生长[17]。米酒酸味的主要来源是乳酸菌产生的乳酸,而乳酸和乙醇反应生成酯类是米酒主要的风味来源,同时在乳酸菌的代谢过程中产生乙酰和双乙酰,赋予米酒特殊的风味[18]。Jiao等[19]采用变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)技术对米酒细菌类群进行研究发现,参与发酵的乳酸菌多样性越高则米酒的感官特性酒越好,因而在米酒发酵过程中提高乳酸菌的多样性有利于提高米酒的感官品质。Lactobacillus和Weissella均为乳酸菌,向凡舒研究指出Lactobacillus fermentum(发酵乳杆菌)、Lactobacillus agilis(能动乳杆菌)和Lactococcus lactis(乳酸乳球菌)为湖北省孝感地区米酒中优势乳酸菌,Weissella cibaria(食窦魏斯氏乳酸菌)、Lactobacillus johnsonii(约汉逊氏乳杆菌)和Lactobacillus brevis(短乳杆菌)为四川省成都地区米酒中优势乳酸菌,不同地区米酒中乳酸菌的类群存在一定的差异[20]。由此可见,米酒和米酒曲中的优势细菌类群均为乳酸菌,乳酸菌的类群构成对米酒的风味品质形成影响较大。
2.3 基于OTU水平不同地区米酒曲细菌类群分析
经过100%和97%相似度进行OTU划分后共得到3366个OTU,样本中的OTU分布结果如图5所示。
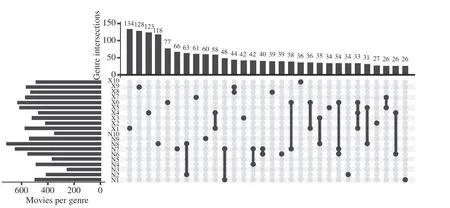
图5 OTU在不同样本中的分布Fig.5 Distribution of OTUs in different samples
本研究发现仅有1个OTU在所有米酒曲样本中均存在,隶属于Weissella,其在南宁和孝感地区米酒曲中的平均相对含量分别为1.35%和8.77%,地区之间差异并不显著(P>0.05);有2个OTU在19个样本中存在,分别隶属于Staphylococcus和Pediococcus,累计平均相对含量为3.16%;有6个OTU在18个样本中存在,隶属于Lactobacillus、棒形杆菌属(Clavibacter)和Weissella,累计平均相对含量为34.09%。有1085个OTU仅存在一个样本中,包含序列条数仅有13419条,仅占所有序列条数的2.00%,但并没有OTU仅存在某一地区所有米酒曲中。由此可见,南宁和孝感地区的米酒曲虽然各自含有少量独特的细菌类群,但更多的是共有大量的细菌类群。
2.4 不同地区米酒曲细菌类群表型结果分析
将OTU矩阵与样本的分类信息上传至BugBase网站进行表型预测,结果如图6所示。
由图6可知,南宁地区米酒曲中革兰氏阳性菌含量高度显著高于孝感地区(P<0.01),而在氧化胁迫耐受、生物膜形成、革兰氏阴性以及兼性厌氧方面呈现出高度显著的相反趋势(P<0.01)。虽然两个地区米酒曲中均存在一定数量的致病菌,但是南宁地区米酒曲中致病菌的致病潜力要高度显著低于孝感地区(P<0.01)。农户家自制的米酒曲方式较为传统,且制作方式较为开放,环境中的病原菌或其他微生物混入米酒曲之中可能造成米酒曲的污染,因而对米酒曲的制作方式进行规范化,保持环境卫生和筛选优良特性的发酵菌株对于提升米酒的品质和安全性均具有积极意义。
3 结论
南宁地区米酒曲细菌类群以Lactobacillus为主,而孝感地区以Weissella为主,且南宁地区米酒曲细菌类群的多样性偏低。虽然南宁和孝感地区米酒曲细菌群落结构存在明显的差异,但这种差异主要是由于同一细菌类群在2个地区样本中的含量不同导致的,每个地区米酒曲中并不含有太多独特的细菌类群。

