新烟碱类农药呋虫胺对映体选择性研究进展
刘子琪,呼 啸,李 莉,朱 峰,袁龙飞,李 薇,程有普,陈增龙**
新烟碱类农药呋虫胺对映体选择性研究进展
刘子琪1,2,呼 啸1,2,李 莉1,朱 峰3,袁龙飞1,李 薇1,程有普2*,陈增龙1**
(1.中国科学院动物研究所农业虫害鼠害综合治理研究国家重点实验室,北京 100101;2.天津农学院园艺园林学院,天津 300384;3.贵州省植物保护研究所,贵州 贵阳 550006)
农业生产中,呋虫胺以外消旋体的形式销售和使用,在进入生态环境后出现对映体选择性降解、吸收、代谢、排泄等.不区分对映体间差异的传统风险评估给呋虫胺的合理使用与生态安全带来了诸多隐患.研究指出-呋虫胺既是高毒体也是高活体,其生态毒性为-呋虫胺的13.9~145.9倍,但-呋虫胺也表现出较高的杀虫活性,且作物中优先降解,开发高比例的体农药有利于维持杀虫活性的同时降低对非靶生物和生态环境的负效应. 本文旨在综述呋虫胺对映体选择性生物活性、生态毒性及环境行为研究进展,为其科学难题的解决提供新思路,也为其科学有效管理提供理论依据.
呋虫胺;对映体选择性;生物活性;生态毒理;环境行为
新烟碱类农药是通过农药烟碱不断进行结构优化创制的,是目前开发利用最成功的杀虫剂.它作用于昆虫中枢神经系统中烟碱型乙酰胆碱受体(nAChRs),通过高效阻断昆虫的正常神经传递致使昆虫死亡[1].该类农药凭借良好的生物活性和无交互抗性展现出了巨大的应用前景,正在逐步取代传统有机磷类和氨基甲酸酯类杀虫剂,成为全球用量最大的杀虫剂品种[2].据统计,新烟碱类杀虫剂占据全球种子处理杀虫剂市场份额的80%以上,登记国家超过120个[3].截止2018年底,我国已登记11种新烟碱类农药,占比登记农药总数的7.6%[4].随着新型农药的创制,手性新烟碱类杀虫剂逐步进入人们的视野,呋虫胺作为全球首个登记且大宗用量的手性新烟碱类杀虫剂备受关注.
呋虫胺是日本三井化学开发的第三代新烟碱类杀虫剂,国际纯粹与应用化学联合会(IUPAC)将其命名为(EZ)-()-1-甲基-2-硝基-3-(四氢-3-呋喃甲基)胍,CAS号为165252-70-0.常温下呋虫胺在水、甲苯、正己烷中的溶解度分别为39830、150、0.009mg/L,蒸汽压为1.7 × 10-3mPa,辛醇水分配系数logP为-0.549(pH 7)[5].呋虫胺作为我国最早商品化的手性新烟碱类杀虫剂,其分子结构中的四氢呋喃基取代了传统的氯代吡啶基、氯代噻唑基,且不含卤族元素和芳环.因其呋喃环三号位具有一个不对称的碳原子而具有手性,包含两个对映异构体——-呋虫胺和-呋虫胺[6](图1).呋虫胺在杀虫效能方面也与传统烟碱类农药有所不同,它通过胃毒和触杀两种方式作用于靶标生物.并具有内吸性强、持效期长、速效快、杀虫谱广等优点,即使在很低的剂量下也可以表现出对刺吸式口器害虫的高杀虫活性.用于防治叶蝉、粉虱、蚜虫、蓟马、二化螟及其抗性品系,同时对鳞翅目、鞘翅目、甲虫目、双翅目和总翅目害虫,以及包括蚂蚁、家蝇、蜚蠊、蚊子在内的卫生害虫均有良好的防效[7-8]. 2002年呋虫胺在日本取得首次登记,随后在韩国、美国等20多个国家获得登记[9-10].2013年7月在我国获得登记,主要包括谷物、蔬菜、果树等24种作物[4].目前,除了呋虫胺悬浮剂(SC)、可湿性粉剂(WP)、水分散粒剂(WG)等7种单剂外,还可以与杀菌剂复配,进一步扩大防治谱[4].可见,呋虫胺作为代表性新烟碱类杀虫剂品种,展现出了广阔的应用前景.
欧盟食品安全局(EFSA)评估指出新烟碱类杀虫剂对全球性授粉昆虫蜜蜂、生态指示性生物蚯蚓,以及重要经济昆虫家蚕等高毒,并且可以通过飘尘、花粉、露水等途径导致蜜蜂急性中毒,同时还能引起行为障碍、定向困难及活动迟缓等一系列慢性毒性症状[11].新烟碱类农药还因较强的内吸性,导致其在植物体和环境介质中残留量增加,残效期增长.随着农业生产中呋虫胺投放量的日益增大,研究发现呋虫胺同样避免不了传统新烟碱类农药的弊端.它对蜜蜂、蚯蚓,乃至哺乳动物具有显著的负面影响,成为威胁全球农业环境生物安全的重大科学难题之一[12].英国赫特福德大学农药属性数据库(PPDB)也指出,呋虫胺对蜜蜂高毒,半致死剂量超过0.023μg/ bee;对蚯蚓高毒,半致死浓度为4.9mg/kg;对哺乳动物短期摄入高风险,对大鼠短期摄食无可见作用剂量(NOEL)为22mg/kg;此外,呋虫胺在土壤环境中也具有持久性,其半衰期高达75~82d[5].可见,持续以外消旋体形式销售和使用的呋虫胺,已给生态环境安全和人类健康带来了诸多隐患,导致呋虫胺被部分国际组织和发达国家禁限用,其环境行为归趋和生物安全问题也已成为全球的研究热点[13].因此,从异构体层面上研究呋虫胺的生物活性、生态毒性、环境行为归趋,解析选择性毒理,对于降低其暴露风险、减少环境污染、减施增效等科学问题具有重要意义,这既是对手性新烟碱类农药的重要补充,也是对呋虫胺更全面、深入的安全评价.
本文选取呋虫胺作为手性新烟碱类农药的典型代表,综合国内外相关研究进展,对呋虫胺对映体选择性分析方法学、构型稳定性、生物活性、环境行为、生态毒性以及毒理解析进行综述,旨在为呋虫胺全面安全性评价和生态风险规避提供解决思路,也为新烟碱类农药的合理应用与科学管理提供理论依据.

图1 呋虫胺对映体镜面对称结构式
1 呋虫胺手性分析方法学研究
呋虫胺手性分析方法是痕量追踪呋虫胺对映体及其代谢物的有效手段,也是其生态环境安全评价的基石.农药残留联席会议(JMPR)评价指出,植物源产品中用于制定呋虫胺的最大残留限量(MRL)仅需要考虑呋虫胺母体,而膳食暴露风险评估则需要考虑呋虫胺及其代谢物1-甲基-3-(四氢-3-呋喃基甲基)脲(简称,UF)和1-甲基-3-(四氢-3-呋喃基甲基)胍二氢(简称,DN),以呋虫胺表示;动物源产品中用于制定呋虫胺MRL和膳食暴露风险评估均需要考虑呋虫胺及其代谢物UF,以呋虫胺表示[14].
目前已有研究通过高效液相色谱法(HPLC),以直链淀粉-三(3, 5-二甲基苯基氨基甲酸酯),通过乙腈提取,石墨化碳黑固相萃取柱净化,建立了呋虫胺在大米、番茄和苹果上的手性分离分析方法[15].该方法中-呋虫胺和-呋虫胺分离度为1.8,定量限(LOQ)达到0.2~0.5mg/kg,平均回收率为75.8%~ 92.9%,相对标准偏差(RSD)<16.5%.还有研究利用超临界流体色谱-串联质谱(SFC-MS/MS)系统建立了呋虫胺及其代谢物UF在蜂产品和环境样品中的对映体分离分析方法[13].该方法结合直链淀粉-三(3, 5-二甲基苯基氨基甲酸酯),以二氧化碳为主流动相,在4.5min内便同时实现了呋虫胺及其代谢物UF对映体的基线分离,分离度高于1.9,LOQ为0.001~ 0.005mg/kg,平均回收率为78.3%~100.2%, RSD< 8.0%[13,16].该研究进一步通过超临界流体色谱结合手性制备色谱柱获得高收率的呋虫胺及其代谢物UF的单一对映体,对映体比率达到99.2%~99.9%,这为后续量产呋虫胺及其代谢物对映体提供了技术支持[16].而对于呋虫胺另一主要代谢物DN尚未实现对映体分离,推测其与分子结构中磷酸基团的空间位阻有关,这成为植物源产品中呋虫胺立体代谢研究和膳食暴露风险评估的瓶颈,也成为后续呋虫胺手性研究的重点与突破点之一.
2 呋虫胺手性构型稳定性研究
呋虫胺手性构型稳定性研究是开展对映体选择性环境行为、生物活性、生态毒理等研究的基础,也是其能否进行光学纯手性单体农药开发应用的关键.通过HPLC结合直链淀粉-三(3,5-二甲基苯基氨基甲酸酯)手性固定相分析发现,呋虫胺在有机溶剂(甲醇、乙腈、乙醇、异丙醇、乙酸乙酯、二氯甲烷)和水溶液中手性构型稳定[17].在避光、室内自然光照,以及人工氙灯光照条件下,呋虫胺两对映体间未出现转化现象,也不存在对映体选择性降解,其对映体分数(EF)在0.475~0.512之间.研究表明,对映体间转化的手性农药通常具备两个特征,一是具有以-碳为手性中心的构型,二是处于质子型溶剂中,如水、小分子醇等[18-19].如图2所示,-碳上的质子呈酸性易丢失,从而形成碳负离子中间体,质子型溶剂中的质子可加入碳负离子使其质子化,重新形成母体化合物.呋虫胺对映体分子结构中不具备-碳是其手性构型稳定的主要原因.此外,对映体间转化强弱还与碳负离子的稳定性密切相关[20-22].研究还发现,在避光和室内自然光照条件下,呋虫胺对映体在有机溶剂和水溶液中无明显降解;但在人工氙灯光照条件下,两对映体降解迅速[17].造成这种光解速率差异的主要原因在于吸收光谱发生了改变[23-24].此外,呋虫胺对映体在不同溶剂中的光解速率差异可能还与溶剂极性、溶剂与靶标分子间的作用以及溶剂本身对光谱的吸收有关[25-27].
由此可见,呋虫胺在常规有机溶剂以及水溶液中手性构型稳定,这为呋虫胺的生态环境安全评价和人类健康风险评估提供了数据支撑,也为其对映体选择性毒理解析和高效低风险光学纯手性单体农药的开发应用提供了理论基础.后续应以此为基础,深入开展呋虫胺对映体在试验样本或基质储藏周期内的稳定性差异研究,对映体水平上探讨储藏稳定性的影响因子,并解析其稳定性机理.
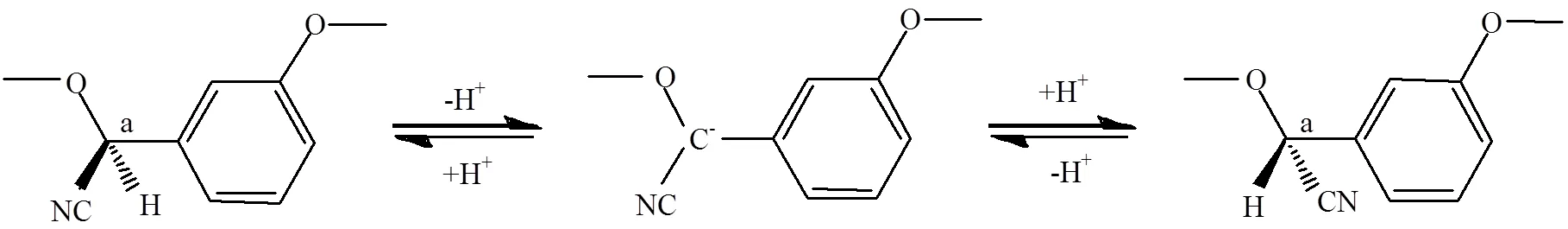
图2 手性农药对映体转化模式
3 呋虫胺对映体选择性生物活性研究
生物活性是评价呋虫胺杀虫效果的关键指标.根据手性农药对映体间生物活性差异,目前主要分为4种类型,一是不同对映体之间的活性差异大,主要集中在某一个对映体上,其他为低效体或无效体;二是对映体均具有一定活性,但活性差异在10倍以内;三是对映体间活性几乎没有差别,这种情况较少;四是对映体间作用机理不同,导致活性类型不同[28].通过触杀和胃毒两种暴露模式研究发现,呋虫胺对靶标害虫棉蚜的生物活性是外消旋体呋虫胺的1.7~2.0倍,是呋虫胺的2.7~3.2倍;-呋虫胺对绿盲蝽的生物活性是外消旋体呋虫胺的2.2~2.4倍,是-呋虫胺的3.3~3.4倍,无论是棉蚜还是绿盲蝽,呋虫胺两对映体间生物活性差异均达到显著水平(<0.01)[12].-呋虫胺对于卫生害虫家蝇、美洲大蠊也表现出较强的生物活性,通过放射性配体([3H]地棘蛙素(EPI)、[3H] α-环蛇毒素(α-BGT)和[3H]吡虫啉([3H]IMI))与美洲大蠊和家蝇的nAChR结合抑制率研究表明,相较于-呋虫胺和呋虫胺外消旋体,-呋虫胺具有较强的抑制能力,-呋虫胺对家蝇的生物活性是-呋虫胺的3.0~3.4倍[29],对美洲大蠊的生物活性是-呋虫胺的2.2~7.3倍[30];呋虫胺对映体目前唯有对德国小蠊的生物活性表现出较大差异,-呋虫胺对于对活体德国小蠊的击倒活性和杀虫活性分别为-呋虫胺的54.5和49.0倍[29].综上可知,呋虫胺对映体的活性大小顺序依次为-呋虫胺>呋虫胺外消旋体>-呋虫胺.呋虫胺对映体对棉蚜高效,但对绿盲蝽的防效一般,这在农业生产过程中需要注意.结合棉蚜的外源表达系统研究推测,在现有实验技术条件下,可能还有未发现的呋虫胺对映体靶标作用位点;加上昆虫的表皮穿透性、解毒代谢酶以及靶标部位敏感性等也有可能影响生物活性测定的结果,这些因素对于棉蚜毒理学机制的影响仍需进一步验证[31].目前,呋虫胺对映体对靶标害虫的选择性生物活性研究局限于此,后续研究中需针对呋虫胺对映体可能的关键靶标作用位点进行重点筛查,进一步明确这种选择性差异的分子机制.
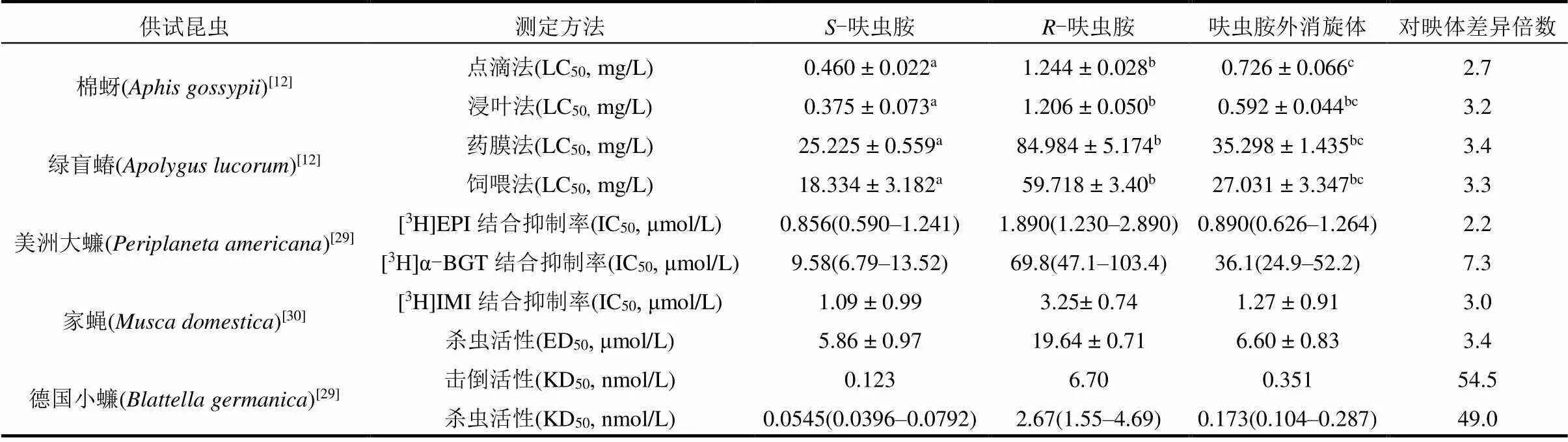
表1 呋虫胺及其对映体(S-呋虫胺和R-呋虫胺)对靶标害虫的生物活性
注1以上数据均以平均值±标准误差的形式表示;2上标字母经单因素方差分析与Tukey’s HSD显著性差异分析后标注,字母不同方有显著性差异(< 0.01).
4 呋虫胺对映体选择性环境行为研究
从对映体层面上,系统评估呋虫胺在环境介质中的对映体选择性行为特征差异,对其科学合理使用和生态环境安全至关重要[32].目前,呋虫胺对映体选择性环境行为研究主要集中在植物体和土壤介质中,涉及对映体选择性降解[33-34]、代谢[16,35]、转化和迁移[18]等方面.已有研究通过叶面喷施和根部滴灌两种施药方式测定了呋虫胺对映体在黄瓜和番茄中的降解代谢规律,发现其在黄瓜中对映体选择性降解行为有差异,但统计分析并不显著(>0.05),-呋虫胺和-呋虫胺的半衰期分别为8.3~11.7d和7.6~10.8d,残留浓度表现为先上升至最大值后又逐渐降低,这主要由于植株对呋虫胺的吸收速率和呋虫胺自身降解或代谢速率综合作用导致[33,34].呋虫胺在番茄中的降解和代谢同样具有对映体选择性,无论通过茎叶吸收还是根部吸收途径,-呋虫胺在番茄果实内优先降解(半衰期,9.1~12.6d),导致-呋虫胺相对富集(半衰期,10.3~13.3d).叶面喷施模式下,呋虫胺对映体降解同时还伴随对映体选择性代谢, (–)-UF在番茄果实内优先生成,随着时间推移,(+)- UF的降解速率大于(–)-UF,造成(–)-UF半衰期(57.8±9.2)d显著高于(+)-UF(46.2±11.0)d,进而导致(–)- UF相对富集;而代谢物DN始终未检出[16].研究同时指出,呋虫胺对映体在甘蓝中表现出不同的吸收、转化与分布特征,-呋虫胺的吸收速率、转化速率和转化量明显高于-呋虫胺,两对映体在转化的同时代谢生成UF和DN,代谢物的含量由母体代谢生成和自身降解双重生理途径决定[16].不同植物体中呋虫胺对映体选择性行为特征存在差异可能与植物体内关键酶、栽培方式、以及原始积累量密切相关[36-38].
呋虫胺在土壤中的降解也具有对映体选择性,不同培养环境、不同土壤类型中的降解速率和选择性归趋也存在差异.-呋虫胺和-呋虫胺在有氧和厌氧土壤中的平均降解半衰期分别为73.7~232.8d和86.4~265.9d[16](表2).在相同培养环境、不同土壤类型中,呋虫胺降解速率不同,其中在有氧培养条件下,呋虫胺对映体在中性沙质土壤中降解最快;而厌氧培养条件下,碱性粉质土壤中两对映体的降解最快[16].此外,在同一土壤类型、不同培养条件下,呋虫胺对映体的选择性降解归趋一致;并发现土壤质地和pH值对于呋虫胺对映体的选择性降解也存在显著影响,表现为在中性的砂质土壤中,-呋虫胺优先降解导致-呋虫胺相对富集,而在酸性和碱性的粉质土壤中降解选择性趋势则相反,表现为-呋虫胺优先降解,-呋虫胺相对富集[18].呋虫胺对映体选择性降解的同时选择性代谢为UF对映体,-呋虫胺代谢生成(+)-UF,而-呋虫胺代谢生成(–)-UF,代谢过程中手性构型未发生变化[12].不同培养环境、不同土壤类型中UF对映体选择性代谢趋势和代谢量也存在差异,厌氧土壤中呋虫胺对映体的代谢量明显高于有氧土壤,表明厌氧土壤微生物对呋虫胺对映体的代谢影响显著[16,35].无论何种土壤类型和培养条件,呋虫胺对映体间始终未发生转化,表明手性构型稳定.综上可见,呋虫胺对映体选择性差异与培养条件、土壤类型、土壤酸碱度、土壤微生物等因素密切相关[39-41].后续应加强呋虫胺对映体在模式动物体内的行为特征研究,以期系统揭示其在动植物体内的对映体选择性行为归趋.
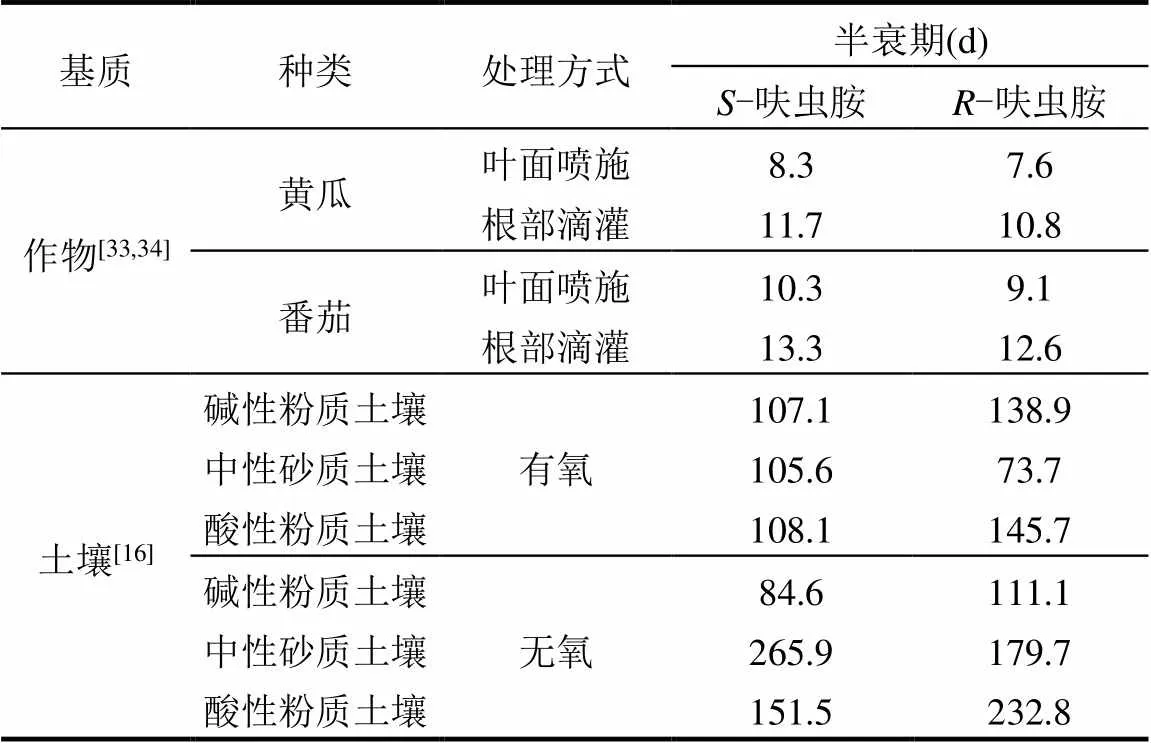
表2 S-呋虫胺和R-呋虫胺在作物和土壤中的降解半衰期
5 呋虫胺对映体选择性生态毒性研究
目前,呋虫胺对映体选择性生态毒性研究主要针对生态指示性生物蚯蚓和全球性授粉昆虫蜜蜂展开.表3总结了呋虫胺对映体对赤子爱胜蚓和意大利蜜蜂的选择性生态毒性.呋虫胺对映体急性毒性研究表明,-呋虫胺对蚯蚓的毒性最高,是-呋虫胺的71.5倍,统计学分析两对映体的生态毒性差异显著(<0.05)[16].根据GB/T 31270.15毒性分级标准[42],-呋虫胺对赤子爱胜蚓属于高毒,呋虫胺外消旋体属于中毒,-呋虫胺则属于低毒.研究指出,呋虫胺对映体对赤子爱胜蚓的毒性大小与其在土壤中的降解速率有关,通过分析在人工土壤中染毒14d的蚯蚓发现,其体内-呋虫胺降解率为46.0%~ 58.8%,而-呋虫胺降解率在65.6%~73.7%,这可能是导致-呋虫胺高毒的原因之一[16].通过滤纸法染毒的结果也表明-呋虫胺对蚯蚓的毒性最高,是-呋虫胺的13.9倍[35].在亚急性毒性试验中,经1.0mg/kg浓度的呋虫胺染毒42d后,呋虫胺对映体对蚯蚓的生长、繁殖均产生了明显的抑制作用[35].采用石蜡切片技术和苏木精-伊红染色液染色法,探究了不同剂量水平下呋虫胺外消旋体和对映体对蚯蚓组织器官损伤的差异,发现-呋虫胺对于蚯蚓的毒性最大,其次为呋虫胺外消旋体,而-呋虫胺对于蚯蚓的毒性最小,并且剂量越高对蚯蚓的损伤越大,损伤组织的恢复速度越慢[43].在低剂量水平下(0.25mg/kg),经-呋虫胺处理的蚯蚓,7d时开始出现损伤,14d时内部受损最为严重,表现为角质层细胞破裂,表皮组织部分断裂,纵层肌排列紊乱,肠道细胞呈撕裂状,21d时开始出现损伤修复迹象,到28d时其体内细胞恢复完整.经-呋虫胺处理后10d时蚯蚓组织开始出现损伤.21d时受损最严重,28d时其组织器官恢复情况较好.而在高剂量水平下(1.00mg/ kg),-呋虫胺处理的蚯蚓在3d开始出现损伤,7d时肠道受损最严重,表现为表皮细胞撕裂开始脱落,体腔内血管严重偏移,隔膜破裂消失,肠道细胞组织撕裂加剧,盲道细胞裂解收缩,脱落消失;14d仍表现出持续性伤害,直至21d出现自我修复迹象,28d仍在恢复期.经-呋虫胺染毒的蚯蚓,在染毒后7d开始出现损伤细胞,14d细胞受损最严重,21d开始出现恢复现象,28d时基本完全恢复.呋虫胺外消旋体对蚯蚓的最初受损时间和受损最重时间以及28d内受损组织的恢复情况均介于两对映体之间[43].此外,也有研究在不同类别农药对赤子爱胜蚓毒性评价过程中指出,新烟碱类杀虫剂的毒性最高,依次高于氨基甲酸酯类、有机磷类、大环内酯类和拟除虫菊酯类[44];而在新烟碱类杀虫剂中,呋虫胺表现出来的毒性效应最高,依次高于吡虫啉、烯啶虫胺、噻虫胺、噻虫啉等[45-46].可见,呋虫胺对于蚯蚓具有较大危害,在农业生产过程中应进一步增强对蚯蚓的保护.
呋虫胺对蜜蜂的毒性同样表现出显著的对映体选择性差异.研究指出,-呋虫胺对意大利蜜蜂的急性毒性是-呋虫胺的39.2~145.9倍,其中接触毒性-呋虫胺是-呋虫胺的145.9倍,是呋虫胺外消旋体的2倍,经口毒性-呋虫胺是-呋虫胺的39.1倍,是呋虫胺外消旋体的15.5倍[7].毒性分级表明,-呋虫胺对于意大利蜜蜂属于高毒,而-呋虫胺属于中毒.可见,呋虫胺对映体对蚯蚓和蜜蜂的急性毒性选择性一致,毒性大小顺序均为-呋虫胺>呋虫胺外消旋体>-呋虫胺.呋虫胺对映体在亚致死剂量下对意大利蜜蜂的选择性毒性研究也表明,-呋虫胺相比于-呋虫胺具有较高的急性经口毒性,并且-呋虫胺对蜜蜂体内的生物酶如羧酸酯酶、谷胱甘肽-S-转移酶的促进作用以及对多酚氧化酶、乙酰胆碱酯酶(AChE)抑制作用均强于-呋虫胺[47].此外,还探究了不同亚致死浓度下呋虫胺对映体对于蜜蜂蔗糖敏感性、学习记忆能力以及蜜蜂脑内章鱼胺浓度的影响,结果表明-呋虫胺使蜜蜂对蔗糖的敏感性受到更大的抑制作用;而-呋虫胺对蜜蜂学习和记忆的负面影响大于-呋虫胺,且经过-呋虫胺处理的蜜蜂头部的章鱼胺浓度显著高于经过-呋虫胺处理组(<0.05),两者相差1.36倍[48].还有研究发现传统新烟碱类农药不仅影响蜂群密度[49-50]、生存能力[51-52]、种群增长和蜂王的生产[53-54],还会导致蜜蜂神经损伤和线粒体功能障碍[55],并且蜂群不仅无法主动规避新烟碱农药反而偏好含有此类农药的花粉[56].
可见,-呋虫胺既是高活体也是高毒体,其对蚯蚓和蜜蜂的毒性远高于-呋虫胺,而-呋虫胺同样体现出较高的杀虫活性,可在有效控害的基础上通过高比例-呋虫胺的合成来降低对非靶生物的暴露风险,这仍需结合实际生产进行全面应用评价.在后续的农业生产中需注意规避呋虫胺对于蚯蚓、蜜蜂等非靶标生物的暴露,以维持生态系统的可持续发展.

表3 呋虫胺及其对映体(S-呋虫胺和R-呋虫胺)对非靶标生物的生态毒性
6 呋虫胺对映体选择性毒理研究
手性农药对映体间的毒性差异机理主要源自4个方面,一是生物吸收的差异性,二是生物转化和代谢作用的差异性,三是生物大分子之间相互作用的差异性,四是上述差异性的综合作用结果[16].呋虫胺对于非靶标生物的对映体选择性毒理研究主要针对蜜蜂和蚯蚓展开.利用双电极电压钳结合爪蟾卵母细胞对意大利蜜蜂的致毒机理研究表明,呋虫胺对映体的选择性差异源自nAChRs的8亚基;通过同源建模与分子对接分析得出,-呋虫胺中-NO2与靶标受体亚基B链精氨酸173残基间发现额外的三重氢键作用力,多重氢键作用网络能够进一步增加-呋虫胺与8功能位点有效结合的稳定性,进而使-呋虫胺以一种优势构型对意大利蜜蜂产生更高的毒性[12,20].此外,对蜜蜂大脑的高通量环状RNA测序结果显示,-呋虫胺比-呋虫胺能引起更多的基因调控变化,其中经-呋虫胺处理的基因组中有11个上调基因和7个下调基因,在-呋虫胺处理组中有10个上调基因和13个下调基因.在进一步的GO富集和KEGG通路分析中指出,与胞浆内Ca2+隔离有关的SERCA基因、可导致血管生物学中通道活性降低的Kca基因以及对细胞信号和代谢具有关键调节作用的Maxik基因可能导致呋虫胺对映体对蜜蜂嗅觉产生选择性作用[48].呋虫胺对映体对赤子爱胜蚓的选择性毒理研究发现,相比于-呋虫胺,-呋虫胺对于蚯蚓体内 AChE、抗氧化酶(过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px))、解毒酶(羧酸酯酶(CarE)和谷胱甘肽转移酶(GST))以及氧化还原产物丙二醛(MDA)的影响较大,且表现出优先激活或抑制效应[16].-呋虫胺一方面能够加快神经递质的水解,中断乙酰胆碱在突触中的传递,并阻止与nAChRs的结合;另一方面胁迫产生活性氧自由基导致蚯蚓抗氧化防御系统损伤,进而对蚯蚓产生高毒;研究进一步指出,-呋虫胺相比于-呋虫胺能显著抑制赤子爱胜蚓AChE相关信号转导基因(EW1_F1P07_H02)和Acyl携带蛋白基因(EW1_F1P04_C04)的上调表达,并对其信号转导和GABA受体转运功能产生影响;-呋虫胺还能通过显著上调氨基己糖苷酶基因(EW1_ F2P14_D06),加快水解N-乙酰氨基半乳糖,使得GM2神经节苷脂转化为GM3神经节苷脂,阻断细胞间通讯;还能抑制携带蛋白基因(EW1_F1P10_E08)和Ca2+-ATPase通道基因(Lr_PAHCF_64C08_ Skplus),进而抑制蚯蚓体内钙离子的主动运输,干扰相关信号传导,导致神经功能障碍,从而产生神经毒性[16].通过对比分析呋虫胺对映体暴露组和对照组发现,-呋虫胺、呋虫胺外消旋体和-呋虫胺对于影响蚯蚓生长发育与繁殖的TCTP、ANN基因也均有抑制作用,其中-呋虫胺的抑制作用最为显著[35,57].此外,呋虫胺对于蚯蚓基因的转录也具有对映体选择性差异,与空白对照组相比,经过-呋虫胺暴露处理后的差异表达基因数量为1555个,而-呋虫胺处理组的差异表达基因数量高达10686个,为对映体的6.9倍,这说明呋虫胺对蚯蚓具有对映体选择性毒性,其中-呋虫胺对蚯蚓的影响显著大于-呋虫胺[35].还有研究发现,将蚯蚓暴露于-呋虫胺、呋虫胺外消旋体和-呋虫胺后,其体内ROS的动态平衡受到影响,其中经过-呋虫胺处理的最为显著.相较于-呋虫胺,-呋虫胺与蚯蚓体内生物大分子如蛋白质、酶和核酸等具有较强的交互作用,这种强烈的交互作用破坏了生物大分子的正常功能,导致了呋虫胺对映体的选择性行为特征[57].
7 结论与展望
7.1 结论
当前通过色谱/质谱系统建立了呋虫胺及其代谢物UF的手性分析方法,定量限达到0.001~ 0.005mg/kg,可快速、有效痕量追踪生态环境中靶标对映体;呋虫胺对映体在有机溶剂和水溶液中构型稳定,在光照条件下降解迅速,但不存在对映体选择性差异;-呋虫胺对非靶标生物意大利蜜蜂和赤子爱胜蚯蚓表现出高毒特性,而-呋虫胺对于已研究的靶标害虫表现出相当的杀虫效力;-呋虫胺和-呋虫胺在植物体和环境介质中表现出不同的行为特征;呋虫胺对蜜蜂和蚯蚓的毒理学研究也阐明了两对映体的选择性差异源自nAChRs的8亚基,并分别从基因和蛋白水平解析了呋虫胺对映体选择性差异的分子机制.
7.2 展望
后续研究中应加快呋虫胺另一主要代谢物DN对映体的手性分离,为植物源产品中呋虫胺立体代谢特征和膳食风险评估提供方法学基础.在深入评估基础上,建议研发和使用高比例的-呋虫胺农药,在有效控害的同时降低呋虫胺对非靶生物的毒害作用,以避免生态环境进一步恶化.此外,还应重视手性新烟碱类农药对哺乳动物和人类健康的影响,建立科学有效的风险评估体系,减少低活体、无效体,甚至有毒体进入生物体内,从而降低其对生物安全和人类健康的潜在威胁.
[1] Motohiro T, John E C. Neonicotinoid insecticide toxicology: Mechanisms of selective action [J]. Annual Review of Pharmacology and Toxicology, 2004,45(45):247-268.
[2] Zeng Z. Risks of Neonicotinoid Pesticides [J]. Science, 2013,340 (6139):1403-1403.
[3] Jeschke P, Nauen R, Schindler M, et al. Overview of the status and global strategy for neonicotinoids [J]. Journal of Agricultural and Food Chemistry, 2010,59(7):2897-2908.
[4] 农业农村部农药检定所.中国农药信息网[EB/OL]. [2020-06-25]. http://www.chinapesticide.org.cn/.
Pesticide Inspection Office of the Ministry of Agriculture and Rural Affairs. China Pesticide Information Network [EB/OL]. [2020-06-25]. http://www.chinapesticide.org.cn/.
[5] IUPAC. Available information on dinotefuran in pesticides properties dataBase [EB/OL]. [2020-07-03]. http://sitem.herts.ac.uk/aeru/ppdb/ en/Reports/1195.htm.
[6] Wakita T, Kinoshita K, Yamada E, et al. The discovery of dinotefuran: A novel neonicotinoid [J]. Pest Management Science, 2003,59(9): 1016-1022.
[7] Wakita T, Kinoshita K, Kodaka K, et al. Synthesis and structure- activity relationships of dinotefuran derivatives: modification in thetetrahydro-3-furylmethyl part [J]. Journal of Pesticide Science, 2004,(29):356-363.
[8] Corbel V, Duchon S, Zaim M, et al. Dinotefuran: a potential neoni- cotinoid insecticide against resistant mosquitoes [J]. Journal of Medical Entomology, 2004,(41):712-717.
[9] 程志明.新型杀虫剂呋虫胺的创制[J]. 世界农药, 2005,27(1):1-5.
Cheng Z M. The creation of a new insecticide furfuramide [J]. World Pesticide, 2005,27(1):1-5.
[10] Wakita T. Molecular design of dinotefuran with unique insecticidal properties [J]. Journal of Agricultural and Food Chemistry, 2010, 59(7):2938-2942.
[11] EFSA. European Food Safety Authority [EB/OL]. [2020-06-23] (URL:http://www.efsa.europa.eu/en/publications/efsajournal.htm).
[12] Chen Z L, Yao M X, Dong F S, et al. Ecological toxicity reduction of dinotefuran to honeybee: New perspective from an enantiomeric level [J]. Environment International, 2019,130:104854.
[13] Chen Z L, Dong F S, Li S, et al. Response surface methodology for the enantioseparation of dinotefuran and its chiral metabolite in bee products and environmental samples by supercritical fluid chromatography/tandem mass spectrometry [J]. Journal of Chromatography A, 2015,1410:181-189.
[14] Joint Meeting On Pesticide Residues Pesticide residues in food 2012 [DB/OL]. [2020-06-15]. http://www.fao.org/docrep/017/i3111e/ i3111e.
[15] Chen X, Dong F S, Liu X, et al. Enantioselective separation and determination of the dinotefuran enantiomers in rice, tomato and apple by HPLC [J]. Journal of Separation Science, 2012,35(2):200-205.
[16] 陈增龙.呋虫胺对映体选择性环境行为与毒性差异分子机制[D]. 北京:中国农业科学院, 2017.
Chen Z L. The molecular mechanism of dinotefuran enantioselective environmental behavior and toxicity difference [D]. Beijing: Chinese Academy of Agricultural Sciences, 2017.
[17] 陈增龙,陈 秀,董丰收,等.呋虫胺在有机溶剂和水中的手性稳定性[J]. 中国农业科学, 2015,48(9):1756-1763.
Chen Z L, Chen X, Dong F S, et al. Chiral stability of dinotefuran in organic solvents and water [J]. Chinese Agricultural Sciences, 2015, 48(9):1756-1763.
[18] Qin S, Gan J. Abiotic enantiomerization of permethrin and cypermethrin: effects of organic solvents [J]. Journal of Agricultural and Food Chemistry, 2007,55(14):5734-5739.
[19] Li Z, Zhang Y, Li Q, et al. Enantioselective degradation, abiotic racemization, and chiral transformation of triadimefon in soils [J]. Environmental Science & Technology, 2011,45(7):2797-2803.
[20] Li Z, Wu T, Li Q, et al. Characterization of racemization of chiral pesticides in organic solvents and water [J]. Journal of Chromatography A, 2010,1217(36):5718-5723.
[21] Richard J P, Amyes T L, Toteva M M. Formation and stability of carbocations and carbanions in water and intrinsic barriers to their reactions [J]. Accounts of Chemical Research, 2001,34(12):981-988.
[22] Carey F A, Sundberg R J. Advanced organic chemistry: Part A: structure and mechanisms [M]. Springer, US, 2000.
[23] 梁 菁,郭正元,冯丽萍,等.农药在环境中光化学降解的影响因素[J]. 农业环境科学学报, 2007,26(B10):668-673.
Liang J, Guo Z Y, Feng L P, et al. Influencing factors of photochemical degradation of pesticides in the environment [J]. Journal of Agricultural Environmental Sciences, 2007,26(B10):668-673.
[24] 任丽萍,田 芹,周志强,等.己唑醇的光化学降解[J]. 农药学学报, 2004,6(4):73-77.
Ren L P, Tian Q, Zhou Z Q, et al. Photochemical degradation of hexaconazole [J]. Journal of Agricultural Pharmacy, 2004,6(4):73-77.
[25] 李明磊.(E)-O-烃基-α-氧代环十二酮肟的合成、构效关系及其光化学行为的研究[D]. 北京:中国农业大学, 2002.
Li M L. Studies on synthesis and photochemical behaviour of (E)-O-alkyl-α-oxo cuclododecanone oximes [D]. Beijing: China Agricultural University, 2002.
[26] Ahmad I, Anwar Z, Ahmed S, et al. Solvent effect on the photolysis of riboflavin [J]. An Official Journal of the American Association of Pharmaceutical Scientists, 2015,16(5).
[27] 张晓清.农药在不同介质中的光解特性研究[D]. 南京:南京农业大学, 2008.
Zhang X Q. Studies on the photochemical degradation of pesticides in different medium [D]. Nanjing: Nanjing Agricultural University, 2008.
[28] 董丰收,李 晶,李远播,等.手性三唑类杀菌剂立体生物活性、生态毒性及选择性富集研究进展[J]. 中国科学, 2016,46(5):613-618.
Dong F S, Li J, Li Y B, et al. Chiral triazole fungicides stereobiological activity, ecotoxicity and advances in selective enrichment research [J]. Scientia Sinica, 2016,46(5):613-618.
[29] Mori K, Okumoto T, Kawahara N, et al. Interaction of dinotefuran and its analogues with nicotinic acetylcholine receptors of cockroach nerve cords [J]. Pest Management Science, 2002,58(2):190-196.
[30] Kiriyama K, Nishiwaki H, Nakagawa Y, et al. Insecticidal activity and nicotinic acetylcholine receptor binding of dinotefuran and its analogues in the housefly, Musca domestica [J]. Pest Management Science, 2003,59(10):1093-1100.
[31] 姚香梅.新烟碱类杀虫剂对靶标和非靶标昆虫乙酰胆碱受体毒理学特性研究[D]. 北京:中国农业科学院, 2015.
Yao X M. Pharmcological characteristics of neonicotinoid insecticides on the nicotinic acetylcholine receptors of target and non-target insects [D]. Beijing: Chinese Academy of Agricultural Sciences, 2015.
[32] Liu W, Gan J, Schlenk D, et al. Enantioselectivity in environmental safety of current chiral insecticides [J]. Proceedings of the National Academy of Sciences of the United States of America, 2005,102 (3):701-706.
[33] Chen X, Dong F S, Xu J, et al. Enantioselective degradation of chiral insecticide dinotefuran in greenhouse cucumber and soil [J]. Chirality, 2015,27(2):137-141.
[34] 陈 秀.呋虫胺对映体对蜜蜂选择毒性及其在黄瓜和土壤中降解行为[D]. 北京:中国农业科学院, 2013.
Chen X. Dinotefuran enantiomers: Enantioselective toxicities to honeybees and degradation behaviors in cucumber and soil [D]. Beijing: Chinese Academy of Agricultural Sciences, 2013.
[35] 刘 通.呋虫胺对映体的选择性环境行为及生态和毒理效应[D]. 北京:中国农业科学院, 2018.
Liu T. Selective environmental behavior and ecological and toxicological effects of dinotefuran enantiomers [D]. Beijing: Chinese Academy of Agricultural Sciences, 2018.
[36] Chen Z L, Dong F S, Ren X, et al. Enantioselective fate of dinotefuran from tomato cultivation to home canning for refining dietary exposure [J]. Journal of Hazardous Materials, 2020,124254.
[37] Wu C, Sun J, Zhang A, et al. Dissipation and enantioselective degradation of plant growth retardants paclobutrazol and uniconazole in open field, greenhouse, and laboratory soils [J]. Journal of Environmental Science and Technology, 2013,47:843-849.
[38] Dong F S, Cheng L, Liu X G, et al. Enantioselective analysis of triazole fungicide myclobutanil in cucumber and soil under different application modes by chiral liquid chromatography/tandem mass spectrometry [J]. Journal of Agricultural and Food Chemistry, 2012, 60(8):1929-1936.
[39] Zhu Y F, Zhang D D, He L. Enantioselective biodegradation and enantiomerization of dichlorprop in soils [J]. Chemosphere, 2020, 258:127322.
[40] Li R N, Pan X L, Wang Q Q, et al. Development of s-fluxametamide for bioactivity improvement and risk reduction: systemic evaluation of the novel insecticide fluxametamide at the enantiomeric leve [J]. Environmental Science & Technology, 2019,53(23):13657-13665.
[41] Zhang Z, Gao B, Li L, et al. Enantioselective degradation and transformation of the chiral fungicide prothioconazole and its chiral metabolite in soils [J]. Science of the Total Environment, 2018,634: 875-883.
[42] GB/T 31270.15-2014 化学农药环境安全评价试验准则第15部分:蚯蚓急性毒性试验[S].
GB/T 31270.15-2014 Test guidelines on environmental safety assessment for chemical pesticides——Part 15: Earthworm acute toxicity test [S].
[43] 张 莹,程有普,张彩霞,等.切片法研究呋虫胺对映体对蚯蚓组织结构的损伤差异[J]. 农药, 2020,59(3):188-192.
Zhang Y, Cheng Y P, Zhang C X, et al. The difference of toxicity of dinotefuran enantiomers to tissue structure of eisenia foetida by section method [J]. Agrochemicals, 2020,59(3):188-192.
[44] 冯 磊.三种新烟碱类杀虫剂对蚯蚓的影响[D]. 北京:中国农业科学院, 2014.
Feng L. The effect of three neonicotinoid insecticides on earthworms [D]. Beijing: Chinese Academy of Agricultural Sciences, 2014.
[45] Wang Y, Cang T, Zhao X, et al. Comparative acute toxicity of twenty- four insecticides to earthworm, Eisenia fetida [J]. Ecotoxicology & Environmental Safety, 2012,79(6):122-128.
[46] 谭丽超,卜元卿,程 燕,等.杀虫剂的结构差异对蜜蜂急性毒性影响[C]. 中国毒理学会第七次全国毒理学大会暨第八届湖北科技论坛论文集, 2015.
Tan L C, Bu Y Q, Cheng Y, et al. Effects of structural differences of insecticides on acute toxicity of honeybees [C]//The 7th National Toxicological Congress of China Toxicological Society and the 8th Hubei Forum on Science and Technology, 2015.
[47] 刘思宏.呋虫胺对映体对蜜蜂的亚致死效应研究[D]. 南宁:广西大学, 2018.
Liu S H. Sublethal effects of dinotefuran enantiosmers on honeybees[D]. Nanning: Guangxi University, 2018.
[48] Liu S H, Liu Y M, He F M, et al. Enantioselective olfactory effects of the neonicotinoid dinotefuran on honey bees () [J]. Journal of Agricultural and Food Chemistry, 2019,67:12105-12116.
[49] Raine N E, Gill R J. Ecology: Tasteless pesticides affect bees in the field [J]. Nature, 2015,521(7550):38.
[50] Dave G. Neonicotinoids impact bumblebee colony fitness in the field; a reanalysis of the UK's Food & Environment Research Agency 2012 experiment [J]. Peer Journal, 2015,3:854.
[51] Ecology: pesticides alter bee foraging [J]. Nature, 2016,531(7596): 553-553.
[52] Sanchez-bayo F. The trouble with neonicotinoids [J]. Science, 2014, 346(6211):806-807.
[53] Penelope R W, Stephanie O, Felix L W, et al. Neonicotinoid pesticide reduces bumble bee colony growth and queen production [J]. Science, 2012,336(6079):351-352.
[54] Goulson D, Nicholls E, Botias C, et al. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers [J]. Science, 2015,347(6229):1435-1435.
[55] Christopher M, Joao G P, Sheila S, et al. Chronic exposure to neonicotinoids increases neuronal vulnerability to mitochondrial dysfunction in the bumblebee (Bombus terrestris) [J]. The FASEB Journal, 2015,29(5):2112-2119.
[56] Kessler S C, Tiedeken E J, Simcock K L, et al. Bees prefer foods containing neonicotinoid pesticides [J]. Nature, 2015,521(7550): 74-76.
[57] Liu T, Chen D, Li Y Q, et al. Enantioselective bioaccumulation and toxicity of the neonicotinoid insecticide dinotefuran in earthworms (eisenia fetida) [J]. Journal of Agricultural and Food Chemistry, 2018, 66(17):4531-4540.
Research progress on the enantioselectivity of a neonicotinoid pesticide dinotefuran.
LIU Zi-qi1,2, HU Xiao1,2, LI Li1, ZHU Feng3, YUAN Long-fei1, LI Wei1, CHENG You-pu2*, CHEN Zeng-long1**
(1.State Key Laboratory of Integrated Management of Pest Insects and Rodents, Institute of Zoology, Chinese Academy of Sciences, Beijing 100101, China;2.College of Horticulture and Landscape, Tianjin Agricultural University, Tianjin 300384, China;3.Guizhou Institute of Plant Protection, Guiyang 550006, China)., 2021,41(10):4811~4819
In the agricultural production, dinotefuran is sold and used in the form of racemate. Enantioselective degradation, absorption, metabolism and excretion of dinotefuran were observed in the ecological environment. Traditional risk assessments brought potential hazards to the rational use and ecological safety of dinotefuran without consideration of the differences between enantiomers.-dinotefuran was an enantiomer with both high toxicities and activities, and its ecological toxicities were 13.9~145.9times than that of-dinotefuran. However,-dinotefuran also had comparable bioactivities and degraded preferentially in crops. The development of a high proportion of-form pesticide could maintain the insecticidal potency and further reduce the negative effects to non-target organisms and ecological environment. This manuscript aimed to review the research progress on the enantioselective bioactivity, ecotoxicology, and environmental fate of dinotefuran, which will be conducive to propose novel ideas for solving the above scientific problems and further to provide theoretical foundation for effective management of dinotefuran.
dinotefuran;enantioselectivity;biological activity;ecological toxicology;environmental fate
X503
A
1000-6923(2021)10-4811-09
刘子琪(1997-),女,黑龙江大兴安岭人,天津农学院园艺园林学院硕士研究生,中国科学院动物研究所联合培养,研究方向为农药残留与分子毒理学.发表论文5篇.
2021-02-24
国家自然科学基金(31801771);农业虫害鼠害综合治理研究国家重点实验室开放研究基金资助项目(IPM1919)
* 责任作者, * 副教授, chengyoupu@tjau.edu.cn; ** 助理研究员, chenzenglong@ioz.ac.cn

