一株史氏鲟源腐生葡萄球菌的分离鉴定及其基因组分析
周华书
(周宁县水产技术站,福建 宁德 355400)
腐生葡萄球菌(Staphylococcussaprophyticus)是一种革兰氏阳性、凝固酶阴性、非溶血性球菌[1-2]。腐生葡萄球菌广泛存在于自然环境中,目前已报道该菌株可从女性生殖道、奶牛、腌肉制品、人胃肠道等中被分离鉴定。近年来,腐生葡萄球菌已成为动物源感染的常见病原菌[3-4],随着抗生素的大量使用甚至滥用,导致腐生葡萄球菌具有多重耐药的趋势[5]。但关于从鲟鱼病料中分离到腐生葡萄球菌的研究却鲜有报道。另外,腐败葡萄球菌作为水产品的特定腐败菌[6],能够迅速繁殖并产生具有腐败臭味代谢产物的菌群[7],极大地影响了水产品的品质、贮藏货架期。细菌全基因组测序及生物信息学的快速发展,为研究腐生葡萄球菌的进化关系提供了分子水平的依据,并在葡萄球菌耐药性及致病因子、相关疫情暴发的检测和鉴定等方面均具有重要意义[8]。
2021年3月周宁县某史氏鲟养殖场的史氏鲟(Acipenserschrenckii)出现腐皮、溃疡等症状,而且有死亡病例。本研究从史氏鲟溃疡病灶处分离到1株革兰氏阳性菌,通过形态学特征、生理生化特征、16S rRNA基因序列及系统进化树对该菌株进行鉴定,研究了其耐药特性,旨在为该菌的后续研究提供指导,为该菌可能引起的疾病防治提供科学资料。同时采用高通量测序平台从全基因组序列层面分析菌株JY08的进化地位、毒力因子和耐药基因,为进一步评估该菌株基因组特征提供科学数据。
1 材料与方法
1.1 病料样品来源和主要试剂
发病的史氏鲟来源于福建省周宁县某史氏鲟养殖场,体质量为550~700 g,体长为55 cm左右。将病料放入白色的搪瓷盘中,可见腐皮及皮肤溃疡等症状。
脑心浸液(BectoTMBrain heart infusion,BHI)购自BD公司;TSB、LB液体培养基,哥伦比亚血琼脂培养基(5%脱脂绵羊血)购自广州环凯微生物科技有限公司。API 全自动细菌鉴定仪(型号:VITEK 2 COMPACT 30)及相关试剂购自法国梅里埃公司。细菌基因组DNA提取试剂盒、TaqDNA聚合酶购自生工生物工程(上海)股份有限公司;药敏纸片购自杭州微生物试剂有限公司。试验中所用引物均由生工生物工程(上海)股份有限公司合成。
1.2 菌株的分离和培养
选取具有腐皮的典型症状史氏鲟病例,用75%的酒精对病鱼进行体表消毒,无菌取其腹部溃疡组织经匀浆粉碎后涂布于BHI、TSB、LB琼脂培养基上进行分离培养,置于30℃恒温培养箱中培养48 h后,观察生长的菌落,并挑取平板上形态颜色一致的菌落,在相同条件下进一步划线纯化培养,最后转移到LB液体培养基中培养至对数期,于16%的甘油中(-80℃)保存待用,菌株编号为JY08。
1.3 形态学观察和生理生化特征试验
将菌株JY08接种于TSA琼脂培养基平板及哥伦比亚血琼脂培养基(5%脱脂绵羊血)平板,30℃培养18 h后观察菌落的大小、形态、颜色及溶血现象等,利用透射电子显微镜观察其超微形态结构。挑取BHI琼脂培养基上的单菌落置于载玻片上,经革兰氏染色后,置于光学显微镜下观察细菌形态。用无菌棉签蘸取适量JY08单菌落于生理盐水中,充分摇匀后使用浊度仪配制0.50~0.63 McF的菌悬液,将混合液加入GPN鉴定卡中,将鉴定卡放于API全自动细菌鉴定仪中培养,鉴定仪自动读取生理生化鉴定结果。
1.4 抗生素敏感试验
采用纸片扩散法(K-B法)检测菌株JY08对30种药敏纸片的敏感性,每种药物设3个重复。30℃培养24 h后观察,用游标卡尺测量抑菌圈直径,取抑菌圈直径平均值,根据美国临床实验室标准研究所出版的药敏试验指南的标准判定菌株对不同药物的敏感性。质控菌株为大肠杆菌(ATCC25922)。
1.5 16S rRNA基因序列扩增及系统发育树构建
参照细菌基因组DNA提取试剂盒说明书提取菌株JY08基因组DNA,以此为模板利用细菌通用引物扩增16S rRNA基因序列,上游引物27F:5′-AGAGTTTGATC(C/A)TGGCTCAG-3′,下游引物1492R:5′-GGTTACCTTGTTACGACTT-3′。PCR扩增程序:95℃ 3 min;94℃ 30 s,55℃ 30 s,72℃ 90 s,30个循环;72℃ 10 min。PCR产物经回收纯化,由铂尚生物技术(上海)有限公司(福州测序部)测序。
将序列提交到EzBioCloud数据库中进行16S rRNA基因序列相似性分析。从EzBioCloud数据库中提取与菌株JY08同源性较高菌株的16S rRNA基因序列,并从中选取16个与该株菌最相似菌株的16S rRNA基因序列,利用Clustal W进行比对,用MEGA7软件包中的Neighbor-joining法构建系统进化树,通过1 000次Bootstrap检验置信度。
1.6 基因组草图测序及分析
利用琼脂糖凝胶电泳、Nanodrop检测和Qubit检测上述菌株JY08基因组DNA的质量,将纯化的基因组DNA经Covaris破碎仪随机打断成长度为350 bp小片段,经末端修复和加A尾后在片段两端连接接头制备 DNA文库。
库检合格后,利用Illumina NovaSeq PE150测序平台对菌株JY08 DNA文库进行基因组测序。数据下机后经过预处理后得到 clean data,使用 SOAP denovo(Version 2.04)、SPAdes、ABySS组装软件进行组装,并最终使用CISA软件进行整合;采用gapclose(Version:1.12)优化整合组装结果,同时过滤掉 500 bp以下(污染)的片段,从而获得最终的组装结果。使用GeneMarkS(Version 4.17)软件预测编码基因。采用毒力因子数据库(Virulence Factors of Pathogenic Bacteria,VFDB)和抗生素耐药基因数据库(Comprehensive Antibiotic Research Database,CARD)对菌株的基因组中所包含的毒力基因和耐药基因进行比对。
2 结果
2.1 形态学特征和生理生化特征
从腐皮及皮肤溃疡等症状的病鱼组织中分离到一株细菌,命名为JY08。该菌革兰氏染色为阴性;在BHI、TSB和LB固体培养基上生长良好,在哥伦比亚血琼脂培养基(5%脱脂绵羊血)经过30℃培养24 h后形成大小约为0.3~0.5 cm、光滑、湿润、圆形、边缘整齐、不透明、白色菌落,不产生溶血圈;透射电子显微镜观察可见,菌株JY08约为0.5 μm的球形(图1)。
API 全自动细菌鉴定仪鉴定结果(表1)显示,菌株JY08为腐生葡萄球菌,检测结果的置信度高,为98%。菌株JY08能发酵D-核糖、D-麦芽糖、D-甘露糖、蔗糖和D-海藻糖;精氨酸双水解酶1、α-葡萄糖苷酶、焦谷氨酸芳胺酶和尿素酶试验为阳性;能够在6.5% NaCl培养基上生长。


表1 菌株JY08生理生化特征
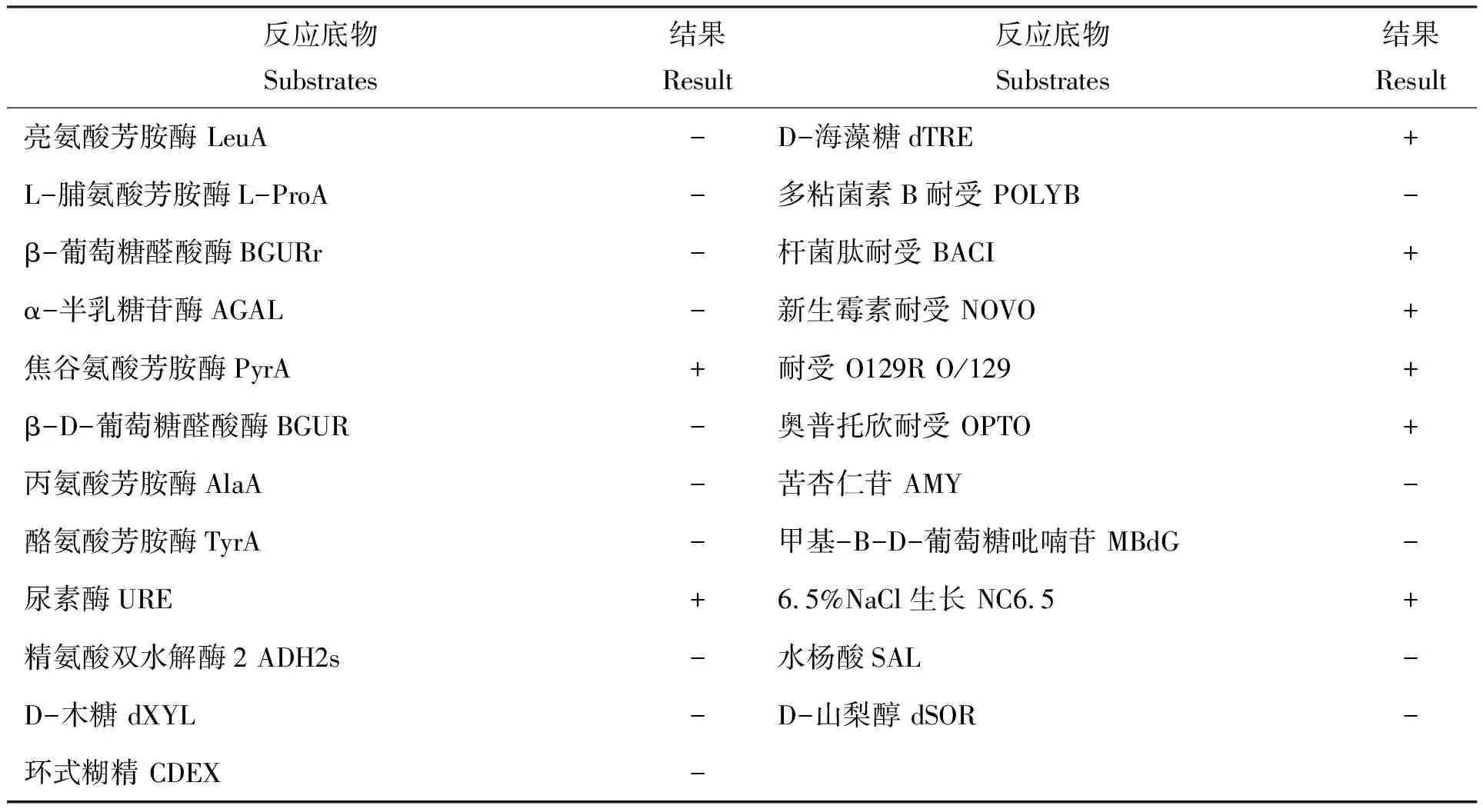
续表1
2.2 菌株JY08药敏试验结果
分离菌的药敏试验结果显示,菌株JY08对β-内酰胺类、大环内酯类、磺胺类和林可霉素类等17种抗生素具有完全耐药性;对氨基糖苷类、喹诺酮类和氯霉素类等11种药物敏感;对多粘菌素B和呋喃唑酮2种药物中度敏感(表2)。

表2 菌株JY08药物敏感结果
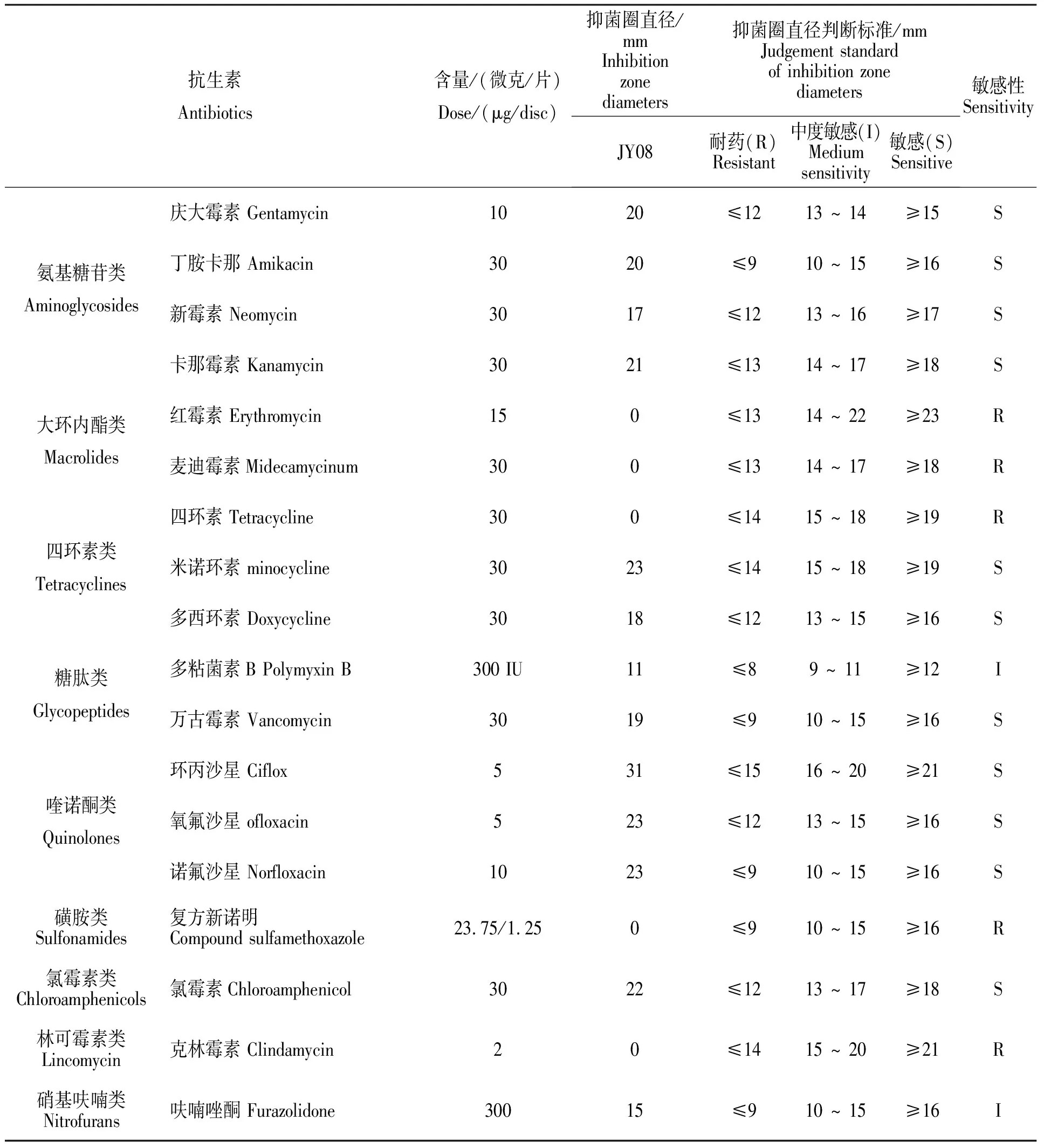
续表2
2.3 16Sr RNA基因序列及系统发育树分析
以菌株JY08的基因组DNA为模板,利用通用引物经PCR扩增得到16S rRNA基因产物,测序结果显示该基因为1 541 bp。将该序列提交到EzBioCloud(https://www.ezbiocloud.net/)进行序列相似性比对分析,结果显示,菌株JY08的16S rRNA基因序列与腐生葡萄球菌腐生亚种(Staphylococcussaprophyticussubsp.saprophyticus)相似度最高,为100%。基于16S rRNA基因序列构建的系统发育树表明,菌株JY08与腐生葡萄球菌腐生亚种(Staphylococcussaprophyticussubsp.saprophyticusATCC 15305)聚集到一个发育支(图2)。进一步表明菌株JY08属于葡萄球菌属,与腐生葡萄球菌腐生亚种具有较近的亲缘关系。

2.4 菌株JY08基因组测序结果
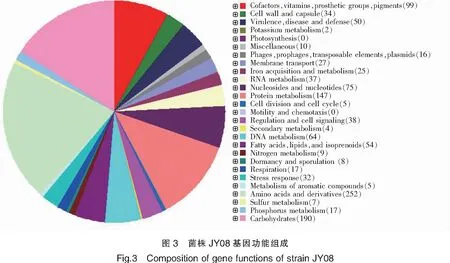
菌株JY08经Illumina测序平台进行基因组测序后,共得到1 089 M bp clean data,通过对所测序列进行组装,最终获得20个contig,组装的contigs总长度为2 666 340 bp,N50为 366 095,测序平均覆盖深度408×,基因组质量满足后续生物信息学分析。基因组鸟嘌呤-胞嘧啶(GC)含量为33.01%,对基因组编码基因预测,注释得到的基因总数为2 672个(图3)。
2.5 菌株JY08耐药基因分析
通过对染色体基因序列进行比对,发现菌株JY08携带了多种类型的抗生素耐药基因,包括10大类103个抗生素耐药基因。从表3中可知,外排泵系统基因数量最多,主要包括macB(8个)、patA(6个)和lmrB(5个)等71个耐药基因。其次为介导糖肽类抗生素(万古霉素)耐药的vanRC/I/M/F/I等13个耐药基因,其余为介导β-内酰胺类、多肽类抗生素(多粘菌素)、四环素类抗生素(四环素)、喹诺酮类、磺胺类和二氨基嘧啶类等抗生素耐药的基因。

表3 菌株JY08中耐药基因分析结果
2.6 菌株JY08中毒力因子分析
经VFDB数据库比对,发现菌株JY08共携带了61种毒力因子及123个相关毒力基因,其中与细菌黏附功能相关的毒力因子有26个包含49个基因;与胞外酶相关的毒力因子有15个包含20个基因;与宿主免疫逃逸相关的毒力因子有3个包含25个基因;与分泌系统相关的毒力因子有7个包含10个基因;与毒素相关的毒力因子有4个包含5个基因;与铁摄取相关的毒力因子有6个包含14个基因(表4)。

表4 菌株JY08的毒力因子检测结果

续表4

续表4
3 讨论
腐生葡萄球菌在自然界中广泛存在,具有丰富的生物学功能。目前,已分别从羊[9]、鸡肉[10]、腐败鲳鱼[11]、土壤[12]中分离鉴定出腐生葡萄球菌。刘力等[13]从白腐乳中分离出一株腐生葡萄球菌ZH910,接种至白腐乳发酵体系中,可赋予白腐乳优良的风味并明显加快产香速度。熊晶晶等[14]从舟山双峰盐场的盐田中分离筛选到一株对孔雀石绿具有较强脱色能力的腐生葡萄球菌JJ-1,孔雀石绿的主要降解产物为4-(二甲氨基)二苯甲酮。本研究从养殖的史氏鲟皮肤溃疡病灶处分离鉴定出腐生葡萄球菌菌株JY08。该菌株能发酵乳糖和D-甘露醇,不能发酵D-甘露糖,从而可以把其与向益等[9]从羊分离的腐生葡萄球菌QJ-01区分开,同时也表明菌株JY08可能具有特异的性质。
耐药基因在各物种间广泛传播,使细菌产生多重耐药性,研究细菌的耐药基因有助于理解耐药表型与基因型的关系,并为临床药物的使用提供参考。有研究检测到36株人源腐生葡萄球菌对氨基糖苷类药物(庆大霉素等)敏感率为100%[15],对苯唑西林、青霉素、庆大霉素耐药[16-17]。耐药试验结果表明,菌株JY08对10大类抗生素中的4种具有耐药性,但不对庆大霉素耐药。根据多重耐药定义,即对三种或三种以上抗菌类中的至少一种药物产生获得性耐药,因此菌株JY08为多重耐药菌,本研究结果与文献[9,18]结果不一致,可能是菌株分离源不同或者与该养殖场对一些抗生素使用情况有关。通过全基因组测序,发现该菌携带多种类型的抗生素耐药基因,并以外排泵基因为主,表明外排泵系统可能为腐生葡萄球菌JY08产生耐药性的主要因素。此外,研究发现15个基因与糖肽类和多肽类抗生素抗性相关,但在药敏试验中,菌株对这两类抗生素敏感,表明这些基因可能不完整或者没有表达。与药敏试验对应,基因组中未发现氨基糖苷类抗生素抗性基因;此外,本研究发现磷霉素类、夫西地酸和二氨基嘧啶类等抗生素的耐药基因,提示在生产实践过程中应避免这些药物的使用[19]。
近年来随着人们对于各种毒力因子的逐步了解,一些毒力因子的致病机理也逐渐被揭示出来。通过与VFDB数据库比对,发现腐生葡萄球菌JY08携带了大量毒力因子及相关毒力基因。例如属于免疫逃避类毒力因子的荚膜及荚膜多糖是一种广泛存在于细菌、支原体、部分真菌等菌体表面的碳水化合物;荚膜多糖有助于菌体抵抗干燥和低温等不利环境,并通过在菌体表面形成物理屏障阻碍宿主补体的杀伤与吞噬作用;在长期多种应激-压力环境下,病原菌已进化出多种免疫逃避机制并促进宿主感染[19]。此外,细菌毒素类包含多种溶血素,其中溶血素毒力基因hlyA具有广谱杀细胞作用,可作用于红细胞、肾脏上皮细胞和免疫细胞,诱导细胞凋亡[20]。Den Reijer P M等[21]研究表明溶血素在金黄色葡萄球菌生物膜形成等致病过程中也起着重要作用,增加了金黄色葡萄球菌的危害性。编码LPS和Fibronectin-binding protein毒力因子的基因数量较多,这些吸附类毒力因子有助于病原菌定植,形成生物膜,建立自身微生态环境。
综上所述,本研究对从史氏鲟源分离到的菌株JY08进行了常规鉴定及生物学特性分析,确定该菌为腐生葡萄球菌。该菌株对10大类抗生素中的4种完全耐药,为多重耐药菌。首次通过基因组测序技术对史氏鲟源腐生葡萄球菌进行检测,研究了其中的毒力因子及耐药基因情况,较为全面地预测史氏鲟源腐生葡萄球菌耐药基因、耐药谱、毒力因子及相关毒力基因等重要致病特性。研究结果为今后详细探究腐生葡萄球菌JY08的致病机制、流行规律和进化变异等方面提供了借鉴依据。

