CaCl2的水解反应对固态SiO2显微特征的影响
高运明,黄振彪,何 林,李光强
(武汉科技大学 钢铁冶金及资源利用省部共建教育部重点实验室,武汉 430081)

目前熔盐对SiO2显微结构影响的报道仅见于杨娟玉等[12]在1 173 K下对CaCl2熔盐与纳米SiO2颗粒压制的电极片的相互作用的研究。他们发现SiO2电极片在熔盐中浸泡30 min后相组成和化学组成均没有改变,但在纳米尺寸效应和熔盐的助熔作用下,结构和形貌变化很大,电极片由纳米颗粒组成的烧结多孔体转变为彼此相连的网状多孔体。外加电压促使熔融或者半熔融SiO2表面先电解形成Si核,然后Si核再与熔盐以及熔融或者半熔融SiO2形成新的3PI;随着熔融或者半熔融SiO2不断还原,Si核进一步长大并形成Si纳米线。
CaCl2熔盐因具有电导率高、稳定性好、价格低、绿色环保等优点而成为电解固态SiO2制备Si的研究中最常用的介质[2-15]。但CaCl2盐在空气中极易吸收水分而潮解,为避免水分对电解行为的干扰,在CaCl2盐升温或熔化过程中往往需要严格的脱水操作,这无疑增加了处理成本;另一方面,目前关于CaCl2盐水解反应的认识很有限[16-17],导致在升温或熔化过程中的脱水操作实际上并不统一[4,8-12,18]。笔者拟研究微米级SiO2压制的圆柱样与脱水不完全的CaCl2熔盐的相互作用,利用SEM-EDS及X射线衍射(XRD)等手段,结合有关热力学理论分析,考察水解反应下SiO2圆柱样显微特征的变化及其原因,为后续研究中指导CaCl2盐脱水处理以及调控电解产物Si的形貌、结构提供参考。
1 实 验

将浸泡后的圆柱样放入超声波清洗仪中,用蒸馏水清洗30 min,圆柱样保持完整;然后再将其放置于真空干燥箱中373 K烘干。按图1(a)分离烘干后的圆柱样,喷金处理后利用SEM-EDS显微表征圆柱样外表面以及靠近钼丝部位、断面中心和边部等部位(观察取样位置如图1(b)所示)。由于浸泡后的圆柱样质量较小,未进行XRD等其他检测。为了对比,对SiO2原料粉末以及烧结后的SiO2圆柱体进行SEM-EDS形貌观察、成分分析以及XRD物相检测;对CaCl2原料也进行了XRD检测。
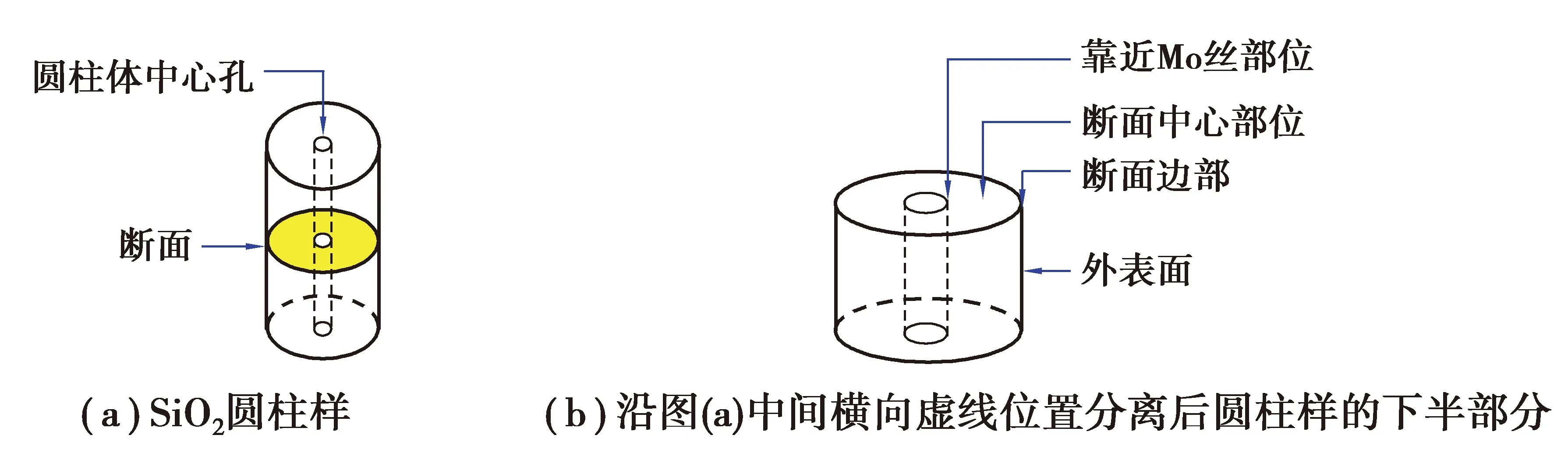
图1 SiO2圆柱样在熔盐中浸泡后取样位置示意图Fig. 1 Diagram of the sampling position of the SiO2 cylinder after immersion in the melt
2 结果与讨论
2.1 原料物相及烧结后的显微特征

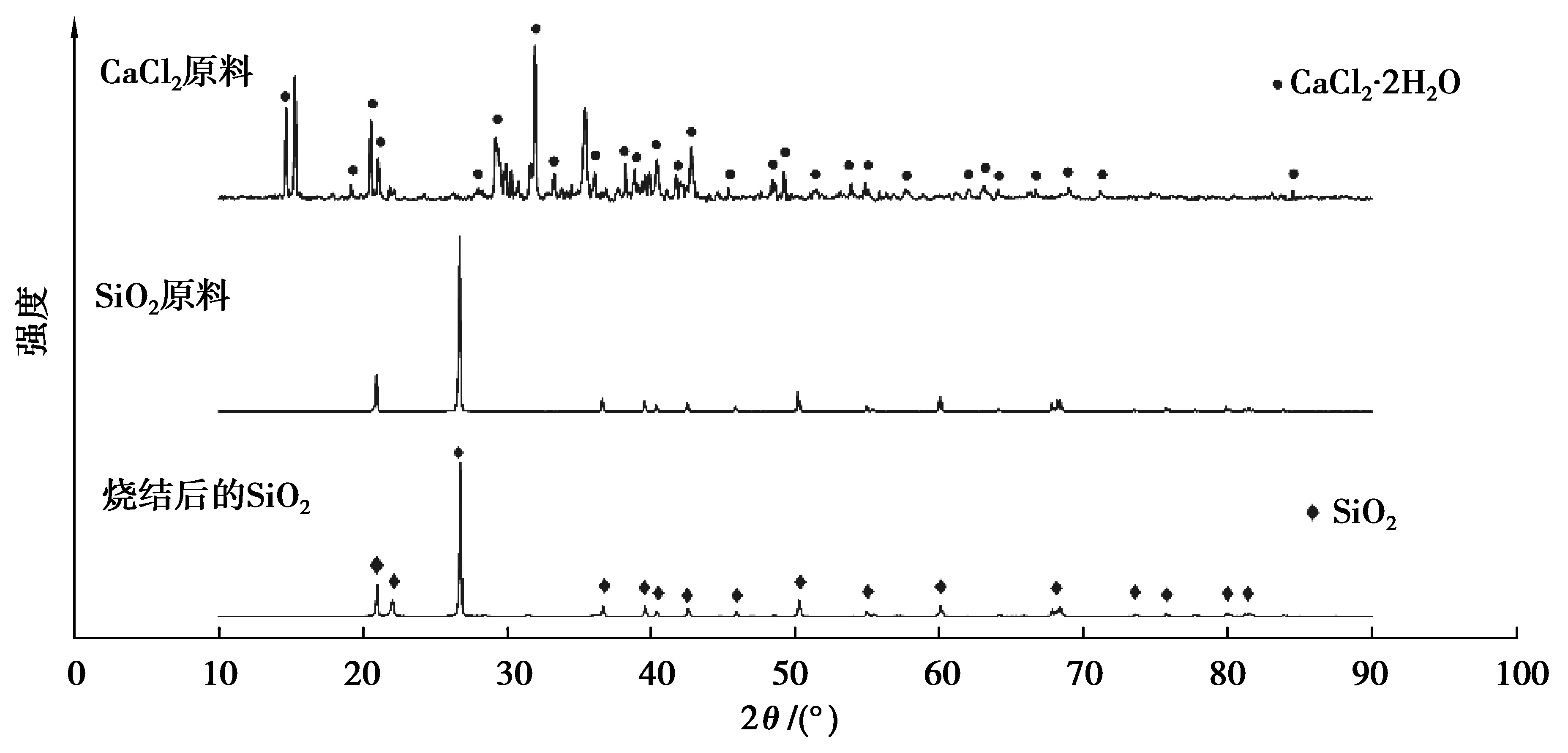
图2 CaCl2和SiO2原料及烧结后SiO2的XRD图谱Fig. 2 XRD patterns of CaCl2 and SiO2 raw materials and SiO2 cylinder after sintering
图3为SiO2烧结前后的SEM形貌及其放大图。SiO2原料(图3(a))粉末比较松散,颗粒尺寸大小不一,一般在5~50 μm之间;压制和高温烧结后颗粒变得紧密,小颗粒变多,且容易附着在大颗粒表面(图3b),表明SiO2原料在压制和烧结后有些大颗粒已碎裂变小。由于颗粒存在轻微软熔现象,彼此甚至轻微粘连在一起(图3c),但颗粒仍能保持各自的形状。另外,SiO2烧结前后经EDS检测,成分没有任何变化。

图3 SiO2的SEM图Fig. 3 SEM images of SiO2
2.2 浸泡后的显微特征
2.2.1 浸泡1 h


图4 SiO2圆柱样在熔盐中浸泡1 h后的SEM图Fig. 4 SEM images of SiO2 cylinder after immersion in the melt for 1 h

表1 图4中SiO2圆柱体有关位置点的EDS成分分析

续表1
在靠近钼丝部位(图4(b)和4(e)),虽总体上仍保持颗粒状态,但相比于烧结样(图3(b)和3(c)),形貌有少许变化,一些大颗粒表面镶嵌有很多半圆珠状的小颗粒(图4(e))。经EDS分析(表1),小半圆珠状物质组成主要包含Si、O以及极少量Ca元素,Ca的存在表明熔盐已开始沿钼丝与圆柱样中心之间的空隙渗透进来。因CaO已在圆柱体表层参与反应,随熔盐渗透进来的CaO浓度很低。结合SiO2-CaO相图[19]判断,小半圆珠应为SiO2及反应生成的很少量CS组成。表面光滑的大颗粒仍为SiO2相,基本不含CS。可以推测,浸泡时附着在大颗粒表面上已经轻微软熔的小颗粒SiO2,在熔盐助熔作用下,颗粒棱角进一步软熔或SiO2直接微量溶解[20];同时在熔盐中少量CaO作用下,小颗粒表面SiO2因生成少量CS而溶解,二者共同作用导致SiO2小颗粒的不规则棱角以及微小颗粒的溶解、消失。由于小颗粒处于溶解有SiO2和CS的熔盐环境中,当温度下降时,熔盐中SiO2和CS可在凝固的软熔小颗粒SiO2表面饱和析出,形成小半圆珠,并几乎半镶嵌在大颗粒表面。上述物理化学作用导致靠近钼丝部位的SiO2小颗粒形貌发生小许变化,但成分变化不大。在外力作用下,有少数半圆珠脱落,在大颗粒表面还留下相应的凹坑痕迹(图4(e))。
在SiO2圆柱样断面中心部位(图4(c)和4(f)),仍基本维持烧结后的颗粒形貌。因渗透进入的CaCl2熔盐量更少,上述小颗粒圆珠化的倾向虽然少量存在(表1),但形貌变化不及靠近钼丝部位明显。
2.2.2 浸泡2 h



图5 SiO2圆柱样在熔盐中浸泡2 h后的SEM图Fig. 5 SEM images of SiO2 cylinder after immersion in the melt for 2 h

表2 图5中SiO2圆柱体有关位置点的EDS成分分析
圆柱样靠近钼丝(图5(e)和5(f))以及断面中心部位(图5(g)和5(h))的颗粒形貌也有明显变化。虽然大部分仍是SiO2颗粒,但由于浸泡时间较长,有较多熔盐渗入,导致局部形态和组成已开始变化。如靠近钼丝的位置点(图5(f)点1)已生成了新相CS,断面中心部位已有位置点(图5(h)点1和3)少量片状化,存在CS相以及清洗后残留的CaCl2(参见表2);另外,小颗粒也存在小半圆珠化,并且附着或镶嵌在大颗粒表面。
可见,浸泡2 h后的圆柱样表面进一步形成C2S相,并富集有过量CaO,导致形貌和结构变化更大;而内部(靠近钼丝部位及断面中心)因熔盐渗透较少,CaO含量较低,颗粒形貌变化相对较小,仅局部有CS相生成。但相比浸泡1 h,圆柱样内部变化更明显。
2.3 讨论
2.3.1 硅酸盐形成的热力学分析


表3 1 173 K温度下与生成硅酸盐有关的热力学数据
在非标准态下,利用式(1),可计算生成各硅酸盐时的CaO平衡活度。溶解在CaCl2熔盐中的CaO活度以纯固态CaO为标准态;假设SiO2及各种硅酸盐不溶于熔盐,或即使它们在熔盐中有少许溶解,其浓度也能达到饱和,选择它们各自的纯固态物质为标准态时,其活度均为1。

(1)

aCaO=γCaOxCaO。
(2)
文献中关于CaO在CaCl2熔盐中达到饱和(1 173 K时其饱和浓度达20 mol%)时的γCaO有2个类似公式:
RTlnγCaO=8 669+6.146T[21],
(3)
RTlnγCaO=6 961+5.06T[22]。
(4)
当T=1 173 K时,式(3)和(4)计算的γCaO值分别为5.1和3.8,二者差别不大,均表明CaCl2-CaO熔体相对理想溶液呈现明显的正偏差。假设γCaO与xCaO无关,将CaO饱和时的γCaO值代入式(2)可得到对应的xCaO,并进一步转换成wCaO,结果见表3。
可见在CaCl2熔盐中生成各硅酸盐所对应的CaO平衡活度很低,生成CS时对应的CaO活度最小,仅1.2×10-4(对应的质量分数平均为0.001 4%),生成C2S时的CaO活度较大,也仅为1.0×10-3(对应的质量分数平均为0.012%)。
参加反应的CaO只能来源于CaCl2盐的水解反应(稍后分析),并且很容易达到形成各硅酸盐所需的活度。圆柱体外表面同时存在多种硅酸盐,可能与外表面局部CaO活度不均匀以及硅酸盐逐级形成有关,另外也存在外表层局部脱落和冷却过程中C2S与SiO2进一步反应转变为CS的可能(表3)。这些热力学分析与上述浸泡实验观察结果基本一致。
2.3.2 硅酸盐理论分解电压计算


表4 在1 173 K标准态下体系内相关反应的ΔG和组元的E

(5)

可见相比于固态SiO2,硅酸盐电解制备Si的分解电压都增大了,其中CS的分解电压增大约0.2 V,而其他硅酸盐分解电压增大约0.3 V,显示SiO2转变为硅酸盐后电解变得困难。为此,在外加大电压电解条件下,不仅使硅钙合金或钙金属也可能被还原出来,污染产物硅[4-5,9,15,23],而且也影响到产物硅的形貌和长大[9,20]。因此,在采用FFC工艺制备硅的过程中,应尽量避免各种固态硅酸盐生成,以降低CaCl2熔盐中固态SiO2全部还原的难度。
2.3.3 CaCl2盐的水解反应
室温下CaCl2因暴露在空气中不可避免含有一定量的自由水和结晶水,自由水通过蒸发可有效脱除,而结晶水(参见图2)需先高温分解、然后蒸发脱除。考虑动力学因素,升温过程中含水CaCl2完全脱水较为困难。一般认为在升温过程或在熔融状态下CaCl2盐与H2O有2种生成CaO的水解反应机理[16]。
第1种:
CaCl2+ H2O = CaO + 2HCl(g)。
(6)
第2种:
CaCl2+ 2H2O = Ca(OH)2+ 2HCl(g),
(7)
Ca(OH)2= CaO + H2O。
(8)
从热力学上看,第2种机理中反应式(7)(8)叠加,即转化为第1种机理反应式(6),因此这里主要从热力学上分析实验过程中第1种水解反应。

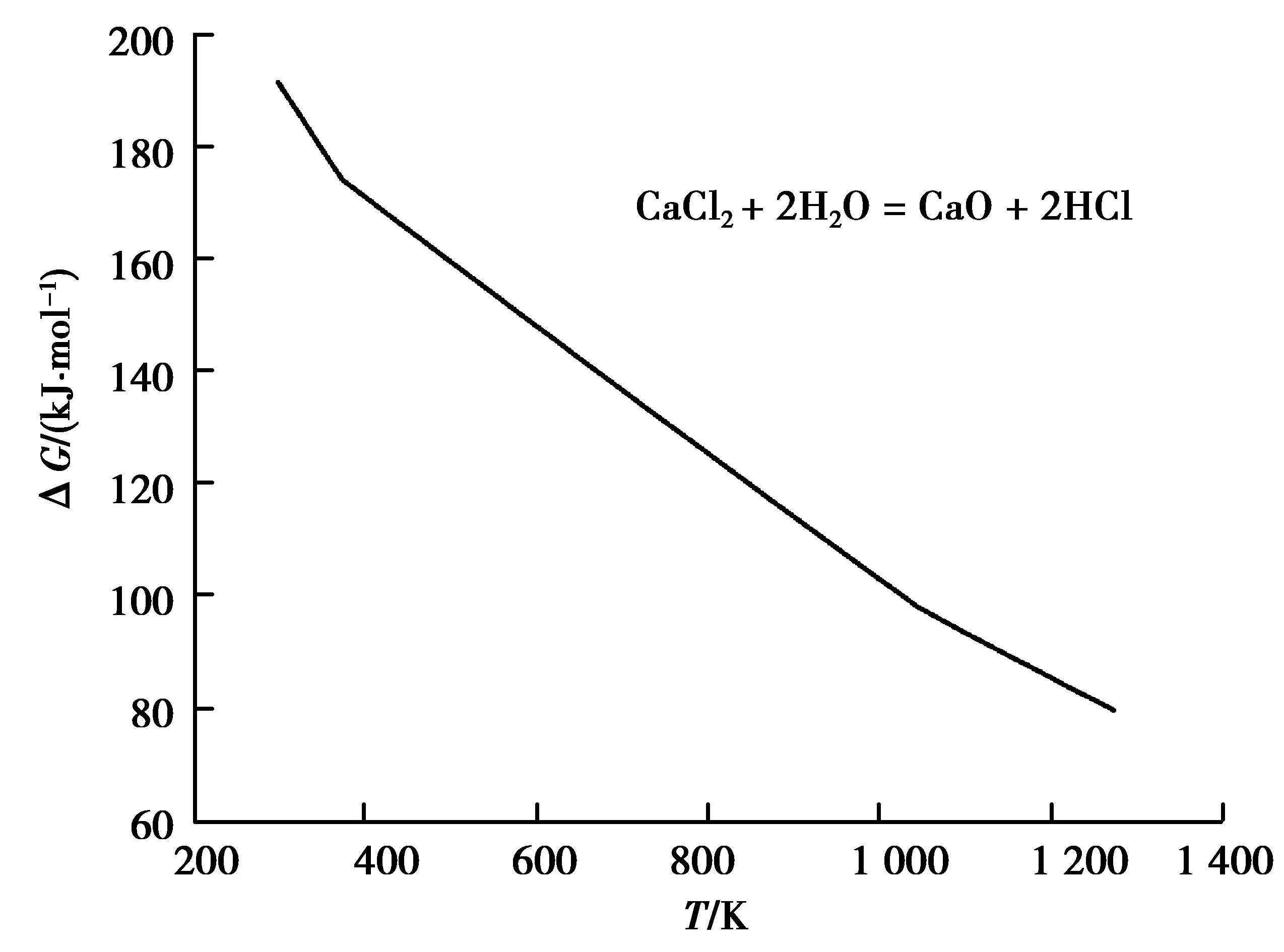
图6 反应(6)的ΔGθ-T的关系Fig. 6 Relationship between ΔG0 and T of the reaction (6)
利用式(9)可进一步获得反应(6)在不同温度、非标准态下的H2O与HCl的平衡分压(即pH2O和pHCl)的对应关系,这里选取473, 773, 973, 1 173 K等4个温度下比较,如图7。在前3个温度下CaCl2和CaO均为固态(此时CaCl2和CaO的活度为1),在温度1 173 K为熔体状态(假设CaCl2和溶解的CaO活度均为1)。

图7 反应(6)的pH2O与pHCl的平衡关系Fig. 7 Equilibrium relationship between pH2O and pHCl of the reaction (6)

(9)

从图7中可知,温度越低,平衡线上相同的pH2O对应的pHCl也越低。平衡线以下区域为水解区(即CaO生成区)。在某温度下脱水过程中,固态CaCl2盐表层初始水蒸气分压往往较大甚至饱和,当HCl的分压很低(例如初始气氛)时,水解反应(6)即可正向进行,并可达到平衡。平衡线以上区域为H2O稳定区,此时可采取抽真空或在流动气氛下降低水蒸气分压脱水。但由于水解反应(6)中1 mol的H2O蒸气可生成2 mol的HCl气体,抽真空或在流动气氛操作会导致水解平衡反应向正方向(即生成CaO方向)移动。又由于反应(6)为吸热反应(FactSage热力学软件数据),温度越高,其正向进行程度(平衡常数)越大,特别是在高温熔体状态CaO活度远小于1的条件下更容易水解生成CaO。考虑动力学因素,低温下的水解反应即使能进行也将很缓慢,在相对低温下不抽真空或采取抽真空或流动气氛的脱水操作是合理的[4,8-12,18,26]。高温熔体预电解虽可继续脱除残余水分[9,12,15,20-21,26](参见表4),但在预电解之前CaCl2可能已经水解,并生成了CaO;当然,预电解对脱除熔盐中其他杂质仍有利。因此,在低温下充分脱水对于抑制水解反应、控制CaO的生成更重要。
由于水分是从表面到内层逐步脱除的,鉴于CaCl2在约517 K后才失去全部结晶水[25],为严格控制CaCl2盐高温水解产生CaO,建议加强CaCl2原料在573 K以下的低温长时间保温或缓慢升温的脱水操作。
本实验中尽管在473 K的干燥箱内对CaCl2盐进行了低温真空(真空度小于133 Pa)脱水操作,但转移到高温炉的过程又暴露在空气中,且实验中并没有特意在高温炉内氩气(仅用硅胶干燥)流动气氛下再次进行长时间低温保温或缓慢升温的脱水操作,导致CaCl2盐脱水不完全,高温水解生成了CaO,并溶于CaCl2熔盐,CaO扩散至SiO2圆柱体表面发生反应,并伴随熔盐渗透扩散,在圆柱体表面和内部分别与SiO2形成了各种硅酸盐。上述热力学计算已经表明,在圆柱体外表面由于CaO的活度(浓度)大,容易生成高钙硅酸盐,如C3S2或C2S;在内部由于CaO的活度(浓度)小,则可能生成低钙硅酸盐,如CS。对于仅内置阴极集流体的SiO2圆柱体在外加电压时,依据3PI还原理论[14-15],外表面形成的硅酸盐层只能在最后阶段还原,硅酸盐层的持续存在可在一定程度上阻碍CaCl2熔盐向圆柱体内部的扩散和3PI的形成,同时也降低内部SiO2还原产生的O2-向外传递的速度,最终使SiO2圆柱体阴极还原速度减慢、还原难度增加。
3 结 论
1)在1 173 K的CaCl2熔盐中浸泡不同时间后,SiO2圆柱样外表面形貌、组成、结构变化较大,内部形貌变化较小。形貌、结构发生变化的主要原因是SiO2与熔盐中溶解的CaO作用,逐级生成多种硅酸盐。外表面CaO浓度高,可生成C2S或C3S2;内部则可能生成CS,也会受到渗透熔盐的轻微助熔作用。
2)热力学计算表明,SiO2圆柱样在CaCl2熔盐中生成硅酸盐所需CaO的活度很低。生成CS时CaO的活度仅为1.2×10-4;生成C2S时CaO的活度也仅为1.0×10-3。SiO2转变为硅酸盐后,理论分解电压增大,电解还原难度增加,还原速度也减慢。
3)在CaCl2熔盐中生成各种硅酸盐所需的CaO来自盐的水解反应。温度越高,水解反应越容易进行。为严格控制CaCl2盐中的CaO含量,宜加强CaCl2原料在低温(一般在573 K以下)下不抽真空或在真空或干燥流动气氛下长时间保温或缓慢升温的脱水操作。

