miR-295抑制高糖诱导的小鼠成骨细胞系MC3T3-E1的凋亡
曲 野,刘立柱,徐瑞敏,吴开弟,代伟宏
(海南医学院第二附属医院 创伤骨科, 海南 海口 570311)
糖尿病(diabetes mellitus,DM)性骨质疏松症(diabetic osteoporosis,DOP)是多见于老年DM患者的慢性并发症,骨骼结构破坏和骨量减少是其重要病理特征[1-2]。高糖引起的成骨细胞骨形成能力减弱是导致DOP的重要原因,无翅基因(wingless,Wnt)信号通路失活在其中发挥重要作用,而Dickkopf同源物1(dickkopf homolog 1,DKK1)为Wnt信号通路的内源性抑制剂,其水平升高可抑制Wnt信号通路活化,阻碍成骨作用[3]。微小RNA(microRNAs,miRNAs)与代谢性骨病的发生密切相关,某些miRNAs可通过靶向抑制DKK1表达促进骨折愈合[4]。miR-295是miRNAs的一个成员,在DOP大鼠骨组织中表达下调[2],但其是否参与高糖诱导(high glucose-induced, HG-induced)的成骨细胞凋亡及其作用机制尚不清楚。本研究以小鼠成骨细胞系MC3T3-E1为对象,探讨miR-295过表达对高糖诱导成骨细胞凋亡的影响并以DKK1为切点初步分析其机制。
1 材料与方法
1.1 主要材料
小鼠成骨细胞系MC3T3-E1(宁波明舟生物科技有限公司);α-MEM培养基和胎牛血清(HyClone公司);青链霉素混合液(×100)细胞培养专用、高效放射免疫沉淀法(radio-immunoprecipitation assay, RIPA)裂解液、TriQuick Reagent总RNA提取试剂、Lipofectamine 3000、噻唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]试剂盒、膜联蛋白V-异硫氰酸荧光素(annexin V-FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒、二奎啉甲酸(bicinchoninic acid, BCA)蛋白质浓度测定试剂盒、双荧光素酶报告基因检测试剂盒和SDS-PAGE凝胶制备试剂盒(北京索莱宝科技有限公司);cDNA第一链合成试剂盒(北京百奥莱博科技有限公司);pGL3-basic荧光素酶报告基因载体(上海海吉浩格生物科技有限公司);miR-295模拟物及其阴性对照miR-control(南通市百奥迈科生物技术有限公司);β连环蛋白(β-catenin)、DKK1、c-Myc、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydro-genase,GAPDH)抗体(Cell Signaling Technology公司)。
1.2 方法
1.2.1 细胞的分组及处理:将细胞分为1)对照(Ctrl)组;2)高糖(HG)组:用含22 mmol/L葡萄糖的培养基培养24 h,“3)和4)组与此相同”;3)(HG+miR-对照)组:转染miR-对照组48 h后行高糖培养;4)(HG+miR-295)组:转染miR-295模拟物行高糖培养,每组设置3个复孔。其中,miR-295模拟物和miR-对照的转染参照Lipofectamine 3000说明书。
1.2.2 RT-qPCR检测MC3T3-E1细胞中miR-295表达水平:向MC3T3-E1细胞中加入TriQuick Reagent总RNA提取试剂提取总RNA,将RNA定量后,参照cDNA第一链合成试剂盒说明书将RNA反转录合成单链cDNA。将2 μL cDNA、5 μL SYBR Green、2.2 μL DEPC(diethylpyrocarbonate)水和各0.4 μL正反引物混匀制成总体积为10 μL的反应体系;置于荧光定量PCR仪进行扩增,MC3T3-E1细胞中miR-295的表达水平采用2-△△Ct值表示。其中,扩增条件为96 ℃ 5 min,1个循环;96 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,40个循环。引物由上海生工生物工程有限公司设计并合成:miR-295 正向引物序列:5′-CTCAAATGTGGGGCACAC-3′,反向引物序列:5′-GAACATGTCTGCGTATCTC-3′;内参U6正向引物序列:5′-CTCGCTTCGGCAGCACA-3′,反向引物序列:5′-AACGCTTCACGAATTTGCGT-3′。
1.2.3 MTT法检测MC3T3-E1细胞活力:将对数增殖期MC3T3-E1细胞按照每孔1×105个接种至96孔板,按照1.2中分组进行相应处理,另外设不含细胞的空白组以进行调零检测;处理结束后,每孔加入20 μL MTT 5 g/L溶液孵育4 h;弃上清液后,每孔加入150 μL二甲基亚砜摇床孵育10 min。运用全自动酶标仪测定各组MC3T3-E1细胞在490 nm波长处的吸光度(A)值,并以(A实验组-A空白组)/(A对照组-A空白组)×100%表示各组细胞存活率。该实验行3次重复检测。
1.2.4 流式细胞仪检测MC3T3-E1细胞凋亡:胰蛋白酶消化收集按照1.2中分组处理结束后的各组MC3T3-E1细胞,加入预冷的磷酸缓冲液漂洗2次后,用1×结合缓冲液调整细胞为1×106个/mL;向100 μL细胞悬液中加入5 μL annexin V-FITC、5 μL PI,充分混匀后避光反应15 min,用流式细胞仪检测MC3T3-E1细胞凋亡率。该实验行3次重复检测。
1.2.5 免疫印迹法检测MC3T3-E1细胞中β-catenin、DKK1、c-Myc和Bcl-2蛋白表达水平:向MC3T3-E1细胞中加入RIPA裂解液抽提总蛋白,用BCA法定量后,加入等体积上样缓冲液煮沸5 min变性。将蛋白样品行SDS-PAGE分离后,转至聚偏氟乙烯膜上;封闭液室温封膜1h,加入β-catenin(1∶2 000)、DKK1(1∶1 000)、c-Myc(1∶1 000)、Bcl-2(1∶1 000)和GAPDH(1∶2 000)特异性一抗室温孵育2 h;洗涤液洗膜后,再加入辣根过氧化酶标记的二抗(1∶5 000)室温孵育1 h。化学发光剂暗室内显色后,GAPDH作内参,采用凝胶成像分析系统及图像处理软件进行分析。该实验重复检测3次。
1.2.6 双荧光素酶报告基因检测miR-295和Dkk1靶向关系:采用Targetscan软件预测miR-295与Dkk13′UTR结合位点后,将含miR-295与Dkk13′UTR结合位点的序列片段和定点突变后的序列片段克隆重组至pGL3-basic载体上,构建野生型(Wt)-DKK1和突变型(Mut)-DKK1荧光素酶载体质粒。参照Lipofectamine3000说明书分别将miR-295模拟物(miR-295)+Wt-DKK1、miR-295+Mut-DKK1、miR-control+Wt-DKK1和miR-control+Mut-DKK1共转染至MC3T3-E1细胞,记为(miR-295+Wt-DKK1)组、(miR-295+Mut-DKK1)组、(miR-control+Wt-DKK1)组和(miR-control+Mut-DKK1)组,其中每组设3个复孔;转染48 h后,检测各组MC3T3-E1细胞的荧光素酶活性,操作步骤参照双荧光素酶报告基因检测试剂盒说明书。该实验重复检测3次。
1.3 统计学分析
2 结果
2.1 高糖下MC3T3-E1细胞中miR-295的表达水平
与对照组比较,HG组MC3T3-E1细胞中miR-295表达水平明显降低(P<0.05);与HG+miR-control组比较,HG+miR-295组MC3T3-E1细胞中miR-295表达水平明显升高(P<0.05)(表1)。

表1 各组MC3T3-E1细胞中miR-295表达水平
2.2 miR-295对高糖下MC3T3-E1细胞活力的影响
HG组MC3T3-E1细胞存活率较对照组明显降低(P<0.05),但(HG+miR-295)组MC3T3-E1细胞存活率明显高于(HG+miR-control)组(P<0.05)(表2)。
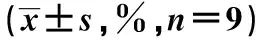
表2 各组MC3T3-E1细胞存活率和凋亡率
2.3 miR-295对高糖下MC3T3-E1细胞凋亡的影响
与对照组比较,HG组MC3T3-E1细胞凋亡率明显升高(P<0.05);(HG+miR-295)组MC3T3-E1细胞凋亡率较(HG+miR-control)组明显降低(P<0.05)(表2,图1)。
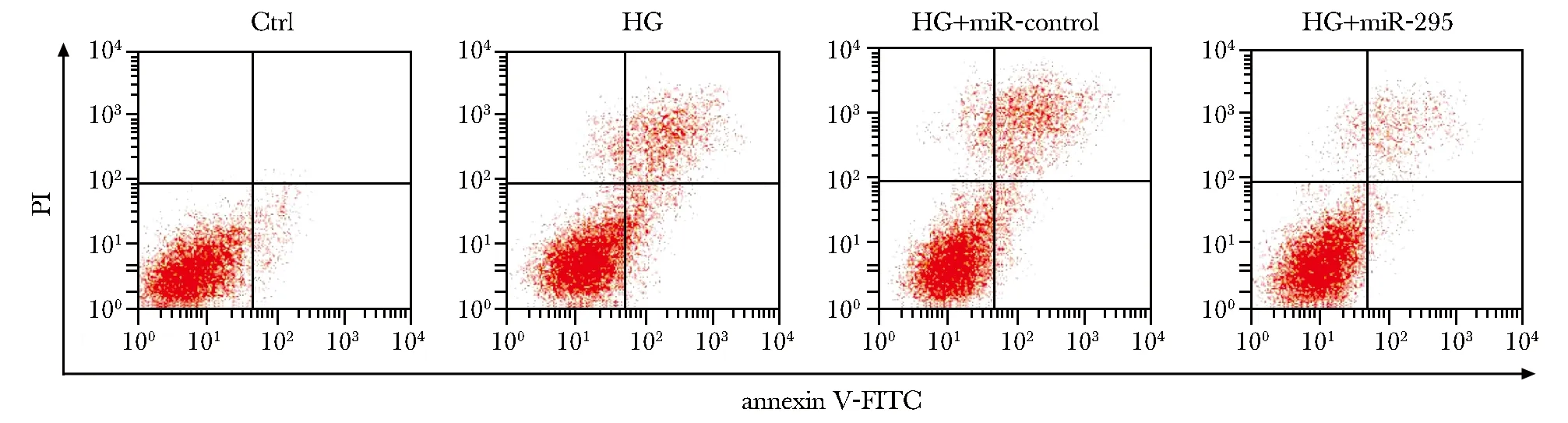
图1 miR-295对高糖诱导的MC3T3-E1细胞凋亡的影响Fig 1 Effect of miR-295 on high glucose-induced apoptosis
2.4 miR-295对高糖下MC3T3-E1细胞中Wnt/β-catenin通路的影响
与对照组比较,HG组MC3T3-E1细胞中β-catenin蛋白及下游相关蛋白c-Myc、Bcl-2表达水平明显降低(P<0.05),而DKK1表达水平明显升高(P<0.05);与(HG+miR-对照)组比较,(HG+miR-295)组MC3T3-E1细胞中β-catenin、c-Myc和Bcl-2蛋白表达水平明显升高(P<0.05),而DKK1蛋白表达水平明显降低(P<0.05)(图2,表3)。

表3 MC3T3-E1细胞中β-catenin、DKK1、c-Myc和Bcl-2蛋白表达水平
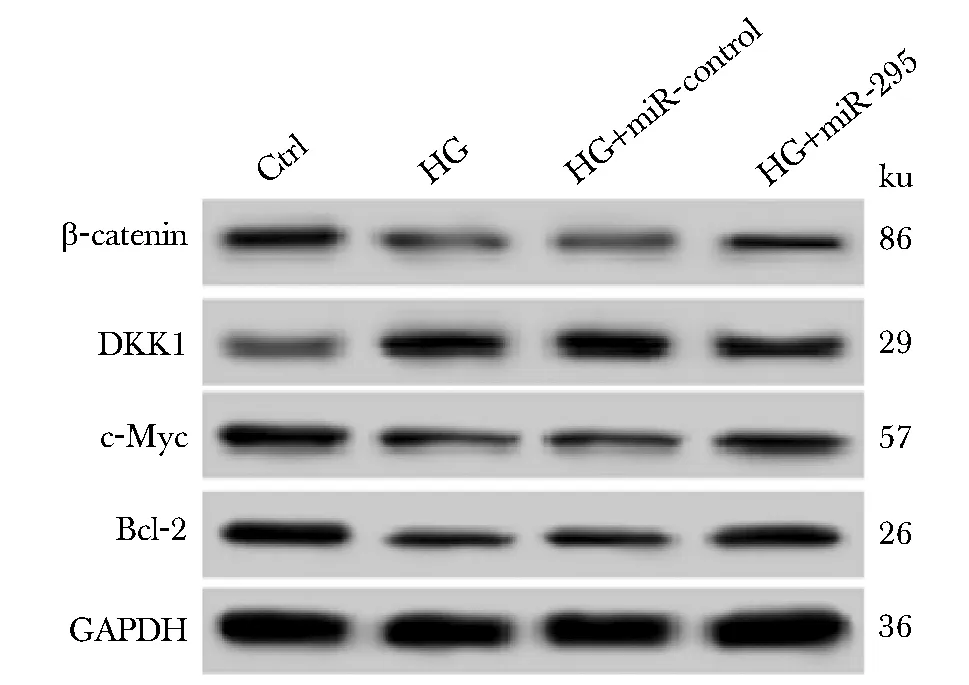
图2 Western blot检测Wnt/β-catenin通路相关蛋白表达Fig 2 Western blot was used to detect the expression of Wnt/β-catenin pathway related proteins
2.5 miR-295和Dkk1靶向关系的验证
Targetscan软件预测结果显示,miR-295和Dkk13′UTR之间存在互补的结合位点;双荧光素酶报告基因实验检测结果显示,(miR-295+Wt-DKK1)组MC3T3-E1细胞的荧光素酶活性明显低于(miR-control+Wt-DKK1)组,但(miR-control+Mut-DKK1)组和(miR-295+Mut-DKK1)组MC3T3-E1细胞的荧光素酶活性差异无统计学意义(图3,表4)。

表4 比较各组MC3T3-E1细胞荧光素酶活性

图3 miR-295和Dkk1 3′UTR互补的结合位点Fig 3 Complementary binding sites of miR-295 and Dkk1 3′UTR
3 讨论
DOP是一种常见的代谢性疾病,严重威胁人们健康[5]。成骨细胞过度凋亡引发成骨细胞功能异常、骨吸收增多和骨形成减少[3];DM患者的高糖环境对成骨细胞的增殖不利[6]。miRNAs不具有编码蛋白质的功能, 但可通过与靶基因碱基互补配对在转录水平上调控其表达[7]。有报道[8-10],miR-139-3p低表达具有抑制成骨细胞分化和促进成骨细胞凋亡的作用,miR-7223-5p可靶向调控PI3KR1表达抑制成骨细胞增殖并促进其凋亡;miR-455-3p可通过靶向HIPK2拮抗高糖诱导的成骨细胞凋亡并促进成骨细胞增殖。miR-295在胚胎干细胞中具有潜在的促生存功能[11]。已有研究表明[2], DOP大鼠骨组织中miR-295表达下调,但其作用并不清楚。本研究表明,miR-295过表达可抑制MC3T3-E1细胞凋亡。提示,miR-295可能通过调控成骨细胞凋亡在DOP发生发展过程中扮演着重要角色。
Wnt/β-catenin信号通路Wnt可通过与Frizzled结合被活化,经过一系列作用可导致β-catenin过度积累入核,通过激活下游相关基因,如原癌基因c-Myc和抗凋亡基因Bcl-2等表达;DKK1可通过细胞膜上LRP5/6和Kremen1/2形成三聚体,进而阻断Wnt信号的传递[12]。Wnt/β-catenin信号通路失调与包括DOP在内的多种疾病的发生发展密切相关[13]。Wnt/β-catenin信号通路活化可促进成骨细胞增殖并抑制其凋亡,而抑制Wnt/β-catenin信号通路可促进成骨细胞凋亡[14]。本研究发现,MC3T3-E1细胞中β-catenin、c-Myc和Bcl-2蛋白表达水平明显降低,而DKK1蛋白表达水平明显升高,MC3T3-E1细胞中Wnt/β-catenin信号通路活化明显受到抑制。与文献报道相似[15]。进一步检测表明,miR-295过表达可激活高糖下MC3T3-E1细胞中Wnt/β-catenin信号通路。提示,miR-295过表达抑制高糖诱导的MC3T3-E1细胞凋亡可能与其激活Wnt/β-catenin信号通路有关。进一步预测到miR-295与Dkk13′UTR区域存在互补的结合位点,Dkk1可能是miR-295的潜在靶基因,miR-295可能通过靶向抑制DKK1表达激活Wnt/β-catenin信号通路影响成骨细胞功能。
综上所述,miR-295可抑制高糖诱导的成骨细胞凋亡,其作用机制可能与靶向下调DKK1表达激活Wnt/β-catenin通路有关。本研究局限于细胞水平,后期拟用DOP大鼠模型进一步从整体水平探讨miR-295的作用,以期为DOP发病机制及防治提供新依据。

